G-MDSCs及HO-1对异基因造血干细胞移植后患者发生急性移植物抗宿主病的预测价值*
陈璐, 倪明, 王力, 潘成云, 亢倩, 詹雲, 赵鹏, 王季石,3***
(1.贵州医科大学附属医院 血液内科, 贵州 贵阳 550001; 2.贵州医科大学 临床医学院, 贵州 贵阳 550004; 3.苏州大学附属第一医院 国家血液病临床研究中心, 江苏 苏州 215006)
目前,异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, allo-HSCT)仍是多种常规疗法无法治愈的血液系统疾病的唯一有效选择[1-3]。allo-HSCT后可发生多种并发症,其中移植物抗宿主病(graft-versus-host disease, GvHD)发生率高,严重影响患者生存质量,甚至导致患者死亡[3-5]。如今,以细胞治疗为基础的抗急性GvHD(acute GvHD,aGvHD)疗法已取得了一定的进展[6],调节性T细胞(regulatory T cells, Tregs)、免疫耐受性树突状细胞(tolerogenic dendritic cells, tDCs)及间充质干细胞(mesenchymal stromal cells, MSCs)均在aGvHD动物模型或Ⅰ期临床实验中展示出一定的疗效[7]。髓系来源的抑制性细胞(myeloid-derived suppressor cells, MDSCs)是病理激活的中性粒细胞和单核细胞,该群细胞具有强大的免疫抑制活性,在加速肿瘤进展和破坏抗癌治疗效果方面发挥着重要作用[8]。虽然已经观察到人类MDSCs与GvHD之间的临床相关性[9],但无实际数据可以确定人MDSCs是否可在体内预防和/或控制GvHD。血红素加氧酶-1(heme oxygenase-1, HO-1)属于应激蛋白家族[10],可对缺氧、细胞因子等刺激作出反应[11],并诱导免疫耐受[12]。本课题组前期研究结果显示,Ⅲ~Ⅳ aGvHD患者的HO-1表达明显低于未发生aGvHD患者,提示氧化应激分子HO-1可能有助于控制aGvHD[13-14]。然而,HO-1如何降低患者aGvHD的发生风险目前尚不清楚,因此本研究拟通过分析all-HSCT后病人不同时间点的新鲜外周血、探讨粒细胞的-MDSCs(granulocytic-MDSCs,G-MDSCs)及胞内HO-1、白细胞介素10(interleukin-10, IL-10)等细胞因子对aGvHD发病的预测作用。
1 材料与方法
1.1 实验材料
1.1.1样本来源及分组 选取2021 年9月—2023 年1月allo-HSCT术后患者29例,要求符合初次确诊、术前接受清髓治疗及预计生存时间大于3个月,排除行自体造血干细胞移植(autologous hematopoietic stem cell transplantation, AHSCT)术患者及传染性疾病(如乙肝、梅毒、艾滋病等)患者。取新鲜外周血(未过夜)作为标本来源。本研究已根据《赫尔辛基宣言》获得了病人以及供者的知情同意。
1.1.2主要试剂及仪器 抗分化簇14抗体(anti-cluster of differentiation 14, anti-CD14)、抗人类白细胞抗原DR抗体(anti-human leukocyte antigen-DR, anti-HLA-DR)、抗分化簇11b抗体(anti-cluster of differentiation 11b, CD11b)及IL-10(anti-IL-10)抗体(美国Thermo Fisher Scientific公司),抗分化簇33抗体(anti-cluster of differentiation 33, anti-CD33)、红细胞裂解液及细胞破膜液均为美国BD Biosciences公司),抗HO-1(anti-HO-1)抗体(英国abcam公司),流式细胞计数微球(美国BioLegend公司),5 g/L牛血清白蛋白(protein standard solution, BSA;北京索莱宝科技有限公司),1×磷酸盐缓冲液(phosphate buffered solution, PBS;中国兰杰柯科技有限公司);5 mL流式试管(墨西哥FALCON公司),流式细胞仪(BD FACSLyricTMFlow Cytometer,美国BD Biosciences公司),牛血清白蛋白(protein standard solution, BSA;北京索莱宝科技有限公司。
1.2 实验方法
1.2.1一般临床资料及aGvHD的诊断 收集患者性别、年龄、疾病诊断[急性髓系白血病(acute myeloid leukemia, AML)、急性淋巴细胞白血病(acute lymphoid leukemia,ALL)、骨髓增生异常综合征(myelodysplastic syndromes,MDS)、再生障碍性贫血(aplastic anemia,AA)及非霍奇金淋巴瘤(non Hodgkin lymphoma, NHL)]、术前预处理方案[白消安/环磷酰胺(busulfan/cyclophosphamide,Bu/Cy)、抗胸腺细胞球蛋白(anti-thymocyte globulin,ATG)、阿扎胞苷(azacitidine,AZA)、伊达比星(idarubicin,IDA)、美法仑(melphalan, Mel)、依托泊苷(etoposide,VP16)、氟尿嘧啶 (fluorouracil,Flu)、环磷酰胺(cyclophosphamide, CTX)、环孢霉素(cyclosporine,Cs)及霉酚酸酯(mycophenolate mofetil,MMF)]、排异预防、感染及复发情况等一般资料;结合患者移植治疗过程中临时与长期医嘱以及对应病程,参照1974年西雅图分级标准[15]判断患者是否发生aGvHD及其程度。
1.2.2血标本抽取 抽取病例组患者移植完成后第2、3、4、6、8周及第3个月等6个时间点的空腹新鲜外周血。
1.2.3全血活细胞中G-MDSCs表面抗原染色 取“1.2.2”项下新鲜外周血加入FACS试管中,加含有1% BSA的FACS Buffer 500 μL,2 000 r/min离心5 min,重复操作洗涤细胞2遍;取出FACS Tube,吸取上层悬液,含有5% BSA的Blocking Buffer 50 μL重悬细胞,同步细胞表面抗原封闭15 min;避光,往FACS Tube内加G-MDSCs表面标记抗体CD14、HLA-DR、CD11b、CD33各1 μL,避光孵育15~20 min;抗体孵育结束,加FACS Buffer 1 mL洗涤上述细胞1次,离心时间、转速、温度等条件同前。采用BD FACSLyricTM流式上机检测G-MDSCs的百分比和绝对值计数。
1.2.4HO-1与IL-10的表达 取“1.2.2”项下新鲜外周血,采用破膜染色检测G-MDSCs中氧化应激蛋白HO-1[14]及经典免疫抑制因子IL-10[16]的表达,使用荧光减一对照(fluorescence minus one control, FMO control)确保染色的可靠性,即在对照管中加入除anti-HO-1及anti-IL-10之外的其他抗体作为染色对照组。
1.2.5G-MDSCs膜内抗原HO-1、IL-10破膜染色 取“1.2.3”项下表面抗原染色完毕后细胞,往FACS Tube中加稀释后的Lysing Solution(1×)1 mL裂解,避光10 min;2 000 r/min离心5 min,收获细胞,FACS Buffer 500 μL洗涤细胞;FACS Tube中加稀释后的Permeabilization Solution (1×)500 μL破膜,置于暗环境15 min;2 000 r/min离心5 min,收获细胞,FACS Buffer 500 μL洗涤细胞;往收获的细胞中加Blocking Buffer重悬细胞,室温避光15 min;加G-MDSCs膜内标记抗体HO-1 和IL-10各1 μL,避光孵育30 min,同时开启BD FACSLyricTM备用;抗体孵育结束,将装有Precision Count Beads的试剂瓶置于XH-C旋涡混合器上振荡30 s~1 min,吸取25 μL于FACS Tube中用于计算各细胞群体绝对值数目;加FACS Buffer或0.9%氯化钠注射液1 mL 后上机检测得中位荧光强度(median fluorescence intensity, MFI)、表达百分比及绝对值计数等。
1.2.6流式数据分析 取“1.2.5”项下表面抗原染色及破膜染色完毕的细胞,采用Flowojo 10.6.2(美国 BD Bioscience 公司)软件进行流式数据分析,详细分析策略见图1。首先圈选活细胞,随后对其表型进行分析,寻找G-MDSCs;通过圈选绝对值计数微球对G-MDSCs进行计数。

注:(1)表示Precision Count Beads,(2)表示活细胞群体;SSC-A/FSC-A后流式框选在(2)基础上展开。图1 CD14-HLA-DR-CD11b+CD33midG-MDSCs、HO-1及IL-10流式分析策略Fig.1 Strategy analysis of CD14-HLA-DR-CD11b+CD33midG-MDSCs, HO-1, and IL-10
1.3 统计学分析
利用SPSS 20.0统计学软件进行数据分析。计数资料以 [n(%)]表示,数据比较采用χ2检验;运用Mann Whitney秩和检验及两独立样本t检验比较计量资料;以P<0.05为差异有统计学意义。
2 结果
2.1 临床特征
allo-HSCT术后患者分为有aGvHD组(n=15)和无aGvHD组(n=14),2组患者性别、年龄、疾病诊断类型、是否外周血来源、预处理方案、aGvHD预防方案、是否发生感染及复发等一般临床资料,差异无统计学意义(P>0.05,表1)。allo-HSCT患者术后发生aGvHD的平均天数为42.5(11,139)d,aGvHD分度0、Ⅰ、Ⅱ及Ⅲ~Ⅳ分别为0、2、7及5例,累及皮肤、胃肠道、肝脏及未知部位分别为12、11、12及1例。
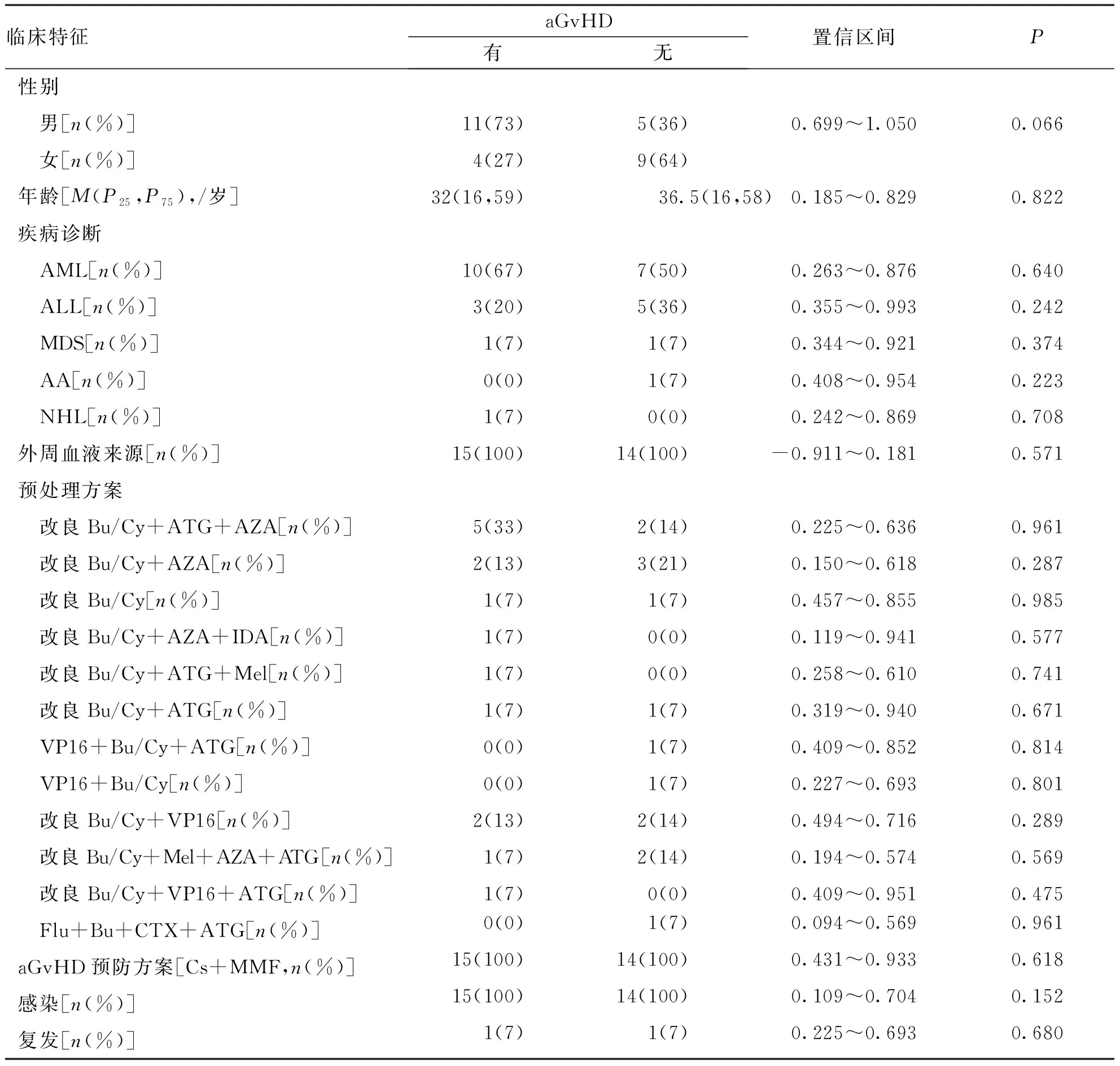
表1 有aGvHD组和无aGvHD组allo-HSCT术后患者的临床特征Tab.1 Clinical characteristics after allo-HSCT in aGvHD group and non-aGvHD group
2.2 G-MDSCs水平
2组患者allo-HSCT后第2周于外周血中检测到G-MDSCs,且在第4周时有aGvHD组病人G-MDSCs的百分比及绝对值计数均高于无aGvHD组,差异有统计学意义(P<0.05,图2)。

注:A为百分比,B为绝对值计数;(1)与无aGvHD组比较,P<0.05。图2 有aGvHD组和无aGvHD组allo-HSCT术后患者不同时间点G-MDSCs的水平Fig.2 Expressions of G-MDSCs in patients with aGvHD and without aGvHD after allo-HSCT at different time points
2.3 HO-1和IL-10的表达
结果显示,HO-1及IL-10对照管表达均在0附近,但HO-1组实验管峰值较对照管明显右移(范围103~104),IL-10组实验管峰大约位于0~104且较对照管右移。见图3。

图3 allo-HSCT术后患者G-MDSCs中HO-1与IL-10的表达(FMO染色)Fig.3 Expressions of HO-1 and IL-10 in G-MDSCs of patients after allo-HSCT (FMO staining)
2.4 HO-1表达的百分比、MFI及绝对值计数
在allo-HSCT后第4周时有aGvHD组病人G-MDSCs中HO-1表达的百分比、MFI及绝对值计数均高于无aGvHD组,其差异均有统计学意义(P<0.05)。见图4。

注:A为表达百分比,B为MFI,C为绝对值计数;(1)与无aGvHD组比较,P<0.05。图4 有aGvHD组和无aGvHD组allo-HSCT术后患者不同时间点G-MDSCs中HO-1的水平Fig.4 Expressions of HO-1 in G-MDSCs of patients with aGvHD and without aGvHD after allo-HSCT at different time points
3 讨论
aGvHD是allo-HSCT后典型且严重并发症,其发病机制至今仍不明确。以往研究认为,人类白细胞抗原(human leukocyte antigen, HLA)不合引起的同种异体反应性T细胞激活及随后造成的靶器官损伤是aGvHD的主要病理生理过程,在同胞全相合异基因移植中GvHD发生率为30%~50%,而在无关供体异基因移植中发生率高达70%[17];发生重度aGvHD的约占无关供体移植患者的50%,重度aGvHD患者5年存活率不到20%[18]。因此,对allo-HSCT患者进行GvHD的预防及治疗是提高患者长期生存率及改善生存质量的关键。MDSCs是一类维持机体稳态的细胞群体,正常人体内均有存在[19-20]。当机体在处于应激及出现炎症反应等病理状态时,体内免疫细胞被激活,此时MDSCs比例增多以控制自身过度反应的免疫状态[21-22]。目前,不论是在肿瘤的免疫逃逸研究领域,还是在allo-HSCT背景下的免疫耐受,MDSCs都是科学研究之热点。
为从多层面探讨MDSCs可能在aGvHD发生发展中参与的作用,在移植后不同时间点对患者的外周血进行免疫监测时加入了CD14-HLA-DR-CD11b+CD33midG-MDSCs的绝对数,从而使得数据不仅仅有描述细胞间相对数量关系的百分比,也可以凭借绝对数描述患者外周血中G-MDSCs的数量。结果显示,患者G-MDSCs水平高于正常人,随着时间的延长逐渐下降,印证了移植后早期免疫重建中大量不成熟粒细胞中有较多G-MDSCs的猜想,这也提示了G-MDSCs在移植后早期患者中的表达具有一定的异质性。Wang等[23]报道了在异基因骨髓移植受者小鼠模型中,移植后MDSCs的比例明显升高,随后会逐渐下降至未行骨髓移植的对照组水平;也有研究显示,allo-HSCT后第28天时拥有高百分比(P=0.025 7)和高绝对数(P=0.011 1)G-MDSCs的患者随后发生aGvHD的风险较高,提示高水平的G-MDSCs可能对aGvHD发生有预测作用;林毓等[19]利用小鼠建立不同严重程度的aGvHD模型,发现移植后2周各组小鼠外周血及脾脏中MDSCs及各亚群的比例均处于较高水平,但移植后4周无aGvHD组小鼠外周血和脾脏MDSCs及其各亚群水平下降,轻度及中重度aGvHD组小鼠MDSCs比例仍保持在较高水平,脾脏MDSCs比例与aGvHD的严重程度呈正相关,中重度组比例较轻度组更高,表明了小鼠异基因骨髓移植后aGvHD可诱导脾脏MDSCs的聚集,且与aGvHD严重程度呈正相关。这与本实验结果有一致之处。因此,有理由认为allo-HSCT术后随着患者免疫重建的进行,其机体内各免疫细胞逐渐趋于成熟,G-MDSCs表达百分率逐渐降低;但发生aGvHD后G-MDSCs的表达量明显升高。因此,allo-HSCT后G-MDSCs的延迟降低可能标志着患者体内存在尚无明显临床症状的炎症,因而有较高发生aGvHD的风险。
HO-1是一种氧化应激标志物[14],已有研究表明其在诱导由细胞中活性氧(reactive oxygen species, ROS)积累引发的氧化应激反应通路相关基因表达中起作用[24-25]。为进一步深入分析G-MDSCs的变化与机体炎症反应间的关联性,本研究对allo-HSCT后患者不同时间点外周血标本中G-MDSCs进行了破膜染色,观察其胞内HO-1的表达情况。结果显示,有aGvHD组allo-HSCT后患者G-MDSCs中HO-1的表达百分比、绝对数及MFI均高于无aGvHD组患者,提示尽管此时患者无明显aGvHD症状,但其体内的氧化应激反应已处于较高水平,免疫系统处于较强的激活状态,因此有较高aGvHD发生风险。IL-10是一类经典的并具有抗炎特性的细胞因子,在预防炎症及病态自身免疫中起到重要作用[26-28];IL-10可通过限制机体对病原体的免疫应答,进而防止宿主受到损伤,在感染中发挥核心作用[29];也是MDSCs发挥免疫抑制作用的机制之一[30]。然而,在allo-HSCT后患者外周血G-MDSCs中并未观察到 IL-10的大量表达,其原因还需后续行转录组测序等来进一步探明。
综上所述,本研究描述了G-MDSCs在allo-HSCT后患者3月内的变化趋势,并对移植后早期G-MDSCs的免疫重建过程这一新兴研究领域进行了探讨,结果表明G-MDSCs及HO-1可能是allo-HSCT后患者aGvHD发生的预警标志,同时也可以反映患者体内的炎症水平。

