金钱菇中降血压肽的纯化和磁性脂质体分离鉴定
陆苑 陆玉婷 杨思敏 冯学珍 伍善广
摘 要:为了从金钱菇中快速分离出降血压肽,利用超声细胞破碎法提取金钱菇蛋白,采用透析、超滤的方法对提取物进行纯化,以固定化金属亲和磁性脂质体(metal affinity-immobilied magnetic liposome,MA-IML)作为吸附介质,以金钱菇提取物为吸附对象,吸附分离其中的降血压肽,并解析其结构,利用分子对接分析其结合血管紧张素I转化酶(angiotensin-I converting enzyme, ACE)的能力。结果表明:对金钱菇提取液用透析、超滤的方法进行纯化后,蛋白含量由37.67%提高至51.18%,多糖含量由26.80%降低至6.90%,ACE抑制率由61.83%提高至79.77%,纯化后更有利于分离降血压肽;用MA-IML粒子吸附分离出金钱菇纯化液中的降血压活性组分,经反相高效液相色谱法分析其为单一组分,该组分为五肽,其氨基酸序列为苯丙氨酸-丙氨酸-色氨酸-丙氨酸-酪氨酸(Phe-Ala-Trp-Ala-Tyr,FAWAY),IC50為179 μmol/L。分子对接模拟表明,FAWAY能与ACE自发发生结合并形成稳定的构象。该研究制备的MA-IML可作为从金钱菇中分离降血压肽的有效工具。
关键词:磁性脂质体;金钱菇;降血压肽;血管紧张素I转化酶(ACE);分离鉴定;分子对接
中图分类号:R284.2 DOI:10.16375/j.cnki.cn45-1395/t.2023.03.016
0 引言
高血压是最常见的慢性疾病,是心血管疾病的主要危险因素,也是世界范围内患者死亡的主要原因[1-2]。血管紧张素I转化酶(angiotensin-I converting enzyme, ACE)通过将血管紧张素I转化为血管紧张素II,并催化血管舒张剂——缓激肽的降解,在血压调节中发挥重要作用[2]。换言之,ACE抑制剂可抑制ACE,降低血压。
从天然产物蛋白质中提取的ACE抑制剂比合成药物更安全。许多研究报道了从牛奶、豆类、蛋、鱼和乳制品等天然产物中提取、分离和纯化得到ACE抑制剂[3-4]。由于蛋白质水解产物很复杂,ACE抑制剂的纯化和鉴定的步骤存在一定困难[5]。亲和层析法是对多肽和蛋白质进行分离纯化的有效方法[6]。1992年,Winzerling等[7]首次报道了固定化金属亲和色谱法(immobilized metal affinity chromatography, IMAC),IMAC在纯化工艺中具有效率高、纯度高、成本低的优点。近年来有报道,利用IMAC对ACE抑制肽进行纯化[8-12]。2014年,Nagami等[13]开发了一种新的色谱技术——金属亲和固定化脂质体色谱(metal affinity-immobilized liposome chromatography, MA-ILC),同时具有IMAC和固定化脂质体色谱ILC的特性。在IMAC中,蛋白质或多肽的分离取决于与金属离子的亲和性差异,而在ILC中脂质体通过疏水相互作用与多种蛋白质或多肽结合。然而,MA-ILC的预处理步骤和操作过程比较复杂。有研究报道磁性固定化金属亲和分离介质能显著提高分离效率[14]。
为了简化分离操作,本课题组结合磁性技术和MA-ILC的分离特性,制备了一种新的固定化金属亲和磁性脂质体(metal affinity-immobilized magnetic liposome, MA-IML)[15],并成功地将其应用于从长蛇鲻蛋白水解产物中分离出ACE抑制肽[16]。用这种磁性脂质体粒子吸附蛋白质或多肽后,可简单地用磁铁快速分离吸附介质和溶液。
食用菌是健康研究的热门领域,具有极高的保健和药用价值,从食用菌(如松茸、姬菇、巨大口蘑、多脂鳞伞、双孢蘑菇等)中分离出的生物活性肽被发现有降血压的功效[17-18]。金钱菇(Lentinus edodes)是一种幼小型、未开伞的香菇,呈小圆形,因像铜板般形状而得名。目前尚未见从金钱菇中提取分离降血压活性肽的相关报道,故本研究选取金钱菇为研究对象,通过超声破碎提取后对蛋白进行纯化,以前期研究制备的MA-IML粒子为吸附介质,分离金钱菇中的降血压肽,为从其他食用菌中快速筛选降血压肽提供了参考。
1 材料与方法
1.1 材料与试剂
金钱菇,广西平南县红心食品有限公司;葡萄糖标准液,国药集团化学试剂有限公司;BCA蛋白浓度测定试剂盒,碧云天生物技术有限公司;马尿酰组胺酰亮氨酸(HHL)、血管紧张素I转换酶(ACE),北京拜尔迪生物技术有限公司;卵磷脂,上海太伟药业股份有限公司;甲醇、乙腈为色谱纯,无水乙醇、氨水、硫酸镍等其他试剂均为分析纯,成都市科隆化学品有限公司。
1.2 仪器与设备
高效液相色谱仪UltiMate3000,赛默飞世尔科技(中国)有限公司;紫外可见分光光度计UV-1900,岛津仪器(苏州)有限公司;酶标仪1510,赛默飞世尔科技(中国)有限公司;基质辅助激光解析电离飞行时间质谱仪AXIMA Performance,岛津(中国)有限公司;依利特色谱柱Hypersil ODS,大连依利特分析仪器有限公司;超声波细胞破碎仪JY98-III,宁波新芝生物有限公司;真空冷冻干燥机LGJ-10,北京松源华兴科技发展有限公司;旋转蒸发仪,东京理化器械株式会社(中国);恒温水浴摇床,天津奥特赛恩斯仪器有限公司;恒温水浴锅,常州蒙特仪器制造有限公司;数显电动搅拌器,常州普天仪器制造有限公司;电子天平,德国塞利多斯集团(中国)等。
1.3 方法
1.3.1 原材料处理
金钱菇粉碎、过筛,利用超声细胞破碎仪,以水为溶剂、按料液比1∶10,在一定pH条件下进行超声提取,离心,2%活性炭脱色,旋转蒸发浓缩,真空干燥,得到金钱菇浸膏,待用。
1.3.2 多糖和蛋白浓度的测定
1.3.2.1 葡萄糖标准曲线的制定
由于没有市售的香菇多糖标准品,类似实验都用葡萄糖标准品来测定多糖浓度[19]。根据文献[20],采用苯酚硫酸法测定多糖的浓度。将葡萄糖标准液稀释至0.1 mg/mL,分别移取0、0.2、0.4、0.6、0.8、1.0 mL葡萄糖标准液于10 mL离心管中,加纯化水使总体积为2 mL。将5%苯酚溶液1 mL依次加到各离心管中,再加入5 mL浓硫酸,混匀,置于沸水浴15 min,冷却后用紫外分光光度计在490 nm处测定吸光度。以葡萄糖浓度为横坐标,吸光度为纵坐标,绘制葡萄糖的标准曲线。
1.3.2.2 蛋白标准曲线的制定
根据文献[21],用BCA法测定蛋白浓度。配制500 μg/mL 的蛋白标准溶液。将500 μg/mL 蛋白标准溶液按0、4、8、12、16、20 μL分别加入到6支1.5 mL离心管里,然后加入纯化水使其总体积为20 μL,依次向各管加入BCA工作液200 μL,混匀后在37 ℃的水浴中孵育30 min,用酶标仪在562 nm处测定吸光度。以蛋白浓度为横坐标,吸光度为纵坐标,绘制蛋白标准曲线。
1.3.3 ACE抑制率的测定
根据文献[22],采用高效液相色谱法测定吸附蛋白的ACE抑制率。色谱柱:依利特Hypersil ODS,4.6 mm×150.0 mm,5 μm;流动相:A相,甲醇;B相,水(含0.1%三氟乙酸);流速:1.0 mL/min;进样量:20 μL;检测波长:228 nm。
样品处理:配制0.1 mol/L硼酸缓冲液,将待测样品经BCA法测定蛋白浓度后,加入ACE溶液,在37 ℃水浴中恒温振荡10 min,然后加入5 mmol/L的HHL溶液,在37 ℃水浴中恒温振摇30 min,最后加入2 mol/L的HCl使反应终止。按上述色谱条件进样分析,样品中蛋白对ACE的抑制率按式(1)进行計算。
IP = [1 ? (Atest/Acontrol)] × 100%. (1)
式中:IP表示抑制率,Atest表示待测样品的峰面积,Acontrol表示对照组的峰面积。
1.3.4 金钱菇溶液的纯化
取适量金钱菇浸膏用纯化水溶解得到金钱菇粗溶液。采用透析和超滤的方法对金钱菇粗溶液进行纯化。取金钱菇粗溶液放在扎好一端口的3KD透析袋中,扎紧另一端口,置锥形瓶中,加200 mL纯化水,37 ℃恒温振荡摇床2 h,倒出洗脱液,重复透析一次,合并洗脱液,旋转蒸发浓缩,得到金钱菇穿透液。将金钱菇穿透液置于3KD超滤管中,14 000g(g为重力加速度)离心15 min,将超滤管内未滤下的金钱菇穿透液取出,滤液为金钱菇纯化液。为确定透析和超滤后金钱菇溶液纯化的效果,根据1.3.2和1.3.3的方法测定并比较金钱菇粗溶液、金钱菇穿透液和金钱菇纯化液的多糖含量、蛋白含量和ACE抑制率。
1.3.5 固定化金属磁性脂质体的制备
按照文献[15]的方法制备MA-IML粒子。首先,采用化学共沉淀法,以FeCl3·6H2O和FeCl2·4H2O为原料,制备磁性Fe3O4粒子。其次采用薄膜分散法,以N-十六烷基亚氨基二乙酸和卵磷脂为原料、无水乙醇为溶剂,旋蒸得到脂质体薄膜。将Fe3O4粒子用少量纯化水混匀后倒入上述薄膜中荡洗,使脂质体充分包裹住磁性Fe3O4粒子,磁棒吸附粒子,弃去上清,加入纯化水多次洗涤粒子直至上清液澄明。最后将磁性粒子置于0.05 mol/L的硫酸镍溶液中浸泡过夜,使镍离子连接到磁性脂质体粒子上,即得MA-IML。
1.3.6 金钱菇降血压活性组分的分离与分析
以MA-IML粒子为吸附介质,参照文献[9]的方法进行吸附反应。取适量金钱菇溶液和粒子置于10 mL离心管中,在30 °C恒温摇床进行吸附反应30 min,磁性吸附分离粒子,用纯化水反复多次洗涤粒子,直到上清液检测不到蛋白(紫外检测280 nm处吸光度为0),保证粒子中无游离蛋白。然后往粒子中加入0.05 mol/L稀盐酸25 mL,在30 °C恒温摇床中反应2 h,以洗脱吸附在粒子上的蛋白,磁性吸附分离粒子,收集洗脱液,调pH至中性,旋蒸浓缩,微孔滤膜过滤,得到蛋白溶液。重复多次吸附实验,收集金钱菇蛋白。采用BCA法测定蛋白浓度,根据1.3.3的方法测定蛋白的ACE抑制率,用线性回归分析计算半数抑制浓度(median inhibitory concentration, IC50),即ACE抑制率为50%时的蛋白浓度。蛋白的IC50越小,ACE抑制活性(即降血压活性)越高。
采用反相高效液相色谱法(reverse phase-high performance liquid chromatography,RP-HPLC)[10]分析收集金钱菇蛋白,即降血压活性组分。色谱柱:依利特Hypersil ODS,4.6 mm×150.0 mm,5 μm;流动相:A相,水(含1%三氟乙酸);B相,乙腈;梯度:0~60 min,0~50% B;流速:1.0 mL/min;进样量:20 μL;检测波长:220 nm。
1.3.7 金钱菇降血压肽的序列鉴定与验证
将收集到的金钱菇降血压活性组分用基质辅助激光解析电离飞行时间(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry, MALDI-TOF)质谱仪对降血压肽进行分析,获得一级、二级质谱图,解析降血压肽的氨基酸序列。由吉尔生化(上海)有限公司合成解析出的降血压肽。根据1.3.3的方法测定降血压肽的ACE抑制率,计算IC50,验证其ACE抑制活性。
1.3.8 分子对接
将鉴定得到的降血压肽与ACE进行分子对接模拟,以进一步确认降血压肽和酶之间的相互作用。将核心蛋白名称(ACE)输入 PDB 数据库,在“Scientific Name of Source Organism”中设置筛选条件为“Homo sapien & X-RAY Diffraction”,获取“Summary Reports”,选中“ligand”并按“Resolution: Best to Worst”排序,得到最适合的PDB ID:1O86。运用薛定谔软件对蛋白受体和配体进行分子对接,验证蛋白与配体之间的互作关系。一般认为,对接得分小于0,提示配体分子与受体蛋白能自发结合;对接得分小于-5,提示结合具有显著性,且分值越小,表示配体与受体的结合能力越强,结合构象越稳定。
2 结果与分析
2.1 多糖和蛋白质量浓度的测定
2.1.1 多糖质量浓度的测定
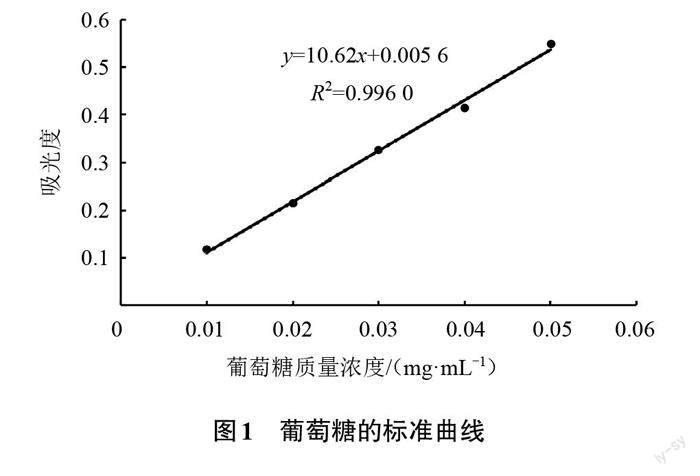
葡萄糖的标准曲线如图1所示,通过线性回归得到吸光度(y)和葡萄糖质量浓度(x)关系的方程:y =10.62x+0.005 6(相关系数R2=0.996 0),线性范围为0.01~0.05 mg/mL,在此范围内吸光度和葡萄糖质量浓度的线性关系良好。采用苯酚硫酸法建立的葡萄糖标准曲线可用于测定金钱菇溶液中的多糖质量浓度及多糖含量。
2.1.2 蛋白质量浓度的测定
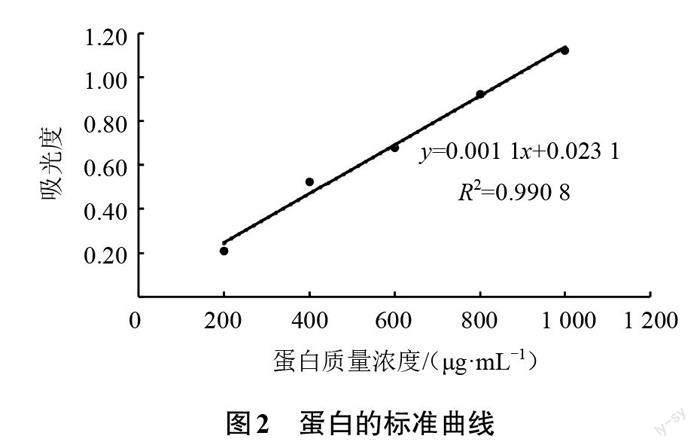
蛋白的标准曲线如图2所示,通过线性回归得到吸光度(y)和蛋白质量浓度(x)关系的方程:y =0.001 1x+0.023 1(R2=0.990 8),线性范围为200~1 000 μg/mL,在此范围内吸光度和蛋白质量浓度的线性关系良好。采用BCA法建立的蛋白标准曲线可用于测定后续金钱菇溶液中的蛋白质量浓度及蛋白含量。
2.2 金钱菇溶液的纯化结果
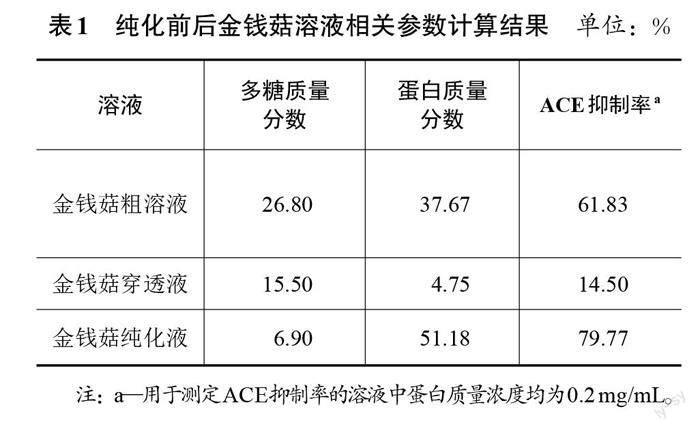
根据葡萄糖和蛋白的标准曲线、样品体积和金钱菇浸膏的初始质量,可以计算得到金钱菇溶液样品中的多糖含量和蛋白含量。从表1的对比结果可知,经过透析和超滤,金钱菇纯化液与未经纯化的金钱菇粗溶液相比,多糖质量分数由26.80%降低至6.90%,蛋白质量分数由37.67%增加至51.18%,ACE抑制率由61.83%增加至79.77%,说明透析和超滤的方法能有效提高金钱菇溶液中的活性蛋白质量分数,除去大部分会影响活性蛋白分离的糖类,从而有利于后续实验从金钱菇溶液中分离出活性蛋白。故后续实验以金钱菇纯化液为分离降血压活性蛋白的实验对象。
2.3 金钱菇降血压活性组分的分析结果
以MA-IML粒子为吸附介质,金钱菇纯化液为吸附对象,进行多次吸附实验收集蛋白,测得金钱菇蛋白的IC50为0.118 mg/mL。这表明金钱菇蛋白的ACE抑制活性较高,也证明利用MA-IML粒子可以有效吸附分离得到金钱菇溶液中的降血压活性组分。
利用RP-HPLC对吸附分离出的金钱菇降血压活性组分进行分析,结果如图3所示,色谱图中有一个明显的单峰。这说明从金钱菇溶液中分离得到的降血压活性组分为单一组分,后续实验可以直接以浓缩后的金钱菇蛋白吸附液为对象进行MALDI-TOF质谱分析。
2.4 金钱菇降血压肽的氨基酸序列分析与验证结果
对金钱菇降血压活性组分进行质谱分析和鉴定,得到的一级质谱图如图4所示,图中有1个丰度最高的母离子质荷比(m/z)为656,可推测为分子量656的多肽。选择这个m/z为656的母离子进行二级质谱分析,得到如图5所示的二级质谱图(肽图),结合二级质谱图中的碎片离子峰对这一降血压肽进行氨基酸序列分析,推测得到的氨基酸结构信息如表2所示。
根据所用质谱仪的碎片断裂模式及18种基本氨基酸的分子量,从二级质谱图中可以找到部分b离子和y离子的碎片离子峰,推测从金钱菇溶液中吸附分离出来的降血压肽为表2所示的氨基酸序列:苯丙氨酸-丙氨酸-色氨酸-丙氨酸-酪氨酸(Phe-Ala-Trp-Ala-Tyr,FAWAY)。将这个序列的五肽合成出来之后,测定其ACE抑制率,计算得到其IC50值为179 μmol/L,与上述初步测定的金钱菇蛋白IC50值非常接近,故可确定从纯化后的金钱菇溶液中吸附分离出来的活性组分是序列为FAWAY的五肽。
2.5 分子對接结果
降血压肽与ACE结合才能发挥抑制ACE的作用。二者之间的结合能力,可以利用薛定谔软件对分离得到的降血压肽FAWAY和ACE进行分子对接模拟,对接模型如图6所示,FAWAY与ACE之间可以形成6个氢键、1个盐桥和2个π键。模拟得到的对接得分为-6.592,表明FAWAY与ACE可以自发发生结合,且具有较强的结合能力,结合构象较稳定。分子对接结果预测了从金钱菇中分离出来的降血压肽FAWAY能够与ACE发生相互作用,从而发挥其对ACE的抑制作用。
3 讨论
3.1 金钱菇溶液的纯化
降血压肽通常是由2~12个氨基酸组成的短肽[23]。由于实验以金钱菇提取物为分离降血压肽的对象,溶液中除了不同分子量大小的蛋白质和多肽外,可能还含有较多的香菇多糖,会影响小分子活性蛋白的分离,因此,考虑用常见的透析和超滤的方法来除去多糖和大分子蛋白,提高金钱菇溶液中活性蛋白的纯度。此外,金钱菇穿透液中也检测到少量蛋白,说明可能有部分疏水性较强的降血压肽与超滤膜发生了相互作用而吸附在膜上[23],未进入滤液中。有文献报道用大孔吸附树脂来纯化燕麦肽[24],使多糖质量分数由66.76%降低至36.61%,蛋白质量分数由28.38%增加至62.93%,ACE抑制率由65.76%增加至78.56%,本研究的纯化效果与文献报道相当,说明透析、超滤的纯化方法可行。
3.2 金钱菇降血压活性组分的分离
很多文献报道了从食用菌中分离、纯化降血压肽的方法,最常用的包括超滤法、排阻色谱法、离子交换色谱法和一维或二维反相高效液相色谱法[25]。Kaprasob等[26]采用多个步骤从一种牛肝菌中分离降血压肽,首先用不同规格的超滤膜对牛肝菌蛋白水解物进行超滤,筛选出ACE抑制活性最高的馏分,对其进行离子交换色谱分离,其中蛋白含量最高、活性最好的组分再用反相高效液相色谱法进行分离,最后获得纯度较高的组分,用于氨基酸序列分析。类似地,Zhang等[27]利用超滤、醇沉、离子交换和凝胶过滤等多步方法,从5种食用菌中分别纯化得到降血压活性组分,进行氨基酸序列鉴定。超滤法利用蛋白分子量的差异进行分离,但能否有效分离还取决于蛋白和超滤膜的相互作用。排阻色谱法(或称为凝胶色谱法)和离子交换色谱法对混合物的分离能力较差,反相高效液相色谱法对低丰度蛋白的检测能力有限。因此这些方法常常联合使用,从而实现对复杂蛋白体系的有效分离。但这些方法联用的最大缺点是,每一步都需对各个组分逐一进行活性验证,样品或材料预处理的步骤较多,实验耗费的时间较长,分离过程繁杂。
本實验利用磁性亲和吸附介质,可以直接对超滤过的金钱菇提取液中的多肽进行吸附分离并得到了单一组分,省去了复杂的前处理操作,还可以利用外部磁场迅速进行分离,磁性粒子可以回收循环再利用,大大节省了实验时间和成本。实验结果表明,本研究所采用的磁性脂质体吸附分离方法,其效果与文献报道相当。
3.3 金钱菇降血压肽的活性与结合机制
本研究分离鉴定出的金钱菇降血压肽FAWAY鲜有文献报道。最近的一篇综述[28]总结了从多种食用菌中分离鉴定得到的降血压肽,其IC50值范围为3.2 ~ 1 079.0 μmol/L,平均值为240.0 μmol/L。本研究发现的金钱菇降血压肽FAWAY活性与其他食用菌中的降血压肽活性相近。此外,本研究的分子对接模拟与文献报道的结果[25-26]相似,食用菌降血压肽与ACE结合的作用力中以氢键为主,其他分子间作用力对二者的稳定结合也起到了不可忽视的作用。
4 结论
MA-IML作为一种新型吸附介质,分离出了金钱菇中的一种活性较好的降血压肽FAWAY,证明MA-IML可作为从金钱菇中分离ACE抑制肽的有效工具。但作为一次以食用菌为研究对象的新尝试,本研究尚存在一些值得进一步研究的问题。首先,金钱菇蛋白的提取方法需要进行优化,例如,以蛋白含量、ACE抑制率等为指标,通过单因素或正交试验研究pH值、温度、超声功率、超声时间等因素对提取的影响;其次,在利用MA-IML吸附金钱菇活性组分时,还可以对粒子与吸附溶液的固液比、吸附溶液pH值、吸附温度、吸附时间、洗脱液浓度等因素进行优化,从而提高吸附分离降血压肽的效率;此外,在分子对接预测结果的基础上,可以通过动力学实验进一步分析金钱菇降血压肽对ACE的抑制作用机制,明确其抑制类型。天然产物提取物仍是一个复杂的体系,开发一种快速筛选天然产物中降血压肽的新方法将为食品科学、保健品开发等领域的研究提供高效的途径。本研究利用磁性脂质体分离金钱菇中的降血压肽,可作为从食用菌中分离活性肽的参考依据。
参考文献
[1] AGUIAR L, FERREIRA J, MATOS A, et al. Interplay between glycemia and the genetics of eNOS and ACE for the susceptibility to the onset and development of hypertension on the Portuguese population[J]. Gene Reports, 2021, 22: 100975.
[2] HIPPAUF F, LUNOW D, HUETTNER C, et al. Enhancing ACE-inhibition of food protein hydrolysates by selective adsorption using porous carbon materials[J]. Carbon, 2015, 87: 309-316.
[3] WU S F, WANG X C, QI W, et al. Bioactive protein/peptides of flaxseed: a review[J]. Trends in Food Science and Technology, 2019, 92: 184-193.
[4] LEE S Y, HUR S J. Antihypertensive peptides from animal products, marine organisms, and plants[J]. Food Chemistry, 2017, 228: 506-517.
[5] VILLADONIGA C, CANTERA A M B. New ACE-inhibitory peptides derived from α-lactalbumin produced by hydrolysis with Bromelia antiacantha peptidases[J]. Biocatalysis and Agricultural Biotechnolog, 2019, 20: 101258.
[6] HAMEED O, OZCAN F, ERTUL S, et al. Preparation of immobilized metal affinity nanofiber for globulin depletion[J]. Biology Nano Science, 2020, 10(4): 1084-1093.
[7] WINZERLING J J, BERNA P, PORATH J. How to use immobilized metal ion affinity chromatography[J]. Methods, 1992, 4(1): 4-13.
[8] LIU P R, LAN X D, YASEEN M, et al. Immobilized metal affinity chromatography matrix modified by poly (ethylene glycol) methyl ether for purification of angiotensin I-converting enzyme inhibitory peptide from casein hydrolysate[J]. Journal of Chromatography B, 2020, 1143: 122042.
[9] LAN X D, LIAO D K, WU S G, et al. Rapid purification and characterization of angiotensin converting enzyme inhibitory peptides from lizard fish protein hydrolysates with magnetic affinity separation[J]. Food Chemistry,2015,182:136-142.
[10] MEGIAS C, PEDROCHE J, YUST M M, et al. Immobilization of angiotensin-converting enzyme on glyoxyl-agarose[J]. Journal of Agricultural and Food Chemistry, 2006, 54(13): 4641-4645.
[11] WU S G, FENG X Z, LU Y, et al. Purification of angiotensin I-converting enzyme(ACE)inhibitory peptides from casein hydrolysate by IMAC-Ni2+[J]. Amino Acids, 2017, 49(10): 1787-1791.
[12] SUN L X, WU S G, ZHOU L Q, et al. Separation and characterization of angiotensin I converting enzyme (ACE) inhibitory peptides from Saurida elongata proteins hydrolysate by IMAC-Ni2+[J]. Marine Drugs, 2017, 15(2): 29.
[13] NAGAMI H, UMAKOSHI H, KITAURA T, et al. Development of metal affinity-immobilized liposome chromatography and its basic characteristics[J].Biochemical Engineering Journal, 2014, 84: 66-73.
[14] ABUDIAB T, BEITLE JR R R. Preparation of magnetic immobilized metal affinity separation media and its use in the isolation of proteins[J].Journal of Chromatography A, 1998,795(2): 211-217.
[15] LU Y, LIAO D K, FENG X Z,et al. Development and adsorption characterization of metal affinity-immobilized magnetic liposome[J].Journal of Nanomaterials,2020, 2020:1-8.
[16] LU Y, WU Y J, HOU X H, et al. Separation and identification of ACE inhibitory peptides from lizard fish proteins hydrolysates by metal affinity-immobilized magnetic liposome[J]. Protein Expression and Purification, 2022, 191: 106027.
[17] ZHOU J J, CHEN M F, WU S J, et al. A review on mushroom-derived bioactive peptides: preparation and biological activities[J]. Food Research International, 2020, 134: 109230.
[18] GENG X R, TIAN G T, ZHANG W W, et al. A tricholoma matsutake peptide with angiotensin converting enzyme inhibitory and antioxidative activities and antihypertensive effects in spontaneously hypertensive rats[J]. Scientific Reports,2016,6(1):1-9.
[19] 李宝良,李书剑.香菇多糖苯酚试剂测定研究[J].中国卫生检验杂志,2005,15(11):54-55.
[20] 溫文娟,刘珊,黄远丽.苯酚硫酸法与蒽酮硫酸法测定香菇多糖含量比较[J].现代食品,2020(21): 177-179.
[21] 王丽,王吟,胡业勤,等.BCA法检测组分百日咳疫苗中间品蛋白含量的可行性评价[J].中国生物制品学杂志,2020,33(9):1048-1053.
[22] WU S G, SUN J H, TONG Z F, et al. Optimization of hydrolysis conditions for the production of angiotensin-I converting enzyme-inhibitory peptides and isolation of a novel peptide from lizard fish (Saurida elongata) muscle protein hydrolysate[J].Marine Drugs, 2012, 10(5): 1066-1080.
[23] PIOVESANA S, CAPRIOTTI A L,CAVALIERE C, et al. Recent trends and analytical challenges in plant bioactive peptide separation, identification and validation[J]. Analytical and Bioanalytical Chemistry, 2018, 410(15): 3425-3444.
[24] 王雙,王昌涛,韩扬.燕麦ACE抑制肽的分离纯化及其活性研究[J].食品科学,2010,31(24):222-229.
[25] ABDELHEDI O,NASRI M. Basic and recent advances in marine antihypertensive peptides :production,structure-activity relationship and bioavailability[J]. Trends in Food Science and Technology,2019,88:543-557.
[26] KAPRASOB R, KHONGDETCH J, LAOHAKUNJIT N, et al. Isolation and characterization, antioxidant, and antihypertensive activity of novel bioactive peptides derived from hydrolysis of King Boletus mushroom[J]. LWT-Food Science and Technology,2022,160:113287.
[27] ZHANG P, ROYTRAKUL S, SUTHEERAWATTANA
NONDA M. Production and purification of glucosamine and angiotensin-I converting enzyme(ACE)inhibitory peptides from mushroom hydrolysates[J].Journal of Functional Foods, 2017, 36: 72-83.
[28] LANDI N, CLEMENTE A,PEDONE P V, et al. An updated review of bioactive peptides from mushrooms in a well-defined molecular weight range[J].Toxins, 2022,14(2): 84.
Purification of anti-hypertensive peptide and separation identification of magnetic liposome from Lentinus edodes
LU Yuan, LU Yuting, YANG Simin, FENG Xuezhen, WU Shanguang*
(Medical School, Guangxi University of Science and Technology, Liuzhou 545005, China)
Abstract:To separate anti-hypertensive peptide from Lentinus edodes, the Lentinus edodes proteins were extracted by using an ultrasonic cell disrupter and purified by dialysis and ultra-filtration. The metal affinity-immobilized magnetic liposome(MA-IML)particles were prepared and used as absorption medium to separate anti-hypertensive peptide from Lentinus edodes. The amino acid

