陆地棉漆酶基因家族成员表达模式分析
左春阳 李亚玮 李焱龙 金双侠 朱龙付 张献龙 闵 玲
陆地棉漆酶基因家族成员表达模式分析
左春阳**李亚玮**李焱龙 金双侠 朱龙付 张献龙 闵 玲*
华中农业大学作物遗传改良全国重点实验室/ 湖北洪山实验室, 湖北武汉 430070
漆酶是铜蓝氧化酶蛋白家族的一员, 在植物木质素合成和提高植株抵御胁迫能力等方面发挥着重要作用。本研究从陆地棉基因组中鉴定到104个漆酶基因()家族成员, 进行了系统进化树和组织表达图谱的构建, 并随机选取了20个基因进行荧光定量PCR分析, 验证了表达热图的结果。为进一步探索漆酶在棉花中担当的角色, 本研究采用启动子-GUS融合载体转化拟南芥, 通过转基因拟南芥不同发育过程不同组织GUS染色结果, 分析了陆地棉漆酶基因家族6个成员(、、、、、)的精细表达模式。为探究漆酶在逆境中发挥的作用, 对该6个漆酶基因进行了切割和刺洞2种创伤胁迫诱导表达分析, 并利用2个棉花品系‘84021’ (高温耐受型)和‘H05’ (高温敏感型)在常温和高温胁迫条件下不同时期的花药进行相应基因的荧光定量PCR分析。研究结果表明, 随机挑选的20个基因在根、茎、叶、花瓣、花药和柱头6个组织中差异表达, 大多数基因的表达与转录组结果一致。6个漆酶基因的启动子能够不同程度地驱动基因在种子萌发时期、二叶期、四叶期表达; 创伤处理结果显示、的启动子受创伤诱导后驱动GUS蛋白在叶片中表达的能力显著提高, 暗示着这2个基因可能参与创伤胁迫响应。6个基因在棉花耐高温品系‘84021’的四分体时期和花药开裂期高温胁迫后都有表达量显著下调的趋势, 推测基因可能负调控陆地棉花药高温耐受性。本研究结果为进一步探索漆酶家族基因功能提供了参考。
陆地棉; 漆酶基因; 启动子-GUS表达模式分析; 花药高温响应; 创伤诱导
1883年Yoshida首次从日本漆树()的汁液中分离得到漆酶(benzenediol: oxygen oxidoreductases [EC1.10.3.2])[1], 该酶是一种结合铜离子的糖蛋白, 属于铜蓝氧化酶蛋白家族, 其氧化机理是利用分子氧作为电子受体, 催化多种酚类化合物和芳香胺的氧化, 并将其还原为水[2]。漆酶根据来源可分为真菌漆酶和植物漆酶[3], 在真菌中, 它主要与木质素的降解[4]、分生孢子的致病性[5]和脱毒作用[6]有关。植物漆酶的生理功能主要是参与防御反应相关的过程, 如细胞壁木质素合成和酚类化合物聚合等[7]。木质素是植物细胞壁氧化聚合木质素单体而形成的高聚物, 也是植物细胞壁的主要成分之一。被子植物的木质素是复杂的酚类聚合物, 在细胞质基质中合成的木质素单体, 被输送至细胞壁, 在此氧化生成木质素。长期以来, 植物细胞壁丰富的过氧化物酶被认为是催化木质素单体氧化聚合的首要酶, 但有研究表明, 漆酶分泌到植物细胞次生壁, 在有氧气存在时, 可以催化同样的聚合反应。1992年从欧亚槭树()中分离得到漆酶, 并证明其可以体外催化木质素单体的氧化聚合[8], 该研究还认为漆酶参与木质素单体氧化聚合形成寡聚物, 而过氧化物酶则参与后期形成高聚物的反应[8]。Liang等[9]发现拟南芥漆酶基因的突变会导致突变体中木质素单体的聚合活性下降, 拟南芥种子中木质素含量减少30%。而将野生棉的漆酶基因在杨树中超量表达可显著提高杨树中木质素的含量, 证明棉花的漆酶基因也参与木质素的合成[10]。Bao等[11]在研究火炬松()漆酶时同样得出了漆酶与木质素合成相关的结论。Berthet等[12]在拟南芥中发现了2个在茎中强烈表达的基因:和, 通过对突变体的研究发现,和都参与了拟南芥茎的组成性木质化, 并且参与了G木质素单位在纤维中的沉积。Miguel等[13]依据试验发现,、、定位于果荚的木质化细胞壁, 利用CRISPR/Cas9同时敲除了这3个基因, 突变体表现出严重的生长阻滞、产生木质化减少和茎秆木质部导管塌陷, 证明内果皮木质化需要、和的驱动。
近年来, 各种研究表明漆酶不仅是植物木质素合成途径中的关键酶之一, 能够起到调控植物体内酚类代谢物合成的作用, 从而参与木质素纤维细胞壁的结构形成, 而且与植物的生长发育乃至育性性状有关。Zhang等[14]确定了OsmiR397通过下调其靶基因来增加籽粒产量。Zhong等[15]发现OsAGO17与形成一个RNA诱导沉默复合体(RISC), 通过抑制基因表达影响水稻发育, 从而证明OsAGO17可能是sRNA通路中的一个关键蛋白, 对水稻籽粒大小和粒重具有正向调控作用。Sun等[16]研究表明, 13对miRNA/靶基因通过响应温度变化调控水稻PA64S的雄性育性, 其中miR156、miR5488和miR399分别通过影响SPLs、花药壁木质素合成和类黄酮代谢途径来影响PA64S的雄性育性。
此外, 种种研究表明植物漆酶还具有其他生物学功能, 在生物技术领域应用广泛[17]。研究者将棉花漆酶基因在拟南芥中过量表达, 发现转基因拟南芥对酚酸类物质的抗性明显增强[10]。Jiao等[18]从平菇全基因组序列中鉴定出12个漆酶基因, 分析了12个基因在平菇不同发育阶段和不同培养基质下的表达模式, 结果表明,和可能分别参与木质素的降解和菌丝体的形成, 随后在平菇中过表达基因, 可显著提高转化子的漆酶活性, 且转基因菌株在30 d内对棉秆木质素的降解率比野生型高2.36%~6.30%。该研究表明过表达可显著增强棉秆木质素的降解。此外, 当利用35S启动子驱动土豆漆酶基因在番茄中过量表达时, 可改变番茄体内氯原酸等酚类物质的含量, 从而显著提高转基因番茄对丁香假单胞菌(pv.)的抗性[19]。而另一方面, 有研究报道漆酶可以保护真菌病原菌免受寄主植保素和鞣质等化合物的影响[20], 所以漆酶也被认为是重要的病原菌毒力因子, 漆酶活性下降与真菌毒力下降有直接的关联[21-22]。
除此之外也有植物漆酶抗病虫的报道, Hu等[23]证明了过表达棉花漆酶基因导致木质化的增加, 与真菌病原体大丽黄萎病菌和棉铃虫的耐受性增加有关, 转基因操纵的表达可以增强棉花对病原体和害虫的防御反应。Wei等[24]鉴定了棉花漆酶基因, 该基因参与木质素生物合成和植物对黄萎病的抗性。Pourcel等[25]研究报道一个基因TT/AtLAC15, 其参与类黄酮在拟南芥种皮中的氧化聚合和原花青素的合成, 对于植物抗紫外线、抗病、抗虫、清除自由基、调节种子休眠和萌发等生理功能具有重要作用。
漆酶是多基因家族, 在双子叶模式植物拟南芥中有17个成员[26], 在单子叶模式植物水稻中有30个成员[27], 功能冗余以及其底物的广泛性使得漆酶在植物体内的功能难以被准确鉴定。本研究对陆地棉漆酶基因家族成员进行鉴定, 通过启动子-GUS融合载体转化拟南芥, 揭示了陆地棉漆酶家族6个成员的组织表达模式, 探究了漆酶基因在不同生长发育时期的表达情况; 并通过对转基因植株进行创伤诱导处理, 探究漆酶在抗虫抗病方面的应用。此外, 在耐、敏高温陆地棉材料高温和常温条件下探究花药中漆酶表达量的变化趋势, 为了解漆酶基因在花药高温胁迫响应方面的作用奠定了基础。本研究以期为深入了解漆酶在陆地棉生长发育过程及抗逆胁迫响应中所承担的功能提供理论依据。
1 材料与方法
1.1 植物材料与种植条件
哥伦比亚野生型拟南芥(,)作为转基因受体材料。所有拟南芥种子种植前经过2 d的4℃低温春化处理, 人工气候箱种植时温度设置为22℃,湿度为60%, 16 h光照(光强100~120 μmol m–2s–1)。用于组织表达分析的材料为陆地棉()‘H05’, 用于高温诱导表达分析的材料为陆地棉‘84021’和‘H05’, 温室种植‘84021’和‘H05’, 于盛蕾时期设定白天28~35℃持续12 h, 晚上20~25℃持续12 h为正常条件, 高温条件为白天37~39℃持续12 h,晚上29~31℃持续12 h, 高温处理周期为7 d。
1.2 载体与菌株
pGEM-T Easy载体用于TA克隆; pDONOR221为BP-LR反应入门载体; 用于启动子表达模式分析所用载体为pGWB433。载体转化的大肠杆菌受体为; 拟南芥的侵染农杆菌()菌株为(菌株、质粒由华中农业大学作物遗传改良全国重点实验室棉花遗传改良课题组保存)。
1.3 载体构建及遗传转化
根据基因的启动子序列设计引物, 扩增目的片段并通过BP反应将PCR产物连接到中间载体pDONR221 (购于Invitrogen公司)上, 之后与目的载体(pGWB433)进行LR反应, 最终获得不同基因的启动子序列的重组载体。利用农杆菌介导的花序浸染法将构建的表达载体转入拟南芥[20]。首先, 将活化后的含有目的载体的农杆菌()接种到200 mL液体LB培养基中, 在28℃摇床上200转 min–1培养过夜, 待菌液OD600达到0.8~0.9后离心收集菌体, 并用浸染缓冲液(5%蔗糖, 0.01% Silwet L-77)将菌体重悬, 随后进行花序浸染转化。收取T0代拟南芥种子, 并用75%酒精消毒2次, 每次5 min, 再使用50% (v/v)的84消毒液消毒3次, 每次1 min, 之后用无菌水于超净工作台中清洗种子5次, 每次1 min, 后将种子播种于加入了卡拉霉素的培养基中进行转基因阳性植株的筛选。卡拉霉素筛选法筛选至T2代全部不出现抗性分离的阳性纯系植株。
1.4 主要酶类和试剂
RNA提取试剂盒购于Sigma公司, 反转录酶M-MLV Reverse Tran-scriptase购于Promega公司, 限制性内切酶购于NEB公司,DNA聚合酶, dNTP和T4 DNA连接酶。GUS染液配方如下: 0.9 g L–1X-Gluc (4-甲基-7-氧香豆素-β-D-葡萄糖苷酸, Alfa Aesar), 50 mmol L–1磷酸钾缓冲液(pH 7.0), 20% (v/v)甲醇和100 mg L–1氯霉素。qRT-PCR试剂购于ABI公司。载体构建过程中所用的抗生素有氨苄青霉素、庆大霉素、卡那霉素、利福平等, 均购自Sigma公司。
1.5 陆地棉漆酶基因家族成员的鉴定及进化树构建
在棉花基因组数据库(https://cottonfgd.org/)通过关键词“Laccase”检索, 获得陆地棉基因组数据库中漆酶基因家族成员的CDS序列和蛋白序列, 再用NCBI (https://www.ncbi.nlm.nih.gov/)的Blastn和Blastp以及DNAMAN对已获得的陆地棉漆酶家族()的成员进行鉴定分析, 陆地棉漆酶基因基本信息见表1。利用MEGA 7对拟南芥、水稻、陆地棉漆酶家族成员进行多序列比对, 并运用邻接法(Neighbor-Joining法, Bootstrap设为1000, 其他参数为默认值)构建系统进化树。本研究中陆地棉基因序列来源于华中农业大学数据库(https://www.cottongen.org/); 拟南芥基因数据来源于TAIR数据库(http:// www.arabidopsis.org/); 水稻序列来自phytozome数据库(https://phytozome.jgi.doe.gov/pz/portal.html)。

表1 本试验所用引物及用途
1.6 陆地棉漆酶基因家族成员组织表达热图分析
基于本课题组前期陆地棉高温敏感品系“H05”不同组织的表达谱数据[28], 数据结果最终归一化为TPM (transcripts per kilobase of exon model per million mapped reads), 获得GhLAC基因家族各成员的表达量数据, 利用Heatmap Illustrator软件(https:// hemi.biocuckoo.org/)绘制GhLAC基因家族各成员的组织表达热图。
1.7 陆地棉漆酶基因家族组织表达分析
分别以陆地棉“H05”根、茎、叶、花瓣、柱头和花药等不同组织cDNA为模板, 利用qRT-PCR方法检测候选基因的表达情况。棉花不同组织的RNA提取依据改良的异硫氰酸胍法[29], 微量分光光度计(NanoDrop2000, 美国)检测RNA浓度, 电泳检测RNA质量。每份材料取3 µg RNA于0.5 mL无RNA酶离心管中用M-MLV逆转录酶(Invitrogen)进行反转录合成cDNA。反转的cDNA样品稀释100倍作为表达量检测的模板。设置每个样本3次生物学重复和3次技术重复, 内参基因选定看家基因(Gh_ A11G011460)。反应体系包含7 µL稀释的cDNA模板、7 µL SYBR Green Master Mix Reagent (Bio-Rad公司)、正反引物各0.5 µL (4.5 nmol L–1)。反应程序为95℃预变性60 s; 95℃ 15 s, 60℃ 30 s, 40个循环。采用2–ΔΔCt方法计算基因的相对表达量[30]。基因qRT-PCR定量引物跨外显子设计, 详见表1。
1.8 拟南芥不同时期GUS染色及创伤诱导处理
将拟南芥于种子萌发期、二叶期、四叶期以及成熟期分别取样后, 放入含有反应底物X-Gluc的染色液中(0.9 g L–1X-Gluc, 50 mmol L–1磷酸钾缓冲液(pH 7.0), 20% (v/v)甲醇和100 mg L–1氯霉素), 37℃染色过夜, 随后用75%酒精充分脱色, 用体式显微镜(Leica MZFLⅢ)观察并照相。筛选出纯合株系进行创伤诱导处理。本试验设置对照组, 切割处理组, 刺洞处理组3组进行, 分别标记为CK、C和P。当拟南芥生长至二叶期与四叶期时分别取样。刺洞处理组用无菌细针在拟南芥其中一片子叶上进行刺洞,切割处理组用无菌刀在拟南芥其中一片子叶上进行切割, 对照组不作处理。之后对所有材料进行GUS染色处理, 方法同上。
2 结果与分析
2.1 陆地棉漆酶基因家族(GhLAC)成员的鉴定及进化树构建
在陆地棉基因组中共寻找到104个LAC基因家族成员, 将陆地棉、单子叶模式植物水稻和双子叶模式植物拟南芥的蛋白序列共同使用MEGA 7软件进行Construct/Test Neighbor-Joining Tree分析, 构建系统发育树(图1)。为进一步了解家族成员的功能, 根据漆酶基因蛋白序列比对结果[31], 将漆酶基因家族分为6组。第I组包括8个陆地棉漆酶成员, 2个水稻漆酶成员和1个拟南芥漆酶成员; 第II组包括17个陆地棉漆酶成员, 4个水稻漆酶成员和3个拟南芥漆酶基因; 第III组包括19个陆地棉漆酶成员, 2个水稻漆酶成员和5个拟南芥漆酶基因; 第IV组只有7个陆地棉漆酶成员和4个水稻漆酶成员; 第V组包括21个陆地棉漆酶成员, 7个水稻漆酶成员和4个拟南芥漆酶成员; 第VI组包括32个陆地棉漆酶成员, 11个水稻漆酶成员和4个拟南芥漆酶成员。
根据陆地棉漆酶基因在染色体上的位置信息以及进化树所展示的部分同源关系,对该104个LAC基因家族成员进行命名(表2), 其中A和D亚组同源基因对有30对, 命名为~, A亚组特异基因命名为, D亚组特异基因命名为, 有2个基因定位在scaffold上, 将其命名为和。
2.2 GhLAC家族基因组织表达模式分析
基于本课题组前期“H05”不同组织的表达谱数据[28], 将基因在“H05”根、茎、叶、花瓣、花药与柱头中表达量的值进行log2计算后, 用于构建基因家族成员的表达热图(图2)。结果显示, 在104个陆地棉LAC基因中, 有43个基因在6个组织中表达量较低, 其中有9个基因(、、、、、、、、)在6个组织中表达量TPM值为0; 其余61个基因在不同组织中有不同程度的表达。有5个基因在根中高量表达, 其中、和表达量较高; 有19个基因在茎中高量表达, 其中、和表达量较高; 有18个基因在叶中高量表达, 其中、和表达量较高; 有4个基因在花瓣中高量表达, 其中表达量最高; 有12个基因在花药中高量表达, 其中和表达量最高; 有8个基因在柱头中高量表达, 其中和表达量最高(图2-B)。

图1 陆地棉、拟南芥和水稻LAC基因家族进化树分析

表2 陆地棉LAC基因家族信息

(续表2)
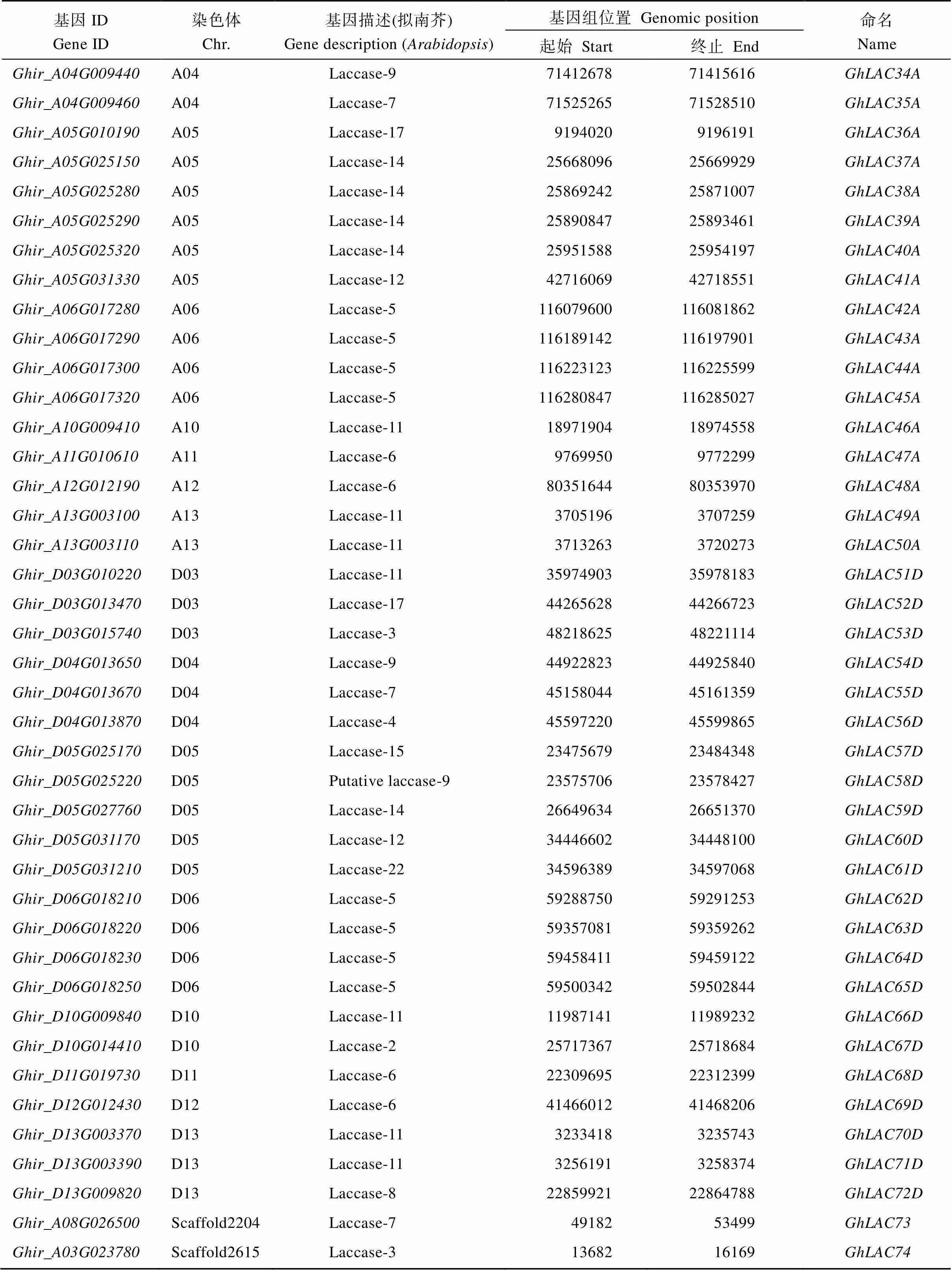
(续表2)

图2 陆地棉LAC基因表达热图
A:基因家族在‘H05’根、茎、叶、花瓣、花药与柱头中的表达热图。B: 不同组织中高量表达的基因。
A: heat map ofgene family expression in root, stem, leaf, petal, anther, and stigma of H05. B: the classification of highly expressed genes in different tissues.
为证实表达谱数据的可靠性, 随机挑选20个基因, 并跨5′UTR和CDS区域设计引物, 在“H05”的根、茎、叶、花瓣、花药和柱头6个组织进行qRT-PCR分析。结果显示这20个基因在6个组织中差异表达, 大部分基因的表达与表达谱结果一致。其中、、和在根部特异高量表达, 其他组织不表达或表达量低。其余16个基因在5个组织中都能检测到不同程度的表达。、、和在根中优势表达;、和在茎中优势表达;、和在叶中优势表达;、、、、和在花瓣中优势表达;、在柱头中优势表达;、在花药中优势表达(图3)。
2.3 6个GhLACs基因启动子在转基因拟南芥中的表达模式分析
为探讨家族基因在棉花中的功能, 进一步了解基因家族成员在不同组织中的精细表达情况, 根据上述表达结果(图2和图3), 本研究分别在A/D亚组中各挑选3个, 共6个有着不同的组织表达模式的陆地棉漆酶基因, 分别为、、、、、, 进行相应启动子的克隆, 并将棉花基因的启动子与目的载体pGWB433进行连接, 获得重组载体, 并转化拟南芥, 最终获得转基因植株, 在不同时期进行GUS染色; 并对这6个漆酶基因在耐高温品系‘84021’和敏高温品系‘H05’高温和常温条件下的四分体时期(TS)、绒毡层发育与降解时期(TDS)和花药开裂时期(ADS)花药中的表达进行qRT-PCR分析。

图3 GhLAC基因家族部分成员组织表达分析
R: 根; S: 茎; L: 叶; P: 花瓣; St: 柱头; A: 花药。误差值代表3个生物学重复的标准差,()为内参基因。通过ANOVA方法分析表达差异显著性, 不同的字母代表在0.05概率水平差异显著。
R: root; S: stem; L: leaf; P: petal; St: stigma; A: anther. The error value represents the standard deviation of the three replicates, and() was the internal reference gene. Different letters indicate significantly different at< 0.05 by one-way ANOVA.
2.3.1 6个基因家族成员在种子萌发时期的表达模式分析 GUS染色结果显示, 在种子萌发初期,、和基因的启动子可以驱动报告基因的表达, 而、、的启动子在此时期未能驱动报告基因的表达。其中、驱动基因在整个种子表达;表达程度较高,表达程度相对低些;在幼根有微量表达。在种子萌发后期, 除转基因植株没有被染上色外, 其余5个都有被染上色, 其表达部位有各自的特点:驱动基因在根部表达, 且表达丰度较高;、驱动基因在根以及根毛处显著表达;与分别驱动基因在幼根处和下胚轴表达(图4)。
2.3.2 6个基因家族成员在二叶期和四叶期的表达模式分析 将拟南芥长出两片子叶的时期称为二叶期; 随后拟南芥发育形成第1对真叶, 也称莲座叶, 该时期称为四叶期; 在这一时期, 随着叶片表皮的发育, 形成表皮毛[32]。二叶期时, 除外(图5-C),和均能驱动基因表达。和驱动基因在整个幼苗都有表达, 前者在子叶表达丰度较高(图5-A), 后者在子叶叶片、根、根毛等多个部位表达丰度较高(图5-B);在子叶的叶尖端少量表达(图5-D);和仅在根部表达,驱动基因微量表达(图5-E)而驱动基因显著表达(图5-F)。四叶期, 一直未表达的基因启动子在这一时期驱动表达, 表达部位在子叶的叶片生长点及叶脉处(图5-I)。在子叶和真叶上高量表达(图5-G)。驱动基因在叶片、根、根毛等部位显著表达(图5-H);在此阶段未表达(图5-K),基因启动子除了一直驱动基因在根部表达外, 也在真叶的表皮毛上特异表达(图5-L)。在四叶期驱动表达的部位增多, 且表达丰度也增加, 二叶期只在子叶中驱动基因表达(图5-D), 而四叶期在子叶、根部及叶脉网状结构中均能驱动基因表达(图5-J)。

图4 6个GhLACs基因启动子驱动GUS基因在种子萌发时期的表达
Stage 1: 种子萌发初期; Stage 2: 种子萌发后期。RH: 根毛; Ra: 幼根。图中标尺均为200 µm。
Stage 1: the early seed germination stage; Stage 2: the later seed germination stage. RH: root hair; Ra: radicle. Bar: 200 µm.

图5 6个GhLACs基因启动子驱动GUS基因在二叶期和四叶期的表达模式分析
Stage 1: 二叶期; Stage 2: 四叶期。Tr: 表皮毛。标尺为1 mm。(A~F)和(G~L): ProGhLAC12A、ProGhLAC14A、ProGhLAC20A、ProGhLAC25D、ProGhLAC59D和ProGhLAC63D在二叶期(A~F)和四叶期(G~L)的表达模式分析; (M~R)和(S~X): ProGhLAC12A、ProGhLAC14A、ProGhLAC20A、ProGhLAC25D、ProGhLAC59D和ProGhLAC63D在四叶期的叶(M~R)和根(S~X)的表达模式分析。
Stage 1: two-leaf stage; Stage 2: four-leaf stage.Tr: trichome. Bar: 1 mm. (A–F) and (G–L): the relative expression pattern of,,,,andat two-leaf (A–F) and four-leaf (G–L) stages; (M–R) and (S–X): the analysis of leaf (M–R) and root (S–X) expression patterns of,,,,, andat four-leaf stage.
四叶期时, 分别对6个漆酶基因的子叶及根部进行放大观察。叶部和没有驱动表达(图5-Q, R), 其余基因启动子都能驱动表达(图5-M~O, P)。在根部,、、、转基因植株中均观察到不同程度GUS染色(图5-S, T, V, X),而和的根部未被染色(图5-U, W)。
2.3.3 6个基因家族成员在成熟期不同部位的表达模式分析 在成熟时期, 主要以花和叶作为重点考察对象, 在和转基因植株的花器官上没有观察到基因的表达(图6-E, F)。其他4个基因的转基因植株都能观察到不同程度的GUS着色。在花药中高量表达(图6-A);驱动基因表达丰度较高, GUS着色主要集中在雄蕊(图6-B);在花药中表达(图6-C);在柱头和花丝中有基因的表达(图6-D)。对于成熟期叶片而言, 除外(图6-K), 各基因启动子都能不同程度地驱动基因的表达。和的叶柄处及叶基部能观察到GUS着色(图6-G, H);和基因启动子能驱动基因在叶片的表皮毛中微量表达(图6-I, L);驱动基因在叶脉中有微量表达(图6-J)。

图6 GhLACs基因启动子驱动GUS基因在成熟期花序和叶片中的表达分析
(A~F)、(G~L)分别代表了、、、、与基因启动子驱动基因在花期和成熟期叶部的表达情况。An: 花药。标尺为1 mm。
(A–F) and (G–L) represent the expression ofgene driven by the promoter of,,,,,andgenes in flowering and leave at mature stage, respectively. An: anther. Bar: 1 mm.
2.4 6个GhLACs基因家族成员逆境胁迫诱导表达分析
2.4.1 二叶期和四叶期创伤诱导处理表达模式分析
植物不断遭受各种虫害, 每年造成大量的产量和质量损失。研究表明漆酶具有木质素聚合酶的功能, 参与单木质素聚合形成木质素, 提高了机械强度, 并加强细胞壁, 提供了物理屏障, 木质素使植物细胞壁更难以被咀嚼式和刺吸式昆虫穿透[33-34]。为探究漆酶基因在抗虫方面的作用, 因此分别对、、、、和六种转基因株系在二叶期的子叶和四叶期的子叶或真叶进行切割和刺洞处理, 得到不同处理后结果(图7)。
5种不同转基因材料在二叶期经过创伤处理后,和驱动表达丰度增加,、、和基因启动子在二叶期不受创伤诱导。
四叶期时, 对转基因材料的子叶或真叶进行处理。其中, 对和转基因株系的子叶和真叶均进行了切割和刺洞处理, 切割后,的子叶和真叶中表达丰度均增加,只在被切割的那片真叶中表达丰度明显增加; 刺洞处理后,转基因株系子叶的刺洞区域的表达丰度相对于周围区域较低,也只在被刺洞的那片子叶或真叶中GUS表达丰度明显增加, 这些有趣的现象暗示了不同的可能参与不同的创伤信号响应或传导。与二叶期相同, 其余4个基因启动子在四叶期同样未受到明显的创伤诱导。

图7 二叶期和四叶期创伤诱导表达模式分析
A: 二叶期创伤诱导表达模式分析; B: 四叶期创伤诱导表达模式分析。CK: 对照组; C: 切割组; P: 刺洞组。红色箭头代表切割处理, 白色箭头代表刺洞处理。标尺为2 mm。
A and B: the expression patterns induced by trauma at the two leaf seedling stage (A) and four leaf seedling stage (B). CK: the control group; C: cutting group; P: piercing group. The red arrow represents cutting treatment, and the white arrow represents piercing treatment. Bar: 2 mm.
2.4.2 6个基因家族成员在花药响应高温胁迫中的作用 课题组前期研究表明, 高温雄性不育是棉花减产的主要原因[35-36], 从组织表达热图结果可知, 有大量的基因在花药中有表达(图2)。且6个漆酶家族成员启动子成熟期花序GUS染色发现, 其中4个漆酶家族成员在花药中有表达(图6)。为探讨这6个漆酶家族成员是否参与花药高温胁迫响应, 我们在2个棉花品系‘84021’ (高温耐受型)和‘H05’ (高温敏感型)在常温和高温条件下四分体时期(TS)、绒毡层降解期(TDS)和花药开裂期(ADS)的花药中, 进行相应基因的荧光定量PCR分析。结果显示, 6个漆酶基因家族成员在耐温材料‘84021’的四分体时期花药中, 受高温胁迫后表达量均显著下调, 其中、和在敏温材料‘H05’中高温后的表达量也出现明显下调, 但6个基因在耐温材料‘84021’四分体时期花药中常温下的表达显著高于敏温材料‘H05’, 高温后6个基因在‘84021’中表达下降的程度也明显高于敏温材料‘H05’。在绒毡层降解时期,、和在2种材料中均表现出相类似的变化趋势。花药开裂时期, 在敏高温材料‘H05’中, 除外, 其他5个基因受高温诱导后有不同程度的上调表达; 而在耐高温材料‘84021’中, 6个基因均显著下调(图8)。6个漆酶成员中,在花药中的表达量相对较高, 这与驱动基因在花药中的表达趋势相同(图6)。

图8 6个GhLAC基因家族成员高温诱导表达分析
基因在2个陆地棉品系‘84021’ (耐高温品系)、‘H05’ (敏高温品系)中TS (四分体时期; 花蕾长度6~7 mm)、TDS (绒毡层降解时期; 花蕾长度9~14 mm)和ADS (花药开裂时期; 花蕾长度大于24 mm)的花药中的荧光定量检测。HN: 常温下的‘H05’; HH: 高温下的‘H05’; 8N: 常温下的‘84021’; 8H: 高温下的‘84021’。误差值代表3个生物学重复的标准差,()为内参基因。使用检验进行统计学分析, 星号表示有显著差异(*< 0.05, **< 0.01)。
The relative expression pattern ofgenes was performed in 84021 (high temperature tolerance line) and H05 (high temperature sensitive line) anthers at TS (tetrad stage; 6- to 7-mm bud), TDS (tapetal degradation stage; 9–14 mm bud), and ADS (anther dehiscence stage; more than 24-mm bud) under NT and HT by qRT-PCR. HN: H05 under normal temperature; HH: H05 under high temperature; 8N: 84021 under normal temperature; 8H: 84021 under high temperature. The error value represents the standard deviation of three biological replicates, and() as the internal reference gene.Asterisks indicate significant differences (*< 0.05, **< 0.01) by Student’stest.
3 讨论
本研究从高质量的陆地棉全基因组中鉴定出104个漆酶基因成员。染色体定位发现, 除A07和D07染色体外, 其他染色体都不均匀地分布着基因。A亚组有50个漆酶基因, 其中30个基因与D亚组同源, 20个漆酶基因特异; D亚组有52个漆酶基因, 其中22个漆酶基因特异。和定位在scaffold上。结合系统进化树和表达热图结果, 同源基因的表达存在一定相似性。进一步随机选择20个GhLAC基因荧光定量PCR发现, GhLAC基因家族成员在“H05”品系根、茎、叶、花瓣、花药和柱头中存在差异表达, 暗示漆酶基因可能在棉花生长发育不同过程中起着不同的作用。
通过对后续挑选的6个基因启动子驱动染色的结果可以初步了解所研究的漆酶家族成员的表达情况。从转基因拟南芥的表达模式结果来看, 6个漆酶基因各自在不同时期被不同程度诱导表达, 其表达部位有一个共同的特点, 即导管结构(叶脉或根的输导组织)。研究显示在植物维管发育过程中, 木质素漆酶活性与过氧化物酶活性对于单木质素聚合是必要的, 而不是冗余的[37], 我们推测这6个漆酶基因家族成员参与维管束的合成, 这一点有待后续研究。多功能漆酶在植物细胞伸长中起着重要作用, 影响棉花纤维品质[38], 本研究中基因启动子在种子萌发期、二叶期和四叶期的根毛处都驱动表达;在种子萌发期根毛处、四叶期真叶和成熟期叶片的表皮毛处驱动表达, 推测这2个基因与纤维发育存在相关性。此外, 研究证明位于幼穗中高表达的OsmiR397b, 通过下调目标基因的表达增加水稻穗长、株高和籽粒大小[14];、、和在花器官上有表达, 主要存在于柱头、花丝、雄蕊和花药中; 因此我们推测棉花漆酶基因可能同样与种子发育相关。
陆地棉漆酶基因在防御病原体和昆虫方面也有一定作用[39]。本研究进行创伤诱导实验目的是寻找与抗虫相关的漆酶基因, 从本试验结果可以得出创伤处理能使和的表达量从无到有或从少到多。Hu等[23]研究证明表达上调导致木质素含量增加, 棉铃虫和棉蚜的取食偏好降低, 棉铃虫和棉蚜的初始侵染和定殖受到限制, 而下调基因降低了木质素含量, 从而导致棉花对大丽轮枝菌和棉铃虫的耐受性降低。Zhang等[40]研究发现转基因拟南芥株系细胞壁木质化增强, 显著提高了转基因拟南芥对黄萎病菌的抗性; 而的RNAi系对大丽轮枝菌的敏感性增加, 木质素含量降低。因此我们推测本试验中被创伤显著诱导的2个基因和可能会通过增强细胞壁木质化, 提高棉花对大丽轮枝菌和棉铃虫或蚜虫的抗性。
值得注意的是, 本研究挑选的6个漆酶基因在棉花耐温品系‘84021’和敏温品系‘H05’的qRT-PCR结果表明, 高温胁迫后, 6个基因在‘84021’四分体时期以及花药开裂时期的表达量都呈现显著下调的趋势, 而在敏温品系‘H05’花药开裂期受高温诱导显著上调(图8)。Zhang等[28]对NT和HT条件下棉花中差异表达的基因进行了分析, 共鉴定出833个差异表达基因(DEGs), 其中包含, 该漆酶基因可能受到高温诱导影响棉花花药开裂与雄性不育, 因此我们推测本研究中的6个基因在敏温材料中受到高温诱导上调表达可能与敏温材料高温不育表型相关。同时, 内果皮细胞壁内的非对称木质素沉积是种子爆发性传播所必需的一种特性。Miguel等[13]通过定量分析发现, 与野生型相比, 果荚木质化程度较低的突变体中木质素含量明显降低, 而这一突变体的种子传播距离也明显变短: 突变体的种子最大传播距离减少了0.5 m。经过定位发现,、、定位于果荚的木质化细胞壁; 说明漆酶基因可能也与花药壁的木质化存在关联, 从而影响花药开裂和种子传播。因此, 我们推测本研究中的6个基因在耐温材料中可能受到高温诱导, 参与花药开裂过程。
植物漆酶作为一种多功能的氧化酶[41], 位于木质素合成途径的最后一步, 负责将不同木质素单体交联聚合形成多聚物——木质素[42]。木质素是细胞壁的重要组成部分, 自然条件下, 细胞壁作为植物固有的基本组成部分保证植株生长发育[12], 是抵御病原菌入侵的天然屏障。在此过程中, 漆酶除了参与木质素合成外[43], 还参与类黄酮代谢[44]、创伤修复[31]等与植物生长发育和逆境胁迫相关的过程,并与花药开裂[13]和抗虫[23]相关。综上所述, 基于的表达模式分析和前期的研究报道, 说明陆地棉中漆酶家族基因是功能丰富的一类基因。本研究结果可为进一步探索的功能提供一定的指导。
4 结论
本研究鉴定了陆地棉基因组中的基因家族, 104个GhLAC家族成员分布在24条染色体上。随机挑选20个基因对表达谱数据进行验证, 结果表明大部分基因的表达趋势与转录组相同。对其中6个漆酶基因的表达模式分析发现,和基因启动子表达部位主要在根毛处或表皮毛处,、、和主要在花器官上表达。结合前人研究结果, 我们推测陆地棉漆酶基因可能同样与纤维发育或种子发育相关。此外,和受创伤诱导, 可能参与抗虫等逆境响应过程, 但其调控机制还需进一步研究。6个基因的荧光定量PCR结果表明, 在耐温材料‘84021’中, 高温胁迫后6个漆酶基因的表达量在四分体时期(TS)和花药开裂期(ADS)都呈现显著下调的趋势, 推测基因可能负调控高温下陆地棉花药耐受性。本研究结果为后续深入解析陆地棉基因的抗虫功能及高温响应机制提供一定理论指导。
[1] Hüttermann A, Mai C, Kharazipour A. Modification of lignin for the production of new compounded materials., 2001, 55: 387–394.
[2] Piontek K, Antorini M, Choinowski T. Crystal structure of a laccase from the fungus Trametes versicolor at 1.90-A resolution containing a full complement of coppers., 2002, 277: 37663–37669.
[3] Claus H. Laccases: structure, reactions, distribution., 2004, 35: 93–96.
[4] Ander P, Eriksson K E. The importance of phenol oxidase activity in lignin degradation by the white rot fungus., 1976, 109: 1–8.
[5] Williamson P R. Laccase and melanin in the pathogenesis of., 1997, 2: 99–107.
[6] Carbajo J M, Junca H, Terrón M C, González T, Yagüe S, Zapico E, González A E. Tannic acid induces transcription of laccase genein the white-rot fungus., 2002, 48: 1041–1047.
[7] Weech M H, Chapleau M, Pan L, Ide C, Bede J C. Caterpillar saliva interferes with induceddefence responsesthe systemic acquired resistance pathway., 2008, 59: 2437–2448.
[8] Sterjiades R, Dean J F D, Eriksson K E. Laccase from sycamore maple () polymerizes monolignols., 1992, 99: 1162–1168.
[9] Liang M, Davis E, Gardner D, Cai X, Wu Y. Involvement ofin lignin synthesis in seeds and in root elongation of., 2006, 224: 1185–1196.
[10] Wang G D, Li Q J, Luo B, Chen X Y. Ex planta phytoremediation of trichlorophenol and phenolic allelochemicalsan engineered secretory laccase., 2004, 22: 893–897.
[11] Bao W, O’Malley D M, Whetten R, Sederoff R R. A laccase associated with lignification in loblolly pine xylem., 1993, 260: 672–674.
[12] Berthet S, Demont C N, Pollet B, Bidzinski P, Cézard L, Le B P, Borrega N, Hervé J, Blondet E, Balzergue S, Lapierre C, Jouanin L. Disruption ofandresults in tissue-specific alterations to lignification ofstems., 2011, 23: 1124–1137.
[13] Miguel P A, Schneider I, Kroll P, Hofhuis H, Metzger S, Pauly M, Hay A. Explosive seed dispersal depends on SPL7 to ensure sufficient copper for localized lignin deposition via laccases., 2022, 119: e2202287119.
[14] Zhang Y C, Yu Y, Wang C Y, Li Z Y, Liu Q, Xu J, Liao J Y, Wang X J, Qu L H, Chen F, Xin P, Yan C, Chu J, Li H Q, Chen Y Q. Overexpression of microRNA OsmiR397 improves rice yield by increasing grain size and promoting panicle branching., 2013, 31: 848–852.
[15] Zhong J, He W J, Peng Z, Zhang H, Li F, Yao J L. A putative AGO protein, OsAGO17, positively regulates grain size and grain weight through OsmiR397b in rice., 2020, 18: 916–928.
[16] Sun Y J, Xiong X G, Wang Q, Zhu L, Wang L, He Y, Zeng H L. Integrated analysis of small RNA, transcriptome, and degradome sequencing reveals the miR156, miR5488 and miR399 are involved in the regulation of male sterility in PTGMS rice., 2021, 22: 2260.
[17] Mayer A M, Staples R C. Laccase: new functions for an old enzyme., 2002, 60: 551–565.
[18] Jiao X Y, Li G Q, Wang Y, Nie F, Cheng X, Abdullah M, Lin Y, Cai Y P. Systematic analysis of the pleurotus ostreatus laccase gene () family and functional characterization ofinvolved in the degradation of cotton-straw lignin., 2018, 23: 880.
[19] Li L, Steffens J C. Overexpression of polyphenol oxidase in transgenic tomato plants results in enhanced bacterial disease resistance., 2002, 215: 239–247.
[20] Choi G H, Larson T G, Nuss D L. Molecular analysis of the laccase gene from the chestnut blight fungus and selective suppression of its expression in an isogenic hypovirulent strain., 1992, 5: 119–128.
[21] Zhu X, Gibbons J, Zhang S, Williamson P R. Copper-mediated reversal of defective laccase in aavirulent mutant of., 2003, 47: 1007–1014.
[22] Anagnostakis S L. The Ecology and Physiology of the Fungal Mycelium. Cambridge: Cambridge University Press, 1984. pp 353–366.
[23] Hu Q, Min L, Yang X Y, Jin S X, Zhang L, Li Y Y, Ma Y Z, Qi X W, Li D Q, Liu H B, Lindsey K, Zhu L F, Zhang X L. Laccase GhLac1 modulates broad-spectrum biotic stress tolerancemanipulating phenylpropanoid pathway and jasmonic acid synthesis., 2018, 176: 1808–1823.
[24] Wei T P, Tang Y, Jia P, Zeng Y, Wang B, Wu P, Quan Y G, Chen A M, Li Y C, Wu J H. A cotton lignin biosynthesis gene,, fine-tuned by ghr-miR397modulates plant resistance against., 2021, 18: 12.
[25] Pourcel L, Routaboul J M, Kerhoas L, Caboche M, Lepiniec L, Debeaujon I. TRANSPARENT TESTA10 encodes a laccase-like enzyme involved in oxidative polymerization of flavonoids inseed coat., 2005, 17: 2966–2980.
[26] Turlapati P V, Kim K W, Davin L B, Lewis N G. The laccase multigene family in: towards addressing the mystery of their gene function(s)., 2011, 233: 439–470.
[27] Niladevi K N, Sukumaran R K, Prema D. Utilization of rice straw for laccase production byin solid-state fermentation., 2007, 34: 665–674.
[28] Zhang R, Zhou L L, Li Y L, Ma H H, Li Y W, Ma Y Z, Lyu R J, Yang J, Wang W R, Alifu A, Zhang X L, Kong J, Min L. Rapid identification of pollen- and anther-specific genes in response to high-temperature stress based on transcriptome profiling analysis in cotton., 2022, 23: 3378.
[29] Min L, Zhu L F, Tu L L, Deng F L, Yuan D J, Zhang X L. Cottondisrupts normal male reproduction by delaying tapetum programmed cell death via inactivating starch synthase., 2013, 75: 823–835.
[30] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(−Delta Delta C(T)) Method., 2001, 25: 402–408.
[31] McCaig B C, Meagher R B, Dean J F D. Gene structure and molecular analysis of the laccase-like multicopper oxidase (LMCO) gene family in., 2005, 221: 619–636.
[32] Dharmawardhana D P, Ellis B E, Carlson J E. Characterization of vascular lignification in., 1992, 70: 2238–2244.
[33] Naoumkina M A, Zhao Q, Gallego-Giraldo L, Dai X, Zhao P X, Dixon R A. Genome-wide analysis of phenylpropanoid defence pathways., 2010, 11: 829–846.
[34] Mottiar Y, Vanholme R, Boerjan W, Ralph J, Mansfield S D. Designer lignins: harnessing the plasticity of lignification., 2016, 37: 190–200.
[35] Min L, Li Y Y, Hu Q, Zhu L F, Gao W H, Wu Y L, Ding Y H, Liu S M, Yang X Y, Zhang X L. Sugar and auxin signaling pathways respond to high-temperature stress during anther development as revealed by transcript profiling analysis in cotton., 2014, 164: 1293–1308.
[36] Ma Y Z, Min L, Wang M J, Wang C Z, Zhao Y L, Li Y Y, Fang Q D, Wu Y L, Xie S, Ding Y H, Su X J, Hu Q, Zhang Q H, Li X Y, Zhang X L. Disrupted genome methylation in response to high temperature has distinct affects on microspore abortion and anther indehiscence., 2018, 30: 1387–1403.
[37] Zhao Q, Nakashima J, Chen F, Yin Y, Fu C, Yun J, Shao H, Wang X, Wang Z Y, Dixon R A. Laccase is necessary and nonredundant with peroxidase for lignin polymerization during vascular development in., 2013, 25: 3976–3987.
[38] Balasubramanian V K, Rai K M, Thu S W, Hii M M, Mendu V. Genome-wide identification of multifunctional laccase gene family in cotton (spp.); expression and biochemical analysis during fiber development., 2016, 6: 34309.
[39] Johansson M, Denekamp M, Asiegbu F O. Production and isozyme pattern of extracellular laccase in the S and P intersterility groups of the root pathogen., 1999, 103: 365–371.
[40] Zhang Y, Wu L Z, Wang X F, Chen B, Zhao J, Cui J, Li Z K, Yang J, Wu G Y, Zhang G Y, Ma Z Y. The cotton laccase geneenhances Verticillium wilt resistance via an increase in defence-induced lignification and lignin components in the cell walls of plants., 2019, 20:309–322.
[41] Torres J, Svistunenko D, Karlsson B, Cooper C E, Wilson M T. Fast reduction of a copper center in laccase by nitric oxide and formation of a peroxide intermediate., 2002, 124: 963–967.
[42] 靳蓉, 张飞龙. 漆酶的结构与催化反应机理. 中国生漆, 2012, 31(4): 6–16.Jin R, Zhang F L. Structure and catalytic mechanism of laccase., 2012, 31(4): 6–16 (in Chinese with English abstract).
[43] Zhao Q, Nakashima J, Chen F, Yin Y, Fu C, Yun J, Shao H, Wang Z Y, Dixon R A. Laccase is necessary and nonredundant with peroxidase for lignin polymerization during vascular development in., 2013, 25: 3976–3987.
[44] Lan W, Lu F, Regner M, Zhu Y, Rencoret J, Ralph S A, Zakai U I, Morreel K, Boerjan W, Ralph J. Tricin, a flavonoid monomer in monocot lignification., 2015, 167: 1284–1295.
Relative expression patterns of laccase gene family members in uplandL.
ZUO Chun-Yang**, LI Ya-Wei**, LI Yan-Long, JIN Shuang-Xia, ZHU Long-Fu, ZHANG Xian-Long, and MIN Ling*
National Key Laboratory of Crop Genetic Improvement / Hubei Hongshan Laboratory, Huazhong Agricultural University, Wuhan 430070, Hubei, China
Laccase, a member of the blue copper oxidase protein family, plays an important role in plant lignin synthesis and improving plant resistance to stress. In this study, 104 members of the Laccase gene () family were identified from the upland cottongenome. Phylogenetic tree and tissue expression map were constructed. Twenty genes were randomly selected for qRT-PCR analysis to verify the results of expression heat map. To further explore the role of laccase in cotton, promoter-GUS fusion vectors were transformed into. The detailed expression patterns of six members of the Laccase gene family (,,,,, and) were studied by GUS staining in different tissues during different developmental period of transgenic. To explore the role of laccase in stress, the expression of the six laccase genes was analyzed by cutting and piercing, and the corresponding genes were analyzed by qRT-PCR using the anther of two cotton strains ‘84021’ (high temperature tolerant) and ‘H05’ (high temperature sensitive) at different stages under normal and high temperature conditions. The results showed that 20 randomly selected genes were differentially expressed in six tissues of root, stem, leaf, petal, anther, and stigma, and the relative expression levels of most genes were consistent with the transcriptome data. The promoter of six laccase genes could drivegene expression in different levels at germination, two-leaf, and four-leaf stages. The trauma treatment indicated that the promoter ofandsignificantly improved the ability to drive GUS protein expression in leaves after trauma induction, suggesting that the two genes might be involved in traumatic stress response. In addition, the relative expression levels of the sixgenes were significantly down-regulated after high temperature stress at the tetrad stage and anther dehiscence stage of cotton strain ‘84021’, suggestinggene might negatively regulate the high temperature tolerance of cotton anthers. The results of this study provide the reference for further exploring the function of laccase family genes.
L.; laccase gene; the promoter-GUS expression pattern; anther response to high temperature; wound induced expression
2022-11-02;
2023-02-21;
2023-03-13.
10.3724/SP.J.1006.2023.24246
通信作者(Corresponding author):闵玲, E-mail: lingmin@mail.hzau.edu.cn
**同等贡献(Contributed equally to this work)
左春阳, E-mail: 727202632@qq.com
本研究由湖北洪山实验室重大项目课题(2022hszd004)和国家自然科学基金项目“GhHRK基因增强棉花花粉高温耐性的调控网络解析” (32072024)资助。
This study was supported by the Major Project of Hubei Hongshan Laboratory (2022hszd004) and the National Natural Science Foundation of China “Regulatory Network Analysis of GhHRK Gene Enhancing Pollen High Temperature Tolerance in Cotton” (32072024).
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20230313.0838.002.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

