磁共振化学交换饱和转移谷氨酸成像在精神分裂症中的应用
刘悦,董麟瑞,黄圣翔,许丽雪,刘瑞,黄朋举,李军,王威,于爱红
精神分裂症(schizophrenia,SCZ)是一种复杂的慢性神经精神障碍,病因未明[1],对社会和家庭造成极大的不良影响。SCZ好发于青春后期或成年早期,表现为偏执妄想、幻听、记忆力差和认知控制能力差。谷氨酸神经递质异常在精神分裂症的病理生理机制中起着重要的作用[2]。通过质子磁共振波谱(1H-magnetic resonance spectroscopy,1H-MRS)对大脑特定神经递质的定量是有限的[3]。1H-MRS对局部脑区谷氨酸检测,在较低磁共振场强很难区别谷氨酸(glutamate,Glu)和谷氨酰胺(glutamine,Gln ),1H-MRS Glu水平常常表达的是Glu和Gln的结合物,即Glx[4]。化学交换饱和转移技术(chemical exchange saturation transfer,CEST)是一种新的磁共振成像(magnetic resonance imaging,MRI)方法,通过施加特定频率的饱和脉冲,对可交换的质子或分子进行预饱和,然后通过氢质子交换这种饱和传递给自由水引起水信号的下降,这种成像技术方法显示了更高的敏感度[5,6]。其中用于检测Glu中的胺基质子与自由水之间化学交换的CEST技术,称之为谷氨酸CEST(glutamate chemical exchange saturation transfer,GluCEST),GluCEST可以定量分析大脑区域谷氨酸含量[7,8]。本研究基于GluCEST成像技术,比较 SCZ和健康对照组(healthy control,HC)的大脑不同区域谷氨酸的含量,探讨SCZ神经生化物质谷氨酸特点,为SCZ的病理机制研究提供依据。
材料与方法
1.研究对象
本研究纳入2022年2月-2022年8月就诊于首都医科大学附属北京安定医院门诊的21例SCZ患者。纳入标准:①符合《美国精神障碍诊断与统计手册第5版》(DSM-5)中SCZ诊断标准;②汉族,右利手;③年龄18~60岁,性别不限;④小学以上学历。排除标准:①患有其他精神障碍病史;②酒精和药物依赖;③智力障碍;④妊娠或哺乳期妇女;⑤严重的身体疾病,主要包括神经系统器质性疾病;⑥磁共振扫描禁忌症。此外,还纳入了年龄与性别相匹配的16例HC。HC为附近社区的居民、学生健康志愿者。本研究得到了首都医科大学附属北京安定医院医学伦理委员会批准。所有受试者均签署知情同意书。
2.方法
对SCZ和HC组研究对象收集一般人口学信息表,包括姓名、性别、年龄、受教育程度、利手、重度疾病史、精神病家族史等。采用阳性和阴性症状评定量表(positive and negative syndrome scale,PANSS)评估SCZ患者入组时临床症状,其中包括PANSS阳性量表评分、PANSS阴性量表评分、一般精神病理量表评分和PANSS总分。
采用Siemens 3.0T Prisma MR扫描仪进行影像数据采集。在扫描过程中,要求受试者在大脑清醒的状态下保持安静、闭眼、头部勿动以及正常呼吸,并使用制造商提供的泡沫垫和耳机来限制头部活动、减少噪音。完成大脑解剖定位后,扫描前需要手动匀场。采集全脑3D高分辨率结构像(T1WI)数据,结构相数据采用三维磁化强度预备梯度回波序列(three dimensional magnetization prepared rapid gradient echo,3D-MPRAGE)。高分辨率结构像数据采集参数:TR 2530 ms,TE 1.85 ms,翻转角9°,像素大小1.0 mm×1.0 mm×1.0 mm,FOV 256 mm×256 mm,层厚1 mm,层数192。采集GluCEST数据,采集参数为B1场强:TR 3500 ms,TE 17 ms,像素大小1.4 mm×1.4 mm×2.8 mm, FOV 212 mm×212 mm,层厚2.79 mm,层数648;B0场强:TR 30 ms,TE 4.92 ms,像素大小1.4 mm×1.4 mm×2.8 mm,FOV 212 mm×212 mm,层厚2.79 mm,层数288。共计耗时约14 min。
3.图像分析和处理
选用FSL(V6.0, FMRIB, Oxford University)FLIRT模块工具,对GluCEST图像进行配准以校正运动伪影,将GluCEST图像与3D结构图像进行配准重建,使配准后的图像具备空间一致性。利用Freesurfer 6.0软件后处理模块对3D结构图像进行分割,将分割结果变换成与重建后的CEST图像同维度,再利用图像矩阵对配准后的GluCEST图像进行不同脑区分割。提取出海马、杏仁核、丘脑、尾状核、胼胝体、皮层下、额叶、顶叶、枕叶和颞叶十个大脑感兴趣区(ROI),分别计算各3D ROI内GluCEST图像的平均值,代表此区域内Glutamate含量的平均水平。所有的CEST图像处理经MATLAB的CEST图像定量分析系统实现CEST数据的自动快速处理(图1)。
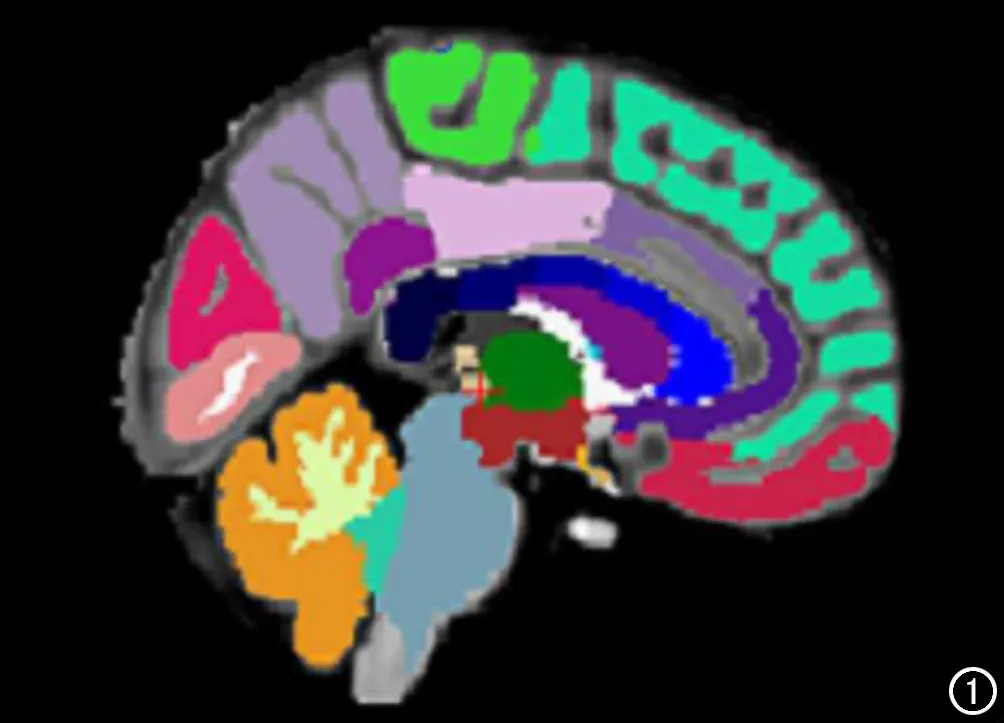
图1 Freesurfer 6.0软件分割不同脑区示意图。
获得的CEST图像利用非对称分析方程式计算得出GluCEST量化参数图,定量分析磁化转移率不对称性(magnetization transfer ratio asymmetry, MTRasym):
MTRasym(Δω) = MZW(Δω)-MZW(-Δω)/M0W[9]
(1)
其中Δω 为两个质子池之间的固有频率差值,M0W为不施加饱和脉冲扫描所获得的图像,MZW(-Δω)和MZW(Δω)分别向偏离水质子峰-3.0 ppm及+3.0 ppm处施加饱和脉冲后扫描所获得的信号。为了去除其他因素的影响,Ling等[10]及Zaiss等[11]对量化参数进行归一化,得到被参考值标准化的化学交换饱和转移效应比率(CESTR normalized with the reference value,CESTRnr)和基于倒Z谱分析的磁化转移率(magnetization transfer ratio relaxation due to exchange,MTRRex)。
4.统计学分析
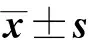
结 果
1.一般资料和量表评分
人口学资料和临床量表的评分结果见表1。SCZ和HC两组之间性别、年龄差异均无统计学意义(P>0.05)。SCZ组患者PANSS阳性量表评分为9.95±3.17,PANSS阴性量表评分为11.48±7.41,一般精神病理量表评分为23.76±7.37,PANSS总分为45.20±16.45。

表1 精神分裂症与健康对照组一般资料比较
2.额叶和海马GluCEST测量值水平的比较
分析SCZ和HC对照组GluCEST水平,分割、计算大脑区域海马、杏仁核、丘脑、尾状核、胼胝体、皮层下、额叶、顶叶、枕叶和颞叶谷氨酸水平。在额叶和海马脑区,SCZ组与HC对照组GluCEST量化参数值MTRasym、CESTRnr、MTRRex差异均有统计学意义(P<0.05);相对于HC组,SCZ患者额叶GluCEST值明显升高(P<0.05);相对于HC组,SCZ患者海马GluCEST值明显降低(P<0.05),见表2,图2~4。杏仁核、丘脑、尾状核、胼胝体、皮层下、顶叶、枕叶和颞叶在SCZ组与HC对照组之间差异无统计学意义(P>0.05)。

表2 精神分裂症与健康对照有差异脑区谷氨酸水平

图2 相对于HC组,SCZ患者额叶MTRasym值明显升高(P<0.05);相对于HC组,SCZ患者海马MTRasym值明显降低(P<0.05)。 图3 相对于HC组,SCZ患者额叶CESTRnr值明显升高(P<0.05);相对于HC组,SCZ患者海马CESTRnr值明显降低(P<0.05)。 图4 相对于HC组,SCZ患者额叶MTRRex值明显升高(P<0.05);相对于HC组,SCZ患者海马MTRRex值明显降低(P<0.05)。
3.额叶和海马GluCEST测量值与PANSS量表评分的相关分析
SCZ患者的额叶、海马谷氨酸水平与PANSS阳性、阴性症状量表评分、一般精神病理量表评分和PANSS总分均无明显相关性(r=-0.15~0.19,P>0.05)。
讨 论
本研究基于GluCEST成像,通过测量SCZ组和HC组大脑中的谷氨酸水平来研究SCZ谷氨酸神经递质的异常。结果显示,与HC相比,SCZ组额叶和海马脑区存在谷氨酸水平的明显差异,表现为SCZ组额叶谷氨酸水平升高,而在海马谷氨酸水平降低。结果显示了SCZ特定脑区谷氨酸神经递质水平的异常。
SCZ的发病机制复杂,已有各种假说。备受关注的N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体功能下降被认为是SCZ病理生理机制的主要基础[12]。NMDA受体功能障碍会引起谷氨酸水平失衡[13]。谷氨酸类化合物[Glutamate(Glu)+谷氨酰胺Glutamine(Gln)=Glx]可以通过1H-MRS检测,Glu和Gln峰显著重叠,难以分辨,这使得MRS单独定量Glu困难[14]。Cai等[8]发现GluCEST能在无创的情况下得到Glu准确的量化,与传统的1H-MRS相比,GluCEST成像具有更好的空间分辨率,而且不受Gln干扰,可以更精准地观察到Glu水平的分布改变。本研究通过GluCEST成像发现SCZ患者额叶Glu水平升高。既往文献提示基于1H-MRS发现部分SCZ患者脑内的Glx水平明显升高,Gln水平也增加[15],这与本研究SCZ患者额叶Glu水平升高的结果类似。额叶是多种精神障碍易受累脑区,本结果可能反映了受累脑区Glu突触活动的进行性减少,神经传递功能失调[13]。
本研究还发现GluCEST成像SCZ组海马谷氨酸水平降低。海马是精神分裂症中关键功能和结构异常的部位[16]。越来越多的研究证据[17]表明,海马功能障碍可能与精神分裂症的病理生理学有关,尤其是海马区域的Glu水平异常。既往关于海马Glu水平的研究较少,这有可能由于海马的1H-MRS具有挑战性,因为该区域体积小且靠近骨骼结构,导致体素尺寸小,敏感性变化大,从而影响信噪比和波谱分辨率[18]。现有关于海马Glu水平的研究较少,结果也不一致:Rauchmann等[19]发现1H-MRS检测首发SCZ患者的海马的Glx水平下降。但也有研究临床高危或高风险(clinical high risk,CHR)人群、首发SCZ及HC组之间的Glu代谢物没有差异[20,21]。Shakory等[16]报道CHR组的海马Glu代谢物较低,表明疾病早期海马神经化学异常,而且还发现未服用药物的SCZ患者的海马Glx水平高于HC。还需要对同质SCZ患者进行进一步研究,探索海马脑区的Glu代谢物水平。
SCZ患者Glu水平与临床症状的相关性研究没有取得一致性结果。大部分研究未发现Glu与阳性症状的相关性[22-24]。Glu与阴性症状的相关性也不一致,有报道其与认知下降和阴性症状主要精神病理症状有关[25],也有报道无相关[26]。本研究分别对SCZ患者额叶和海马Glu含量与PANSS阳性、阴性症状量表评分进行了相关分析,结果没有相关性。其可能原因为:本研究中SCZ患者组以临床缓解期居多,药物治疗后临床症状减少,且本研究病例数较少,这些原因可能影响相关分析结果。还需进行进一步研究探索。
本研究仍存在不足之处:第一,本研究的每组样本量较小,没有进一步根据SCZ临床发展的首发、复发、缓解期进行分组,有待进一步扩大样本量分组进行研究;第二,入组的部分患者服用抗精神分裂症药物治疗,虽然精神药物对大脑的影响仍有争议,但我们不能排除这些药物的混杂效应;第三,本研究是横断面研究,无法研究SCZ患者脑内Glu水平的变化。同时,本研究为一项初步研究,更精细脑区的测量是下一步深入研究的方向。
综上所述,本研究初步发现SCZ患者的GluCEST成像额叶和海马Glu神经递质水平异常,提示GluCEST可定量检测大脑Glu神经递质异常,为SCZ的病理机制提供依据。

