肠道出血性大肠埃希菌菌株及其基因组DNA标准物质的研制及评价
刘娜,王亚萍,赵琳娜,王学硕,崔生辉
中国食品药品检定研究院,北京100050
肠道出血性大肠埃希菌(enterohemorrhagicEscherichia coli,EHEC)是一种人畜共患病的致泻性大肠埃希菌[1],会导致患者出现腹泻、高烧、出血性结肠炎、溶血性尿毒综合征等一系列疾病[2],具有疾病发展速度快、病死率高等特点[3],给人体健康造成严重伤害[4]。牛肉等肉制品以及蔬菜是EHEC 的重要来源[5-6]。基于EHEC 的强致病性,国内外不少研究机构对不同血清型的EHEC[7-8],从不同层面[9-10]研究其致病机理[1,11-15],以期将EHEC 感染风险降至最低[16-17]。而耐药菌株以及多种亚型的出现[5,18],扩大了EHEC 感染的潜在危害性,引起世卫组织以及多个国家的高度重视[19]。
将EHEC 感染风险和致死率降至最低的关键是提升检测能力和检验效率。目前,国内检验EHEC的依据是GB4789.6-2016《食品安全国家标准食品微生物学检验致泻大肠埃希氏菌检验》,其中阳性对照一般至少需提前1 ~2 d 接种纯化,遇到紧急检验任务时,传统的培养方法远不能满足要求,因此,时效性一直是EHEC 检验乃至整个微生物检验的瓶颈。即用型EHEC 标准物质可以缓解时间的紧迫性,但我国目前尚无此方面的报道。
我国在即用型微生物标准物质研究方面起步较晚[20],因此,需各一线实验室依据实际工作需要研制相关标准物质。本课题组通过筛选EHEC 菌株并将其申报为中国医学细菌保藏管理中心(China Medical Bacterial Species Conservation and Management Center,CMCC)标准菌株,进一步研制了EHEC 菌株及其基因组DNA 标准物质,并进行检验及使用效果评价,以期提高EHEC 检验的时效性,同时也弥补我国此方面的空白。
1 材料与方法
1.1菌株 160 株来源于腹泻患者的大肠埃希菌为本实验室保藏。
1.2主要试剂及仪器 营养肉汤培养基、MAC 培养基、EMB 培养基和TSA 培养基购自美国BD 公司;生理盐水购自中国国药集团;肠道菌增菌肉汤购自北京奥博星生物技术有限责任公司;细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;冻干保护剂由本院提供;VITEK COMPACT 2 全自动微生物分析系统购自法国梅里埃公司;基质辅助激光电离飞行时间质谱(Matrix-Assisted Laser Desorption/Ionization Time of Flight Mass Spectrometry,MALDI-TOF MS)购自德国Bruker 公司;LABCONCO FreeZone12L冷冻干燥机购自德国LABCONCO 公司;HYC-940 螺旋涂布仪购自西班牙IΜL公司。
1.3菌株筛选与申报 依据GB4789.6-2016,从160株来源于患者的大肠埃希菌中筛选出EHEC菌株,按照CMCC管理规定,分别用MALDI-TOF MS、VITEK COMPACT 2及16s RNA基因序列测定方法确定菌株种属,再测定eae、stx1、stx2基因序列,并在NCBI 上分析。将上述鉴定的相关材料提交至CMCC。
1.4EHEC菌株标准物质的制备 将新鲜培养的EHEC标准菌株(2 代)经5µm 滤膜过滤,重悬于冻干保护剂中,以20µL/样品的方式进行速冻,通过比较冻干前后CFU 数目,计算冻干存活率。根据冻干存活率制备浓度适宜的菌悬液,以20µL/样品的方式进行速冻,再于冷冻干燥机中进行冷冻干燥,制备样品(103CFU/样品)。将样品放入2 mL 西林瓶中,用冷冻干燥机进行真空压盖,最终制备样品600个。
1.5EHEC 基因组DNA 标准物质的制备 用细菌基因组DNA 提取试剂盒提取EHEC 标准菌株基因组DNA,用Qubit 荧光计检测DNA 溶液浓度。依据预实验结果,取20µg DNA,加入20 mL 冻干保护剂中,混匀,按照菌株标准物质制备方法制备基因组DNA样品(20 ng/样品)600个。
1.6标准物质的均匀性检验
1.6.1菌株标准物质 从制备的EHEC 菌株样品中随机抽取20 瓶,每瓶溶解于1 mL 生理盐水溶液中,通过螺旋涂布仪以E50 模式涂布于TSA 平板,每个样品设2个平行,于(36±1)℃培养18 ~24 h后进行菌落计数,分析均匀性。依据GB4789.6-2016进行检验。
1.6.2基因组DNA 标准物质从制备的EHEC 基因组DNA 样品中随机抽取20 瓶,每瓶溶解于0.1 mL去离子水中,取2µL 作为模板,依据GB4789.6-2016进行检验。
1.7标准物质的稳定性检验
1.7.1运输稳定性 将EHEC 菌株和基因组DNA 样品置于25、37 ℃环境中,分别于1、3、5、7 d 各抽取3个样品,按照均匀性检验方法检测运输稳定性。其中菌株样品以均匀性结果的CFU 均数为基数计算存活率。
1.7.2保存稳定性 将EHEC 菌株和基因组DNA 样品置于4、-20 ℃冰箱中,其中4 ℃保存的样品分别于0、7、14、28 d 各抽取3 个,-20 ℃保存的样品分别于28、60 d 各抽取3 个,按照运输稳定性检测方法检测保存稳定性。
1.8协同标定组织3家有资质的实验室(代号为A、B、C)进行协同标定,向每家实验室分别发放随机抽取的EHEC 菌株和基因组DNA 样品各10 个,并提供作业指导书。菌株样品作业指导书内容为:将每个样品溶解于1 mL 生理盐水中,使用涡旋振荡器充分混匀作为原液,取100µL原液与900µL生理盐水混匀,制成1∶10 稀释液,分别取原液和稀释液100µL,用L 棒或全自动螺旋涂布仪涂布于TSA 平板,设2 个平行,将平板置于(36±1)℃培养18 ~24 h后,统计样品CFU数目,并依据GB4789.6-2016对菌落进行检验。
1.9使用效果评价 参考GB29921-2013《食品安全国家标准食品中致病菌限量》选择20 种食品(呀土豆蜂蜜黄油薯片、呀土豆番茄薯片、呀土豆烤鸡薯片、九日蜂蜜薯片、香老太五香腐乳、香老太秘制白腐乳、香老太秘制辣腐乳、香老太桂林腐乳、乐之饼干、太平饼干、老布特麦麸饼干、老布特南瓜饼干、爱优诺优益力特殊婴儿配方奶粉、萌臻婴儿配方羊奶粉、宝素力幼儿配方奶粉、贝因美特殊医学用途婴儿配方奶粉、老绥远手撕风干牛肉、内蒙古保牛乳业风干牛肉、大牧场手撕风干牛肉、草原心意手撕牛肉)作为基质,对制备的EHEC 菌株样品进行验证。称取每种基质2 份(25 g/份),1 份作为验证基质,1 份作为本底对照。随机取3 个菌株样品,用3 mL 生理盐水溶解作为待验证菌液,取100µL 加入至各验证基质作为试验组,另取100µL 生理盐水加入至本底作为对照组,依据GB4789.6-2016进行检验。
1.10统计学分析 应用SPSS 17.0 软件进行统计学分析,通过单因素方差分析方法分析均匀性检验数据,以P<0.05为差异有统计学意义。
2 结果
2.1菌株筛选与申报 从160株来源于患者的大肠埃希菌中筛选出1 株EHEC 菌株,eae、stx1、stx2基因扩增均为阳性,见图1。依照CMCC相关规定提供生化、MALDI-TOF MS、16s RNA基因序列以及eae、stx1、stx2序列等鉴定资料,申报为标准菌株CMCC(B)43207。

图1 EHEC菌株eae、stx1、stx2基因扩增产物电泳图Fig.1 Electrophoretic profile of amplification products of eae,stx1 and stx2 gene in EHEC strain
2.2标准物质的均匀性 20 个EHEC 菌株样品计数结果见表1。经分析,数值分布符合正态分布,最大值为2 500 CFU/样品,最小值为1 820 CFU/样品,中位数为2 280 CFU/样品,均值为2 286 CFU/样品。经单因素方差分析,差异无统计学意义[F菌株样品=0.662 <FINV(0.05,19,20),P>0.05]。

表1 EHEC样品均匀性计数结果(×103 CFU/样品)Tab.1 Uniformity counting results of EHEC samples(×103CFU/sample)
2.3标准物质的稳定性
2.3.1运输稳定性 EHEC 菌株样品于25 和37 ℃存放7 d,样品活菌数与设定的103CFU/样品要求一致。EHEC基因组DNA样品于25和37 ℃存放7 d后,eae、stx1、stx2基因均仍为阳性。进一步分析发现,于37 ℃存放时,随着时间的延长,样品中活菌数减少的速率加快,前3 d 活菌数无明显变化,至5 d 时,活菌数减少达10%,至7 d时,又继续减少约20%;而于25 ℃存放的样品存活率明显高于37 ℃存放的样品。见表2。我国样品运输一般3 d内到达,偏远地区5 ~7 d 内到达,制备的标准物质仍满足103CFU/样品要求。

表2 EHEC样品运输稳定性计数结果Tab.2 Counting results of transport stability of EHEC samples
2.3.2保存稳定性 EHEC 样品于-20 ℃保存60 d或4 ℃保存28 d后,样品活菌数仍满足设定的103CFU/样品要求,见表3。EHEC 菌株样品和基因组DNA 样品于-20 ℃保存60 d、4 ℃保存28 d 后,eae、stx1、stx2基因均为阳性。
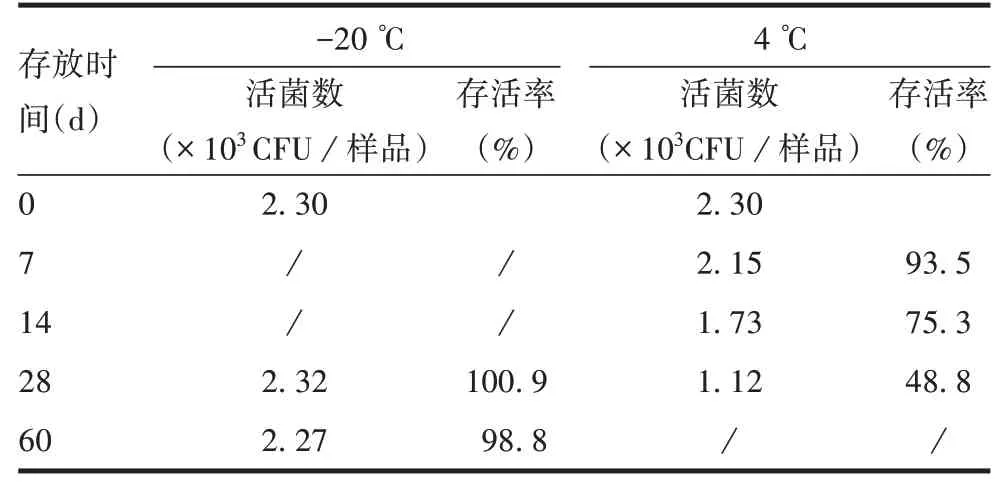
表3 EHEC样品保存稳定性试验结果Tab.3 Results of preservation stability test of EHEC samples
2.4协同标定结果 随机抽取的EHEC 菌株和基因组DNA 样品经3 家实验室鉴定均为EHEC。3 家实验室检测样品活菌含量均在103CFU/样品的水平,见表4。且eae、stx1、stx2基因均为阳性。

表4 3家实验室协作标定结果(×103 CFU/样品)Tab.4 Collaborativecalibrationresultsof3laboratories(×103CFU/sample)
2.5使用效果评价 20 种食品中加入标准物质均能检出目标菌,而样品本底均未检出。
3 讨论
EHEC 血清类型众多[21-23],且不同时间、不同区域国家EHEC 感染有不同的特点[24-25]。本研究通过从腹泻患者来源的大肠埃希菌中筛选EHEC 菌株,并将其申报为CMCC标准菌株CMCC(B)43207,丰富了我国本土来源的EHEC 标准菌株数据库,为今后我国相关标准修订等奠定了基础。在申报标准菌株的基础上,进一步研制了自主知识产权的EHEC菌株及其基因组DNA 标准物质,且两种标准物质均已被纳入国家药品标准物质清单中,其中EHEC 菌株标准物质编号为80024,基因组DNA 标准物质编号为80056。-20 ℃可作为两种标准物质长期存放条件,而4 ℃可作为短期保存条件。EHEC 菌株及其基因组DNA 标准物质不仅可用于加强对食品中EHEC 检验的质量控制,还可用于实验室内部培养基质量、阳性对照、方法确认、人员考核、检验环境等各环节的质量控制。此外,研制的EHEC 菌株及其基因组DNA标准物质均不含基质,既可直接使用,也可依据不同目的添加不同基质,具有很强的灵活性,为今后EHEC的准确、快速检验提供了支持。
本实验室对多个种属菌株的冻干存活率均有研究,存活率最低的为副溶血弧菌(不足1%),而EHEC菌株的冻干存活率高达80%,高于很多粪肠球菌、金黄色葡萄球菌等革兰阳性菌。初步表明在冻干过程中,革兰阳性菌与革兰阴性菌的细胞壁差异不是影响冻干存活率的关键因素。在大肠埃希菌种属范围内比较,冻干存活率介于40%~80%之间,可见菌株种属同样不是影响冻干存活率的关键因素,冻干存活率的高低可能与菌体内某条代谢途径有关。在协同标定中关于菌株标准物质的计数部分,本实验室采取的是螺旋涂布仪接种,而组织的3 家实验室采取的是L棒涂布方法。计数结果显示,所有实验室测得活菌数虽然均满足103CFU/样品的要求,但本实验室测得数目普遍高于其他3 家实验室,且样品之间的误差较小。造成此差异的原因可能是涂布方法的不同,螺旋涂布采用的是E50 模式,接样针接触培养基面积有限,且涂布轨迹清晰明确;而L 棒涂布则是用100 µL 样品液进行涂布,L 棒接触培养基的面积明显大于螺旋涂布的接样针,且涂布轨迹不如螺旋涂布仪统一,可能因此造成了误差。
我国对EHEC 等微生物污染造成的食品安全问题高度重视。在保证结果准确可靠的前提下,优化检验方法、提高时效性是国家对各微生物实验室提出的新要求。本研究研制的EHEC 菌株及其基因组DNA 标准物质可提高EHEC 检验的时效性,同时也弥补了我国在EHEC标准物质方面的空白。

