IL-6、IL-17、Th17与Treg在诊断新生儿败血症中的价值
曹艳林,龚永禄,何 青,吴建华,陈丽华
(1.常德市第一人民医院检验科,湖南 常德 415000;2.常德市第一人民医院儿科,湖南 常德 415000;3.中南大学湘雅三医院检验科,湖南 长沙 410013)
新生儿败血症是指病原体侵入新生儿血液循环并生长繁殖而引起的全身炎性反应综合征,从患儿血液、脑脊液等无菌腔隙体液能培养出致病菌[1]。患儿病情大多比较严重,病死率也较高[2]。该病治疗费用相对较高,对家庭和社会造成了沉重的负担[3]。范含笑等[4]研究报道,目前我国新生儿败血症发病率在活产婴儿中占0.1%~1.0%,住院新生儿病死率高达10.3%,且发生机制尚不清楚,败血症的早期诊断对提高患儿的预后有重要的临床意义。目前,对于新生儿败血症的实验室诊断、免疫学研究及相关治疗的问题亟待解决。
辅助性T细胞17(helper T cell 17,Th17)和调节性T细胞(regulatory T,Treg)是当前免疫学研究的热点之一[5]。周洋等[6]和Punt等[7]研究发现,Th17/Treg细胞平衡机制及其相关因子的变化,对促进机体清除病原体的入侵和抵制炎症反应发挥了重要作用。而白细胞介素-6(interleukin-6,IL-6)作为免疫调节性细胞因子,不仅参与炎症反应,也介导了Th17与Treg细胞的增殖和分化。Ye等[8]研究发现,IL-6是早期诊断新生儿败血症最具敏感性的炎症指标。我们的前期研究证实:新生儿败血症患儿外周血中IL-6水平出现了明显变化[9]。因此,我们推测败血症患儿体内IL-6水平的变化可能打破了患儿的免疫平衡,进而影响疾病的发生发展。为了证实该问题,本研究探讨了外周血中IL-6、IL-17、Th17与Treg细胞在新生儿败血症治疗前后表达水平的变化及临床价值,旨为新生儿败血症的临床诊断及治疗提供科学依据。
1资料与方法
1.1研究对象
收集常德市第一人民医院2020年8月至2022年1月期间确诊为新生儿败血症患者86例作为观察组(其中早产儿47例,足月儿39例),入选标准按照2019年中华医学会儿科学分会新生儿学组制订的专家共识[1]:①疑似诊断,即出生3日龄内的新生儿有下列任何一项者:异常临床表现、母亲有绒毛膜羊膜炎、早产胎膜早破大于18h。如无异常临床表现,血培养阴性,间隔24h的连续2次血非特异性检查2项以下阳性,则可排除败血症。②有异常临床表现,同时满足下列条件中任何一项:有2项以上的血液非特异性检查阳性;脑脊液检查为化脓性脑膜炎改变;血中检出致病菌DNA。③确定诊断为有临床表现,血培养或脑脊液(或其他无菌腔液)培养阳性。新生儿晚发型败血症临床诊断和确定诊断发生在3日龄以上的新生儿,其余条件同新生儿早发型败血症。排除标准:①近7d内使用影响造血功能及免疫功能的药物;②确诊为白血病等血液系统疾病者;③产妇患有其他基础疾病者;④产妇为少数民族者;⑤产妇有吸烟嗜酒史者。选取同期收治的129例新生儿科非败血症患者作为对照组。本研究获得我院医学伦理委员会批准实施(编号:2020-089-01)。所有患儿家长都知情并自愿签署书面知情同意书。
1.2细胞因子的检测方法
1.2.1仪器与试剂
人淋巴细胞分离液(批号:KLSH2001,规格:100mL),佛波酯(Phorbol 12-myristate 13-acetate,PMA)+Ionomycin(离子霉素)淋巴细胞刺激物[批号:PI-2014,规格:50(test,T)]和RPMI-1640培养基(批号:RPMI12003,规格:500mL)购自深圳市达科为生物工程有限公司。PE anti-human FOXP3(批号:B279946,规格:100T),FOXP3 Fix/Perm Buffer Set(批号:B335925,规格:100T),PerCP/Cyanine5.5 anti-human IL-17A(批号:B327457,规格:100T),PE Mouse IgG1,κ Isotype Ctrl(ICFC)(批号:B338362,规格:25T),PerCP/Cyanine5.5 Mouse IgG1,κ Isotype Ctrl(批号:B286218,规格:25T),Monensin Solution (1 000×,批号:B323668,规格:1mL)和BD FACSCantoⅡ流式细胞仪购自美国BioLegend公司。IL-6、IL-17试剂盒(批号:210902,规格:100T)购自青岛瑞斯凯尔生物科技有限公司。
1.2.2标本采集和制备
采集观察组治疗前后和对照组(未接受治疗前)患儿清晨空腹外周静脉血1.5mL,血液样本经EDTA抗凝后于4℃冷藏。密度梯度离心在2h内以2 000rpm的速度进行20min分离血清,-70℃下保存,用于随后的细胞因子检测。将外周血单个核细胞(peripheral blood mononuclear cell,PBMC)悬液浓度调整为1×106~8/mL,充分混匀后接种到添加RPMI 1640培养液的24 孔细胞培养板上。培养板上所有孔细胞再分别加入PMA(Abcam,50ng/mL)、离子霉素(Abcam,2μg/mL)5μL、莫能菌素(Monensin solution,MS)5μL后混匀,并置于温箱(37℃,5% CO2条件下)避光孵育5h。
1.2.3细胞因子IL-6、IL-17的检测流程
样本管中加入 25μL 实验缓冲液,再加入 25μL样品血浆后,向所有管中加入25μL捕获微球抗体(微球加入前充分混匀)和25μL检测抗体,室温避光震荡孵育 2h(400~500r/min),向所有管中加入 25μL SA-PE,室温避光震荡孵育 0.5h(400~500r/min),向每管中加入 1 000μL 1×洗涤缓冲液,涡旋数秒,400g 离心5min,缓慢倒出液体,倒扣于吸水纸上;向每管中加入 200μL洗涤缓冲液,涡旋 10s 将微球重悬,立即上机检测。样本检测完毕后,保存数据源文件至定义的文件夹内,用分析软件 LEGENDplex 8.0 分析同批号标准曲线和标本数据后自动计算输出检测结果(包括 IL-6、IL-17等)。
1.2.4 Th17、Treg细胞的检测流程
按1份细胞核固定液配3份磷酸缓冲盐溶液(phosphate buffer solution,PBS)配制细胞核固定液,按1份细胞核破膜液(FOXP3 permea-bilization buffer,FOXP3 PermBuffer)配9份PBS配制FOXP3 PermBuffer工作液。收获培养板培养的PBMC于流式管中,离心后去上清,用500μL PBS重悬混匀,向所有管加入500μL配制的细胞核固定液,室温下避光震荡孵育0.5h(10~20r/min),离心后弃上清,向所有管加入1mL配制的FOXP3 PermBuffer混匀,3 000rpm,5min离心后去上清,洗涤2次,留300μL液体混匀。其中正常对照管加300μL PBS混匀后平均分成两管(一管作为正常对照管,一管作为同型对照管)。正常对照管和样本管中均加入5μL异硫氰酸荧光素 (fluoresceine isothiocyanate,FITC) 抗人CD4 FITC(anti-human CD4)、5μlPerCP/Cyanine5.5(复合染料) anti-human IL-17A、5μL藻红蛋白(P-phycoerythrin,PE)anti-human FOXP3后混匀;同型对照管分别加入5μL FITC anti-humanCD4、5μL PerCP/Cyanine5.5 Mouse IgG1,κIsotype Ctrl(同型对照-流式抗体)、5μL PE Mouse IgG1,κIsotype Ctrl(ICFC)(同型对照-流式抗体)后混匀,所有管室温下避光震荡孵育1.5h(10~20r/min)。再向所有管加入1mL配制的FOXP3 PermBuffer,3 000rpm,5min离心后去上清,用PBS重悬并通过流式细胞术检测。
1.3统计学方法
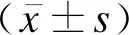
2结果
2.1两组一般资料比较
两组性别构成比、母亲孕龄、胎龄、体重、1min Apgar评分、5min Apgar评分、新生儿发病时间比较差异均无统计学意义(P>0.05),两组具有可比性。见表1。

表1 两组资料比较
2.2观察组与对照组Th17、Treg细胞表达水平
用两色荧光标记法检测细胞因子的水平:用CD4+IL17+标识Th17细胞,对照组与观察组治疗前、观察组治疗后的Th17细胞表达见图1。用CD4+FOXP3+标识Treg细胞,对照组与观察组治疗前、观察组治疗后的Treg细胞表达见图2。

图1 观察组治疗前后及对照组的Th17细胞表达图
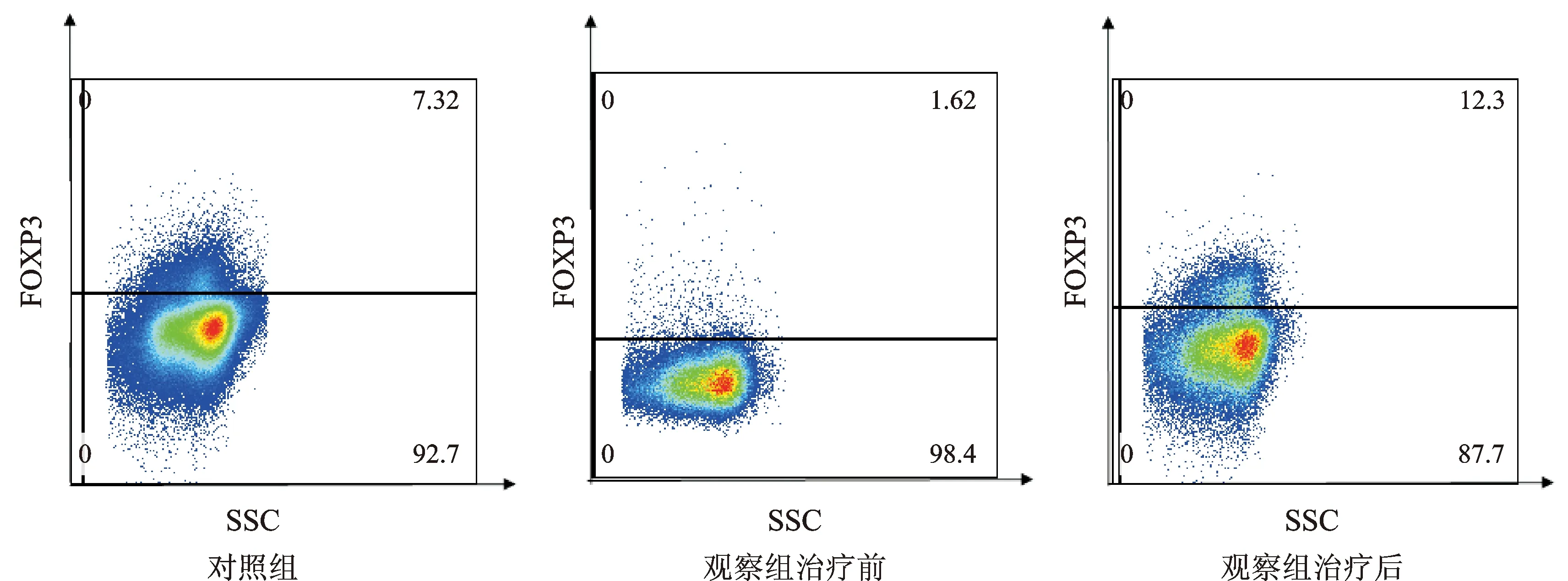
图2 观察组治疗前后及对照组的Treg细胞表达图
2.3观察组与对照组的IL-6、IL-17、Th17、Treg、Th17/Treg表达水平的差异
观察组治疗前、治疗后及对照组的IL-6、Treg、Th17/Treg差异均有统计学意义(P<0.05)。IL-6水平:对照组低于观察组(Z=-5.030,P<0.05),观察组治疗后低于治疗前(Z=-4.050,P<0.05);Treg:观察组治疗后高于治疗前(Z=-2.730,P<0.05),观察组治疗前低于对照组(Z=-2.310,P<0.05)。Th17/Treg:观察组治疗后低于治疗前(Z=-2.550,P<0.05),见表2。
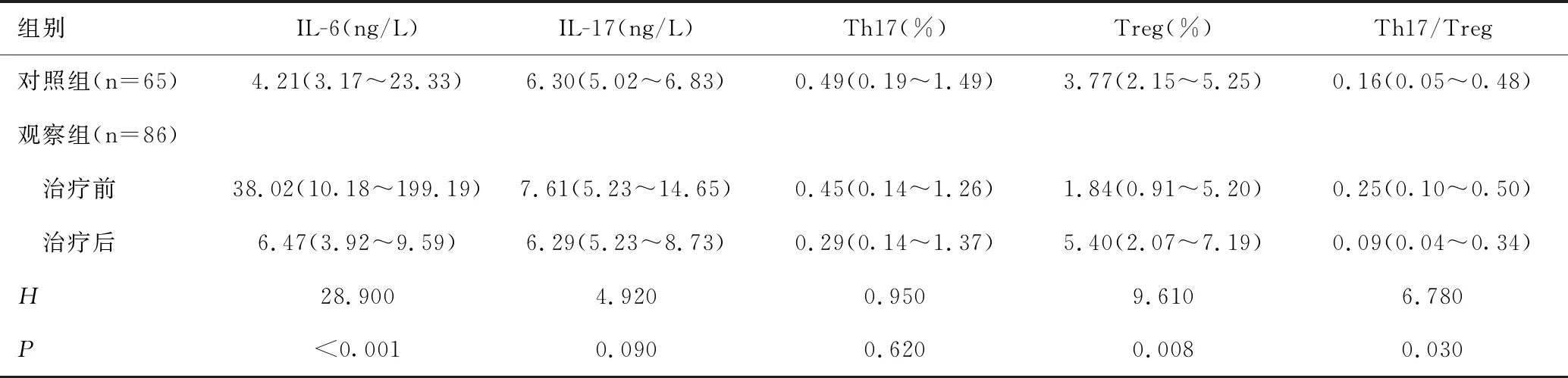
表2 观察组与对照组IL-6、IL-17、Th17、Treg、Th17/Treg表达水平的差异 [M(P25~P75)]
2.4观察组早产儿治疗前后的IL-6、IL-17、Th17、Treg、Th17/Treg表达水平的差异
观察组早产儿治疗后的IL-6、IL-17、Th17/Treg水平均低于治疗前(P<0.05),Treg水平高于治疗前(t=-2.440,P<0.05),见表3。
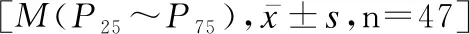
表3 观察组早产儿治疗前后IL-6、IL-17、Th17、Treg、Th17/Treg表达水平
2.5观察组足月产儿治疗前后的IL-6、IL-17、Th17、Treg、Th17/Treg表达水平
观察组足月产儿治疗后的IL-6、Th17/Treg水平均低于治疗前(P<0.05),IL-17水平均高于治疗前(P<0.05),见表4。

表4 观察组足月产儿治疗前后的IL-6、IL-17、Th17、Treg、Th17/Treg表达水平 [M(P25~P75),n=39]
2.6观察组治疗前外周血IL-6、IL-17与Th17、Treg表达水平的相关性分析
Spearman相关性分析显示:观察组治疗前外周血IL-6与Th17的表达水平呈正相关(r=0.507,P<0.05),见图3A;观察组治疗前外周血IL-6与Treg的表达水平呈负相关(r=-0.336,P<0.05),见图3B;观察组治疗前外周血IL-17与Th17的表达水平呈正相关(r=0.730,P<0.05),见图3C;观察组患儿治疗前外周血IL-17与Treg的表达水平无相关性(r=0.101,P>0.05),见图3D。
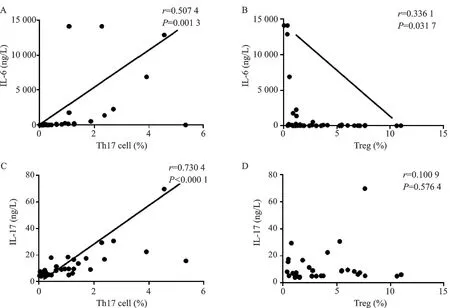
注:A.IL-6与Th17表达水平的相关性;B.IL-6与Treg表达水平的相关性;C.IL-17与Th17表达水平的相关性;D.IL-17与Treg表达水平的相关性。
3讨论
3.1新生儿败血症的早期预警生物学标志物仍然缺乏
新生儿细菌性败血症诊断的“金标准”是血培养阳性,但其诊断周期较长,一般在2~3d,易出现假阴性或假阳性结果,故早期诊断异常困难,易误诊或漏诊。因此,寻找一种针对新生儿败血症的敏感和特异的生物学标志物作为早期预警的指标,对于该病的早期诊断、治疗效果监测和预后判断均具有重要的临床价值。
3.2 IL-6、Th17和Treg与新生儿败血症的以往研究
IL-6是一种重要的促炎因子。Hotoura医师研究发现新生儿败血症时导致新生儿死亡的最主要原因是炎性反应失控,而在人体炎性反应中最活跃的细胞因子之一是IL-6。诊断新生儿败血症时IL-6水平较高提示新生儿存在败血症可能[10]。本实验结果与其相符,新生儿败血症在发病时IL-6水平明显升高,说明患儿体内炎性反应明显;随着病情好转患儿血浆IL-6浓度明显降低,说明其体内炎性反应减弱。
陈硕等[11]研究表明:在分化和维持期间CD4+T细胞及各种亚型有显著可塑性;CD4+T细胞新亚型Th17细胞与Treg细胞间也存在很灵活的可塑性。Liu等[12]研究发现:在炎症因子信号(如IL-1β、IL-6、IL-21、IL-23)作用下Treg细胞能够转化为Th17细胞。Ono等[13]研究报道:在IL-6缺乏时,通过信号通路强化FoxP3作用并促进Treg细胞发育。邢超等[14]研究证实,根据人胸腺、淋巴结、扁桃体和外周血中对Th17、Treg细胞的检测,证实Th17细胞可产生强烈的致炎效应,参与多种疾病的促炎症反应。Yan等[15]研究表明Th17和Treg细胞的不平衡是炎性疾病的特征。
3.3 IL-6、IL-17、Th17、Treg和Th17/Treg与新生儿败血症的新发现
本实验结果中,败血症患儿与对照组比较,发病初期血浆IL-6、IL-17浓度升高明显,同时Treg细胞比例显著降低,而且Th17/Treg细胞比值明显上升,提示新生儿败血症患儿体内炎症反应强烈,Th17与Treg细胞免疫平衡的打破参与患儿疾病的发生发展过程。
观察组早产儿治疗后的IL-6、IL-17、Th17/Treg水平均低于治疗前,差异均具有统计学意义。观察组足月产儿治疗后的IL-6、Th17/Treg水平均低于治疗前,差异均有统计学意义。以上结果提示早产儿发生败血症更为严重。其他的学者研究表明IL-6可以促进Th17细胞的分化发育并调控其功能,而且IL-6抑制Treg细胞的分化发育,Treg细胞可以通过与Th17细胞的相互作用来调节Th17细胞的功能[16-19]。本研究结果显示,治疗前败血症新生儿外周血IL-6与Th17的表达呈正相关,另与Treg细胞比例呈负相关;IL-17与Th17细胞比例呈正相关,而与Treg细胞比例无明显相关性,提示IL-6参与了败血症患儿体内免疫平衡稳态的破坏。发病初期败血症患儿Th17比例变化不明显而其血浆IL-6、IL-17水平明显增高,推测发病初期IL-6水平的变化可能仅仅促进Th17细胞功能增强,这还需要后期实验的进一步证实;本研究显示与治疗前相比,患儿治疗后其血浆IL-6、IL-17水平与Th17细胞比例下降,同时Treg细胞比例上升,从而使得Th17/Treg细胞比值明显降低,进一步证实新生儿败血症患儿IL-6水平的变化导致其体内免疫平衡稳态的变化。由此可见,随着新生儿败血症的发生发展,Th17与Treg细胞所介导的免疫反应发挥着举足轻重的作用。此外,对败血症新生儿外周血Th17与Treg细胞比例及其相关炎性因子IL-6等进行动态监测,能够对临床治疗效果进行准确地评估。
3.4 IL-6、IL-17、Th17、Treg和Th17/Treg参与新生儿败血症发生发展过程的机制尚待明确
IL-6、IL-17、Th17、Treg和Th17/Treg参与新生儿败血症发生发展过程的机制还需进一步实验研究,本研究通过干预新生儿败血症患儿体内IL-6水平从而为改善患儿病情提供了一个新的研究方向。
综上所述,在新生儿败血症的进展过程中,Th17与Treg细胞免疫平衡稳态的打破与之密切相关。加强对败血症新生儿外周血Th17细胞、Treg细胞、Th17/Treg细胞比值及其相关炎性因子IL-6的动态监测,能够对新生儿败血症的病情及临床治疗效果评估提供重要依据。

