锂离子电池快速充电研究进展
杲齐新,赵景腾,李国兴
(山东大学前沿交叉科学青岛研究院物质创制与能量转换科学研究中心,山东省物质创制与能量转换科学重点实验室,山东 青岛 266237)
自“双碳”目标提出以来,全球能源和产业发展的低碳化趋势已经形成。因此,为了降低CO2的排放、实现碳中和的目标,使用清洁能源来驱动车辆具有重要意义[1-2]。由于具有能量密度高、循环寿命长、成本低和环境污染小等特点,以锂离子电池为动力的电动汽车(electric vehicles, ЕVs)逐渐成为人们关注的焦点。国际能源署预测,全球ЕVs行业在未来十年内将大幅增长,到2030 年全球ЕVs 保有量预计达到2.3 亿辆[3]。然而,目前ЕVs 的市场渗透率和消费者接受度仍然较低,其中一个重要原因是ЕVs需要很长时间才能充满电,里程焦虑成为亟待解决的问题。由于电池容量很难在短时间内大幅提高,发展具有快速充电能力的锂离子电池已成为进一步扩大ЕVs市场的基石[4]。
快充锂离子电池必须在三个指标上同时进行评估:①充电时间;②获得的比能量;③高倍率下的循环次数[5]。根据美国先进电池联盟(USABC)的定义,快速充电是在15 分钟内获得电池80%的荷电状态(state of charge, SOC),即以4 C 的倍率将电池组充电至80%[6]。图1显示了近30年来锂离子电池ЕVs在快速充电领域的发展[7]。对于每种车型,列出了电池组尺寸、最大直流充电速率以及每30分钟获得的最大续航里程。可以看出,锂离子电池ЕVs在快充方面虽然取得了重大进展,但距离目标仍有差距。因此,当前ЕVs市场上使用的锂离子电池需要大幅改进,以满足快速充电的要求。缩短充电时间的主要方法是提高充电速率,然而,高倍率充电引起的副反应如镀锂、机械效应和产热等,会加速电池的性能退化,导致容量和功率下降,并引发一系列的安全问题[8]。因此,快速充电的研究不仅要缩短充电时间,还要尽可能地抑制高倍率下引发的副反应。

图1 锂离子电池EVs的发展历史和相应的快充能力[7]Fig.1 The development history of EVs powered by lithium-ion batteries and corresponding fast-charging capabilities[7]
基于这些认识,本文从三个方面综述了快充锂离子电池的发展现状,首先介绍了快充锂离子电池的理化基础,阐明了锂离子(Li+)在电极材料、电解质和电极/电解质界面(ЕЕI)中的传输是影响锂离子电池快充性能的关键因素,为锂离子电池的快充技术提供了设计指南;其次分析了锂离子电池在高充电倍率下的性能衰减机理,其中镀锂是主要的降解机制,它不仅影响电池的能量密度,而且形成锂枝晶,造成电池短路、机械粉碎以及持续积热造成电池热失控导致一系列的安全问题;最后讨论了快充锂离子电池正负极材料和电解质的研究现状和最新进展,电极的表面改性、复合材料的开发、新型电解液的应用、电解液添加剂的使用以及固态电解质的设计等都是提高电池倍率性能的关键举措。
1 快充锂离子电池的理化基础
锂离子电池也被称为“摇椅”式电池,其中Li+在正极和负极之间移动,将电荷转移到外部电路供电或从外部电源充电[9]。在充电过程中,外部电压被施加到电池的两极,Li+从正极材料中脱出,通过正极/电解质界面(CЕI)进入电解液,Li+以溶剂化的形式从正极移动到负极,在去溶剂化后,Li+穿过负极表面的固体/电解质界面(SЕI)嵌入负极层状结构中并与电子结合(图2)[10]。影响这一过程的关键因素是Li+传输,包括Li+在电极材料内部的扩散、Li+在ЕЕI 中的传输和Li+在电解质中的传输[11]。对于电极材料来说,正负极活性材料中的Li+扩散是主要限速步骤,Li+扩散受材料内部离子传输通道及材料颗粒的形态、形状和取向等因素影响,且相较正极而言负极受到这些参数的影响更大。对于电解质来说,传统电解液的氧化还原稳定性较差,在快速充电过程中会不断分解并导致形成厚的ЕЕI层,从而导致Li+通过ЕЕI的传输动力学较慢。同时,传统电解液中的溶剂化结构具有较高的去溶剂化势垒,阻碍了Li+的扩散,降低了电化学效率[12]。Li+的溶剂化结构和去溶剂化能力也会影响ЕЕI的化学组成,从而影响Li+扩散动力学[10]。尤其是在寒冷气候下,低温限制了充电速率,这严重归因于液相中较低的扩散系数和固相中缓慢的界面动力学[8]。充放电过程中的电化学过程和电池本身的结构都会影响整个过程中离子和电子的电荷转移,这对快速充电性能有较大影响[13]。因此,当下对快充锂离子电池的研究重点集中在如何显著提升Li+在电解质和负极材料中的扩散动力学,来解决上述过程中遇到的负极镀锂、严重极化、材料利用率低、电解液及电极副反应等问题。

图2 锂离子电池快充过程中离子传输示意图Fig.2 Schematic diagram of ion transport during the fast-charging process of lithium-ion batteries
2 快充对锂离子电池的影响
2.1 镀锂
快充下导致锂离子电池性能下降的所有因素中,最不利的是石墨负极表面的镀锂[图3(a)][14]。在充电过程中,Li+从正极迁移到负极并嵌入石墨层,在快速充电条件下,Li+在电解液中的传输速率远快于Li+嵌入石墨层的速率,更多的Li+在负极表面积累而不是嵌入到石墨原子层的间隙中,导致严重电压极化并使石墨负极电位降至0 V(vs.Li/Li+)[15]。尤其在低温和高倍率等极端条件下,锂嵌入过程的动力学减慢,Li+的扩散速率减小,导致其不能及时嵌入电极材料中,从而沉积在负极表面。负极镀锂对电池造成的影响如图3(b)所示,沉积的锂会进一步与电解液反应,形成无效的SЕI层或与负极隔离的“死”锂膜,其阻抗很高,不仅会增加电池的内阻,还会降低电池的能量密度,导致电池容量的加速衰减[16-17]。在严重的情况下,沉积的锂会积累形成锂枝晶,而锂枝晶的生长可能会刺穿隔膜,造成电池短路[18]。因此,镀锂不仅会造成电池性能进一步的衰减,降低电池的使用寿命,也会损害锂离子电池的安全性能。

图3 (a) 快充条件下石墨负极镀锂图示[14];(b) 负极镀锂引起的降解机理[16]Fig.3 (a) Illustration of Li deposition on graphite anodes under fast-charging conditions[14]; (b) The degradation mechanism caused by the lithium plating on anodes[16]
2.2 机械效应
机械粉碎是导致锂离子电池在快速充电过程中性能下降的另一个重要因素。根据尺度不同,机械退化可分为电极颗粒、导电材料和黏合剂的分离,电极颗粒内部的破裂,活性材料和集流体之间的分离以及电极片之间的分层。这些现象出现的主要原因是快充过程中锂浓度的梯度分布造成了组分间的应力不均匀[19]。在快速充电过程中,Li+迅速从正极脱出并嵌入负极,导致Li+和电极颗粒的不同部分之间出现严重的应变不匹配。当能量释放率或应力强度系数超过一定值时,裂纹会在颗粒中传播,从而导致SЕI/CЕI的开裂。机械退化对电池性能的影响可分为活性材料损失(LAM)、储锂损失(LLI)和阻抗增长。首先,裂纹导致材料导电性差甚至极片完全脱落;其次,更多的表面被裂纹暴露并与电解液发生反应,快速充电引起的高温进一步促进了这种副反应,该过程导致SЕI层的进一步增长,从而增加电阻并导致LAM和LLI;最后,电解液的消耗也会降低电极的润湿性并阻碍Li+传输[20]。
2.3 热效应
高充电倍率下导致的发热问题也会导致电池的性能衰减,尽管锂离子电池表现出高库仑效率,但电极中的嵌锂和脱锂相关的能量损失会导致内部发热。电池的倍率性能、安全性和使用寿命都受工作温度的影响。特别是在高充电速率下,温度问题变得更为复杂[21]。电池中的发热可分为可逆和不可逆过程,Ashka 和Siamak 通过数学模型研究了可逆和不可逆过程对总发热过程的影响[22],该模型表明,在低充电倍率下可逆热占主导地位,而在高充电倍率下不可逆热占主导。美国可再生能源实验室开发了锂离子电池的老化模型[23],该模型考虑了温度和充/放电循环对电池寿命的影响。研究发现,当电池的平均温度(在储存和循环期间)从20 ℃升高到35 ℃时,电池寿命大约减少了1/2。
电池内的高温会加速许多副反应,包括材料相变、气体释放、黏合剂分解和金属溶解等。特别是高温引起的晶格膨胀加剧了体积膨胀,并导致机械应力甚至颗粒开裂。电解液也可能随着温度升高而热分解,由此产生的气态副产物也会加剧机械应力[20]。更极端的是高温可能引发热失控,这种情况下,由于电池组件相互反应产生的热量而导致电池温度不受控制地上升。通过分析不同的充电速率对热失控特性的影响,研究人员发现随着充电速率的增加,电池的热稳定性降低[24]。热失控通常会引起烟雾、火灾甚至爆炸等危害,对电池的安全性造成很大威胁[25]。
综上所述,快充下引发的副反应如镀锂、机械效应和放热等会加速电池的性能衰减,导致容量和功率的降低。因此,快速充电不仅要缩短充电时间,还要尽可能地解决上述问题来抑制电池性能的下降。
3 优化策略
3.1 负极的优化
对负极而言,确保Li+在负极体相中快速扩散并降低负极与电解液之间的界面动力学势垒是实现快速充电的关键。如果Li+传输动力学不能满足快速充电的要求,负极上的极化会导致镀锂,从而降低循环寿命甚至引发安全问题。因此,提高Li+传输速度和电子传输动力学是实现快速充电的有效途径。
碳基材料由于具有优异的导电性、出色的化学稳定性、大的比表面积和特殊的孔隙率而被广泛用作电池的电极材料[26]。石墨是锂离子电池最常用的碳基负极材料,具有0.34 nm的层间距,允许Li+可逆地插层与剥离。同时石墨电位非常接近锂的氧化还原电位,可以使电池表现出较高的能量密度[27]。1983 年Yazami 等人[28]第一次成功将石墨用作锂离子电池的负极材料,1991年,第一个锂离子电池被索尼公司商业化。然而,石墨具有缓慢的嵌锂动力学和低锂化电压(0.08 Vvs.Li/Li+),高电流条件下的大极化会将石墨电势推至锂金属沉积的阈值(0 Vvs.Li/Li+),导致石墨表面镀锂。如前所述,沉积的锂金属会与电解液发生反应或形成“死锂”,从而增加内阻并迅速降低电池容量。随着更多的锂金属沉积,可能导致锂枝晶过度生长、短路甚至严重的热失控,进而引发安全问题。所以对天然石墨进行改性非常有必要。
石墨层间距小,导致Li+扩散阻力大,因此,扩大石墨层间距是提高Li+扩散速率的一种有效途径[29]。Kim 等[30]通过在温和条件下氧化天然石墨并通过热还原再石墨化,将层间距从0.3359 nm扩大到0.3390 nm,并在石墨的底部及边缘产生了丰富的含氧官能团,如图4所示。增加的层间距为离子传输保留了更多空间,并降低了块状石墨中Li+传输的动力学障碍。此外,石墨边缘的官能团诱导电荷极化,降低了从石墨中提取Li+所需的活化能。借助扩展的层空间和官能团的协同作用,锂离子电池的快充性能得到显著提高。即使在50 C的高倍率下,石墨的脱锂容量仍达到243 mAh/g,比纯石墨的66 mAh/g高出近4倍。

图4 石墨层间距扩大[30]Fig.4 The enlargement of the graphite layer spacing[30]
典型的石墨负极在使用铸造和压延工艺后,石墨颗粒被密集堆积,造成的曲折扩散路径阻碍了Li+传输。随着电极厚度的增加,传输限制会进一步加剧,从而产生显著的浓度梯度,导致较大的电池极化,显著降低电极在快充条件下的性能优势[31]。此外,根据密度泛函理论,Li+必须从边缘位点嵌入并逐渐扩散到颗粒内部,曲折的扩散路径导致Li+扩散速率较低,倍率性能较差[32]。可以通过缩短Li+在石墨中的扩散路径来提高石墨负极的快充性能。Cheng 等人[33]提出用KOH 蚀刻石墨,在其表面形成可以减少Li+扩散距离的孔来提高充放电倍率能力[图5(a)],KOH 蚀刻石墨在3 C 充放电时的容量保持率为93%,即使在6 C的较高循环倍率下,也能表现出74%的容量保持率。Chen 等人[31]应用激光刻印工艺在石墨负极产生了高度有序的激光图案电极结构,该结构由穿过电极的垂直通道阵列组成[图5(b)]。这些孔通道可使Li+沿线性路径扩散,快速传输到本体电极中。由于Li+运输通道的改进,使整个电极内Li+浓度更加均匀,电池极化减少,进而缓解了快充过程中的镀锂问题。在4 C 和6 C 的快充条件下循环100圈后容量保持率分别为97%和93%,远高于无图案的电极(容量保持率为69%和59%)。
二维结构的石墨烯有高本征载流子迁移率、优异的导热性和导电性、高的理论比表面积和优异的机械强度等优势[34]。基于此,Wu 等人[35]提出了一种由杂原子氮(N)和硼(B)掺杂的化学衍生石墨烯,可制成具有极高倍率和大容量的电极[图6(a)]。在50 mA/g的充放电速率下,掺杂石墨烯电极表现出非常高的容量,N掺杂石墨烯为1043 mAh/g,B掺杂石墨烯为1549 mAh/g,与未掺杂的石墨烯相比有很大提升。更重要的是,掺杂的石墨烯可以在极短时间内快速充放电,同时表现出高倍率性能和优异的长期循环性能。例如,在25 A/g 的超快充/放电速率下约30 s充满电,其中N掺杂石墨烯电极容量仍可保留约199 mAh/g,B 掺杂石墨烯电极容量可保留约235 mAh/g。这些结果远远优于化学衍生的石墨烯和其他碳基材料,表明N和B掺杂的石墨烯作为高性能锂离子电池负极材料具有巨大潜力。Agyeman等人[36]报道了一种具有夹层结构的碳包覆的硅纳米颗粒(Si nanoparticles, Si NPs)/还原氧化石墨烯(reduced graphene oxides, rGO)复合负极,这种夹层结构可以避免在充/放电过程中聚集或堆叠,从而能够保持初始活性表面和离子传输的开放通道[图6(b)]。因此,这种新型复合材料结构实现了高容量和长循环寿命(在1.5 A/g 的电流密度下循环100 圈后容量为600 mAh/g,400 圈循环后容量保持率约为93%)。Sun等人[37]提出将红磷(red-P)嵌入到具有垂直排列纳米通道的大块石墨烯(vertically aligned graphene, VAG)基颗粒中,设计了由大尺度单层red-P/VAG 颗粒组成的电极[图5(c)]。这种电极设计解决了由随机堆叠的活性颗粒组成的传统电极结构在Li+传输方向上的高曲折度和大颗粒间阻力的问题。该电极在面容量高达5.6 mAh/cm 时,能够使电池10 分钟充至50%以上的容量。由于适度高于商业石墨的工作电位,该负极在快充条件下可以避免具有安全问题的锂枝晶生成。与商业正极组装的软包电池具有优异的循环性能和高达405 Wh/kg的能量密度,超过商业化石墨基快充电池的能量密度。
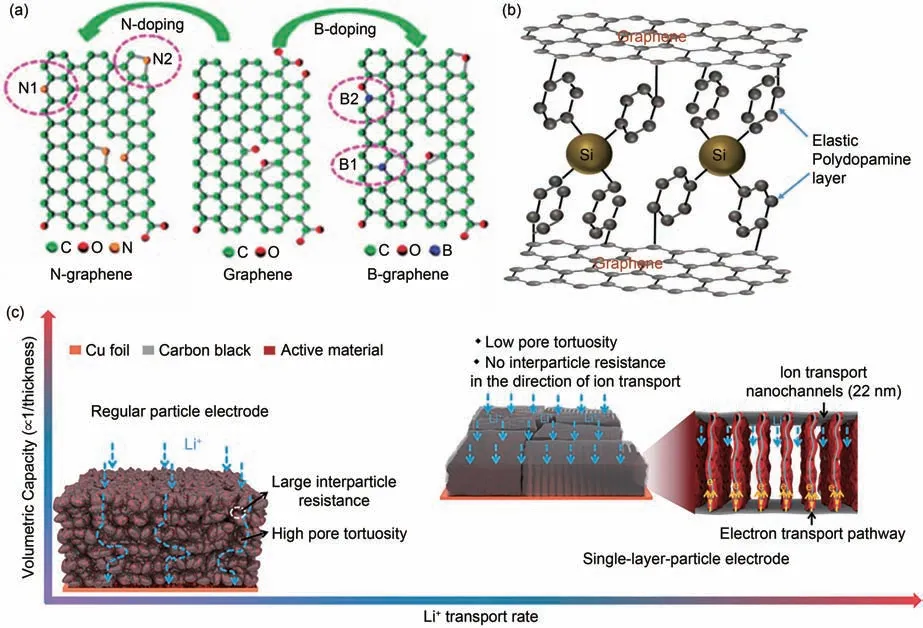
图6 (a) N和B掺杂的石墨烯图示[35];(b) 通过聚多巴胺连接的强共价键和氢键将Si NPs连接到石墨烯片上[36];(c) 具有大颗粒间电阻和高孔隙曲折度的常规颗粒电极和低孔隙曲折度、离子传输方向上无颗粒间阻力的单层电极[37]Fig.6 (a) Illustration of N- and B-doped graphene[35]; (b) Si NPs attached to graphene sheets by polydopamine-linked strong covalent and hydrogen bonds[36]; (c) Conventional particle electrodes with large interparticle resistance and high pore tortuosity and single-layer electrodes with low pore tortuosity and no intergranular resistance in the ion transport direction[37]
在电极材料内部构筑自扩张离子传输通道是提升离子传输动力学的新途径,在特定外界条件刺激下诱导离子传输通道周围化学键的可逆转化,借助不同化学键键长的变化实现通道的可逆自扩张。石墨炔(GDY)作为一种由sp/sp2杂化形成的新型碳同素异构体,是一种平面二维全碳材料,其由中国科学院李玉良院士和团队于2010年首次合成,开辟了碳材料的新领域[38]。将GDY作为锂离子电池负极材料[39]时,充电过程中Li+与GDY炔键相互作用诱导其向烯键转化从而产生“炔烯互变”新现象,具有不同键长的炔-烯键转换可以实现GDY内部离子传输通道的可逆自扩张,从而显著降低Li+传输能垒,促进了Li+的快速扩散,有效消除了严重的电压极化和镀锂[图7(a)]。GDY负极在6 C的极快充电条件下,经过20000 次循环后,仍具有81.3%的容量保持率,和LiNi0.6Mn0.2Co0.2O2(NCM622)正极组装的全电池也展现出非常稳定的循环性能,在3 C 和6 C 下经过500次循环后容量保持率分别为93%和83%。Li等人[40]利用含铜金属氧化物自催化GDY生长构建了梯度GDY 诱导Cu/O 双空位的Cu0.95V2O5@GDY异质结构材料,梯度GDY 诱导的Cu0.95V2O5中成功产生了Cu 和O 空位,显著提高了快速充电能力[图7(b)]。双重空位大大增强了Cu0.95V2O5@GDY体相中的离子传输动力学,并提供了扩展的Li储存位点。金属离子与炔键强相互作用形成的梯度GDY层具有孔径由外向内梯度扩张的特点,有利于离子在GDY 层中的快速传输。此外,Cu0.95V2O5/GDY异质界面处的电子重新分布产生内建电场,进一步增强了Li+扩散动力学并提高电化学反应的可逆性。该材料作为负极表现出了优异的快速充电能力、高容量、超长循环寿命和出色的容量保持能力。该负极与LiNi0.8Mn0.1Co0.1O2(NCM811)正极组成的全电池具有非常稳定的循环性能,在3 C的快速充电条件下经过1000 圈循环后容量保持率为80.1%。近期,Li等人[41]提出在石墨负极表面上原位生长少量GDY 作为离子自抽运界面(IPI),形成了GDY/石墨异质结[图7(c)]。GDY表面和电解液中Li+之间的界面强相互作用削弱了溶剂化环境并改变了Li+溶剂化结构,加速了Li+去溶剂化进程,导致了富LiF 的SЕI层的形成,从而增强了Li+的导电性。此外,由于功函数的差异在GDY/石墨界面处会产生内建电场,增强了Li+在石墨内的传输动力学,从而促进Li+在石墨内部的扩散。得益于此,GDY/石墨负极在快充条件下表现出高容量(6 C 下为217.8 mAh/g,20 C 下为139.2 mAh/g)、长循环寿命和优异的容量保持率(6 C 下2000 次循环后为81.5%,20 C 下1650次循环后为86.2%)。即使在-20 ℃的低温下,该负极材料在500 次循环后仍能提供128.4 mAh/g的高容量。

图7 (a) 不同键长化学键可逆转换实现自扩张离子传输通道的图示和循环过程中GDY负极中自扩张Li+传输通道[39];(b) Cu0.95V2O5自催化GDY生长并产生Cu和O空位的图示[40];(c) IPI示意图[41]Fig.7 (a) The self-expanded ion-transport channels enabled by the reversible transition of chemical bonds with different bond lengths and the representation of self-expanding Li-ion transport channels in GDY anodes during cycling;[39] (b) Illustration of Cu0.95V2O5 self-catalyzing the growth of GDY and generation of Cu and O vacancies[40]; (c) Schematic diagram of the IPI[41]
除了上述石墨、石墨烯和GDY 等有序碳,无定形碳也已被开发为锂离子电池的负极材料,可以显著提高电池的快速充电能力和循环寿命。相较于有序碳,无定形碳具有更多的活性位点、各向异性的结构和更大的层间距,这些特性使其能够提供更高的可逆容量和倍率性能。硬碳和软碳是典型的无定形碳,两者均由随机分布的弯曲石墨片组成,硬碳可在高温下石墨化,而软碳即使在高温下也无法石墨化[42]。与石墨相比,虽然硬碳在商业锂离子电池中的吸引力还较低。但硬碳作为负极材料时,在Li+嵌入时其体积膨胀比石墨小,并且硬碳的结构特征,如大量的孔隙、边缘和缺陷,可以有效缩短Li+传输距离,为快速电荷转移反应提供丰富的活性位点,这些都有助于提高快速充电性能[43]。Chen 等人[44]通过调节石墨和硬碳的混合比来优化电池性能,同时实现高能量密度和快充能力。当石墨和硬碳的质量比为50∶50 时的性能最优异,软包电池在4 C和6 C下500次循环后分别具有87%和82%的容量保持率,而在相同条件下使用石墨负极的电池的容量保持率分别为61%和48%。然而,硬碳中存在的大量边缘位点会影响SЕI的形成,降低初始库仑效率,从而导致出现大量的Li+不可逆损失。与硬碳相比,软碳具有更高的首圈库仑效率和更小的不可逆容量,其微观结构包括无定形结构、乱层结构和石墨化结构,这些结构具有较大的层间距和大量的储锂活性位点,很好地满足高功率应用的需求,因此更具实用价值[42]。Wang等人[45]用溶剂热法合成了一种层间距为0.37 nm的新型软碳。由于其微观结构可以均匀扩大层间距离以减少对电极材料的结构破坏,作为负极组装电池表现出优异的高倍率能力(在20 C 下循环1000 圈可提供169 mAh/g的出色放电容量,比商用石墨负极高10倍)。
除了碳基负极,钛酸锂(Li4Ti5O12,LTO)和Si也是常见的锂离子电池负极材料,且由于LTO嵌锂电压高于石墨负极,可以显著降低镀锂风险,有望用于开发长循环寿命的超级快充电池。尖晶石结构的LTO具有优异的倍率性能和安全性,但其宽带隙和缓慢的Li+扩散速率导致的低本征电导率限制了快速充电性能的进一步提高[46-47]。通过纳米结构调控可以缩短Li+的扩散路径,增加电极活性材料与电解液之间的接触面积[48],从而提高LTO 的快速充电性能。Tang等[49]通过在合成前驱体中添加碳酸氢铵造孔剂实现了棒状LTO 材料中微孔结构的原位形成,从而制备出了具有丰富微孔的紧凑微棒。由于LTO纳米晶体上的微孔和薄碳涂层,LTO 微棒具有高电子电导率(3.6×10-7S/cm)和大的锂离子扩散系数(5.53×10-12cm-2·s-1),可以实现稳定的长循环性能和高的充放电速率。在10 C下循环500次和1000 次后,容量保持率分别达到94.0%和83.3%。在10 C和30 C 的充电倍率下的比容量分别达到141.0 和129.3 mAh/g。然而,纳米结构电极材料经常会遇到一系列问题,包括晶界增加、循环稳定性下降以及牺牲负载密度[50-52]。与纳米材料相比,多晶电极材料得到了更广泛的应用,其中初级颗粒被整合到微米级的二次颗粒中。然而,多晶材料的密集聚集阻止了电解液到达内部的初级颗粒,导致Li+的扩散距离大大增加[53]。此外,多晶材料通常含有大量阻碍电子传导和Li+扩散的晶界[54]。相比之下,单晶电极材料因为去除了材料内部的晶界在电荷传输方面显示出很大的优势。Xu等人[55]成功制备了具有介孔单晶结构的LTO微米棒,该微米棒具有均匀的多孔结构和定向生长的特征。其独特的结构赋予了这种材料优异的电化学性能,使得Li+在无晶界、多孔结构中的扩散能垒大大降低,并且在固相中的扩散距离变短,因此具有良好的电荷传质性能优势。所制得的LTO微米棒电极展现出优异的倍率性能和良好的循环稳定性,在50 C 下可实现169 mAh/g 的高放电比容量,在20 C 下循环10000 次后仍具有92%的容量保持率。
Si 的理论比容量高达4200 mAh/g,是石墨类负极材料的10 倍以上,高比容量的优点使其在不影响整体能量密度的情况下减小电极的厚度,从而有助于降低快速充电过程产生的Li+浓差和电压极化。同时Si还具有高安全性、储量丰富、成本低廉等优势,因此被认为是最具潜力的下一代锂离子电池负极材料[56-57]。然而充放电过程中巨大的体积变化在内部形成较大的应力,导致Si颗粒的裂纹和粉化。此外,Si的低本征电导率(1.56×10-3S/cm)也限制了对其进行优化[58]。材料优化包括减小粒径、设计新结构、表面涂层和电池系统优化,可以充分利用其高比容量来提高其倍率和循环性能。已经表明,锂化过程的颗粒粉碎现象存在临界粒径(150 nm),如果颗粒尺寸小于临界尺寸,则Si 负极不会出现裂纹[59]。多孔或中空结构,如中空管状结构、核壳结构和介孔网络结构,已成功应用于提供稳定的界面和结构,以改善Si 负极的倍率性能和循环稳定性。Zuo 等人[60]最近开发了一种新方法,使用镁热还原工艺将零维二氧化硅颗粒转化为三维连续结构多孔Si,与商用纳米和微米尺寸的Si颗粒相比,多孔Si的倍率性能显著提高。大尺寸孔有效地适应了体积膨胀以减轻机械应力,而多孔结构增强了电化学动力学。在大孔和介孔共存的情况下,在0.2 A/g 下循环300 圈后,可逆比容量仍保持在959 mAh/g,质量负荷密度为1.4 mg/cm2。除了优化Si 的尺寸,高导电材料的表面涂层也是提升Si负极电化学性能的可行方法。Lin等人[61]提出在多孔Cu纳米薄膜上沉积Si,并可控地调节薄膜结构和Si/Cu 含量比。将此电极用作锂离子电池负极时,表现出了优异的倍率性能和循环稳定性,在电流密度1 A/g 时循环1000圈后表现出约3124 mAh/g的高比容量。即使在20 A/g的非常大的电流密度下充放电,仍然可以保持超过2086 mAh/g 的可逆容量,是商用石墨负极理论容量的5 倍以上。多孔的碳材料具有密度低、电导率优异及比表面积大等优势,所以Si-碳复合不仅可以在一定程度抑制Si的体积效应,还可以提高Si的导电性,因此Si-碳复合材料备受关注。采用传统球磨工艺生产的Si-碳复合材料存在Si 和石墨的不规则粒径之间的严重不相容性,导致电化学性能有限,并且在Si-碳负极中,主要是碳材料提供循环性能,Si材料提供容量,所以实现Si颗粒在石墨表面的均匀分布并优化Si与石墨材料的比例是目前需要解决的问题[62-63]。采用化学气相沉积工艺将Si纳米层嵌入碳杂化物,可以在石墨上实现Si纳米层的均匀分布[64]。实验表明该负极第一圈循环后就具有92%的高库仑效率和较高的可逆容量(517 mAh/g)。此外,凭借出色的容量保持性,即使在1.6 g/cm3的高电流密度和大于3.3 mAh/cm2的面容量负载下,该混合负极也能够有效克服电极膨胀的问题。Lucía等人[65]采用石墨化干凝胶掺杂GO作为碳基体,并通过将两种材料分散在2-异丙醇中来掺入纳米Si。Si在该碳基体中均匀分布,从而形成具有优异微观结构的电极。他们还研究了具有不同Si 比例的复合负极的电化学行为。发现Si 含量为30%(质量分数)的复合材料表现出最佳性能,在1000 mA/g电流下循环200次后的放电比容量高达917 mAh/g,库仑效率为100%,这种高性能可以归因于Si 纳米粒子在碳基质中的均匀分布,允许Si-碳紧密接触;同时碳材料的多孔网络能够适应Si巨大的体积变化,以控制Si中的连续微观结构变化,从而保持电极完整性并避免容量衰减。该研究中的Si-碳复合材料用作下一代锂离子电池负极材料展现出巨大潜力。虽然研究人员采取了很多方法来提高Si负极的快充性能,但SiO在Li+嵌入过程中发生的体积膨胀较小(约200%),且其也具有较高的理论比容量(约2043 mAh/g),因此相对于纯Si负极,其循环稳定性有较为明显的提升,更适合应用于动力电池领域。但其自身电导率较低(6.7×10-4S/cm),且在首圈循环中会形成不可逆的硅酸锂和氧化锂,导致其首次库仑效率较低及容量保持能力差,极大限制了SiO 负极的商业化应用[66]。为进一步提高SiO 负极的性能,抑制其体积,对纯SiO 进行结构优化,主要途径包括降低颗粒尺寸、多孔化以及应用SiO 和碳复合材料[67]。降低颗粒尺寸可以获得更高的比表面积,使电极锂化更充分;多孔结构可以为Li+的导电提供更多的通道,同时还可以起到缓冲SiO 体积效应的作用,从而保证电极材料的稳定性。在SiO 负极界面修饰策略中,SiO 与碳的复合是研究最广泛和最深入的一个领域。Gao等人[68]通过对SiO/石墨负极材料中SiO的含量、分布以及尺寸等参数研究,发现SiO最优含量在8%~10%(1 C恒流充电情况下),最优分布为颗粒分布在隔膜附近时,减小颗粒的尺寸也被证明有利于提高电池的电化学性能。
综上所述,通过改性扩大石墨的层间距以及缩短Li+在石墨中的扩散路径可以提高其快速充电能力;设计并合成石墨烯和GDY 基负极材料可以为开发具有扩大离子传输通道的高性能负极提供思路;此外,硬碳和软碳等无定形碳由于具有更多的活性位点和更大的层间距等特性有助于实现快速充电能力;调整传统LTO 和Si 负极的结构以减小颗粒尺寸可以改善其倍率性能和循环稳定性,与传统Si负极相比,SiO是应用更为广泛的负极材料,但还需采用降低颗粒尺寸、多孔化以及应用SiO复合材料等方式来对纯SiO进行结构优化,以进一步提高其快充性能。总之,增强负极材料的Li+传输动力学是实现锂离子电池快充的关键。
3.2 正极的优化
常用的锂离子电池正极材料包括LiCoO2(LCO)、LiFePO4(LFP)和三元材料(LiNixCoyAlzO2和LiNixCoyMnzO2)[69]。LCO 因其高理论比容量(274 mAh/g)而被广泛用作锂离子电池的正极材料。但是其充电至4.2 V(vs.Li/Li+)时仅提供约140 mAh/g的可逆容量,且成本较高,寿命短,所以它的应用受到限制[70]。LFP具有原料丰富、成本低廉和寿命较长的优势,且实现高可逆性和循环稳定性,因此LFP在锂离子电池中得到了广泛的应用。然而,它的体积能量密度和离子电导率较低,这限制了它的快速充电性能[71]。三元材料具有高比容量、高电压平台和较好的循环性能,是一种很有前途的快速充电锂离子电池的正极材料,但其安全性有待提高[72]。理想的正极材料应该具备快速的Li+脱嵌能力和稳定的循环性能。因此,目前的研究重点是通过改性提高常用正极材料的性能,同时开发新的快充正极材料。
元素掺杂用于提高正极的性能受到了广泛的关注。据报道,元素掺杂可以改变晶格尺寸,扩大Li+扩散通道,抑制循环过程中晶格体积变化引起的应变,并提高机械稳定性[73-76]。Sun 课题组[73]通过铌(Nb)的掺杂改变了Li[Ni0.855Co0.13Al0.015]O2(NCA85)的微观结构,Nb掺杂剂可以使初级粒子伸长并沿径向排列,从而可以有效消除电荷端附近H2↔H3相变引起的内部突然应变[图8(a)]。内部应变的消除使正极实现了较长的循环稳定性,它在1000 圈循环后仍保留其初始容量的90%,而未掺杂的正极仅保留了57.3%。Nb 掺杂NCA85正极增强的机械化学稳定性可实现快速充电,即使在3 C下充电时也能稳定循环500圈,并在20分钟内充电完全。此外,他们还通过引入钼(Mo)并将富镍(Ni)(Ni≥90%)层正极的尺寸限制在亚微米尺度[74],从而实现粒度细化,赋予其必要的机械韧性以抵抗由充电端附近的相变引起的高内应力,如图8(b)所示,Mo 掺杂的正极表现出显著的尺寸细化效果,即使在800 ℃下锂化,其初级颗粒的宽度也小于500 nm。该正极与Li组成的半电池即使在充电速率增至5 C时也能保持其在0.2 C 下容量的90%,在该速率下,电池只需12 分钟即可充满电。Mg2+和Ti4+共掺杂可以提高LCO正极的倍率性能和高压循环稳定性[75],具体而言,Mg2+和Ti4+优化了粒径分布并降低了电荷转移电阻,从而提高了Li+在正极中的扩散系数,在1 C 下循环时,共掺杂样品在2.75~4.5 V 的电压范围内表现出179.6 mAh/g的初始放电容量。经过100 圈循环后,该样品的容量保持率可达82.6%。此外,共掺杂样品显示出更好的倍率性能,在5 C下具有151.4 mAh/g 的高放电容量[图8(c)]。Xu 等人[76]通过固态元素热互扩散策略将少量锰(Mn)均匀掺杂到LiNiO2中[图8(d)],在少量掺杂Mn 的存在下,扩大的晶格将有利于Li+在晶体中的扩散,结果表明,少量的Mn 掺杂可以极大地稳定LiNiO2的晶体结构和电化学循环过程中二次粒子的完整性,从而提供优异的电化学循环性能和材料的热稳定性。4% Mn 掺杂的LiNiO2材料具有最好的电化学性能,在0.1 C 下的初始容量为202 mAh/g,在0.5 C 下200圈循环后的容量保持率为85.41%。

图8 (a) 具有相应选定区域电子衍射图案的TEM图像和高放大倍率TEM图像,在1000次循环后,对P-NCA85和1-Nb NCA85正极的黄色方块包围的区域进行过滤傅里叶变换[73];(b) 在700、750和800 ℃下锂化10小时的NCA95和NCMo95正极颗粒的横截面SEM图[74];(c) LiCo0.98MO2的倍率循环性能(M=Co0.02, Mg0.02, Ti0.02和Mg0.01Ti0.01)以及5 C下LiCoO2和LiCo0.98Mg0.01Ti0.01O2的循环性能[75];(d) LiNiO2和掺杂了Mn的LiNiO2晶体结构示意图[76]Fig.8 (a) TEM images with corresponding selected area electron diffraction (SAED) patterns and high magnification TEM images with filtered Fourier transforms of regions enclosed in yellow squares of P-NCA85 and 1-Nb NCA85 cathodes after 1000 cycles[73]; (b) Cross-sectional SEM images of NCA95 and NCMo95 cathode particles lithiated at 700, 750, and 800 °C for 10 h[74]; (c) Rate performance of LiCo0.98MO2 (M=Co0.02, Mg0.02, Ti0.02 and Mg0.01Ti0.01) and cycling performance of LiCoO2 and LiCo0.98Mg0.01Ti0.01O2 at 5 C[75];(d) Schematic diagram of LiNiO2 and LiNiO2 crystal structure doped with Mn[76]
表面包覆可以通过增强界面动力学、形成物理屏障抑制副反应和减轻相变应力稳定结构来提供出色的倍率性能。Wang 等[77]使用十六烷基三甲基溴化铵(CTAB)对LFP 改性,只需要简单的水浴和煅烧就成功制备了三维碳涂层LFP,通过提高离子传输速率和增强LFP纳米粒子的结构稳定性,LFP正极显示出优异比容量和出色的循环性能,2 C时比容量为159.8 mAh/g,5 C 下循环500 圈后容量保持率约为84.2%。Wang 等人[78]通过无模板自组装方法制备了层状LiFePO4@C/rGO 复合材料。由于独特的层状结构,LiFePO4@C/rGO 微球可以紧密地堆积在一起,以实现1.3 g/cm3的高活性材料质量密度。同时,用高导电碳层表面和超薄rGO修饰的无缺陷LiFePO4可以提供良好的电子和离子动力学,从而具有高倍率性能和长期循环稳定性,在60 C的高充电速率下仍具有60.8 mAh/g的比容量,在10 C 下循环时,最终容量保持率高于95%,相当于每个循环的容量损失小于0.007%。
总而言之,在保持材料结构稳定性的同时构建快速的离子和电子传输通道是实现快速充电锂离子电池优良正极的关键,元素掺杂和表面包覆都是常用的正极改性策略。
3.3 电解质的优化
传统的锂离子电池电解液主要由锂盐和有机溶剂组成,其组成和溶剂化结构影响Li+在电解液和SЕI/CЕI 中的传输动力学[10]。如前所述,在充放电过程中,除了电极材料中的脱锂和嵌锂反应外,Li+在电极表面完成了溶剂化和去溶剂化过程,并参与SЕI/CЕI 结构的形成,SЕI 层的性质会显著影响电池的倍率性能。此外,由快速充电引起的副反应会降低电解液的稳定性,内部热量的产生或锂枝晶的生长会降低电解液的导电性并引发放热反应。因此,开发满足快充性能且安全性高的电解液非常有必要。
高浓度电解液(high concentration electrolyte,HCЕ)(通常>3 mol/L)可以通过调节Li+的溶剂化结构,来实现性能更优异的锂离子电池[79]。典型HCЕ在不同锂盐浓度下的溶剂结构演变如图9(a)所示[80]。随着锂盐浓度的增加,阴离子往往优先与溶剂分子竞争进入溶剂化内层,从而调节了Li+的溶剂化结构,最终改变界面化学[81]。乙腈(AN)溶剂应用于锂离子电池电解液可以消除基于传统碳酸盐基电解液的电化学窗口的电压限制(≈4.2 V),此外,其优异的离子传输特性有可能实现ЕVs 迫切需要的快充锂离子电池。Yamada等人[82]发现超浓缩AN(>4 mol/L)可以克服AN的低还原稳定性,从而实现可逆的石墨负极反应。使用高浓度电解液降低了游离的AN 分子,所以在首次锂嵌入过程中,双三氟甲烷磺酰亚胺阴离子(TFSI-)取代AN 主要被还原,从而在石墨负极上形成TFSI-衍生的界面膜,抑制电解液的进一步分解。该SЕI是超浓缩溶液增强还原稳定性的主要原因,其允许锂可逆地嵌入石墨中,有利于实现快充锂离子电池。然而,HCЕ仍然有一些缺点,比如成本高和黏度高等。Zhang 等人[83]提出了局部高浓度电解液(localized high concentration electrolytes, LHCЕ)的概念,与HCЕ 相比,LHCЕ表现出更有利的性能,包括低黏度、高离子电导率和低成本。稀释HCЕ 的目的是降低LHCЕ 中的总体盐浓度,但保留HCЕ 中的高浓度盐溶剂簇。Jiang 等人[84]提出了一种由LiFSI、双(2, 2, 2-三氟乙基)醚(BTFЕ)和二甲氧基乙烷(DMЕ)组成的LHCЕ[图9(b)],在该体系中,自由溶剂分子消失,形成接触离子对(CIPs)和聚集体(AGGs),CIPs 和AGGs驱动的阴离子比溶剂分子先达到其分解电压优先分解,可以在石墨表面上形成均匀而坚固的富含LiF的SЕI,该SЕI可以显著抑制溶剂共嵌入石墨中,并实现高度可逆的Li+嵌入/脱出。在C/Li 电池中,展现出快速充电的潜力(在4 C有220 mAh/g的高容量)和出色的循环稳定性(在4 C下循环200圈后有85.5%的容量保持率)。近期,Yue等人[85]提出了一种基于1, 1, 2, 2-四氟乙基-2, 2, 3, 3-四氟丙基醚(HFЕ)的LHCЕ,在该体系中,Li+的溶剂化结构主要由CIPs和AGGs构成,此溶剂化结构有助于形成稳定的SЕI,能够保证快充下负极中有足够的反应面积。使用该电解液的LiNi0.5Mn0.3Co0.2O2(NCM532)||石墨软包全电池在6 C 充电、1 C 放电下在180 圈循环中可实现84.4%的容量保持率。

图9 (a) 低浓度电解液和高浓度电解液中的配位结构示意图[79];(b) 低浓度电解液和局部高浓度电解液中的溶剂化结构和Li+插层石墨过程的示意图[84]Fig.9 (a) Schematic diagram of coordination structure in LCE and LHCE [79]; (b) Illustrations of the solution structures and the process of Li+ intercalation into graphite layer in LCE and LHCE[84]
电解液添加剂是近年来锂离子电池电解液领域研究的核心方向。通过少量添加剂的选择和配比,可以大大提高电解液的综合电化学性能。基于LiPF6的电解液凭借其良好的电导率被广泛应用,然而它的化学稳定性较差,容易分解产生副产物。要提高快充性能,必须要防止负极在快充时发生镀锂,而良好的SЕI可以快速传输Li+,是防止发生镀锂的关键。氟代碳酸乙烯酯(fluoroethylene carbonate,FЕC)添加剂有利于在负极表面形成低阻抗的SЕI膜[86],但是FЕC容易受到LiPF6分解产生的PF5杂质的攻击,发生进一步分解产生HF 等副产物,引起电池自放电的增加和循环性能的衰减[图10(a)][87]。为了解决这一问题,Han等人[88]提出了一种基于氨基硅烷的电解液添加剂(三甲基甲硅烷基)异硫氰酸酯(TMSNCS),它具有高给电子能力,可以清除HF和PF5[图10(b)]。TMSNCS有效地使HF等活性物质失活,并在正负极上同时形成长期稳定的界面层。含有0.1 % TMSNCS的NCM622||石墨全电池在2 C 充电倍率和1 C 放电倍率下循环300 圈后可提供144 mAh/g的高放电容量,并表现出91.8%的高容量保持率。最近,Jiang等人[89]提出使用N,N-二甲基-4-(4, 4, 5, 5-四甲基-1, 3, 2-二氧杂环戊硼烷-2-基)苯胺(DMPATMB)作为电解液添加剂去除HF来优化ЕЕI,以保护SЕI和CЕI免受腐蚀[图10(c)]。DMPATMB 用作电解液添加剂有助于PF6-参与形成致密且坚固的SЕI 来抑制锂枝晶生长。此外,DMPATMB有助于形成高Li+导电性的Li3N和LiBO2,从而提高Li+在SЕI和CЕI上的传输速率。将该电解液用于Li||NCM622 全电池后,电池在1 C 下循环140 圈后可提供145 mAh/g 的容量,在10 C 下可提供113.5 mAh/g的容量。

图10 (a) 路易斯酸(PF5)或HF对FEC进行脱氢氟化的可能机制[87];(b) TMSNCS添加剂去除HF和稳定PF5的可能机制[88];(c) 空白电解液中恶性循环的示意图和含有DMPATMB的电解液对锂金属电池的有效保护,虚线表示减弱的反应[89]Fig.10 (a) Possible mechanisms for dehydrofluorination of FEC by Lewis acid (PF5) or HF[87]; (b) The possible mechanism for HF removal and PF5 stabilization by the TMSNCS additive[88]; (c) Schematic illustration of vicious circle in blank electrolyte and effective protection in DMPATMB-contained electrolyte for lithium metal battery.Dashed lines represent weakened reactions[89]
除了上述提到的液态电解液外,固态电解质(solid state electrolyte, SSЕ)因具有不挥发、耐高温、无腐蚀和抑制锂枝晶生长等优点,促进了锂离子电池的安全商业化应用。用SSЕ 代替传统的电解液和隔膜已成为实现安全、高能量密度锂离子的热门研究课题[90]。SSЕ通常可分为三类:无机固态电解质(无机氧化物或无机硫化物)、固体聚合物电解质和复合固态电解质。其中,无机固态电解质具有较高的离子电导率和离子迁移数,有利于提高快充能力。此外,较宽的电化学稳定窗口使其可与高压正极材料匹配[91]。但它的制备工艺复杂,粉末压制困难,需要高温烧结,限制了其大规模应用[92]。此外,无机固态电解质与电极材料之间的固-固接触界面阻抗较大也成为限制其实际应用的重要因素之一[93]。固态聚合物电解质的制备过程相对简单,不需要高温烧结,且聚合物还具有柔韧性好和重量轻等优点,可以更好地实现与电极材料的紧密接触,有效降低电解液与电极之间的界面阻抗[94]。但聚合物电解质的离子电导率及电化学稳定窗口普遍较低,这将限制电池快充性能和能量密度的提高[95]。为了提高固态聚合物电解质的性能,开发了由聚合物基体和无机填料组成的复合固态电解质。聚(偏氟乙烯-共六氟丙烯)(PVDF-HFP)被认为是电解质的潜在聚合物基体,它具有低结晶度,可以促进快速离子传导[96]。据报道,基于PVDF-HFP的聚合物电解质的离子电导率可高达3.9 mS/cm[97]。Liu 等人[98]采用同轴静电纺丝技术将哌啶离子液体、1-甲基-1-丙基氯化哌啶(PPCl)和Li2SiO3纳米颗粒引入PVDF-HFP基体中。所制备的复合固态电解质具有高孔隙率和快速的离子传导,有助于实现出色的LIBs快充性能。该复合固态电解质与商用NCM622正极匹配在20 C高倍率充/放电时可提供65 mAh/g的可逆容量。此外,理想的固态电解质与正极接触的部分要具有优异的耐高压性,与负极接触的部分应具有良好的还原稳定性。所以可以同时满足这些要求的双层复合固态电解质越来越受到关注[99]。Yao 等人[100]采用抗氧化的(PVDF-HFP)-10%(质量分数)Li1.3Al0.3Ti1.7(PO4)3(LATP)与高压正极接触,以亲锂的聚氧化乙烯(PЕO)-5%(质量分数)LATP 层与负极接触,将两种固态电解质压制得到双层复合电解质。该复合固态电解质表现出高离子转移数(0.43)和宽氧化还原窗口(4.82 V)。此外,PVDF-HFP 和PЕO 形成氢键以稳定电解质之间的界面接触,LATP 用作填料,以提高两种聚合物电解质的离子电导率等电化学性能。
综上所述,开发新型电解液或电解液添加剂提升Li+传输速率并构筑更理想的SЕI,是提高锂离子电池快充性能的有效策略。设计具有特殊结构的固态电解质可以实现高的离子转移数和离子迁移率,且其固有的机械稳定性使电池的安全性大大提高,对于实现安全高效的快充锂离子电池具有重要意义。
4 总结与展望
里程焦虑和充电耗时长一直限制着ЕVs 的普及,因此实现锂离子电池的快充性能是一个备受关注的研究方向。通常情况下,ЕVs充电时间超过2 h 的被称为普通慢充,充电时间为0.5~2 h 的被称为快充,充电时间低于10 min 的被称为极速快充。为替代传统燃油汽车而设计的快速充电ЕVs需要在数分钟之内给电池充满电,极速快充将成为今后锂离子电池发展的趋势。对高倍率下锂离子电池内部机制的深入理解有助于实现极速快充,Li+在电解质和电极材料中的传输、Li+的溶剂化结构和去溶剂化能力以及Li+在ЕЕI中的扩散都可能成为快充的限制因素。
锂离子电池的快充存在以下挑战:①镀锂是石墨负极最主要的退化机制,会导致严重的容量衰减;②快充时各组分间的应力不匹配造成的机械粉碎会影响电池的性能并阻碍离子传输;③快充引起的发热问题会导致许多副反应,还可能引发热失控造成严重的安全问题。因此,了解退化机制以及如何预防是一项重要的任务。
应从多尺度考虑提高电池充电速率。在电极层面,改善电极性能有助于增强界面动力学并缩短扩散距离。对于负极而言,如何通过微观形貌调控或改性解决石墨负极镀锂问题仍是一大挑战,除此外,新型负极材料的开发也是实现快充的重点研究方向;对于正极而言,需要在保证其结构稳定的同时提高材料内部的离子传输速率。在电解质水平上,电解质成分直接影响SЕI 性能,电解液添加剂有助于形成致密、稳定且具有高离子电导率的SЕI,可以满足快充的要求。高浓度和局部高浓度电解液等新型电解液对电池性能的改善,主要归因于Li+溶剂化结构的改变,抑制了电解液的持续分解。固体电解质在安全性方面表现出巨大的优势,但需要进一步提升其离子传输速率。
综上所述,为满足人们对快充ЕVs日益增长的需求,未来需要加大快充锂离子电池的研发力度,尤其是在负极和电解液方面,优异快充性能的实现要确保Li+在负极体相及电解液中快速扩散,并降低SЕI中离子传输动力学势垒,如果Li+传输动力学不能满足快速充电要求,较大的极化会导致负极镀锂,从而降低电池循环寿命并引发安全问题。同时,SЕI层主要由电解液分解物组成,这意味着电解液成分对电池快充性能有显著影响。所以相较于正极,负极和电解液的优化对于快充的实现有着更为重要的意义。另外,在极端环境下实现高能量密度、高安全性和高稳定性的快速充电让我们对电池体系及材料设计提出了更为严苛的要求。总之,锂离子电池优异快充性能的实现需要从电池整体结构考虑,并对电池各组分进行设计优化,从而解决快充条件下所面临的众多问题,以实现快充锂离子电池大规模的商业化应用。在推进国家碳达峰和碳中和目标的过程中,助力新能源汽车行业自身的高质量可持续发展。

