人尿源干细胞外泌体对髓核样尿源干细胞增殖及分化的影响
朱有福 李承威 沈娜娜 相宏飞 陈伯华 郭柱
(青岛大学附属医院脊柱外科,山东 青岛 266035)
椎间盘退变(IDD)是下腰痛的最常见原因[1],药物及手术两种方式虽能缓解患者疼痛,却无法恢复椎间盘功能[2]。因此,椎间盘组织工程因其具有改善IDD、恢复髓核功能的特点,逐渐成为IDD治疗领域的研究热点[3]。组织工程技术通过将材料学与干细胞及其衍生物结合发挥治疗作用[4],其中常用干细胞为间充质干细胞(MSC)[5]。然而MSC获取困难,无法广泛应用[6]。人尿源干细胞(USC)来源广泛,无伦理争议,具有与MSC接近的生物学特性,获取方式简单无创[7-8]。研究证明,USC可被髓核细胞(NPC)诱导分化为髓核样尿源干细胞(NP-USC)[9-10]。组织工程中干细胞需要同时发挥效应细胞作用以及一定程度的增殖能力[11],因此探究干细胞分化程度与增殖速率的关系显得尤为重要[12]。本研究通过对不同时间下经NPC诱导USC所获得NP-USC的增殖速率、髓核样细胞标记基因和软骨细胞特异性基因与其对应蛋白的表达差异性进行研究,旨在探讨不同分化程度NP-USC的增殖速率及USC-EXO对其促增殖的作用,为椎间盘组织工程筛选合适的NP-USC提供依据。
1 材料和方法
1.1 细胞与试剂
胎牛血清、无外泌体血清购自美国Gibco公司,USC成骨诱导、成脂诱导以及成软骨诱导分化培养基试剂盒均购自美国Cyagen公司,兔抗HIF-1α、抗GLUT1、抗COL2、抗ACAN以及抗β肌动蛋白(β-actin)抗体均购自北京博奥森生物科技有限公司,辣根过氧化物酶(HRP)标记的兔抗人IgG二抗购自美国Santa公司。
1.2 NPC的提取和培养
NPC培养基共50 mL,包含5 mL体积分数0.1胎牛血清,500 μL 1%青-链霉素,剩余以DMEM/F12培养基补足。收集2022年4—6月我院脊柱外科10例L4~L5椎间盘突出患者手术切除的髓核组织样本,无菌转运至超净台内,洗净分离髓核组织并充分剪碎至直径1 mm左右的组织块。用磷酸缓冲盐溶液PBS洗涤3次,转入15 mL离心管中,加入10 mL髓核细胞培养基及2 mLⅡ型胶原酶,转至恒温摇床中37 ℃下充分消化髓核组织。过滤后20 ℃下将滤液1 200 r/min离心5 min,弃去上清液保留细胞沉淀。以NPC培养基悬浮细胞,20 ℃下1 000 r/min离心5 min,弃上清液留细胞沉淀,添加NPC培养基调整细胞密度至5×108/L,接种到12孔板中,转至37 ℃、含体积分数0.05 CO2的温箱中培养,3 d后筛选出可见少许NPC细胞团簇的孔板,更换原培养基继续培养。此后每3 d换液,待细胞融合度达90%左右传代,后续实验取用第3代NPC。
1.3 USC的提取和培养
USC原代培养基共50 mL,包含5 mL体积分数0.1胎牛血清,500 μL 1%青-链霉素,600 μL生长因子添加剂REGM SingleQuot,剩余体积则以DMEM/F12培养基补足。收集同期5名健康成年男性志愿者的洁净中段尿,在超净台内移入50 mL离心管中,室温下1 500 r/min离心5 min,弃上清液至每管剩余0.2 mL。使用USC原代培养基重悬剩余液体,向0.1%明胶溶液包被过的24孔板内每孔加入0.5 mL重悬液,转至37 ℃、含体积分数0.05 CO2的温箱中培养,5 d后筛选出可见少许USC细胞团簇的孔板,更换培养基继续培养。此后每3 d换液,待细胞融合达90%左右传代,后续实验取用第3代USC。
1.4 USC的鉴定
将第3代USC接种到6孔板中,按成骨、成脂、成软骨诱导分化试剂盒说明书配制诱导培养基,待USC融合度达80%左右,将细胞分为1、2、3组。1组进行成骨诱导,每孔加入2 mL USC成骨诱导分化完全培养基,每3 d换液,于第21天时加入4%多聚甲醛固定,茜素红染色后倒置显微镜下观察染色情况。2组进行成脂诱导,每孔先加入USC成脂诱导分化培养基A液,于3 d后再换为USC成脂诱导分化培养基B液,1 d后重新换成A液,交替更换培养基14 d后,用4%多聚甲醛固定,油红O染色后倒置显微镜观察染色情况。3组进行成软骨诱导,每孔加入0.5 mL USC成软骨诱导分化完全培养基,每3 d更换一次培养基,在21 d后用4%多聚甲醛固定,石蜡包埋、切片,以阿利辛蓝染色后倒置显微镜下观察染色情况。
取第3代USC,37 ℃下胰酶消化3 min,获得细胞悬液,加入DMEM/F12培养基终止消化。用移液管将USC的细胞悬液吸至15 mL离心管中。20 ℃下400 r/min离心5 min。离心后弃上清液,剩余约0.2 mL细胞沉淀转至超净台,用含1%牛血清白蛋白(BSA)的PBS对USC洗涤3次。用移液枪取10 μL细胞悬液滴至计数板进行细胞计数,用移液枪分别取200 μL USC细胞悬液分装至5支1.5 mL微型离心管中,每管均加入10 μL的CD29、CD44和CD73一抗,冰盒内静置,避光保存1 h。以4 ℃预冷离心机5 min,将上述微型离心(EP)管以1 500 r/min离心5 min,再次用含1% BSA的PBS溶液洗涤EP管内USC 3次,以提纯细胞。PBS重悬USC,上述微型离心管每管内加入2.5 μL HRP标记的兔抗人IgG二抗,于冰盒内避光静置保存20 min。以4 ℃预冷离心机10 min,然后将上述的EP管以1 500 r/min离心5 min,离心后使用含1% BSA的PBS洗涤EP管内USC 1次。将USC重悬后置于流式细胞仪中检测USC阳性标记物CD29、CD44和CD73的表达。
1.5 USC-EXO的提取与鉴定
配置无外泌体USC培养基50 mL,包含5 mL体积分数0.1的无外泌体胎牛血清,500 μL 1%青-链霉素,以及600 μL生长因子添加剂REGM SingleQuot,剩余体积以DMEM/F12培养基补足。取第3代USC,加入无外泌体的USC培养基,转移至37 ℃、含体积分数0.05 CO2的温箱中培养,72 h后,吸取培养皿中培养基转至50 mL离心管过滤,再转入超速离心管,加热封口,将上述超速离心管置于4 ℃下预冷超高速离心机以500 g离心10 min,吸取上清液以去除细胞。将上清液以2 000 g离心10 min,离心后吸取上清液以去除细胞碎片,之后将上清液以10 000 g离心10 min,离心以后吸取上清液以去除凋亡小体,再取上清液以12 000 g离心120 min。弃上清液,PBS重悬获得USC-EXO悬液,使用100 μL EP管分装,-80 ℃冰箱保存备用。
以37 ℃水浴加热解冻USC-EXO悬液,吸取10 μL滴加至载样铜网,静置5 min自然晾干,移液枪吸取10 μL浓度为3%的磷钨酸溶液,滴加至载样铜网后自然晾干,透射电镜观察USC-EXO并拍照记录。移液枪另吸取10 μL USC-EXO悬液加入比色皿中,使用PBS补足悬液至比色皿体积2/3处,光面朝外置于粒径分析仪中检测粒径分布情况。
1.6 NPC与USC共培养
取第3代NPC接种于24孔板底部,每孔加入200 μL NPC培养基,并放置于Transwell小室,向小室中接种第3代USC,加入150 μL USC完全培养基。将上述共培养细胞分为A、B、C组,A组细胞先共培养7 d,再将共培养获得的NP-USC在无外泌体USC培养基中培养14 d;B组细胞先共培养14 d,再将共培养获得的NP-USC在无外泌体USC培养基中培养7 d;C组细胞共培养21 d。小室内外每天更换新的培养基。另将第3代USC及NPC分别在无外泌体USC培养基中培养21 d,设为USC组及NPC组。
1.7 实时荧光定量PCR(RT-qPCR)检测髓核样细胞标记基因及软骨细胞特异性基因的表达
取1.6中5组细胞,分别在不加USC-EXO及添加USC-EXO的条件下培养28 d后,采用Trizol法提取细胞总RNA,逆转录合成cDNA,以此为模板进行RT-qPCR。根据试剂盒说明书配制反应体系,以GADPH作为内参照,每个样品分别设置3个复孔,实验重复进行3次。采用2-△△CT法计算样本中HIF-1α、GLUT1、COL2及ACANmRNA的相对表达水平。引物名称及其序列见表1。

表1 NPC相关基因引物序列
1.8 Western blot法检测髓核样细胞标记蛋白及软骨细胞特异性蛋白的表达
取1.6中5组细胞,将培养皿中的培养基吸弃,4 ℃预冷PBS冲洗3次,加入3 mL含蛋白酶抑制剂苯甲基磺酰氟的细胞裂解液,冰上裂解30 min;使用细胞刮轻轻刮下细胞,置入离心管中,4 ℃下12 000 r/min离心15 min,取上清液置于冰上备用,BCA法测蛋白浓度。将蛋白和蛋白上样缓冲液混均后进行变性,然后用SDS-PAGE分离样品,再转移到PVDF膜上。于含体积分数0.05脱脂奶粉的封闭液中封闭后,加入ACAN、GLUT1、COL2A1及HIF-1α一抗,4 ℃孵育过夜,洗膜后加入HRP标记的兔抗人二抗室温孵育1 h,再使用ECL方法显影,显影后使用IPP6软件测定上述5组细胞中ACAN、GLUT1、COL2及HIF-1α蛋白的灰度值。
1.9 CCK-8法检测USC及NPC细胞增殖情况
取1.6中5组细胞,分别置于12孔板中,加入无外泌体USC培养基培养。各组每孔均加入1.5中所提取的USC-EXO 200 μL。在培养至第7、14、21、28天时,对各组细胞各加入10 μL CCK-8试剂,37 ℃孵育2 h,使用酶标仪在450 nm波长处测定吸光度值,并计算细胞活力以代表增殖速率。细胞活力=(吸光度测量值-吸光度空白值)/(吸光度对照值-吸光度空白值)×100%。实验重复3次,结果取均值。
1.10统计学分析
2 结 果
2.1 USC鉴定结果
1组细胞经茜素红染色后镜下细胞内满布钙结节(图1A),2组细胞经油红O染色后镜下可见红染的胞内脂滴(图1B),3组细胞经阿利新蓝染色后镜下细胞内蓝染糖胺聚糖分布明显(图1C)。流式细胞术分析结果显示,USC中CD29(99.11%)、CD44(98.85%)和CD73(94.27%)均高表达。

A:成骨分化诱导后茜素红染色结果,B:成软骨分化诱导后阿利新蓝染色结果,C:成脂分化诱导后油红O染色结果
2.2 USC-EXO鉴定结果
使用透射电镜观察USC-EXO直径、数量及大小,纳米粒径分析外泌体直径分布情况。在透射电镜下观察载样铜网上的USC-EXO悬液,可看到多个大小不一的圆形囊泡及部分不规则形囊泡,直径介于50~150 nm;经粒径分析发现,外泌体直径分布接近于正态分布,直径主要在120 nm左右,与透射电镜观察结果相同。
2.3 倒置显微镜观察NPC与USC共培养结果
倒置显微镜下观察结果显示,A组NP-USC增殖至占据全部视野的40%~50%,其形态介于纺锤形和短梭形间;B组NP-USC增殖达到接触融合,其形态均为规则梭形或多角形;C组NP-USC细胞形态与B组无明显差异,形态呈规则梭形或多角形;NPC、USC组细胞分别呈规则梭形和纺锤形。
2.4 A、B、C、USC、NPC组细胞HIF-1α、GLUT1、ACAN、COL2 mRNA相对表达量比较
RT-qPCR结果显示,未添加USC-EXO以及添加USC-EXO时,5组细胞间的HIF-1α、GLUT1、ACAN及COL2 mRNA相对表达量均有显著差异(F=982.09~1 488.54,P<0.01);其中USC、A、B、C组的HIF-1α、GLUT1、COL2、ACANmRNA相对表达量呈逐渐升高趋势(t=53.36~371.86,P<0.01),但C组与NPC组4种基因相对表达量无显著差异(P>0.05),加入USC-EXO前后比较各组细胞中4种基因的相对表达量亦无明显差异(P>0.05)。见表2。

表2 各组ACAN、COL2、GLUT1、HIF-1α mRNA相对表达量比较
2.5 A、B、C、USC、NPC组细胞HIF-1α、GLUT1、ACAN、COL2蛋白相对表达量比较
Western blot方法检测结果显示,5组细胞的HIF1α、GLUT1、ACAN、COL2蛋白相对表达量比较有显著性差异(F=95.72~190.44,P<0.01),其中USC、A、B、C组4种蛋白的相对表达量分别依次升高(t=65.21~185.51,P<0.01),但C组与NPC组4种蛋白相对表达量无显著差异。见图2、表3。
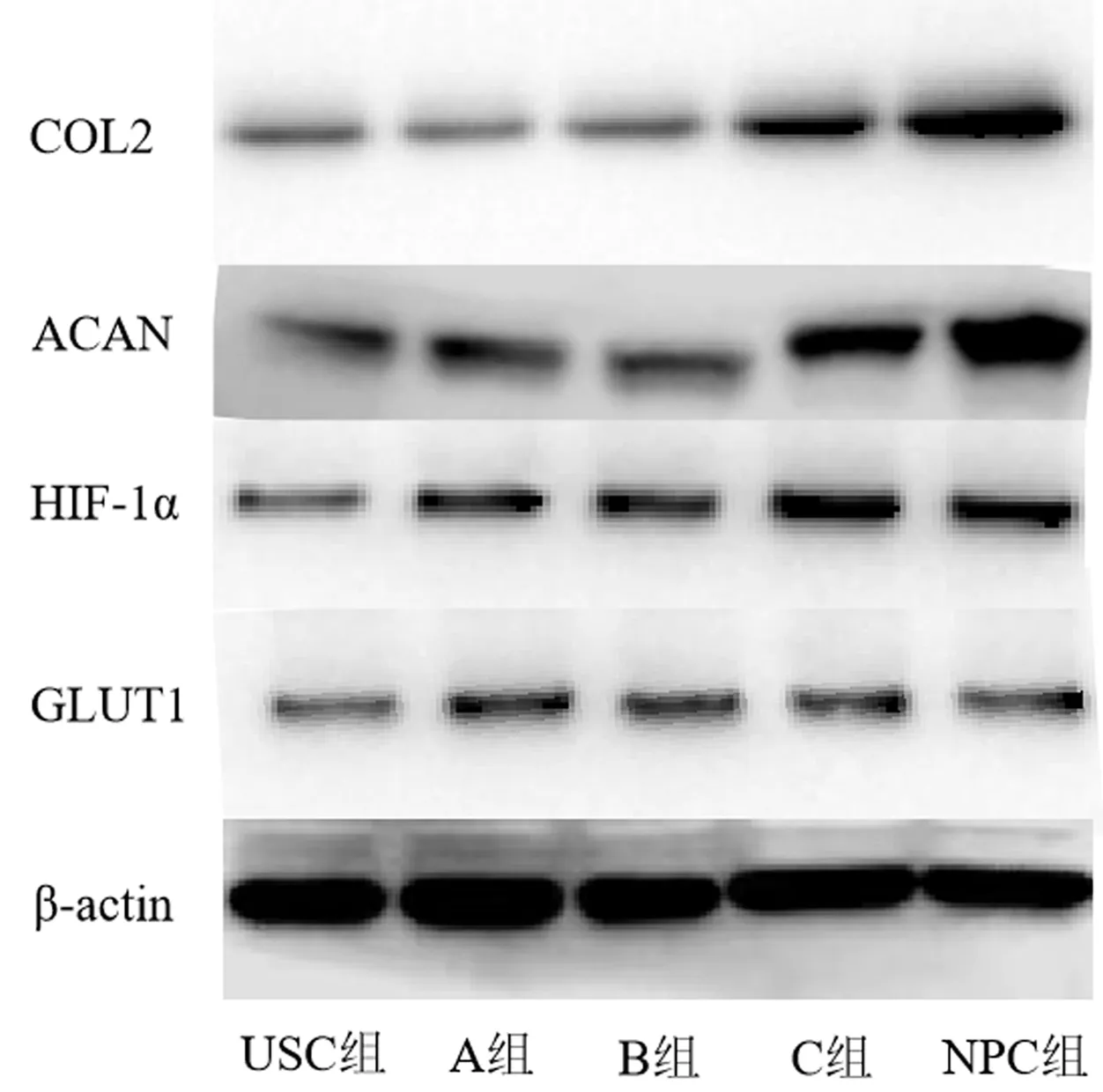
图2 Western blot方法检测5组细胞HIF1α、GLUT1、ACAN、COL2蛋白表达

表3 各组细胞ACAN、COL2、GLUT1、HIF-1α蛋白相对表达量比较
2.6 A、B、C、USC及NPC组细胞增殖能力比较
重复测量设计的方差分析结果显示,时间、组别对细胞活力均有显著的影响(F时间=767.74,F组别=327.55,P<0.05),时间与组别交互作用对细胞活力无显著性影响(P>0.05)。单独效应结果显示,在各时间点USC、A、B、C组细胞活力依次下降(F=3.77~103.58,P<0.05),但C组与NPC组无显著性差异(P>0.05)。5组中每组细胞在第7、14、21、28天时,细胞活力均依次升高(F=9.96~121.68,P<0.05)。见表4。

表4 各组细胞在第7、14、21及28天时细胞活力比较
3 讨 论
随着全球老龄化人口的增加,IDD正逐渐演变成一个难以忽视的健康问题[13]。IDD是一种涉及衰老、压力、过负荷[14]、遗传[15]等因素的自然进程,能引发椎间盘突出、椎管狭窄,使患者活动受限,影响其生活质量。IDD的治疗选择包括保守治疗和手术治疗[16],但这些方法均不能改善IDD。在美国等发达国家中,与IDD治疗有关的直接和间接成本估计每年超过100亿至200亿美元[17]。组织工程作为椎间盘再生治疗的热门研究方向之一[18],可能从源头解决NPC老化凋亡问题。组织工程实验中需要的干细胞应同时具有干细胞的增殖潜力及效应细胞的作用,换言之,诱导分化程度过高或过低的干细胞均不适合用于组织工程实验。本课题组先前研究发现,NPC可通过共培养的方式诱导人USC分化为NP-USC,但尚不了解不同诱导程度下NP-USC分化程度及增殖能力[10]。
诱导干细胞定向分化为髓核样细胞是现今椎间盘组织工程的研究重点方向[19]。确认分化为髓核样细胞的关键在于检测NPC标记基因HIF-1α与GLUT1以及软骨细胞特异性基因COL2以及ACAN的表达情况[20-23]。HIF-1α基因在纤维环和软骨终板中均不表达,仅在氧分压正常条件下的NPC中特异性表达,可以用于检测髓核样细胞中。GLUT1基因同样仅仅表达于髓核细胞中。COL2、ACAN基因主要由软骨细胞表达,其中COL2蛋白是椎间盘中最主要成分[24],ACAN是椎间盘的主要非胶原成分。HIF-1α与GLUT1为NPC细胞标记基因,仅在NPC细胞中大量表达[25],USC中不表达或少量表达。ACAN与COL2基因在软骨细胞中具有不同程度的表达,可区分干细胞是否向软骨样细胞分化,但无法区分其是否为髓核样细胞。本研究通过对HIF-1α、GLUT1、COL2、ACAN基因及其蛋白的检测可区分NP-USC分化程度。
本研究显示,HIF-1α、GLUT1、COL2、ACAN在C组高表达,且表达量与NPC组相近,在USC、A、B组间表达量呈递增的趋势;添加USC-EXO与未添加USC-EXO以后,NP-USC均表达HIF-1α、GLUT1等NPC标记基因及COL2、ACAN等软骨特异性基因,且其表达量无明显差异性。根据上述结果可推断,NPC诱导USC时间越长,所形成的NP-USC分化程度越高,且是否添加USC-EXO不影响NP-USC的分化程度,即USC-EXO可能不具有促进NP-USC进一步分化的能力。RT-qPCR和Western blot法检测结果表明,USC在与NPC共培养的过程中逐渐向髓核样细胞分化,USC与NPC共培养第14天时获得的NP-USC既具有介于USC与NPC之间的增殖潜力,又能够大量表达COL2、ACAN,更适合应用于椎间盘组织工程。而CCK-8法检测结果提示,USC-EXO可促进USC、A组及B组细胞的增殖,但对NPC组与C组细胞增殖无促进作用。
本研究结果显示,NPC诱导USC的时间越长,所形成的NP-USC分化程度越高,增殖速率越低。USC-EXO具有促NP-USC增殖的能力,但其不具有促分化的能力;NP-USC分化程度越高,USC-EXO的促增殖能力越低。本研究仍存在一定的局限性,例如虽已发现随着NP-USC分化时间的延长,USC逐渐向髓核样细胞分化,但对于植入椎间盘后如何控制NP-USC的分化趋势及增殖速率,仍需后续实验进一步研究确定。
伦理批准和知情同意:本研究涉及的所有试验均已通过青岛大学附属医院医学伦理委员会的审核批准(文件号QYFYWZLL25665)。所有试验过程均遵照《涉及人的生物医学研究伦理审查办法》的条例进行。受试对象或其亲属已经签署知情同意书。
作者声明:朱有福、李承威、沈娜娜参与了研究设计;朱有福、相宏飞、陈伯华、郭柱参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。

