甘蓝型油菜RPD3/HDA1基因家族鉴定及早熟相关基因挖掘
张玉玲,张 超,蒋唤唤,梁峰豪,肖华贵,曾 兵,2*
(1 贵州省农业科学院 贵州省油料研究所,贵阳 550006;2 贵州金瑞农业科技有限公司,贵阳 550006)
组蛋白N末端尾部含有乙酰化、泛素化、甲基化、磷酸化、糖基化和羰基化等翻译后修饰位点[1-2],而组蛋白乙酰化是研究最深入的翻译后修饰之一,目前主要集中于组蛋白乙酰化机制和功能的研究[3-4]。乙酰化是通过组蛋白乙酰转移酶(histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylases,HDAC)实现活性转化[4]。前人基于序列相似性和辅因子依赖性,将真核生物中HDAC基因家族分为RPD3/HDA1(reduced potassium dependency 3/histone deacetylase 1)、HD2(histone deacetylase 2)和SIR2(slent information regulator 2)3个亚家族,其中RPD3/HDA1亚家族需要Zn2+催化活性来发挥功能[5-7]。
RPD3/HDA1作为HDAC基因家族最大的亚家族,在植物开花及逆境胁迫响应中的功能被广泛研究[8]。在拟南芥中,AtHDA9基因在短日照条件下通过抑制光周期响应基因AGL19(Agamouslike19)的表达来调控开花时间,而hda9突变体则提高AGL19基因的组蛋白H3K9和H3K27乙酰化水平而使植物表现出早花[9]。同样,AtHDA6基因通过下调DNA去甲基化水平调控开花抑制基因FLC(FLOWERINGLOCUSC)的乙酰化水平,其表达量降低,促进拟南芥开花,而其突变体开花延迟[10]。此外,AtHDA5也可以抑制FLC和MAF1基因的表达,从而促进开花,其hda5-1突变体中FLC和MAF1的组蛋白H3乙酰化水平增加[11]。更重要的是,研究发现AtHDA6、AtHDA5可能与FLC和FVE形成蛋白复合体,通过多种方式改变组蛋白乙酰化水平,来调控植物开花[11-12]。RPD3/HDA1家族成员除了参与植物开花调控,在逆境胁迫中也具有重要作用。学者发现AtHDA6基因在低温胁迫72 h时表达水平显著上调,推测该基因可能在低温胁迫中发挥重要作用[13]。在水稻中,HDA705基因表达能被茉莉酸甲酯(MeJA)诱导,而且水杨酸(SA)和脱落酸(ABA)也能显著诱导HDA702和HDA704基因表达[14-15]。以上研究结果表明RPD3/HDA1基因家族在植物开花及逆境胁迫反应中具有至关重要的作用。
目前,已在不同植物中鉴定到数量不同的RPD3/HDA1家族成员,包括番茄(15)[1]、棉花(18)[16]、拟南芥(10)[16]、水稻(14)[16]、玉米(11)[16]、大豆(28)[17]和白菜型油菜(15)[18]。然而,在甘蓝型油菜(BrassicanapusL.)中尚未进行系统的研究。甘蓝型油菜是主要的油料作物之一,每年为全球提供食用植物油总量的13%~16%[19-20]。长江流域作为冬油菜主产区,种植面积约占中国油菜种植总面积的85%[21],两季作物轮作是该地区的主要种植模式,而该模式下两季作物茬口矛盾显得尤为突出,为了缓解这一矛盾,早熟性状成为油菜理论研究和品种选育的关键性状[22]。早熟性状与开花时间紧密相关,而RPD3/HDA1基因家族被报道参与调控植物开花及逆境胁迫的响应[8,23]。因此,有必要探讨RPD3/HDA1基因在甘蓝型油菜中的潜在功能。本研究通过生物学信息学方法鉴定BnRPD3/BnHDA1基因家族,并对其蛋白理化特性、系统发育树、基因结构、基因复制事件、顺式作用元件、不同组织部位表达谱和低温、ABA胁迫下的表达进行了全面分析,为进一步研究RPD3/HDA1基因在甘蓝型油菜生长发育及胁迫响应中的潜在功能提供参考。
1 材料和方法
1.1 植物材料及处理
甘蓝型油菜‘黔油早2号’由贵州省油料研究所选育,平均生育期为190.07 d,属于早熟品种。‘中双11’平均生育期为233.5 d,为中晚熟品种。研究以‘黔油早2号’和‘中双11’品种为试验材料,选取籽粒饱满的种子置于湿润的培养皿中,待2片子叶完全展开,移栽于土壤(基质∶土壤=3∶1)中,在室外条件下生长至4叶期,分别对2个品种进行胁迫处理。激素处理:使用100 μmol/L ABA对甘蓝型油菜进行喷施,分别于0,1,3,6,12,24 h采集叶片[24]。低温处理:将4叶期油菜置于4 ℃低温培养箱(光照/黑暗为16 h/8 h),分别于0,3,6,12,24,48,72 h收集叶片[25]。以上每个样品均为3个重复。
1.2 方 法
1.2.1 甘蓝型油菜RPD3/HDA1家族成员鉴定及理化特性预测为了鉴定BnRPD3/BnHDA1基因,在甘蓝型油菜全基因组(Brana_ZS_HZAU_V1.0/)(http://brassicadb.cn/#/Download/)中通过Blastp和HMMER 2种方法搜索可能的该家族成员。首先,下载拟南芥和水稻的RPD3/HDA1蛋白序列,将其比对到甘蓝型油菜蛋白数据库,阈值E<1×10-10。接着,从Pfam(https://pfam.xfam.org/)数据库下载Hist_cetyl结构域(PF00850)的隐马尔可夫模型(HMM)文件,利用HMMER 3.0软件在甘蓝型油菜蛋白数据库中搜索BnRPD3/BnHDA1,阈值为E<1×10-5。最后,整合2种方法得到BnRPD3/BnHDA1候选基因。将候选基因蛋白序列提交至Pfam和NCBI-CDD(https://www.ncbi.nlm.nih.gov/cdd/)网站验证保守结构域。在ProtParam(https://web.expasy.org/protparam/)数据库中对该家族基因编码的氨基酸数目、蛋白分子量、等电点和不稳定系数等物理化学特性进行预测分析。
1.2.2 RPD3/HDA1家族系统进化树下载拟南芥和甘蓝型油菜RPD3/HDA1氨基酸序列全长,利用Clustal X软件进行多序列比对,随后使用MEGA7.0软件构建系统进化树,Bootstrap值设置为1 000,并通过在线软件EvolView(https://evolgenius.info//evolview-v2/#mytrees/AS/ASD)对进化树进行可视化。
1.2.3 甘蓝型油菜RPD3/HDA1基因结构、基因复制事件和顺式作用元件预测根据甘蓝型油菜基因组的注释文件(GFF3)提取该家族基因的外显子和内含子等结构信息,使用TBtools软件绘制基因结构图[26]。利用MCScanX(http://chibba.pgml.uga.edu/mcscan2/)软件获取BnRPD3/BnHDA1基因家族的片段重复和串联重复基因,使用Circos软件呈现该家族基因复制事件。使用TBtools软件截取BnRPD3/BnHDA1基因起始密码子上游2 kb的启动子序列,将其提交至PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/) 在线网站预测顺式作用元件种类及数目。通过GSDS 2.0(http://gsds.gao-lab.org/)网站中对其顺式作用元件进行可视化。
1.2.4 甘蓝型油菜RPD3/HDA1基因不同组织部位的表达为了全面了解甘蓝型油菜RPD3/HDA1基因在不同组织部位的表达情况,从BnIR(http://yanglab.hzau.edu.cn/BnIR/expression_zs11)数据库下载了该家族基因在根、茎、叶、花、子叶、萼片和蕾中的RNA-seq数据,使用TBtools软件绘制热图。
1.2.5 RNA提取及qRT-PCR采用SteadyPure Plant RNA Extraction Kit(AG21019,艾科瑞)试剂盒提取低温和ABA处理前后‘黔油早2号’及‘中双11’叶片的RNA,使用微量紫外分光光度计检测RNA的浓度与质量。
利用EvoM-MLV反转录预混型试剂盒(AG11728,艾科瑞)将RNA反转为第一链cDNA,保存于-20 ℃。采用ChamQ Universal SYBR qPCR Master Mix试剂盒(Q711-02,诺唯赞)进行qRT-PCR,按照试剂盒说明书配制反应体系,以Bnactin7 为内参基因。qRT-PCR程序如下:95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火30 s,循环数为40。每个处理设3个生物学重复和3个技术重复,采用2-ΔΔCT方法计算基因相对表达量[27]。通过Excel 2010进行数据整理分析,使用SPSS 22.0软件进行单因素方差分析(P<0.05)。qRT-PCR中使用的所有引物列于表1中。

表1 qRT-PCR引物序列Table 1 qRT-PCR primer sequences
2 结果与分析
2.1 甘蓝型油菜RPD3/HDA1基因家族成员鉴定及理化特性预测
在甘蓝型油菜全基因组中共筛选到28个具有完整保守结构域的RPD3/HDA1基因,该家族成员的理化特性分析结果见表2。
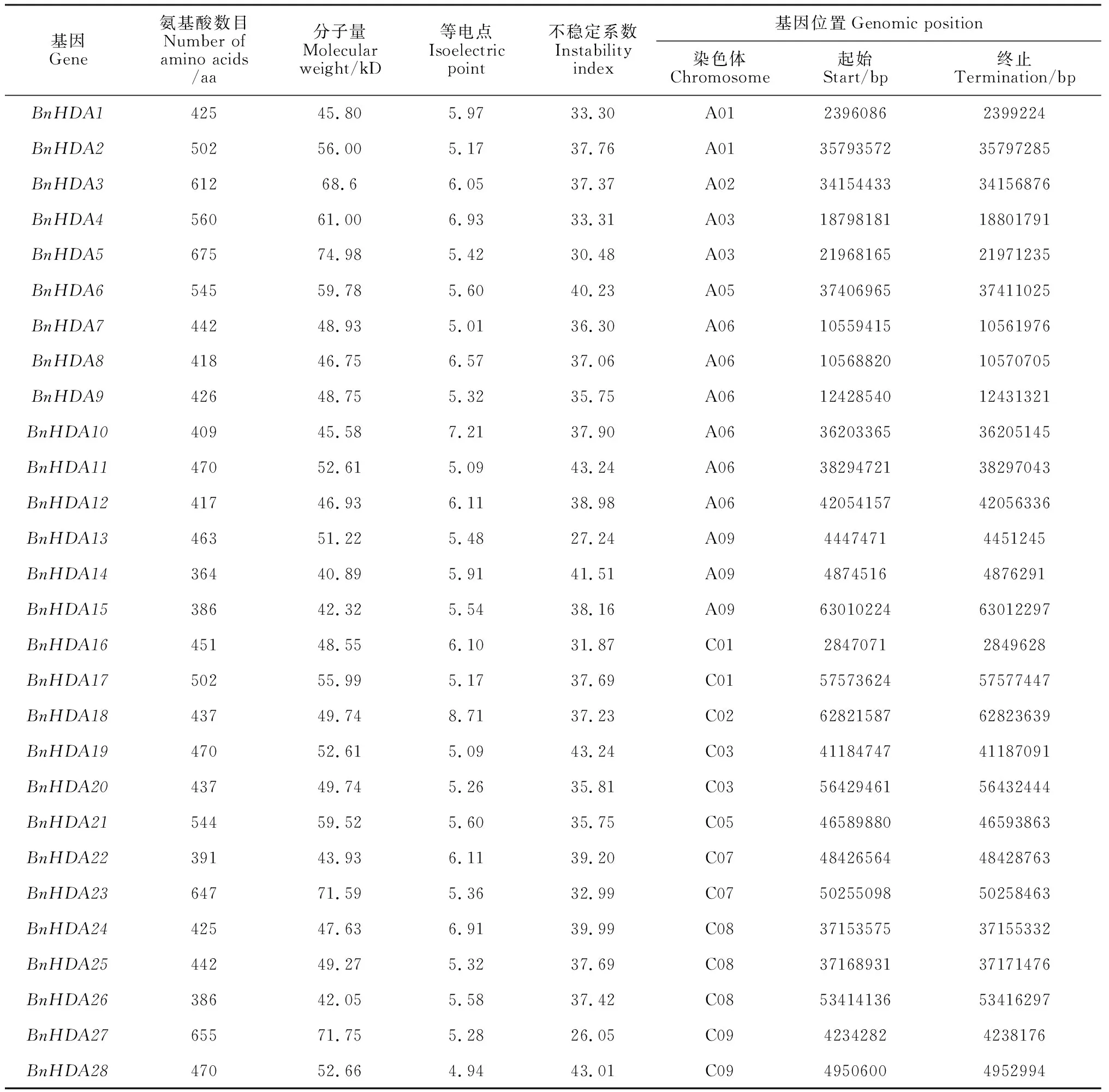
表2 甘蓝型油菜RPD3/HDA1基因家族成员编码氨基酸数目、蛋白理化特性及基因位置Table 2 Number of amino acids encoded by RPD3/HDA1 gene family members, physical and chemical characteristics of protein and gene location in Brassica napus
由表2可知,其编码氨基酸数目变化幅度较大,在363 aa(BnHDA13)~675 aa(BnHDA5)之间不等,蛋白分子量在40.89 kD(BnHDA13)到74.98 kD(BnHDA5)之间,平均为53.04 kD。等电点范围为4.94(BnHDA28)至8.71(BnHDA18),小于7(除BnHDA10、BnHDA18),92.85%的BnRPD3/BnHDA1属于酸性蛋白,说明大部分BnRPD3/BnHDA1蛋白可能在酸性环境中发挥作用。不稳定系数系数介于26.05~43.24之间,为稳定型蛋白(除BnHDA6、BnHDA11、BnHDA14、BnHDA19和BnHDA28)。
2.2 RPD3/HDA1家族系统进化树及基因结构
采用邻接法构建甘蓝型油菜和拟南芥2个物种RPD3/HDA1家族成员(图1)及单独的甘蓝型油菜该家族成员(图2,A)的系统发育树。依据ZHANG等[16]的分类方法将甘蓝型油菜RPD3/HDA1家族成员分为Ⅰ、Ⅱ、Ⅲ和Ⅳ 4个亚家族,其中13个成员分布于Ⅰ亚家族,11个成员在Ⅱ亚家族,Ⅲ亚家族和Ⅳ亚家族中均含有2个成员。在甘蓝型油菜的多倍体化过程中,BnRPD3/BnHDA1不同亚家族基因数量存在差异,可能经历了基因扩增和丢失。此外,BnHDA9和BnHDA20与AtHDA3蛋白高度同源,说明它们可能具有相似或相同的功能。

图1 拟南芥(At)和甘蓝型(Bn)油菜RPD3/HDA1家族成员系统进化树Fig.1 Phylogenetic tree of RPD3/HDA1 family members in Arabidopsis (At) and Brassica napus (Bn)
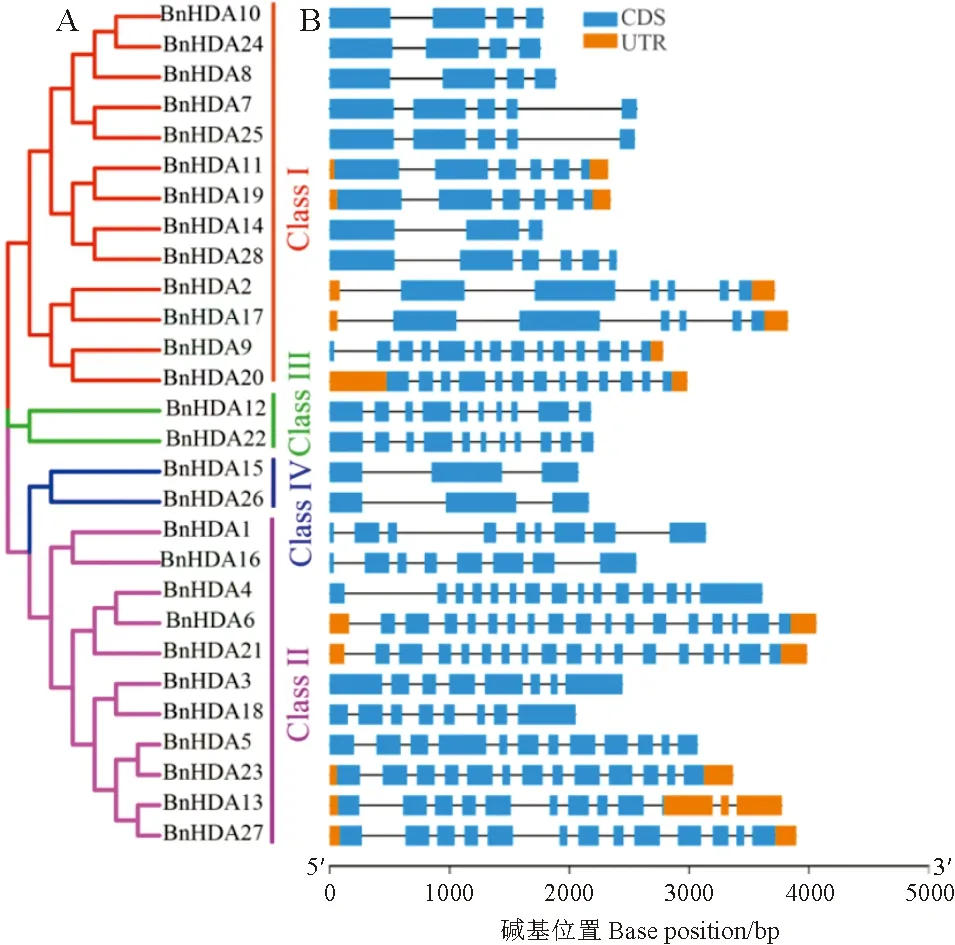
图2 甘蓝型油菜RPD3/HDA1基因结构Fig.2 RPD3/HDA1 gene structures of Brassica napus
基因结构决定基因功能,为了明确甘蓝型油菜RPD3/HDA1家族成员的生物学功能,对其基因结构进行分析。结果(图2,B)表明该家族成员外显子数量在3~17之间,不同亚家族成员的外显子数量存在差异,其中Ⅳ亚家族基因均含有3个外显子,外显子数量最少,而Ⅱ亚家族的外显子数量较多(8~10),这可能与其功能的多样化有关。但同一亚家族成员具有相似的外显子/内含子结构模式,推测同一亚家族成员可能是通过基因复制产生。
2.3 甘蓝型油菜RPD3/HDA1基因重复事件分析
基因重复是基因组进化和基因家族扩展的主要驱动力之一[28]。全基因组复制、片段复制和串联复制是植物基因家族扩张的主要原因[29]。基因和基因组复制使基因数量增加,从而基因功能冗余和分化,使基因组能够在进化过程中不断适应环境的影响[28-29]。
因此,为了阐明BnRPD3/BnHDA1基因家族扩张的机制及解析基因功能,对其进行复制基因分析(图3)。在该家族中共检测到16对复制基因,均为片段复制,表明BnRPD3/BnHDA1基因家族主要通过基因复制实现基因数量的增加,而片段重复是该家族进化的主要驱动力。
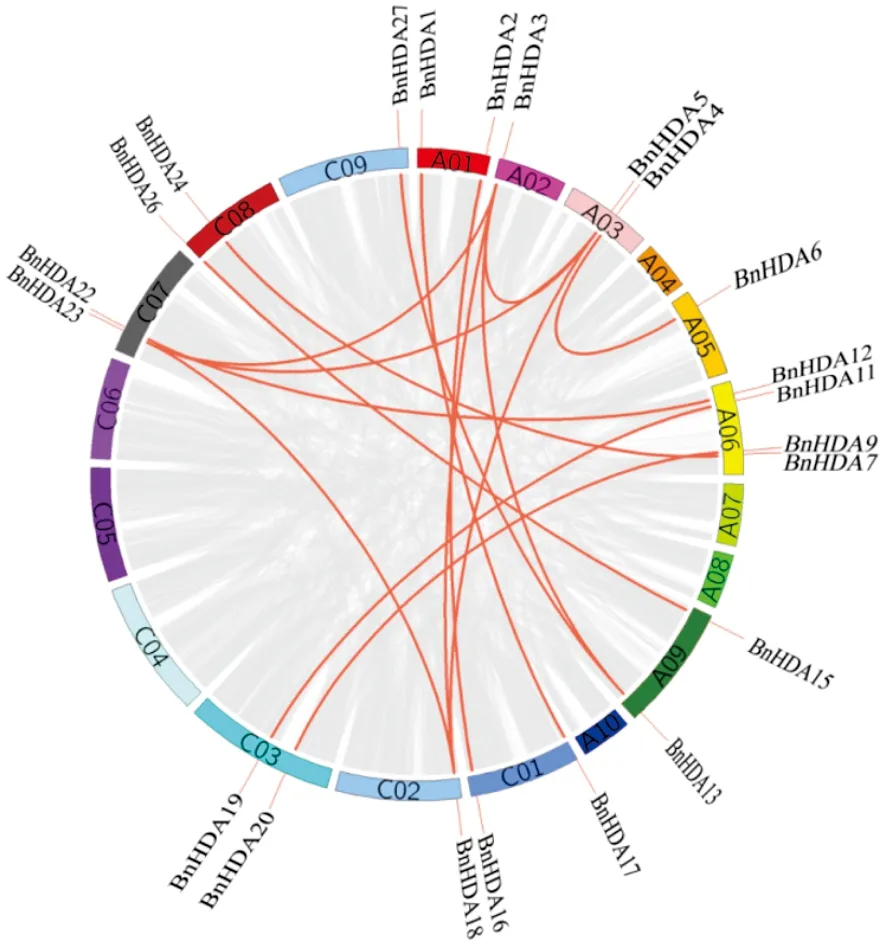
图3 甘蓝型油菜RPD3/HDA1复制基因Fig.3 RPD3/HDA1 replication genes in Brassica napus
2.4 甘蓝型油菜RPD3/HDA1基因顺式作用元件预测
顺式作用元件在启动基因表达中起关键作用。为此,对BnRPD3/BnHDA1家族成员ATG上游2 kb启动子区的顺式作用元件进行预测统计。结果(图4)显示:该家族中共有675个元件与植物激素、环境胁迫和光响应相关,其中与光响应有关的顺式作用元件最多,表明可能参与光有关的植物生长发育过程;其次含有大量与激素有关的元件,包括MeJA、ABA、生长素(IAA)、赤霉素(GA)和SA等。低温和干旱等环境胁迫有关的元件在BnRPD3/BnHDA1基因中也被确定,说明基因家族成员可能参与干旱和低温有关的信号途径。以上研究表明BnRPD3/BnHDA1基因可能通过激素信号通路和防御信号通路参与油菜的生长发育和防御反应的调节。
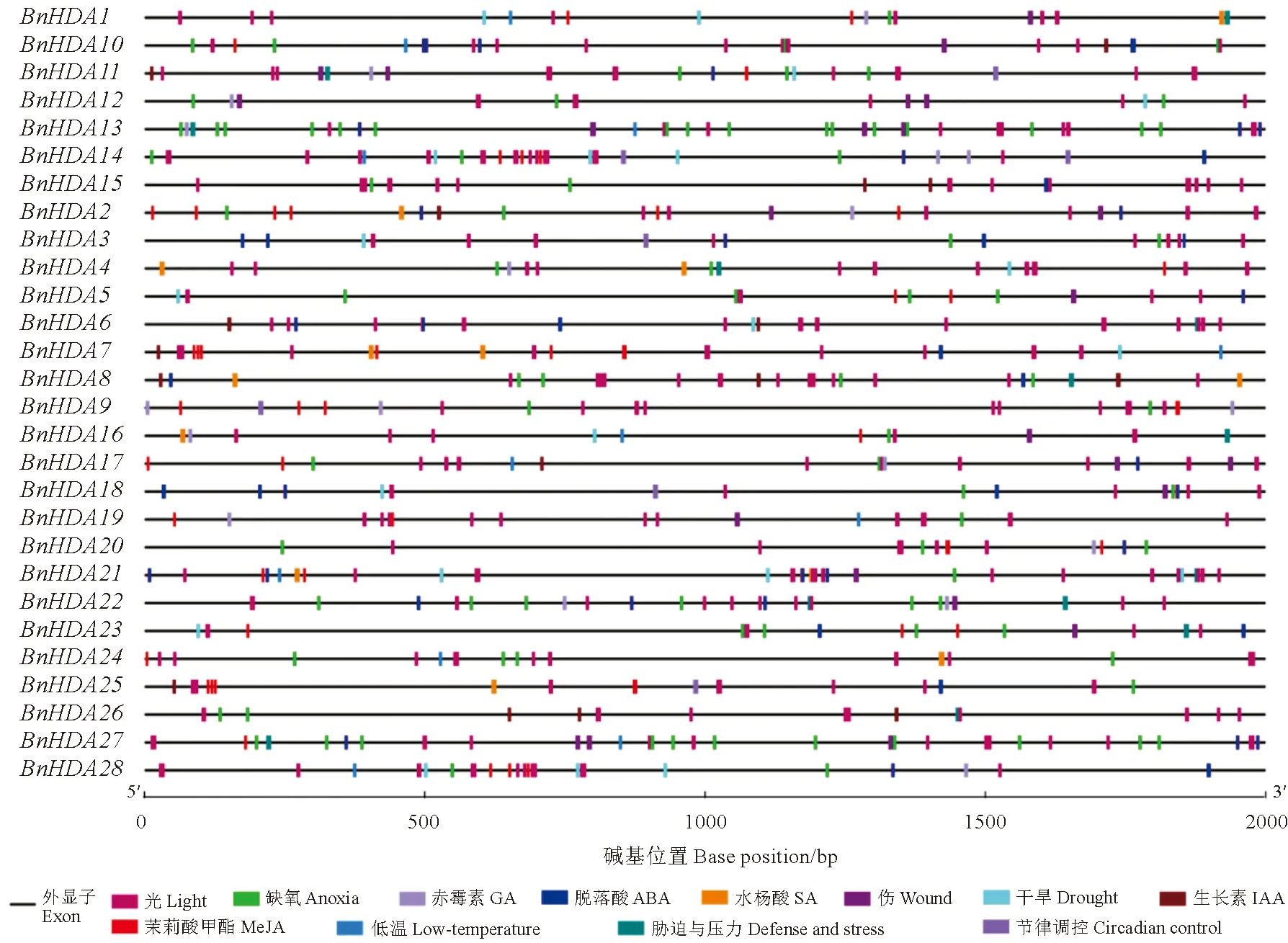
图4 甘蓝型油菜RPD3/HDA1基因顺式作用元件Fig.4 Cis-acting elements in RPD3/HDA1 genes of Brassica napus
2.5 甘蓝型油菜RPD3/HDA1基因不同组织部位表达
为了揭示甘蓝型油菜RPD3/HDA1基因在不同组织部位的表达模式,从BnIR网站下载该家族基因的RNA-seq数据,同时绘制热图(图5)。结果显示:BnRPD3/BnHDA1基因在不同组织部位的表达存在差异,在叶片中表达量相对较高,其中BnHDA2、BnHDA13和BnHDA17在叶片中呈现高表达,而BnHDA3、BnHDA18和BnHDA25基本不表达;BnHDA2和BnHDA17在根中大量表达,而BnHDA7不表达。特别的是,BnHDA17在蕾中的表达量非常高,暗示可能在蕾中发挥功能;BnHDA27在花和萼片中大量表达,猜测可能参与植物花发育。以上研究结果表明BnRPD3/BnHDA1家族基因可能存在基因功能分化。
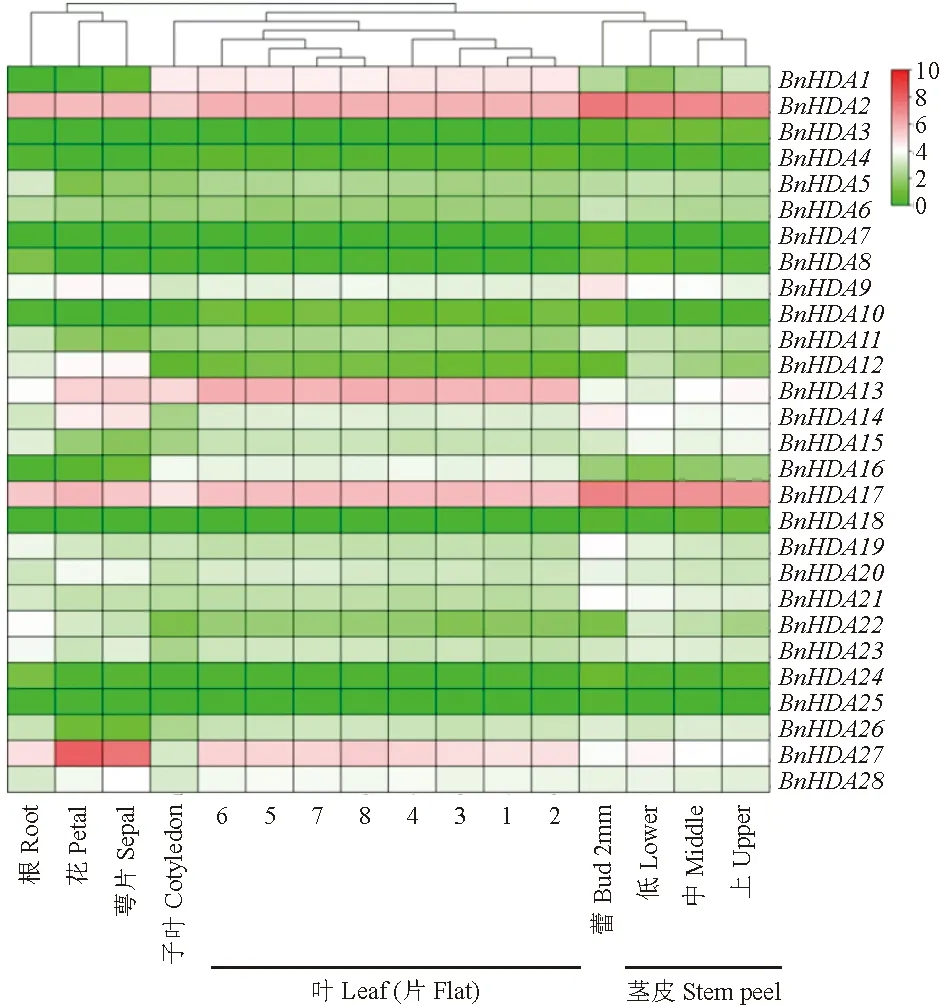
图5 甘蓝型油菜RPD3/HDA1基因不同组织部位表达模式Fig.5 Expression patterns of RPD3/HDA1 genes in different tissue parts of Brassica napus
2.6 不同品种甘蓝型油菜RPD3/HDA1基因表达
为了检测RPD3/HDA1基因在‘黔油早2号’和‘中双11’中的表达差异,根据该家族基因含有的顺式作用元件及不同组织部位的RNA-seq数据选取8个基因进行试验。
qRT-PCR结果(图6)显示:‘黔油早2号’中BnHDA1、BnHDA2、BnHDA9、BnHDA13、BnHDA19、BnHDA21、BnHDA23、BnHDA28基因的表达量分别是‘中双11’对应基因的1.31,2.06,3.41,1.88,1.37,2.67,2.44,1.80倍,该家族基因在早熟品种‘黔油早2号’中的表达量均高于在中晚熟品种‘中双11’中的表达量,推测该家族基因可能参与油菜早熟性状的调控。

图中小写字母表示同一品种中不同基因间在0.05水平上差异显著。下同。图6 甘蓝型油菜RPD3/HDA1基因在不同品种中的表达分析The lowercase letters in the figure indicate significant difference at the 0.05 level between different genes in the same variety. The same as below.Fig.6 Expression analysis of RPD3/HDA1 genes in different varieties of Brassica napus
2.7 不同胁迫条件下甘蓝型油菜RPD3/HDA1基因表达
2.7.1 低温胁迫下的表达为了探究BnRPD3/BnHDA1基因在低温胁迫下的响应情况,利用qRT-PCR检测8个BnRPD3/BnHDA1基因在‘黔油早2号’和‘中双11’中的表达量。
结果(图7)表明:在‘黔油早2号’中,BnHDA1、BnHDA9、BnHDA13、BnHDA21和BnHDA23基因在受到低温胁迫后表达量降低,且显著低于0 h表达水平;BnHDA2、BnHDA19和BnHDA28基因表达量达到峰值的时间存在差异,如BnHDA28在胁迫72 h时表达量最高,显著高于0 h。特别的是,BnHDA13和BnHDA23随着处理时间的递增表达量依次降低,说明它们对冷胁迫具有响应。在‘中双11’中,BnHDA9、BnHDA13、BnHDA19、BnHDA23和BnHDA21基因均在胁迫3 h时表达量最高;BnHDA1基因在冷处理后表达量下调,且处理后各个时间点的表达水平均低于0 h,而BnHDA2基因在胁迫后表达量上调,且显著高于0 h。综上可知,BnRPD3/BnHDA1基因家族参与冷胁迫的响应,但2个品种中表达模式存在差异。

图7 甘蓝型油菜RPD3/HDA1基因冷胁迫(4 ℃)下的表达模式Fig.7 Expression patterns of RPD3/HDA1 genes in Brassica napus under cold stress (4 ℃)
2.7.2 ABA胁迫下的表达qRT-PCR检测了8个BnRPD3/BnHDA1基因在ABA胁迫后的表达水平(图8)。结果显示:‘黔油早2号’中BnHDA1、BnHDA2和BnHDA19基因在受到ABA胁迫后表达量降低,而其他5个BnRPD3/BnHDA1基因在ABA处理后表达量到达峰值的时间不一致,其中BnHDA13和BnHDA28基因在胁迫1 h时表达量达到峰值,分别是0 h的1.09和1.42倍;BnHDA9、BnHDA21和BnHDA23基因在处理6 h时表达量最高,分别是0 h的2.45,1.07,1.35倍。
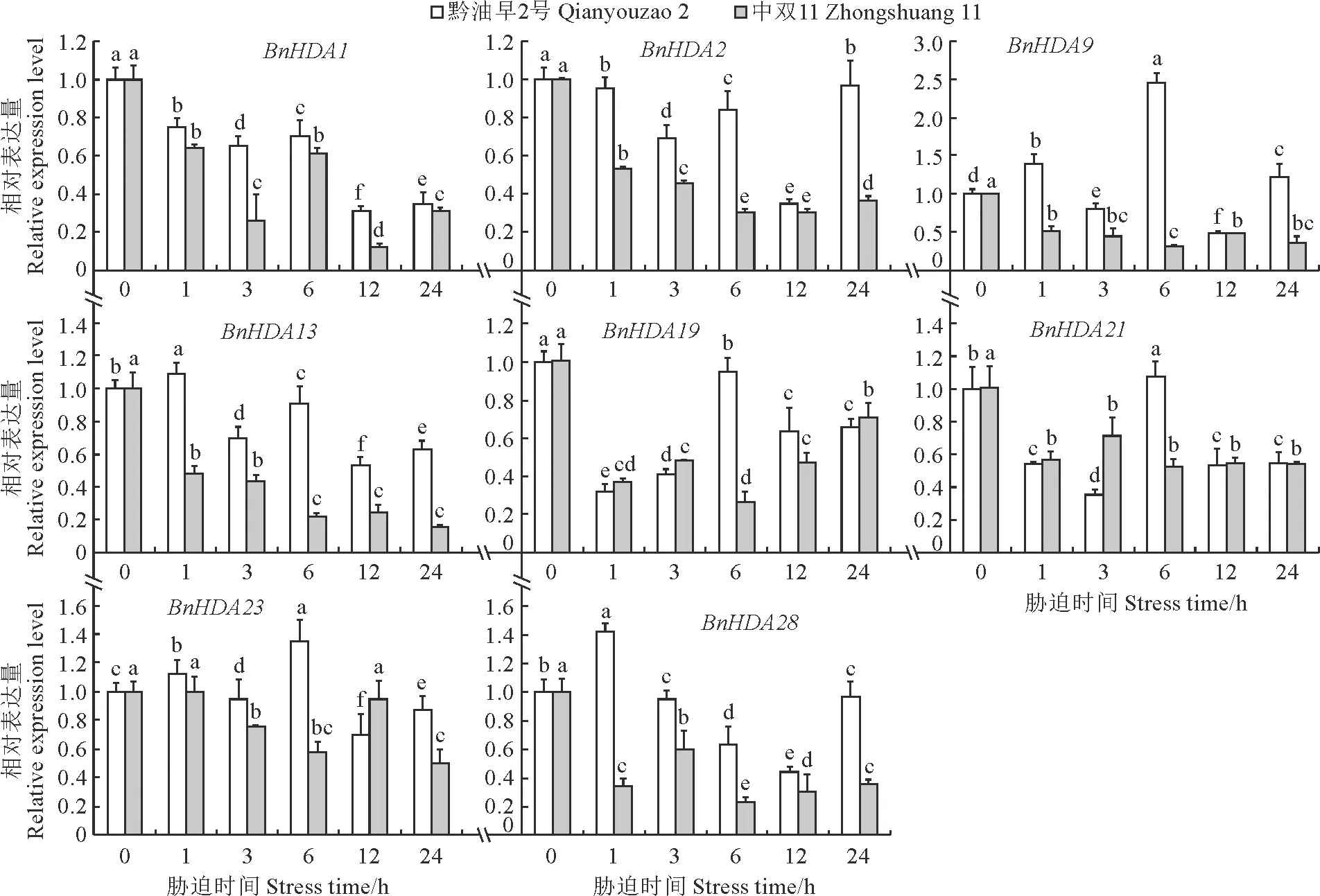
图8 甘蓝型油菜RPD3/HDA1基因在ABA胁迫下的表达模式Fig.8 Expression patterns of RPD3/HDA1 genes in Brassica napus under ABA stress
在‘中双11’中,BnHDA1、BnHDA2、BnHDA9、BnHDA13、BnHDA19、BnHDA21和BnHDA28在ABA胁迫后表达量均下调,且在各处理时间点的表达量均低于0 h。BnHDA23仅在胁迫后1 和12 h稍高于0 h,说明在‘中双11’中该基因家族成员在激素信号途径中可能具有调控作用。综上所述,‘黔油早2号’和‘中双11’中RPD3/HDA1基因在ABA处理后表达水平随着处理时间的递增上调或下调,说明该家族基因能对ABA胁迫做出响应。
3 讨 论
RPD3/HDA1基因家族是调控植物开花重要家族之一[8],该家族成员之间通过协同调节基因表达,以多种方式改变组蛋白乙酰化水平,抑制FLC基因的表达使植物早花[11-12]。植物开花受到多种因素的影响,其中低温是诱导植物由营养生长转向生殖生长的重要环境信号,合理低温能够加快植物开花进程,提高开花产量与品质[30]。郝蓬勃[31]指出植物在未受低温胁迫时FLC大量表达,抑制花芽分化;而长时间低温处理后却抑制了FLC基因的表达,促进花芽分化。此外,低温条件下能诱导ABA积累[32],而外源ABA能有效地减轻冷胁迫带来的伤害[33]。但ABA被认为是植物成花起始的抑制因子,其信号因子ABI4和ABI5能与FLC基因启动子中的ABRE/G-box元件结合促进FLC基因的转录,从而延迟植物开花[34-35]。研究人员发现越早熟的油菜品种在花芽分化期间ABA含量越低,表明低含量的ABA与油菜早熟关系密切[36]。因此,本研究以早熟品种‘黔油早2号’和中晚熟品种‘中双11’为试验材料,来探究冷和ABA胁迫对油菜早熟的影响,以期挖掘到RPD3/HDA1基因家族中调控油菜开花的基因。
本研究在甘蓝型油菜中共鉴定到28个RPD3/HDA1基因,聚类为4个亚家族,不同亚家族基因数量存在差异。由于植物杂交或染色体加倍后基因组序列重排会发生基因丢失[37]。因此,猜测甘蓝和白菜杂交、加倍过程中可能发生了该家族亚家族基因丢失。甘蓝型油菜RPD3/HDA1家族除了不同亚家族基因数量不同以外,其不同亚家族成员的外显子/内含子数量也存在差异。据报道,基因组中转座子元件会使染色体序列发生重排,从而影响基因结构,包括缺失、反转和易位[38],而外显子/内含子的获得或丢失会使基因结构和功能存在差异[39-40]。因此,甘蓝型油菜RPD3/HDA1基因外显子/内含子在进化中发生丢失,可能会使基因功能改变。
本研究采用qRT-PCR方法比较了‘黔油早2号’和‘中双11’中RPD3/HDA1基因的表达水平,发现该家族基因在‘黔油早2号’中的表达量高于‘中双11’,这一结果与张晶晶[41]在早熟棉花中的研究结果一致,暗示BnRPD3/BnHDA1家族基因可能参与油菜早熟性状的调控。HU等[42]发现玉米RPD3/HDA1基因受到低温胁迫后表达水平上调,导致H3和H4组蛋白完全去乙酰化。然而,‘黔油早2号’中BnHDA1、BnHDA9、BnHDA13、BnHDA21和BnHDA23基因受到低温胁迫后表达量降低,‘中双11’中仅BnHDA1基因的表达量下调,表明不同植物及不同的取样时间可能使该基因家族植物冷胁迫中发挥不同的调控作用。此外,低温能够加快植物由营养生长转向生殖生长,促使植物早花[43]。‘黔油早2号’具有早花的特性,受到冷胁迫后‘黔油早2号’较‘中双11’中大部分RPD3/HDA1基因表达量下调幅度大,这可能与该材料早花早熟特性有关。ABA作为植物重要的激素,被认为是一种开花抑制因子,延迟植物开花[34]。ABA处理后RPD3/HDA1基因的表达量在‘黔油早2号’中的下调幅度大于‘中双11’,说明ABA能抑制RPD3/HDA1基因的表达,且在‘黔油早2号’中抑制程度较大,表明RPD3/HDA1基因经ABA处理后可能在油菜开花中发挥调节作用,但具体的调控机制还需进一步研究。
综上所述,本研究借助生物信息学方法对甘蓝型油菜RPD3/HDA1基因家族进行全面鉴定,并明确了该家族基因在低温和ABA处理后的表达模式,进一步丰富了对油菜响应逆境胁迫应答机制的认识,也为早熟油菜抗逆性遗传改良提供了理论基础和候选基因。

