复方胶原蛋白肽粉对皮肤慢性紫外线损伤小鼠的改善作用及机制研究
郭开恩,闫宫花,曾 鑫,黄光春,殷玉婷
(1.江西中医药大学研究生院,江西南昌 330004;2.江西伍方生物科技有限公司,江西南昌 331700;3.江西中医药大学药学院,江西南昌 330004)
日光中的紫外线(ultraviolet,UV)辐射是造成皮肤损伤的主要外因之一,反复的UV 辐射易引起皮肤氧化应激、色素沉积、炎症反应、干燥、皱纹等慢性损伤[1−3],甚至会诱导皮肤癌的发生[4]。Col Ⅰ、ELN、HA 作为细胞外基质(extracellular matrix,ECM)的主要成分,与皮肤的弹性、光泽、保湿性和张力等密切相关,过量的UV 辐射会导致它们降解,皮肤逐渐变得松弛和干燥而呈现出的光老化状态是皮肤慢性紫外线损伤的重要表征[5]。TGF-β1 是转化生长因子β(TGF-β)家族的重要成员,已经被证明可以刺激Ⅰ型胶原蛋白和其它ECM 的合成,同时也能够抵抗ECM 的降解[6],TGF-β1/Smads 信号转导受到抑制是皮肤光老化重要的发病机制之一[7]。皮肤暴露于UV 下会导致活性氧簇(reactive oxygen species,ROS)的快速生成和持续积累,ROS 和抗氧化剂之间的不平衡导致氧化应激的发生,是诱导皮肤损伤,产生皱纹和病理变化的主要因素[8]。
复方胶原蛋白肽粉是江西伍方生物科技有限公司以胶原蛋白肽为主要原料,辅以针叶樱桃提取物、西兰花胚芽提取物、玫瑰花提取物、关山樱花提取物、壳寡糖及低聚果糖制成的一种复方制剂,富含维生素C、黄酮类、多酚和多糖类等天然抗氧化物。胶原蛋白肽作为目前研究广泛、疗效确切的功能性食品能够改善皮肤水和作用、弹性、粗糙度和密度,显著增加真皮层细胞外基质含量,从而有效减少皱纹[9−10],对光老化皮肤具有明显修复效果[11−12]。源自不同天然植物的有效成分如皂苷类、黄酮类、多酚类和多糖类等都能够通过清除自由基起到抗氧化、抗衰老作用[13−15]。复方胶原蛋白肽粉能否在调控TGF-β1/Smads 通路增加ECM 含量的同时,减轻氧化应激反应,从而改善皮肤慢性紫外线损伤,还有待深入探讨。故本研究旨在观察复方胶原蛋白肽粉以及单一鱼胶原蛋白肽对小鼠皮肤慢性UV 损伤的改善效果,同时从调控小鼠皮肤中氧化水平和TGFβ1/Smads 信号通路的角度,初步探讨复方胶原蛋白肽粉改善皮肤慢性紫外线损伤的重要机制,为复方类胶原蛋白肽产品的进一步开发和应用提供创新思路和理论依据。
1 材料与方法
1.1 材料与仪器
ICR 雌性小鼠 SPF 级,(30±2)g,40 只,购自湖南斯莱克景达实验动物有限公司,许可证号SCXK(湘)2019-0004。在江西中医药大学实验动物科技中心SPF 级动物房适应性喂养3 d 后开始实验。实验期间,小鼠自由摄食饮水,饲养室光照12 h,黑暗12 h,室温22~24 ℃,湿度恒定。本实验经江西中医药大学实验动物伦理委员会批准,批准文号JZLLSC20 220757;复方胶原蛋白肽粉 江西伍方生物科技有限公司生产并提供(7.5 g/袋,批号20201206);鱼胶原蛋白肽法国罗赛洛公司生产(10 g/袋,纯度96%,批号20200603),江西伍方生物科技有限公司提供;总抗氧化能力(T-AOC)生化试剂盒、超氧化物歧化酶(SOD)ELISA 试剂盒、谷胱甘肽过氧化物酶(GSHPx)ELISA 试剂盒、丙二醛(MDA)ELISA 试剂盒、I 型胶原蛋白(Col Ⅰ)ELISA 试剂盒、透明质酸(HA)ELISA 试剂盒、弹性蛋白(ELN)ELISA 试剂盒、晚期糖基化终末产物(AGEs)ELISA 试剂盒 江苏酶免生物科技有限公司;总RNA 提取试剂盒 北京天根生化科技有限公司;Real time PCR Master Mix(SYBR Green)试剂盒 日本TOYOBO 公司;TGF-β1 一抗江苏亲科生物研究中心有限公司;GAPDH、SMAD7、SMAD3、SMAD2 一抗 武汉三鹰生物技术有限公司。
SS-03AB 型紫外线光疗仪 上海希格玛高技术有限公司;JRM2016 型切片机、EG1150 HC 型包埋机、DM2000 LED 型荧光显微镜 德国Leica 公司;光谱MAX190 型酶标仪、CFX96TM型Real-Time PCR仪、ChemiDoc XRS+型凝胶成像分析系统 美国Bio-Rad 公司。
1.2 实验方法
1.2.1 复方胶原蛋白肽粉的制备 以胶原蛋白肽为主要原料,针叶樱桃提取物、西兰花胚芽提取物、玫瑰花提取物、关山樱花提取物、壳寡糖及低聚果糖为辅料,混合制备成复方胶原蛋白肽粉,其中胶原蛋白肽含量为66.7%。
1.2.2 分组与给药 小鼠按体重随机分为:正常组、模型组、复方胶原蛋白肽粉组、鱼胶原蛋白肽阳性对照组,每组10 只。适应性喂养3 d 后,根据人和小鼠间按体表面积折算的等效剂量比值[16],设定给药剂量复方胶原蛋白肽粉组2.73 g/kg,鱼胶原蛋白肽组1.82 g/kg,两种受试品均为粉末状,配制溶液时使用超纯水混悬,正常组和模型组给予相应体积超纯水,每天灌胃一次,连续9 周。
1.2.3 小鼠皮肤慢性紫外线损伤模型的建立 辐照前24 h,对所有小鼠进行背部皮肤脱毛处理,先用宠物剃毛器剃去小鼠背部较长毛发,然后均匀涂抹脱毛膏去除余下细短毛发,使其形成约4 cm×3 cm 大小裸露区域。除正常组外,其余各组置于紫外光治疗仪下30 cm 处,UVB 强度0.45 mW/cm2,UVA 强度6.7 mW/cm2,采用UVA 联合UVB 模拟日光进行5 次/周照射,每日一次,照射剂量UVA:UVB=10:1,紫外照射结束后随即灌胃受试品,实验周期为9 周。第一周紫外线的起始强度为最小红斑剂量(minimal erythemal dose,MED),照射剂量UVA 为0.7 J/cm2,UVB 为0.07 J/cm2,每周增加0.5 个MED,整个实验周期UVA、UVB 总照射剂量分别为94.5 J/cm2、9.45 J/cm2。当小鼠皮肤出现粗糙皱纹、局部损伤且有皮革样触感时,表明小鼠皮肤慢性紫外线损伤模型构建成功[17−18]。
1.2.4 样本采集 参考邓明高[19]的方法进行。末次给药24 h 后,用化妆棉蘸取纯水清洗小鼠背部裸露皮肤后腹腔注射剂量为80 mg/kg 的1%戊巴比妥钠,麻醉处死,分离背部中央皮肤,剪去皮下组织和粘连脂肪后使用4 ℃预冷PBS 浸泡去除血液,滤纸吸干表面液体,将皮肤组织切分成三份,一份液氮速冻后转入−80 ℃冻存,一份放入4%多聚甲醛中固定,一份用于当日干燥法测定皮肤含水量。
1.2.5 小鼠皮肤状态变化记录及宏观等级评分 实验期间,每周最后一天利用宏观等级评分方法(见表1)对小鼠背部皮肤皱纹情况进行评分[20],每3 周对小鼠背部裸露皮肤进行拍照记录一次,期间光照条件尽量保持一致。

表1 皮肤皱纹情况评分标准Table 1 Evaluation standard of skin wrinkles
1.2.6 皮肤含水量测定 参考路宁宁[21]的方法进行。先用电子天平称取部分干燥前的背部皮肤质量,标号并记录,于60 ℃烘箱中烘干处理6 h,相同方法再称取干燥后的背部皮肤质量,计算皮肤含水百分比。
1.2.7 皮肤组织病理学观察 参考逯岩松[22]的方法进行。取4%多聚甲醛固定的小鼠背部皮肤组织,常规脱水、包埋,制备石蜡切片,HE 染色后光学显微镜下观察皮肤组织形态学变化。
1.2.8 FRAP 法检测皮肤组织中T-AOC 水平 参考王天顺[23]方法。称取0.1 g 皮肤组织,加入1 mL的80%乙醇进行匀浆,匀浆后转入2 mL 离心管中;于60 ℃,200~300 W 条件下超声提取30 min(间隔5 min 振荡混匀一次),12000 r/min 离心10 min,取上清,按试剂盒说明书,检测T-AOC 水平。
1.2.9 ELISA 检测皮肤组织中Col I、ELN、HA、SOD、GSH-Px、MDA、AGEs 水平 参考王明月[24]方法。取适量皮肤组织,剪碎,加入4 ℃ 0.9% NaCl 溶液(0.9%NaCl 溶液的体积总量是皮肤质量的9 倍)和适量蛋白裂解液,用组织匀浆机匀浆(频率90 Hz,冰上操作,每次10 s,间隔15 s,重复6 次),匀浆后在3000 r/min、4 ℃下冷冻离心15 min,取适量上清液按试剂盒说明检测并计算皮肤组织中上述指标含量。
1.2.10 RT-qPCR 检测皮肤组织中TGF-β1/Smads 信号通路相关mRNA 表达 参考谢璟[25]方法。称取0.1 g 小鼠皮肤组织,加入1 mL 裂解液后充分研磨匀浆提取组织总RNA,酶标仪检测其含量及纯度,OD260/280在1.9~2.2,说明RNA 的纯度符合要求,根据逆转录试剂盒说明进行反转录后得到cDNA,以cDNA 为模板进行PCR 扩增,条件设置为95 ℃预变性60 s,95 ℃变性15 s,65 ℃退火15 s,72 ℃延伸60 s,共40 个循环。结果以GAPDH 作为内参,使用2−ΔΔCt表示最终实验数据,采用相对定量法进行分析后得到mRNA 的表达水平。所有引物均由北京鼎国昌盛生物技术公司设计并合成,引物序列见表2。

表2 引物序列Table 2 Primer sequence
1.2.11 Western blot 检测皮肤组织中TGF-β1/Smads信号通路相关蛋白表达 参考金媛媛[26]方法。称取小鼠皮肤组织约0.1 g,加入10 倍体积量的RIPA 组织裂解液,于4 ℃下消化1 h 后匀浆,匀浆后13000 r/min、4 ℃冷冻离心40 min,取上清20 μL 根据BCA 法检测蛋白浓度。剩余上清液加入1/4 体积量的5×蛋白上样缓冲液,100 ℃下煮15 min 使蛋白变性,自然冷却、混匀后分装。蛋白上样量30 μg,加样经电泳、转膜、封闭后,用5%的BSA 按1:10000比例稀释一抗4 ℃摇床孵育过夜,12 h 后用5%的BSA 按1:1000 比例稀释对应二抗,室温孵育75 min,TBST清洗3 次,每次10 min 后,滴入ECL超敏显影液曝光成像,采用Image J 1.53a 软件进行灰度值分析,以内参GAPDH 计算蛋白相对灰度值。
1.3 数据处理
采用SPSS 21.0 和GraphPad Prism software 8.1统计分析软件处理。计量数据采用平均数±标准差()表示,P<0.05 表示差异有统计学意义。
2 结果与分析
2.1 小鼠背部皮肤评价
2.1.1 小鼠背部皮肤外观变化 图1 所示为各组小鼠在第0 周、第3 周、第6 周及第9 周最后一天时的背部裸露皮肤外观,正常组小鼠背部皮肤纹理细腻,光滑饱满;模型组小鼠背部皮肤逐渐增厚,产生较多粗糙皱纹,有些许色素沉着,最后伴有局部损伤出现;与模型组相比,复方胶原蛋白肽粉组和鱼胶原蛋白肽组小鼠皮肤外观均有不同程度的改善,其皮肤皱纹减少,表皮增厚减弱,色素沉着减轻,外观较为接近正常组;复方胶原蛋白肽粉组小鼠皮肤始终未出现粗大皱纹,细浅皱纹也较少,同时表皮增厚肉眼观察不明显,表明虽然鱼胶原蛋白肽组小鼠的皮肤损伤得到一定的改善,但没有复方胶原蛋白肽粉组效果显著。
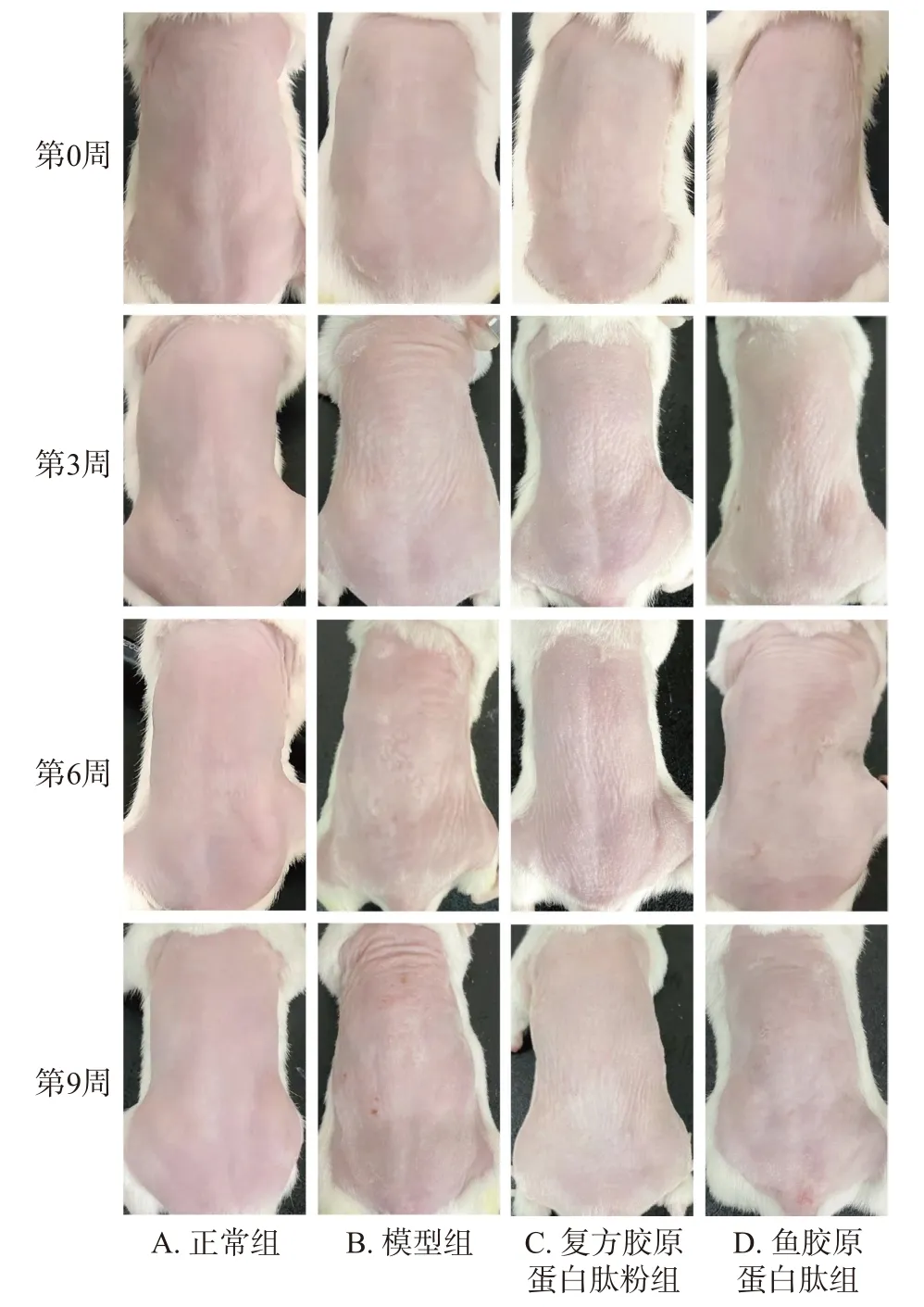
图1 各组小鼠背部裸露皮肤外观变化图Fig.1 Changes of nude skin on the back of mice in each group
2.1.2 小鼠皮肤皱纹宏观等级评分 如图2 所示,随着累积辐照时长的增加,模型组小鼠皮肤皱纹得分不断递增,说明其皱纹逐渐由少变多,由浅入深,从第7 周开始,小鼠皮肤开始有深皱纹出现,亦有一只小鼠出现皮肤破损现象;复方胶原蛋白肽粉组和鱼胶原蛋白肽组小鼠得分均极显著低于模型组(P<0.01),表明复方胶原蛋白肽粉和鱼胶原蛋白肽可缓解紫外线辐射引起的皮肤皱纹;除第5 周外,复方胶原蛋白肽粉组得分均低于鱼胶原蛋白肽组,第8 周和第9 周有显著性差异(P<0.05),表明复方胶原蛋白肽粉对皮肤皱纹的改善效果更加显著。
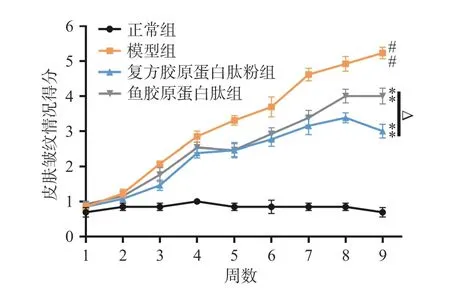
图2 各组小鼠皮肤皱纹情况得分统计图(n=10)Fig.2 Skin wrinkle score of mice in each group (n=10)
2.2 对小鼠皮肤含水量的影响
皮肤含水量是评估皮肤角质层屏障功能和健康状况的常用指标。皮肤暴露于紫外线会对皮肤屏障功能产生影响,真皮深层的水分通过表皮蒸发散失,从而造成皮肤含水量下降[27−28]。有研究表明,皮肤含水量与皮肤的光泽度、粗糙度、饱满度密切相关,皮肤含水量下降会造成皮肤暗沉、触感变硬、表面粗糙有细纹[29]。各组小鼠皮肤含水量如图3 所示,与正常组比较,模型组小鼠皮肤含水量极显著降低(P<0.01),说明经过紫外线辐照后,小鼠皮肤角质层屏障功能受到严重破坏,导致背部皮肤水分大量散失;与模型组比较,复方胶原蛋白肽粉组和鱼胶原蛋白肽组小鼠皮肤含水量显著升高(P<0.05),表明复方胶原蛋白肽粉和鱼胶原蛋白肽都能够有效抑制紫外线辐照过程中小鼠背部皮肤的水分散失,对小鼠皮肤屏障具有保护作用;复方胶原蛋白肽粉组小鼠皮肤含水量极显著高于鱼胶原蛋白肽组(P<0.01),表明复方胶原蛋白肽粉对皮肤的保湿补水效果更佳。

图3 各组小鼠皮肤含水量测定结果(n=10)Fig.3 Determination of skin water content in mice (n=10)
2.3 皮肤组织病理学改变
图4 所示为紫外线辐照结束后,各组小鼠皮肤组织结构变化HE 染色图。正常组小鼠表皮层厚度均匀且较薄,真皮-表皮连接(dermal-epidermal junction,EDJ)区结构呈波浪状起伏,有明显表皮突和真皮乳头,真皮层内胶原纤维束较粗大,且相互交织,排列紧密[30];模型组小鼠表皮层角化过度,较正常组显著增厚,EDJ 区结构扁平,表皮突和真皮乳头不明显,真皮层内胶原纤维束较为纤细,排列分散,这与紫外线辐照引起的皮肤组织病理学改变特征相一致[31];与模型组相比,复方胶原蛋白肽粉组和鱼胶原蛋白肽组皮肤结构均有一定程度的改善,表皮层厚度减少,EDJ 区结构再次呈现出波浪状,表皮突和真皮乳头数量增多,真皮层胶原纤维较为饱满,排列趋向整齐,说明复方胶原蛋白肽粉和鱼胶原蛋白肽均能有效改善紫外线辐照引起的皮肤组织病理学改变。其中复方胶原蛋白肽粉组改善效果更明显,较为接近正常组小鼠皮肤组织。

图4 各组小鼠皮肤组织结构变化HE 染色图(100×,200×)Fig.4 HE staining of mouse skin structure in each group (100×,200×)
2.4 对皮肤组织中氧化指标水平的影响
皮肤暴露于紫外辐照环境中,极易导致活性氧簇(reactive oxygen species,ROS)过度蓄积[32]。抗氧化防御系统主要由SOD、GSH-Px 为主的抗氧化酶组成[33],ROS 诱导氧化应激时,SOD、GSH-Px 等能够通过清除自由基,避免脂质过氧化和蛋白质糖基化的发生,起到抗氧化、抗衰老作用[34],同时氧化反应发生也能够降低抗氧化酶活性[35]。MDA、AGEs 分别是膜脂质过氧化和蛋白质糖基化的产物,可以很好地反映氧化应激严重程度[36]。如表3 所示,与正常组比较,模型组的T-AOC、SOD、GSH-Px 水平均极显著降低(P<0.01),MDA、AGEs 水平极显著升高(P<0.01),说明经紫外线辐照后,小鼠体内抗氧化酶活性降低,总抗氧化能力减弱,相反氧化损伤加重,小鼠模型构建成功;与模型组比较,复方胶原蛋白肽粉组和鱼胶原蛋白肽组T-AOC、SOD、GSH-Px 水平均极显著升高(P<0.01),MDA、AGEs 水平极显著降低(P<0.01),其中复方胶原蛋白肽粉组SOD、MDA、AGEs 水平变化较鱼胶原蛋白肽组更加显著(P<0.05),表明复方胶原蛋白肽粉和鱼胶原蛋白肽均能有效缓解氧化应激反应,提高小鼠的总抗氧化能力,整体上复方胶原蛋白肽粉的抗氧化效果更佳。

表3 各组小鼠皮肤组织中T-AOC、SOD、GSH-Px、MDA、AGEs 水平的检测结果(n=8)Table 3 Levels of T-AOC,SOD,GSH-Px,MDA and AGEs in skin of mice in each group (n=8)
2.5 对皮肤组织中细胞外基质水平的影响
Col I、ELN、HA 是真皮层重要的细胞外基质,也是评估一般功能性食品对皮肤营养补充效果的关键性指标[37]。Col I、ELN 属结构蛋白,起支撑、填充作用,对维持皮肤的饱满度和弹性至关重要[38];HA是皮肤中的“保湿因子”,起滋润和营养作用,直接决定皮肤含水量和保湿能力[39]。有研究表明,经紫外线辐照后的皮肤中Col I、ELN、HA 含量下降,导致真皮层营养流失,水合作用大大减弱,由此皮肤褶皱变形,从而加速衰老[40]。各组小鼠ECM 水平如表4 所示,与正常组比较,模型组小鼠皮肤组织中的Col I、ELN、HA 水平均极显著降低(P<0.01),符合紫外线损伤小鼠皮肤细胞外基质含量变化特征;与模型组比较,复方胶原蛋白肽粉组和鱼胶原蛋白肽组小鼠皮肤组织中Col I、ELN、HA 水平均显著升高(P<0.05),其中复方胶原蛋白肽粉组变化更为显著(P<0.05),表明复方胶原蛋白肽粉和鱼胶原蛋白肽均可有效抵抗紫外辐照诱导的小鼠真皮层细胞外基质流失,增加小鼠皮肤细胞外基质含量,其中复方胶原蛋白肽粉效果更加显著。

表4 各组小鼠皮肤组织中Col I、ELN、HA 水平的检测结果(n=8)Table 4 Levels of Col I,ELN and HA in skin of mice in each group (n=8)
2.6 对TGF-β1/Smads 通路相关mRNA 表达水平的影响
TGF-β1/Smads 信号通路在ECM 的体内合成过程中扮演着重要的角色[41],TGF-β1 信号受激后的主要下游靶点是多个Smad 蛋白,当TGF-β1 与细胞膜上相应受体结合形成复合物时,Smad2 和Smad3 蛋白被其受体磷酸化,随后与Smad4 形成异二聚体复合物转移到细胞核中,激活相关启动子,增加胶原蛋白、弹性蛋白和透明质酸合成酶的表达[42−43],而Smad7 作为负调控因子,能够阻滞Smad2/3 活化,抑制TGF-β1/Smads 的正向信号转导[34]。多项研究表明[36,41,44],UV 辐照能够通过ROS 介导TGF-β/Smad信号转导阻滞,与TGF-β配体和受体及下游Smad蛋白及其mRNA 表达下调有关。表5 所示为各组小鼠皮肤组织中TGF-β1/Smads 通路相关mRNA 表达水平,与正常组比较,模型组小鼠皮肤组织中TGF-β1、TGF-βR2、Smad2、Smad3mRNA 表达水平均显著降低(P<0.05),Smad7mRNA 表达水平显著升高(P<0.05),表明经紫外线辐照后,小鼠皮肤中TGF-β/Smad 信号转导受到抑制;与模型组比较,复方胶原蛋白肽粉组和鱼胶原蛋白肽组小鼠皮肤组织中TGF-β1、TGF-βR2、Smad2、Smad3mRNA 表达水平均显著升高(P<0.05),Smad7mRNA 表达水平极显著降低(P<0.01),其中鱼胶原蛋白肽组的Smad2mRNA、复方胶原蛋白肽粉组的Smad3mRNA 表达水平与模型组比较有上升趋势,但无统计学意义(P>0.05)。

表5 各组小鼠皮肤组织中TGF-β1、TGF-βR2、Smad2、Smad3、Smad7 mRNA 表达水平检测结果(n=6)Table 5 mRNA Expression of TGF-β1,TGF-βR2,Smad2,Smad3 and Smad7 in skin of mice in each group (n=6)
2.7 对TGF-β1/Smads 通路相关蛋白表达的影响
图5、表6 所示为各组小鼠皮肤组织中TGFβ1/Smads 通路相关蛋白表达水平,与正常组比较,模型组小鼠皮肤组织中TGF-β1、TGF-βR2、Smad2、Smad3 蛋白表达水平显著降低(P<0.05),Smad7 蛋白表达水平极显著升高(P<0.01),表明经紫外线辐照后,小鼠皮肤中TGF-β/Smad 信号转导受到抑制,与表5 所示结果相一致;与模型组相比,复方胶原蛋白肽粉组和鱼胶原蛋白肽组小鼠皮肤组织TGF-β1、TGF-βR2、Smad2、Smad3 蛋白表达水平极显著升高(P<0.01),Smad7 蛋白表达水平极显著降低(P<0.01),其中复方胶原蛋白肽粉组的Smad3 蛋白变化更为显著(P<0.01)。综合表5 的数据显示,复方胶原蛋白肽粉和鱼胶原蛋白肽均可能是通过激活TGF-β1/Smads通路增加小鼠真皮层细胞外基质合成,从而有效改善皮肤慢性紫外线损伤。

图5 各组小鼠皮肤组织中TGF-β1/Smads 通路相关蛋白电泳条带Fig.5 Electrophoresis band of TGF-β1/Smads pathway related proteins in skin of mice in each group

表6 各组小鼠皮肤组织中TGF-β1、TGF-βR2、Smad2、Smad3、Smad7 蛋白表达水平测定结果(n=4)Table 6 Protein expressions of TGF-β1,TGF-βR2,Smad2,Smad3 and Smad7 in skin of mice in each group (n=4)
3 结论
本实验以复方胶原蛋白肽粉为研究对象,通过建立小鼠皮肤慢性紫外线损伤模型,观察复方胶原蛋白肽粉对慢性紫外线损伤小鼠皮肤的改善作用,并初步探讨其作用机制。经复方胶原蛋白肽粉灌胃后,小鼠皮肤外观出现明显好转,皱纹情况得分显著降低,皮肤水分流失得到有效抑制,一定程度上改善了小鼠皮肤组织病理变化;小鼠皮肤中SOD、GSH-Px 活性均有不同程度的提高,MDA、AGEs 含量有所下降,有效抑制了体内氧化反应;增加了小鼠皮肤中Col I、ELN、HA 含量,有效抵抗真皮层细胞外基质流失;同时TGF-β1、TGF-βR2、Smad2、Smad3 蛋白及mRNA表达增强,激活皮肤中TGF-β1/Smads 信号转导。
综上所述,复方胶原蛋白肽粉可有效改善小鼠皮肤慢性紫外线损伤,其机制可能与减轻氧化应激反应,同时调控TGF-β1/Smads 信号转导增加细胞外基质合成有关。另一方面,通过和单一鱼胶原蛋白肽的疗效对比,发现复方胶原蛋白肽粉对皮肤慢性紫外线损伤的改善作用更加显著,表明胶原蛋白肽和多种植物有效成分结合后产生协同增效作用。本研究为复方类胶原蛋白肽产品的进一步开发和应用提供了创新思路与理论依据,但复方胶原蛋白肽粉改善皮肤慢性紫外线损伤的机制远不止于此,还有待于从动物实验向细胞实验和临床实验拓展,进一步明确其可调控的分子机制与途径,并根据实验数据逐步优化其配方选择。

