比卡鲁胺对乳腺癌细胞周期、巨噬细胞极化及p38/p-STAT1 水平的影响
吕景娣,王永辉,冷茹冰,王沛,曾琛,孔永红
驻马店市中心医院,河南 驻马店 463000
乳腺癌是女性发病率最高的恶性肿瘤,数据统计显示,全球2018 年乳腺癌新发患者约为210 万,死亡患者约为62.7 万[1]。近年来我国乳腺癌的发病率也呈逐年上升趋势,对女性的身心健康造成严重的威胁[2]。雄激素受体(AR)是一种配体激活的转录因子,是核受体家族一员,主要参与肿瘤细胞的增殖、侵袭和细胞周期的改变等生物学过程[3]。目前研究发现,AR 在多数的肿瘤中均有表达,包括乳腺癌、卵巢癌、子宫内膜癌等[4],其中约77%乳腺癌中发现AR 高表达。目前以AR 为靶标的抗AR治疗在前列腺的治疗中已取得显著成效,并且AR拮抗剂比卡鲁胺已被美国食品药品监督管理局批准用于前列腺癌的临床治疗[5]。但目前AR 拮抗剂对乳腺癌的治疗效果鲜有报道。
肿瘤微环境对肿瘤快速生长有重要作用,且肿瘤恶性生长可影响肿瘤微环境,两者相互影响,其中巨噬细胞在肿瘤微环境中研究较广泛[6]。巨噬细胞在不同的环境刺激下可分为M1 和M2 2 种表型,M1 型可促进炎症反应,对肿瘤细胞有杀伤作用;M2 型可抑制炎症反应并促进肿瘤的进程[7]。研究表明,巨噬细胞的表型可以影响逆转乳腺癌AR 的表达[8-9]。通过巨噬细胞的表型转化,有望成为抑制肿瘤发展的新靶点。P38 丝裂原活化蛋白激酶(p38 MAPK)/信号转导与转录激活子1(STAT1)信号在免疫调节和炎症反应中扮演重要角色。p38 MAPK 参与了多种生物学过程,包括细胞增殖、分化和炎症反应;STAT1 蛋白的磷酸化位点是酪氨酸701(Tyr701),其可介导干扰素信号的重要成员,参与调节细胞免疫应答。目前已有研究发现,p38 MAPK/p-STAT 信号通路在肿瘤环境中对AR 表达水平具有调控作用[10],但目前关于其在乳腺癌中的表达报道较少。因此本研究旨在探究比卡鲁胺对乳腺癌细胞周期、巨噬细胞极化及p38/STAT1 信号表达的影响。
1 材料与方法
1.1 试剂和仪器
人乳腺癌细胞株MCF-7 购自日本保健学研究资源库(HSRRB);巨噬细胞株RAW264.7(中科院上海生命科学研究院细胞库);比卡鲁胺购自浙江质量分数97%,海正药业股份有限公司;p-p38 兔抗人抗体、p21 兔抗人抗体、p-STAT 兔抗人抗体、CDK4 抗体、CD86 抗体、CD206 抗体(货号分别为abx133058、p4749Rb-h、sc-135649、FNab01557、ybs-1035R、MA5-34981)均购自美国Abcam 公司;CCK-8 试剂(货号abs500003)购自日本同仁化学研究所;RNA 提取试剂盒(货号T16674)购自日本Takara 公司;Thermo FC 型酶标仪购自美国Thermo 公司。
1.2 细胞培养
取人乳腺癌细胞株 MCF-7 和巨噬细胞株RAW264.7 培养于含10%胎牛血清的DMEM 培养基中,加青霉素(100 U/mL)–链霉素(100 μg/mL)双抗,后将细胞培养于37 ℃、5% CO2的培养箱中。当细胞密度为80%~90%时,用0.25%胰蛋白酶消化MCF-7 细胞传代,用PBS 收集RAW264.7 细胞传代,每2~3 d 传代1 次,取对数生长的细胞。
1.3 CCK-8 检测细胞增殖能力
胰酶消化对数生长的MCF-7、RAW264.7 细胞,将细胞以1.5×104个/mL 密度接种于96 孔板内,于37 ℃、5% CO2培养箱中培养12 h,吸弃培养基并用PBS 清洗1 次,加入培养基及含有不同浓度(0、25、50、100 μmol/L)的比卡鲁胺培养基,培养箱中继续培养48 h。更换无血清培养基,每孔中加入100 μL 的CCK-8 溶液,于以上相同的培养箱培养1.5 h,于450 nm 波长处在酶标仪上测定各组细胞的吸光度(A)值。
1.4 MCF-7 细胞和RAW264.7 细胞共培养
将在20 μL 基质胶铺于Transwell 小室的底部,于培养箱中静置小室,1 h 左右基质胶完全凝固。将Transwell 细胞共培养的小室置于12 孔板中,将上室和下室用0.41 μm PVDF 膜分开;分别将5×104个巨噬细胞和2×104MCF-7 细胞加入到下室和上室,建立非接触共培养体系。
1.5 分组
设置RAW264.7 细胞组(DNEM 培养基培养RAW264.7 细胞24 h),RAW264.7 细胞+比卡鲁胺组(100 μmol/L 比卡鲁胺培养基培养RAW264.7 细胞24 h),MCF-7 细胞组(DMEM 培养基培养MCF-7 细胞24 h),RAW264.7 细胞+MCF-1 细胞组(DMEM 培养基培养MCF-7 和RAW264.7 细胞24 h),RAW264.7+MCF-1+比卡鲁胺组(100 μmol/L 比卡鲁胺培养基培养MCF-7 和RAW264.7细胞24 h)。
1.6 流式细胞仪检测极化指标
用胰蛋白酶消化RAW264.7 细胞和RAW264.7细胞+比卡鲁胺组细胞,用PBS 洗涤细胞并吹打细胞至细胞悬液,离心机离心细胞悬液,9 000 r/min离心细胞悬液5 min,弃掉上清液,洗涤细胞后用PBS 溶液重悬细胞,加入CD86 抗体5 μL,混匀后将同等计量的CD206 抗体加入,于4 ℃环境下避光染色30 min,弃掉上清液对其表型表达进行检测。
1.7 ELISA 检测细胞因子水平
用胰蛋白酶消化RAW264.7 和RAW264.7+100 μmol/L 组细胞,以2×105/mL 密度接种细胞悬液于6 孔板中,于37 ℃、5% CO2培养箱中培养48 h,收集培养上清液,ELISA 检测培养上清液中TNF-α、IL-6、IL-10 水平。
1.8 Transwell 检测细胞侵袭能力
取 MCF-7 组、RAW264.7 +MCF-1 组、RAW264.7+MCF-1+100 μmol/L 组细胞,调整细胞密度为1.5×104个/mL。在Transwell 上室中平铺Matrigel 胶,紫外线灯照射6 h 消毒,后将200 μL的细胞悬液加入到上室中;将含10% FBS 的DMEM培养基加入到Transwell 的下室中,用37 ℃、5%CO2的孵箱中孵育Transwell 小室24 h。后将上室中残留的细胞和Matrigel 胶用棉签轻轻擦掉,置于甲醛溶液中固定,10 min 后将0.1%的结晶紫加入到上室中孵育,10 min 后清洗小室,后将小室的底部朝上放置,显微镜下观察小室,随机取5~10 个清晰的视野分析细胞侵袭能力。
1.9 流式细胞仪检测细胞周期
取 MCF-7 组、RAW264.7 +MCF-1 组、RAW264.7+MCF-1+100 μmol/L 组细胞,以5×105个/孔的密度接种于6 孔板中,培养24 h。收集细胞,PBS 清洗细胞2 次,1 500 r/min 离心5 min,弃上清液。加入预冷的75%乙醇,于4 ℃固定过夜。1 500 r/min 离心5 min,弃掉上清液。PBS 清洗细胞。加入400 μL PI 和10 μL RNase,于4 ℃环境避光孵育30 min,流式细胞仪检测细胞周期。
1.10 蛋白质印迹检测细胞中p-p38、p21、p-STAT蛋白表达
取 MCF-7 组、RAW264.7 +MCF-1 组、RAW264.7+MCF-1+100 μmol/L 组细胞,胰酶消化细胞,离心细胞并收集上清液,DAB 法检测细胞中蛋白浓度。配制等浓度蛋白溶液为2 μg/mL,按照6∶1 的比例加入相应的体积,煮沸溶液10 min 后保存蛋白溶液于−20 ℃的冰箱。取蛋白样品30 μg,电泳蛋白样品后转移到PVDF 膜上,加入5%的脱脂奶粉到PVDF 膜上,封闭PVDF 膜1h,分别加入一抗p-p38、p21(1∶1 000)、p-STAT(1∶2 000),在4 ℃环境中孵育一抗过夜,后清洗PVDF 膜,加入相应的二抗(1∶1 000),室温孵育二抗2 h。将ECL 发光剂加入到细胞中曝光,用显影液显影,用Image Lab 软件分析各条带灰度值。
1.11 统计学分析
实验数据采用Graphpad priam 8.0 软件进行统计学分析。计量资料均用表示。不同组间数据采用单因素方差(one-way ANOVA)分析,各组间两两比较采用LSD-t检验。
2 结果
2.1 比卡鲁胺对细胞增殖能力影响
用不同浓度的比卡鲁胺干预乳腺癌MCF-7 细胞和巨噬细胞RAW264.7 细胞后可抑制细胞的增殖能力,且呈剂量相关性(P<0.05),见图1。
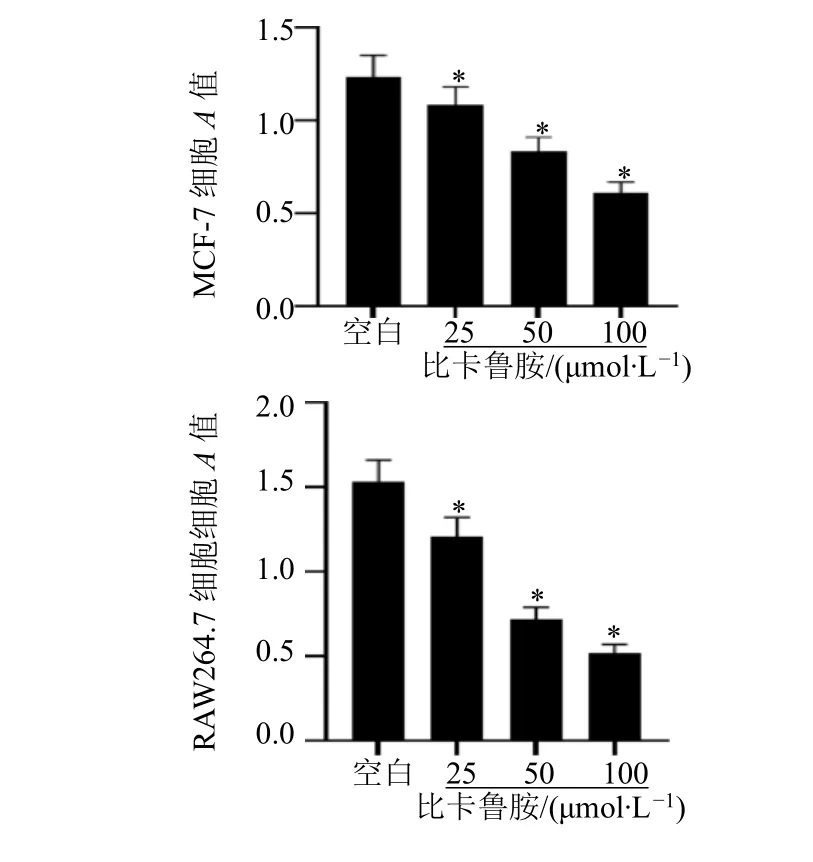
图1 比卡鲁胺对MCF-7 和RAW264.7 细胞增殖能力影响Fig.1 Effects of bicalutamide on the proliferation capacity of MCF-7 and RAW264.7 cells
2.2 比卡鲁胺对RAW264.7 细胞极化的影响
与RAW264.7 细胞组相比,RAW264.7 细胞+比卡鲁胺组M1 型巨噬细胞表面标志物CD86 阳性表达升高,M2 型巨噬细胞表面标志物CD206 阳性表达降低(P<0.05),见图2A~C。RAW264.7 细胞+比卡鲁胺组M1 型巨噬细胞相关因子IL-6、TNF-α 水平均显著高于RAW264.7 细胞组,M2 型巨噬细胞相关因子 IL-10 的水平显著低于RAW264.7 细胞组(P<0.05),见图2D~F。

图2 比卡鲁胺对RAW264.7 细胞极化的影响Fig.2 Effects of bicalutamide on polarization of RAW264.7 cells
2.3 比卡鲁胺调控巨噬细胞RAW264.7 对MCF-7细胞侵袭的影响
与MCF-7细胞组相比,MCF-7细胞+RAW264.7细胞组细胞侵袭能力明显增加(P<0.05);与MCF-7 细胞+RAW264.7 细胞组相比,MCF-7 细胞+RAW264.7 细胞+比卡鲁胺组细胞侵袭能力明显降低(P<0.05),见图3。

图3 比卡鲁胺调控巨噬细胞RAW264.7 对MCF-7 细胞侵袭的影响Fig.3 Effect of bicalutamide on MCF-7 cell invasion by macrophage RAW264.7 cell
2.4 比卡鲁胺调控巨噬细胞RAW264.7 对MCF-7细胞周期影响
与 MCF-7 细胞组相比,MCF-7 细胞+RAW264.7 细胞组G0/G1期细胞所占比例降低,S 期细胞所占比例升高(P<0.05);与MCF-7 细胞+RAW264.7 细胞组相比,MCF-7 细胞+RAW264.7细胞+比卡鲁胺组G0/G1期细胞所占比例升高,S 期细胞所占比例降低(P<0.05),见图4。
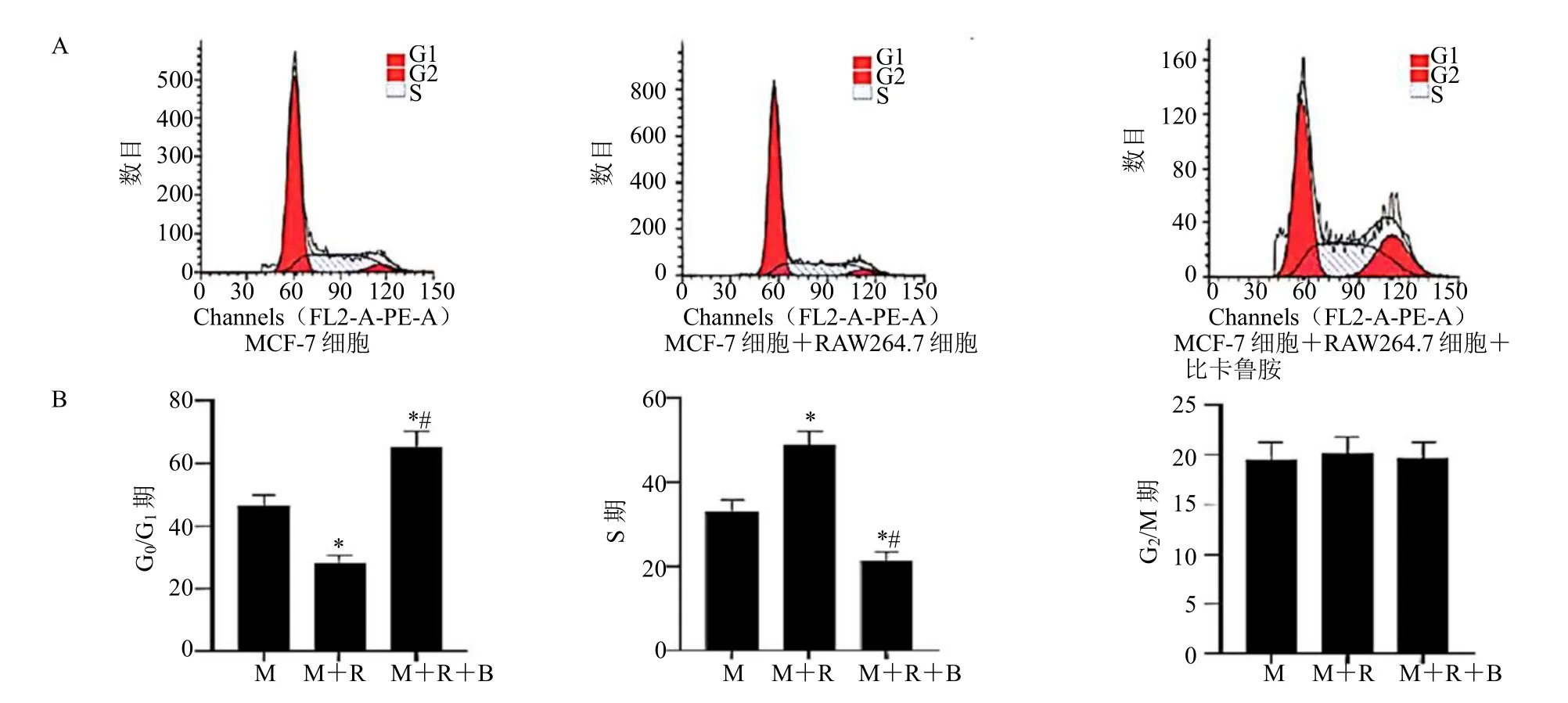
图4 比卡鲁胺调控巨噬细胞RAW264.7 对MCF-7 细胞周期的影响Fig.4 Effect of bicalutamide regulates macrophage RAW264.7 on MCF-7 cell cycle
2.5 比卡鲁胺调控巨噬细胞RAW264.7 对MCF-7细胞中p-p38、p-STAT1、p21、CDK4 蛋白表达的影响
与 MCF-7 细胞组相比,MCF-7 细胞+RAW264.7 细胞组细胞中p-p38、p-STAT1、p21蛋白表达均明显降低,CDK4 蛋白表达增加(P<0.05);与MCF-7 细胞+RAW264.7 细胞组相比,MCF-7 细胞+RAW264.7 细胞+比卡鲁胺组细胞中p-p38、p-STAT1、p21 蛋白表达均明显增加,CDK4蛋白表达降低(P<0.05),见图5。
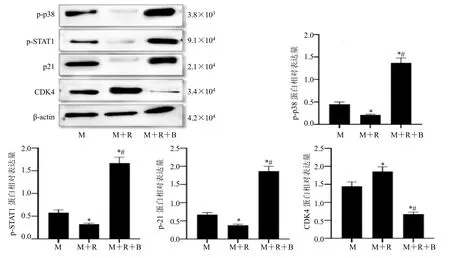
图5 比卡鲁胺调控巨噬细胞对MCF-7 细胞中p-p38、p-STAT1、p21、CDK4 蛋白表达的影响Fig.5 Effects of bicalutamide on the expression of p-p38,p-STAT1,p21,and CDK4 proteins in macrophage-mediated MCF-7 cells
3 讨论
近年来,乳腺癌发病率呈年轻化趋势,严重危害女性的生命健康。有研究发现,AR 与乳腺癌的发生、发展、复发和转移及预后密切相关,提示AR信号通路在乳腺癌的发生发展中具有重要作用[11]。目前有大量的学者研究发现,雄激素及其受体信号通路是乳腺癌患者的治疗靶点,并通过抑制AR 通路可能对乳腺癌有治疗作用[12]。目前雄激素及其受体信号通路在前列腺癌的发生发展中承担重要作用,比卡鲁胺通过抑制AR 的途径被应用于前列腺癌的的临床疗效也取得了满意的疗效。近年来临床实验发现,乳腺癌应用AR 抑制剂比卡鲁胺等治疗也可以获得良好的临床效益[13]。因此,本研究采用比卡鲁胺作为干预药物,结果显示不同浓度的比卡鲁胺均可抑制乳腺癌MCF-7 细胞的增殖能力,且呈剂量相关性。任秋宇等[14]研究证实,比卡鲁胺可抑制AR 高表达TNBC 型BT549 细胞的增殖、侵袭和迁移能力,并诱导其凋亡。
巨噬细胞起源于骨髓单核细胞,以未成熟的状态进入血液,之后从血液迁移到特定部位进一步发育成熟[15]。巨噬细胞具有生物学功能,包括防御生物毒性,吞噬和分泌生长因子、细胞因子、蛋白水解酶等。目前根据外界激活信号的反应,巨噬细胞可以极化成2 个主要表型。M1 型巨噬细胞能释放TNF、IL-12 等促炎因子,具有较强的抗原提呈能力,因此其可提高免疫应答抑制肿瘤生长;M2 型巨噬细胞则可分泌抗炎因子IL-10 和胶原蛋白等来抑制免疫反应,从而促进肿瘤的发生发展[16]。本研究用不同浓度的比卡鲁胺干预培养后的巨噬细胞,发现比卡鲁胺可抑制巨噬细胞的增殖,呈明显的剂量相关性。为进一步探究比卡鲁胺对巨噬细胞极化的影响,本研究通过ELISA 和流式细胞仪检测细胞表面表型,结果显示Raw 组中M1 型巨噬细胞表面标志物CD206 及细胞相关因子IL-10 水平明显升高,M2型巨噬细胞表面标志物CD86 及细胞相关因子IL-6和TNF-α 水平明显降低;比卡鲁胺可降低CD206、IL-10 水平,升高CD806、IL-6 和TNF-α 水平,提示比卡鲁胺可促进M1 型巨噬细胞向M2 型转化。本研究共培养巨噬细胞和乳腺癌细胞,细胞侵袭和周期结果显示,比卡鲁胺可通过调节巨噬细胞极化抑制乳腺癌细胞侵袭,阻滞细胞周期进程。
近年来学者们对细胞周期和细胞凋亡机制的研究逐渐深入,因此调控细胞周期和凋亡的蛋白也越来越受到关注[17]。研究发现,磷酸化的STAT1 能对细胞的凋亡发挥促进作用[18]。学者发现,丝氨酸激酶p38 蛋白在周期停滞和STAT1 丝氨酸磷酸化中起重要的调控作用。此外,p38 的激活和STAT1的转录功能密切相关,其可介导STAT1 的磷酸化。任翠翠等[19]研究发现,可通过抑制乳腺癌细胞中p38/p-STAT1 信号通路的激活,而抑制细胞增殖和迁移。本研究结果显示,卡鲁胺可通过调节巨噬细胞极化促进乳腺癌细胞中p38/p-STAT1 信号通路的激活,和上述研究结果一致。p21 蛋白是周期抑制蛋白之一,具有广泛的激活抑制活性,可通过多种途径参与细胞的发生发展。肿瘤以细胞周期进展失控为主要特征,而细胞周期蛋白依赖激酶(CDK)是细胞周期机制的重要组成部分。p21 可通过抑制CDK 家族成员(CDK2、CDK4、CDK6)活性介导G1-S 周期转化,是构成细胞周期S1 期的检查点。矫璐宇等[20]研究证实,慢性毒介导的CDCA2 基因沉默可抑制乳腺癌细胞增殖、诱导细胞凋亡,促进细胞中p21 表达抑制CDK4 蛋白表达。本研究结果显示,卡鲁胺可通过调节巨噬细胞极化促进p21 蛋白的表达,抑制CDK4 蛋白表达,进而调节细胞周期,抑制细胞增殖。
综上所述,比卡鲁胺可通过调控乳腺癌巨噬细胞极化抑制乳腺癌细胞增殖和侵袭,阻滞细胞周期进程,其机制可能和激活p38/p-STAT1 信号有关。
利益冲突所有作者均声明不存在利益冲突

