甘肃河西走廊葡萄酒产区高产糖苷酶非酿酒酵母菌株筛选及其酿酒适应性分析
姚红红,任学梅,严幻汝,祝霞,2,杨学山,2*
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070) 2(甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州,730070)
源自葡萄果实的萜烯、甲氧基吡嗪、C13-降异戊二烯和挥发性硫醇等品种香气化合物,是呈现葡萄酒风格和特色的关键因素[1-2]。它们在浆果成熟期不断合成和积累,主要以游离态或糖苷键合态形式存在[3]。含量远大于游离态的非挥发性键合态香气前体物,需要在发酵过程中通过酸解或糖苷酶催化,释放出香气糖苷配基才能被消费者感知[4]。酸解过程效率较低,且会造成部分配基重排[5];而酶解反应能高效释放糖苷配基,最大程度避免香气化合物重排。在已研究的葡萄香气糖苷中,葡萄糖与阿拉伯糖、鼠李糖或木糖等进一步缩合而成的二糖苷占总糖苷的80%;其次为葡萄糖单糖苷(约10%),三糖苷含量最低[2]。因此,高效酶解释放二糖苷键合态香气前体物质,是提高葡萄酒品种香气典型性的重要途径。
二糖苷键合态化合物在酶解时,首先根据糖苷的差异,分别被α-L-阿拉伯糖苷酶(α-L-arabinofuranosidase,α-L-Ara,E.C 3.2.1.55)、α-L-鼠李糖苷酶(α-L-rhamnosidase,α-L-Rha,E.C 3.2.1.40)或β-D-木糖苷酶(β-D-xylosidase,β-Xyl,E.C 3.2.1.37)等催化,释放出相应的单萜基-β-D-葡萄糖苷;再在β-D-葡萄糖苷酶(β-glucosidase,β-Glu,E.C 3.2.1.21)作用下即可释放出挥发性香气苷元[6]。有研究显示,在葡萄酒酿造过程中外源性添加的糖苷酶,其活力易受发酵温度、pH和SO2等因子的抑制,影响作用效果[7]。存在于酿酒葡萄果皮表面的非酿酒酵母(non-Saccharomycesyeasts)菌株,作为酒精发酵前期的主要驱动力,虽然发酵能力较弱,但可以合成活力更高、适应性更强的糖苷酶[8]。彭传涛[9]从云南、河南和河北3个葡萄酒产区共分离485株酵母菌,通过筛选鉴定得到1株高产β-Glu的葡萄汁有孢汉逊酵母(Hanseniasporauvarum),将其用于葡萄酒增香酿造试验,发现葡萄酒感官质量和香气成分明显增强;徐建坤[10]从吐鲁番盆地酿酒葡萄表皮筛选得到92株酵母菌,并进一步筛选高产β-Glu的菌株,发现5株产β-Glu较高的菌株,将其用于葡萄酒酿造,发现优选菌株对释放源自葡萄的结合态香气物质具有显著作用;SPAGNA等[11]对300多株酵母菌进行筛选,发现1株异常毕赤酵母(Pichiaanomala)表现出较高的α-L-Ara活力;SABEL等[12]通过对异常维克汉逊酵母(Wickerhamomycesanomalus)产β-Glu的研究发现,该菌株也表现出了较高的α-L-Ara和β-Xyl活力,具有良好的葡萄酒增香酿造潜力。总体而言,目前关于非酿酒酵母菌株的β-Glu及其对葡萄酒香气品质的研究相对较多,但对高产二糖苷酶优良菌株的筛选及相关酶学性质的研究还十分欠缺。
甘肃河西走廊产区葡萄种植历史悠久,风土条件独特,具备筛选本土非酿酒酵母菌株的自然资源优势。本试验分别从产区各子产地采集主栽酿酒葡萄进行自然发酵,通过七叶苷定性显色法和对硝基苯酚(p-nitrophenol,p-NP)定量法筛选高产β-Glu、α-L-Ara、α-L-Rha、β-Xyl的优良本土非酿酒酵母菌株;并探讨各糖苷酶对葡萄酒酿造因子的响应规律,评价发酵条件对菌株所产糖苷酶活力的影响。以期筛选、鉴定优良本土非酿酒酵母菌株,为产区葡萄酒增香酿造提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
在采收期分别从甘肃河西走廊葡萄酒厂采集主栽酿酒葡萄:嘉峪关紫轩(威代尔、美乐)、高台祁连(贵人香、蛇龙珠)、张掖国风(美乐、赤霞珠)和武威莫高(贵人香、黑比诺)各10 kg,用无菌塑料袋封装,冷藏条件下运回实验室。样品总糖198.85~279.00 g/L、pH 3.48~3.95、可滴定酸(酒石酸计)5.08~6.51 g/L,符合酿酒要求。
七叶苷、对硝基苯基β-D-吡喃葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,p-NPG)、4-硝基苯基-α-L-吡喃鼠李糖苷(p-nitrophenyl-α-L-mannopyranoside,p-NP-αRha)、4-硝基苯基-α-L-阿拉伯呋喃糖苷(p-Nitrophenyl-α-L-arabinopyranoside,p-NP-αAra)、4-硝基苯基-β-D-吡喃木糖苷(p-nitrophenyl-β-D-xylopyranoside,p-NP-βXyl),上海源叶生物科技有限公司;酵母浸粉、蛋白胨,北京奥博星生物技术有限公司;无水葡萄糖、无水碳酸钠、柠檬酸、磷酸氢二钠、磷酸二氢钾、硫酸镁等均为国产分析纯,天津市光复精细化工研究所。
1.2 仪器与设备
SW-CJ-1FD型超净工作台、GZX-GF10-Ⅱ型恒温干燥箱,上海跃进医疗器械有限公司;LDZX-50KBS型立式高压蒸汽灭菌器,上海申安医疗器械厂;电子天平,梅特勒-托利多仪器(上海)有限公司;生化培养箱,上海一恒科学仪器有限公司;pHS-3C型pH计,上海雷磁责任有限公司;TU-1810型可见分光光度计,上海元析仪器有限公司。
1.3 培养基
YPD培养基[13](g/L):葡萄糖20,酵母浸粉10,蛋白胨20,自然pH,固体培养基加入20 g/L的琼脂,121 ℃灭菌20 min。
发酵培养基[14](g/L):蛋白胨20,葡萄糖20,NH4NO33,KH2PO44,MgSO4·7H2O 0.5,吐温80 1%(体积分数)和酵母浸粉20。
WL培养基:购自北京奥博星生物技术有限责任公司。称取80.25 g干粉加入1 000 mL蒸馏水中,加热溶解分装,121 ℃灭菌20 min,pH值为5.5±0.2。
初筛培养基[15](g/L):七叶苷3、柠檬酸铁0.5、NaCl 2、MgSO4·7H2O 0.5、KH2PO41,121 ℃灭菌20 min。
1.4 实验方法
1.4.1 菌株分离纯化
葡萄分选、除梗破碎后,加入30 mg/L SO2,分批装入5 L的玻璃发酵罐中,25 ℃自然发酵(样液以子产区酒厂名称+品种首字母命名)。每隔24 h测定发酵液的还原糖和酒精度变化。当发酵液残糖≤4 g/L时,终止发酵。
待发酵启动后,分别于2、4、6、8、10 d各取样1 mL。样液以十进制进行梯度稀释,选取稀释梯度为10-4、10-5、10-6的菌液,无菌吸取0.1 mL,均匀涂布于加有100 mg/L氯霉素(抑制细菌生长)的WL培养基上,并在28 ℃条件下培养3~5 d后,观察菌落颜色形态及大小。
根据菌落颜色、形态及大小,挑取单菌落,在加有100 mg/L氯霉素的YPD固体培养基上划线培养2~3代后,挑取菌落形态一致的菌株接种到YPD液体培养基活化48 h。配制40%的灭菌甘油,与菌液按照1∶1(体积比)的比例加入甘油管,-80 ℃保藏。
1.4.2 产β-Glu菌株初筛
七叶灵(6,7-2-羟基-香豆素-β-D-葡萄糖苷)在β-Glu的作用下能生成葡萄糖和七叶苷原(6,7-2-羟基-香豆素),七叶苷原和Fe3+作用呈棕黑色[16],可对菌株产酶情况进行初步定性分析。将再次YPD液体培养基活化后的菌株,分别按5%(体积分数)的接种量接入到含有七叶苷筛选培养基的96孔板中,28 ℃培养24 h后,根据颜色变化,将其分为高酶活力(深黑色“++++”)、较高酶活力(黑色“+++”)、中酶活力(深灰色“++”)、低酶活力(灰色“+”)和无酶活力(白色“-”)5个显色等级。对显色结果为深黑色的菌株,按照产区首字母大写+品种名称首字母大写+菌株序号进行编号后,分别进行β-Glu、α-L-Ara、α-L-Rha、β-Xyl活力定量测定。
1.4.3 产糖苷酶菌株酶活力测定
(1)β-Glu:酶活力测定反应体系:200 μL反应底物(5 mmol/Lp-NPG),750 μL 0.2 mol/L柠檬酸-0.1 mol/L磷酸缓冲液(pH 5.0),250 μL培养液;反应条件:50 ℃恒温水浴30 min。反应结束后加入1 mL 1 mol/L Na2CO3终止反应。在400 nm处测定吸光度。
酶活力单位(U)定义为pH 5.0,50 ℃反应条件下,1 min水解p-NPG生成1 μmolp-NP所需酶量。
(2)二糖苷酶:参考祝霞等[18]的方法。分别以p-NP-αRha、p-NP-αAra、p-NP-βXyl为底物。反应体系:250 μL培养液,130 μL底物,600 μL 0.2 mol/L柠檬酸-0.1 mol/L磷酸缓冲液;反应条件同β-Glu测定。加入1 mL 0.5 mol/L Na2CO3终止反应后,在400 nm 处测定吸光度。
酶活力单位(U)定义为pH 5.0、50 ℃条件下,每1 min水解p-NP-αRha、p-NP-αAra、p-NP-βXyl产生1 μmolp-NP所需酶量。
1.4.4 优选菌株鉴定
将优选菌株活化后涂布于WL培养基,28 ℃培养72 h,根据菌落形态特征进行初步分类。并对所选菌株进行重新命名,将M-H-1、Q-S-3、Z-W-2和Z-W-5分别命名为HX-1、HX-2、HX-3和HX-4。
基因组DNA提取。采用正向引物NL15′-GCATATCAATAAGCGGAGGAAAAG-3′和NL4反向引物5′-GGTCCGTGGTTCAAGACGG-3′扩增26S rDNA。对PCR产物测序后,登录NCBI数据库(http://www.ncbi.nlm.nih.gov/)进行BLAST分析。
1.4.5 糖苷酶的酿酒适应性分析
将保藏在-80 ℃的优选菌株接种到YPD液体培养基活化48 h,配制pH 3.0、3.2、3.4、3.6、3.8、4.0、5.0、6.0、7.0的柠檬酸-磷酸缓冲液,按1.4.3节的方法(下同),测定菌株糖苷酶活力。
固定柠檬酸-磷酸缓冲液体系为pH 5.0,分别在水浴温度为15、20、25、30、40、50、60、70 ℃、葡萄糖含量0、25、50、100、150、200、250、300 g/L、乙醇体积分数0%、5%、10%、12%、14%、15%、SO2添加量为0、10、20、30、40、50、60 mg/L(以Na2S2O5计)的参数条件下,测定糖苷酶活力。
2 结果与分析
2.1 自然发酵期间还原糖和酒精度的变化
发酵醪液还原糖和酒精度动力学曲线分别见图1-A、图1-B。整体而言,发酵初期(1~2 d),还原糖逐步下降,酒精度逐步上升;发酵中期(3~5 d),还原糖大幅下降,酒精度大幅上升;发酵后期(6~10 d),还原糖下降变缓,酒精度上升也变缓;当酒中还原糖含量≤4 g/L 时,发酵结束。取不同发酵阶段(2、4、6、8、10 d)的发酵液进行菌株分离纯化,得到912株酵母菌株。

A-还原糖含量;B-酒精度
2.2 产β-Glu菌株初筛
利用96孔板七叶苷培养基的显色反应(图2),按照显色等级初步定性判定供试菌株β-Glu活力高低,快速从912株酵母菌中筛选出191株显色等级不同的产β-Glu菌株。产酶菌株在不同发酵时期和不同产区分布不同,第2天高产β-Glu菌株共20株,其中分离自MGH有4株,MGG 1株,QLS 1株,ZXM 8株,ZXW 4株,GFM 2株。第4天高产β-Glu的菌株共有24株,其中MGH 1株,MGG 1株,ZXM 16株,ZXW 3株,GFM 3株。第6天高产β-Glu的菌株数量大幅下降,共有5株,其中QLS 2株,QLG 1株,GFM 2株。第8天和第10天未检测到产酶菌株,可能与发酵后期酒精含量较高,抑制了非酿酒酵母菌株的生长繁殖有关。综上,通过七叶苷定性初步筛选,共初选得到49株高产β-Glu菌株,其中分离自紫轩的高产β-Glu 菌株占比最高(ZXM 49.0%、ZXW 14.3%)。由此表明,非酿酒酵母菌株产糖苷酶的能力具有菌株差异性,且与生存的自然风土条件及发酵生境的动态变化存在一定相关性。

图2 供试菌株在七叶苷培养基中的显色筛选
2.3 菌株产糖苷酶活力定量测定
为了更准确表征初筛菌株的产酶能力,采用p-NP比色法分别对初筛得到的49株菌进行β-Glu、α-L-Ara、α-L-Rha、β-Xyl活力定量测定,结果如图3所示。其中β-Glu活力较高的菌株有M-H-1(12.391 mU/mL)、Z-W-2(9.414 mU/mL)、Q-S-3(13.642 mU/mL)、Z-W-5(12.441 mU/mL)、Z-M-19(8.868 mU/mL)、Z-M-25(8.364 mU/mL)、G-M-5(10.593 mU/mL)。α-L-Ara活力较高的菌株有M-H-1(8.491 mU/mL)、Q-S-3(5.991 mU/mL)、Z-W-2(7.130 mU/mL)、Z-W-5(9.159 mU/mL)、Z-M-3(7.948 mU/mL)。α-L-Rha活力较高的菌株有M-H-1(8.305 mU/mL)、Z-W-2(6.959 mU/mL)、Q-S-3(5.334 mU/mL)、Z-W-5(6.721 mU/mL),β-Xyl活力较高的菌株有M-H-1(18.725 mU/mL)、Z-W-2(13.476 mU/mL)、Z-M-1(6.379 mU/mL)、Q-S-3(6.369 mU/mL),Z-W-5(6.291 mU/mL)。结合二糖苷香气前体物酶解释放的反应过程,综合评价筛选结果,M-H-1、Z-W-2、Z-W-5和Q-S-3菌株不仅可以合成β-Glu,而且可以分泌高活力的二糖苷酶,具有在与酿酒酵母混菌发酵葡萄酒过程中增香的酿造应用潜力。为了便于后期应用,将上述4株菌依次分别命名为HX-1、HX-2、HX-3和HX-4。

图3 本土菌株糖苷酶活性热图聚类分析
2.4 优选菌株系统发育树构建
将优选菌株涂布于WL固体培养基,28 ℃培养72 h后的菌落形态见图4。菌株HX-1、HX-3(图4-A、图4-B)菌落呈绿色,边缘透明,扁平,表面光滑,有透明环,符合葡萄汁有孢汉逊酵母属的菌落形态特征。菌株HX-2、HX-4(图4-C、图4-D)菌落呈突面,表面光滑,符合美极梅奇酵母属(Metschnikowiapulcherrima)的菌落形态特征。
4株供试菌BLAST分析系统发育树结果如图5所示。相同的种被归于一个主分枝内,表明它们具有较近的亲缘性,而不同的种被归于不同的亚分枝上,显示它们在D1/D2区域序列上具有明显区别。HX-1、HX-3与葡萄汁有孢汉逊酵母模式菌株X22-9、APY13的基因序列相似性达到98%以上,确定菌株HX-1与HX-3均为葡萄汁有孢汉逊酵母。HX-2、HX-4与美极梅奇酵母模式菌株NRRLY-7111的基因序列相似性>99%,确定菌株HX-3与HX-4为美极梅奇酵母。
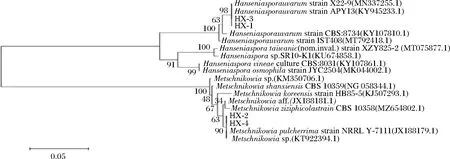
图5 基于26S rDNA序列的酵母菌株的系统发育树
2.5 菌株糖苷酶对酿造因子的适应性分析
葡萄酒发酵过程中,大多数非酿酒酵母菌株在发酵初期占主导地位,其生长繁殖及所产糖苷酶活力受葡萄汁营养物质和发酵温度、pH、酒精、糖含量和SO2添加量等的影响。通过测定各菌株糖苷酶在不同发酵条件下的活力并分析其变化规律,有助于在酿造过程中依据葡萄原料香气糖苷特点,合理选择发酵菌株并优化生产工艺参数。
2.5.1 菌株β-Glu活力变化
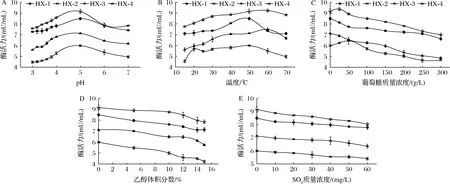
由图6-A可知,4株菌所产β-Glu的最适pH均为5.0。pH 3.0~4.0时,菌株HX-4的酶活力保持在pH 5.0时的79.31%~96.99%,HX-2的酶活力保持在84.50%~91.09%。图6-B表明,温度对4株菌的酶活力的影响存在差异,除HX-4菌株外,其他3株菌的β-Glu最适温度均为50 ℃;15~30 ℃时,HX-2的酶活力保持在最大酶活力的8.60%以上;HX-4保持在84.92%以上,而HX-3下降至最大酶活力的57.24%。由图6-C可知,高质量浓度葡萄糖会抑制β-Glu活力,随着葡萄糖含量的增大,4株菌酶活力均有不同程度的下降。其中HX-3菌株酶活力下降幅度最大,为初始酶活力(葡萄糖含量0 g/L)的61.59%,其他3株菌酶活力均保持在70%以上;当葡萄糖含量较低(<25 g/L)时,对HX-2和HX-4菌株的酶活力有小幅促进作用。乙醇体积分数<5%时,对酶活力几乎没有影响(图6-D);随着乙醇体积分数增大,酶活力开始小幅下降,当酶活力>12%时,除HX-2的酶活力保持在初始酶活力(乙醇体积分数0%)的95%以上,其他3株菌的酶活力下降幅度均增大;其中HX-3下降幅度最大(降幅32.07%),HX-1和HX-4菌株酶活力下降幅度≤14%,说明高乙醇含量对HX-1和HX-4菌株酶活力影响较小。随着SO2含量增大,各菌株酶活力整体呈下降趋势,但对HX-4菌株的酶活力影响较小(图6-E)。

A-pH;B-温度;C-葡萄糖含量;D-乙醇体积分数;E-SO2
葡萄酒酿造生境是一个低pH(3.0~4.0)、较低温度(15~30 ℃)、高SO2(40~60 mg/L),且葡萄糖含量逐渐降低,酒精度逐渐上升的过程。综合图6结果可知,在葡萄酒酿造条件范围内,HX-2和HX-4菌株可以保持较高的β-Glu活力。
2.5.2 菌株α-L-Rha活力变化
由图7-A可知,4株菌所产α-L-Rha最适pH值为5.0。随着pH降低,酶活力下降幅度(22.42%~34.36%)比pH上升时降幅(13.49%~27.89%)更大,说明α-L-Rha对低pH耐受性较弱。当pH值在3.0~4.0时,HX-1可保持pH 5.0时酶活力的69.58%~91.96%。图7-B显示,HX-1的最适温度在40~50 ℃,其他3株菌的最适温度为50 ℃。15~30 ℃时,HX-1菌株的酶活力在最适温度时的85.88%以上,相较其他3株菌能够保持较高的酶活力。随着葡萄糖含量的增大,菌株酶活力受到抑制,其中HX-1,HX-3保持较高酶活力,分别为初始酶活力的81.60%和77.09%;除HX-4外,低葡萄糖含量(<50 g/L)对其他3株菌酶活力有不同程度的促进作用(图7-C)。乙醇体积分数<12%时,对α-L-Rha活力抑制作用不明显,随着乙醇体积分数增大,酶活力下降幅度增大,其中HX-2降幅(18.54%)最大(图7-D)。图7-E表明,SO2含量对4株菌α-L-Rha活力均有抑制作用,当SO2含量>40 mg/L时,HX-3酶活力大幅(29.53%)下降,而其他3株菌酶活力下降幅度(10%左右)大致相同。综合图7结果可以看出,在葡萄酒酿造条件范围内,来源于HX-1的α-L-Rha活力始终保持较高水平,具有较高耐受性。

A-pH;B-温度;C-葡萄糖含量;D-乙醇体积分数;E-SO2
2.5.3 菌株α-L-Ara活力变化
由图8-A可知,4株菌所产α-L-Ara最适pH值为5.0。pH 3.0~4.0时,菌株酶活力均保持在74%以上,其中HX-1和HX-4保持在82%以上。图8-B,α-L-Ara最适温度在50~60 ℃。15 ℃~30 ℃时,HX-1和HX-2酶活力保持了最适温度时的83.60%以上,其他2株菌酶活力在75.72%以上。图8-C表明,较低葡萄糖含量(<50 g/L)对部分菌株酶活力具有促进作用;而随着葡萄糖含量的增大,α-L-Ara活力呈下降趋势,其中HX-3下降幅度(降幅31.80%)最大,其他3株菌降幅在23%左右,说明该酶对高葡萄糖耐受性较低。如图8-D所示,当乙醇体积分数达到10%时,对酶活力抑制作用增大,其中HX-2酶活力下降至初始酶活力的70.45%,HX-1,HX-4酶活力保持在84%以上。SO2含量对4株菌α-L-Ara活力均有抑制作用,且从图8-E来看,不同菌株酶活力下降程度差异不明显,4株菌酶活力均保持在初始酶活力(不添加SO2)87.74%以上。综合图8结果可知,在葡萄酒发酵条件下,HX-4菌株所产α-L-Ara可以保持较高酶活力。
A-pH;B-温度;C-葡萄糖含量;D-乙醇体积分数;E-SO2
2.5.4 菌株β-Xyl活力变化
如图9-A可知,不同菌株β-Xyl最适pH不同,其中HX-1的最适pH值为6.0,其他3株菌的最适pH值为5.0。pH值在3.0~4.0时,HX-3保持在91%以上,HX-1在80%以上。β-Xyl最适温度在50~60 ℃,温度对不同菌株β-Xyl的影响差异较明显,其中对HX-1酶活力影响程度较大。15~30 ℃时,HX-3保持了86.98%~94.58%的酶活力,HX-2、HX-4酶活力保留了62.13%~82.31%(图9-B)。图9-C表明,葡萄糖含量对4株菌β-Xyl活力均有抑制作用。随着葡萄糖含量增大,HX-2和HX-4菌株酶活力下降10%左右;当葡萄糖含量<100 g/L时,HX-1和HX-3酶活力迅速下降(降幅43.6%和32.7%)。图9-D显示,随着乙醇体积分数的增大,HX-1酶活力下降趋势(降幅58.22%)增大;而乙醇体积分数<12%时,其他3株菌下降趋势平缓(降幅14%左右)。由图9-E可以看出,SO2对4株菌的β-Xyl均有较低抑制作用,其中HX-2和HX-3酶活力保持在初始酶活力的94%以上。综上,虽然HX-1的β-Xyl对温度和乙醇含量耐受性较低,但其初始酶活力相较其他3株菌为最高,在酿造条件下仍可保持较高酶活力。

A-pH;B-温度;C-葡萄糖含量;D-乙醇体积分数;E-SO2
3 讨论
本研究通过p-NP比色法测定了河西走廊产区本土非酿酒酵母菌株的β-Glu、α-L-Ara、α-L-Rha、β-Xyl活力,最终优选出高产单糖苷和/或二糖苷酶的4株非酿酒酵母菌株。经26S rDNA D1/D2序列分析,确定HX-1和HX-3为葡萄汁有孢汉逊酵母,HX-2和HX-4为美极梅奇酵母。4株菌产酶结果表明,HX-1所产4种酶活力都较高,与MATEO等[19]筛选的2株葡萄汁有孢汉逊酵母的产酶情况一致;HX-3的β-Glu和β-Xyl表现出高活力,HX-4的β-Glu和α-L-Ara表现出高活力,HX-2仅对β-Glu表现出高活力,表明非酿酒酵母合成分泌糖苷酶具有种间和种内菌株差异[20]。
菌株糖苷酶酿造适应性研究发现,其酶活力易受温度、pH和SO2等发酵条件的影响。本研究中,各糖苷酶最适pH值为5.0~6.0,且pH对不同菌株糖苷酶活力的影响有较大差异,其中β-Glu活力变化最大,这与KUO等[21]的研究结果一致。本研究中各糖苷酶最适温度在30~60 ℃,与来源于真菌的糖苷酶最适温度在30~60 ℃的结论一致[22],且大部分菌株糖苷酶对高温耐受性更高,与马得草[7]的结果一致。HU等[23]指出,高葡萄糖含量对胶红酵母β-Glu具有抑制作用,且随着葡萄糖含量的增大抑制作用越明显。本研究中各糖苷酶活力均被抑制,表明糖苷酶对葡萄糖耐受性较低。除来源于HX-1的β-Xyl外,其他菌株各糖苷酶活力受乙醇影响的结果相似,当乙醇体积分数<10%或12%时,酶活力下降幅度较小,部分菌株酶活力保持稳定,与BAFFI等[24]对出芽短梗霉β-Glu在乙醇体积分数为10%和15%时分别保持了94%和71%的初始活性一致,且在β-Xyl中也得到同样的结果[17]。有研究表明,低浓度的SO2(<20 mg/L)对非酿酒酵母的生长繁殖并不会起到抑制作用,质量浓度过高(>50 mg/L)才会表现出抑制作用,且一些非酿酒酵母对SO2具有较高的耐受性[25],本研究中除HX-3 α-L-Rha在SO2含量>40 mg/L时下降幅度(29.53%)较大外,SO2含量对其他菌株各糖苷酶活力影响差异不明显,说明菌株各糖苷酶对SO2具有较高的耐受性。
已有研究表明,不同葡萄品种香气糖苷含量及种类不同,甚至有些品种具有其独特的糖苷种类[26]。例如,在小粒麝香葡萄中,含量最丰富的香气糖苷是葡萄糖苷和芹菜糖苷,分别为37%和35%[27];在Ecolly、蛇龙珠和玫瑰香中分别检测到7、9和13种萜烯糖苷,其中4种为这3种葡萄所共有,而芳樟醇-3-O-α-L-阿拉伯呋喃-β-D-吡喃葡萄糖苷为Ecoll所特有,吡喃氧化芳樟醇-α-L-阿拉伯呋喃-β-D-吡喃葡萄糖苷为蛇龙珠所特有[28]。刘吉彬[29]通过研究4个不同芳香型葡萄品种(小白玫瑰、玫瑰香、爱格丽和蛇龙珠)中萜烯类香气糖苷,共检测到16种萜烯类糖苷:玫瑰香(13种)、蛇龙珠(9种)、小白玫瑰(9种)、爱格丽(7种),其中8-羟基里哪醇-芹菜糖呋喃基-葡萄糖苷与香茅醇-芹菜糖呋喃基-葡萄糖苷仅存在于玫瑰香葡萄果实中,吡喃-氧化里哪醇-呋喃阿拉伯糖基-葡萄糖苷仅存在于爱格丽葡萄果实中。因此,针对不同葡萄品种中糖苷含量和种类的不同,选择产对应糖苷酶较高的非酿酒酵母应用于葡萄酒酿造,对葡萄酒香气提升及特色葡萄酒生产具有重要意义。
4 结论
本试验以甘肃河西走廊各子产区主栽酿酒葡萄自然发酵的酒样为试材,选取不同发酵时期的发酵液分离纯化得到912株酵母菌。利用96孔板七叶苷培养基进行糖苷酶活性初筛,并采用p-NP法对供试菌株的β-Glu、α-L-Ara、α-L-Rha、β-Xyl粗酶液进行定量测定。酶活力热图聚类分析结果显示,菌株HX-1、HX-2、HX-3、HX-4的4种酶活力均表现出较高水平。菌株26S rDNA D1/D2 PCR扩增测序结果表明,HX-1和HX-3为葡萄汁有孢汉逊酵母,HX-2和HX-4为美极梅奇酵母。
葡萄酒酿造因子对不同菌株酶活力耐受性的影响具有菌株依赖性,高乙醇、高葡萄糖和SO2含量对各糖苷酶均有抑制作用。在正常葡萄酒酿造条件范围内,HX-2和HX-4菌株的β-Glu保持了较高活力;HX-1菌株的α-L-Rha、HX-4菌株的α-L-Ara、HX-1和HX-3的β-Xyl活力较高。因此,在实际酿酒生产中,可根据不同葡萄品种中香气糖苷含量及种类,选择对应糖苷酶活力较高的菌株应用于葡萄酒酿造。

