猪源粪肠球菌对猪小肠上皮细胞黏附及致炎作用的影响
金钺,李滨洲,郭珍珍,王亚宾,魏战勇,陈丽颖
(1.河南农业大学动物医学院,河南 郑州 450046;2.河南省动物性食品安全重点实验室,河南 郑州 450046;3.北京市华都峪口禽业有限责任公司,北京 101206)
粪肠球菌(Enterococcusfaecalis)是人体和动物体内的常驻菌群,存在于肠道和粪便中,作为条件性致病菌已成为医院获得性感染的第三大病原菌。随着多重耐药菌株的出现,该菌已经对公共健康构成较大威胁[1-2]。细菌在宿主细胞表面的黏附和定植是其感染宿主过程的关键步骤,绝大多数细菌在进化过程中逐渐形成了精细的黏附机制,如生物被膜的形成等。相关研究证实,粪肠球菌所形成的生物被膜可使其耐受吞噬作用并大幅提高其耐抗菌药物能力[3]。但是,细菌的侵染是极其复杂的过程,病原菌通过多种免疫逃逸机制实现在机体内的定植,而宿主免疫系统则利用先天免疫和适应性免疫机制靶向对抗病原体感染。此外,病原体还可以利用宿主的炎症反应对抗益生微生物定植,从而在肠道内生长[4-5]。上皮-间质转化(epithelial-mesenchymal transition,EMT)是极化上皮细胞经历一系列形态变化并获得间充质表型的生物学过程,可使细胞运动性和侵袭性增加,同时诱导慢性炎症的微生物病原体会促进EMT的发生[6],且该过程伴随着细胞表面标志物表达水平的变化。
虽然粪肠球菌对于人类和动物的健康威胁已经得到了研究者的共识,但是关于该菌突破肠上皮屏障的机制及该菌入侵细胞后对细胞炎性应答的影响相关研究还较为缺乏。本研究通过构建粪肠球菌体外感染猪小肠上皮细胞(intestinal porcine epithelial cells,IPEC)模型[7],经染色镜检、间接免疫荧光观察和扫描电子显微镜观察粪肠球菌对IPEC-J2的黏附状态,并检测了感染粪肠球菌后IPEC-J2中相关炎性因子包括促炎因子白细胞介素1β(interleukin 1β,IL-1β)、IL-6、IL-8、IL-12和转化生长因子β(transforming growth factor β,TGF-β)的表达变化,观察细胞的炎性反应;应用荧光定量PCR方法检测了EMT标志物包括上皮细胞钙黏蛋白(E-cadherin)、神经钙黏蛋白(N-cadherin)、β-连环蛋白(β-catenin)、蜗形蛋白(snail)和波形蛋白(vimentin)的转录水平变化,探究粪肠球菌感染对细胞表面标志蛋白的影响。
1 材料与方法
1.1 菌株与细胞株来源
猪源粪肠球菌N8菌株和N41菌株,以及对照菌株大肠杆菌O157∶H7由河南农业大学动物医学院微生物实验室保存并提供[8]。IPEC-J2由河南农业大学预防兽医系动物分子病原学团队实验室保存。
1.2 主要仪器
主要仪器包括荧光显微镜(日本Olympus公司)、场发射扫描电子显微镜SU8010(日本Hitachi公司)、酶标仪(美国Thermo公司)、WGZ-2XJ细菌浊度计(上海昕瑞仪器有限公司)、CO2细胞培养箱(美国Thermo公司)、凝胶成像系统(美国Bio-Rad公司)、PCR仪(美国ABI公司)、荧光定量PCR仪(美国Bio-Rad公司)、CJ-ZDF净化工作台(天津市泰斯特仪器有限公司)和电泳仪(美国Thermo公司)等。
1.3 主要试剂
带有辣根过氧化物酶(horseradish peroxidase,HRP)标记和异硫氰酸酯(fluoresceine isothiocyanate,FITC)标记的羊抗兔二抗购自武汉三鹰生物技术有限公司;单抗Anti-β-catenin Rabbit、Anti-vimentin Rabbit和Anti-snail Rabbi购自美国Immunoway公司;其余试剂主要包括弗氏完全佐剂与弗氏不完全佐剂(美国Sigma公司)、DMEM/F12营养液(Hyclone公司)、胎牛血清(Gibco公司)、低分子质量预染Marker(安徽欣伯玉生物科技有限公司)、TaqDNA聚合酶(康为世纪生物科技有限公司)、增强型化学发光(enhanced chemiluminescence,ECL)显色液(苏州新赛美生物科技有限公司)、0.22 μm聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)(北京索莱宝科技有限公司)、脑心浸出液肉汤(brain heart infusion broth,BHI)(青岛海博生物技术有限公司)和SYBR Green I(宝生物工程有限公司)等。
1.4 染色镜检观察
在24孔细胞培养板中提前放置好细胞爬片并使IPEC-J2长成单层,然后用调整至5×107cfu·mL-1、感染复数(multiplicityofinfection,MOI)=100∶1的粪肠球菌进行感作,于37 ℃下孵育2 h后,用磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗去未黏附的细菌,再以体积分数4%多聚甲醛溶液于37 ℃固定30 min。随后,取出细胞爬片放置在载玻片上,分别进行革兰氏染色和吉姆萨染色,在油镜下观察粪肠球菌黏附IPEC-J2状态。
1.5 间接免疫荧光检查
1.5.1 粪肠球菌的灭活与抗体制备 将活化的粪肠球菌培养物调整至1×108cfu·mL-1,以体积分数0.4%的甲醛溶液进行灭活(37 ℃、24 h)。将经甲醛灭活的粪肠球菌N41菌液与弗氏佐剂(首次使用弗氏完全佐剂,之后使用弗氏不完全佐剂)等体积混合后,以多点皮下注射方式接种6周龄新西兰白兔(购自河南省实验动物中心,清洁级),免疫菌数为1×108cfu·只-1,每间隔14 d免疫1次,共接种3次,第3次免疫7 d后进行心脏采血,分离制备阳性血清;同时耳缘静脉采集未免疫健康新西兰白兔血制备阴性血清,于-20 ℃保存。动物试验过程符合河南农业大学动物伦理委员会的相关要求。
1.5.2 间接免疫荧光 同方法1.4制备黏附有粪肠球菌的细胞爬片,依次进行如下处理:1.5 mL细胞组织固定液(37 ℃,30 min),1.5 mL细胞破膜液(25 ℃,15 min),体积分数5%牛血清白蛋白溶液1.5 mL(37 ℃,60 r·min-1,2 h),每一步骤后均以PBS溶液洗涤3次。每孔加入1.5 mL稀释至1∶200的兔抗粪肠球菌血清(一抗)孵育2 h(37 ℃,60 r·min-1),以PBS溶液洗涤3次;随后每孔加入1.5 mL带FITC标签的羊抗兔二抗(1∶1 000稀释),于37 ℃以60 r·min-1缓慢振摇50 min进行孵育,洗涤3次;每孔加入600 μL 4′,6-二脒基-2-苯基吲哚(4′,6-diamidino2-phenylindole,DAPI)溶液,25 ℃下孵育10 min,洗涤3次;最后,以体积分数60%甘油PBS溶液进行封闭。荧光显微镜下观察粪肠球菌黏附IPEC-J2状态。
1.6 场发射扫描电子显微镜观察
同方法1.4制备黏附有粪肠球菌的细胞爬片,加入电镜组织固定液(体积分数2%戊二醛),在4 ℃下固定1 h,用不同体积分数的丙酮溶液(10%、30%、50%、70%、90%和100%,各15 min)对样品进行梯度脱水(置冰上),然后更换体积分数100%丙酮并使其恢复至25 ℃,用液态CO2进行临界点干燥,通过溅射涂覆将干燥样品涂覆于金钯膜。使用Everhart Thornley SE检测器和InLens SE检测器以加速电压3 kV在场发射扫描电子显微镜(Zeiss Merlin)下观察粪肠球菌黏附IPEC-J2的状态。
1.7 EMT标志物检测
以大肠杆菌O157:H7为阳性对照,对粪肠球菌N41诱导IPEC-J2 EMT标志物的变化进行检测和观察。调整菌液含量至5×106cfu·mL-1(MOI=10∶1),于37 ℃、体积分数5% CO2条件下感染单层IPEC-J2持续12 h,用PBS洗去未黏附细胞,将细胞板置于液氮速冻10 min以终止细胞的mRNA转录。用Trizol法提取细胞总RNA,然后用TaKaRa去基因组反转录试剂盒进行反转录。根据GenBank中公布的相关基因序列设计PCR引物(表1),以β-actin基因为内参,检测IPEC-J2上述EMT标志物的mRNA转录水平。

表1 检测EMT标志物基因的PCR引物序列
收取每个培养孔的细胞,检测每孔蛋白质含量。用上样缓冲液对样品进行处理后进行十二烷基磺酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfonate-polyacrylamide gel electrophoresis,SDS-PAGE)电泳,将电泳产物半干转印到0.22 μm PVDF膜上。以0.05 g·mL-1脱脂奶室温封闭2 h,TBST洗涤3次。分别使用5种EMT标志物单抗4 ℃孵育过夜,以HRP标记羊抗兔抗体为二抗,经ECL显色后观察结果。
1.8 IPEC-J2炎性因子表达的检测
1.8.1 细胞样品处理与总RNA提取和反转录 将活化的猪源粪肠球菌N8菌株和N41菌株以5×107cfu·mL-1(MOI=100∶1)感染单层IPEC-J2(24孔板),感作后定时使用PBS洗去游离细胞,将细胞板置液氮中速冻10 min,然后在-80 ℃保存备用。
将细胞板置于冰上,刮取细胞,然后用Trizol法提取细胞总RNA,用去基因组反转录试剂盒(TaKaRa)进行反转录,反应体系为20 μL。所得cDNA样品保存于-20 ℃备用。
1.8.2 细胞炎性因子的测定 根据GenBank公布的细胞因子基因序列设计PCR引物序列(表2),送至生工生物工程(上海)有限公司合成引物。PCR反应体系为25 μL(上、下游引物各1 μL,TaqDNA聚合酶10 μL,ddH2O 11 μL,模板2 μL),反应程序为95 ℃预变性5 min,95 ℃变性50 s,60 ℃退火50 s,72 ℃延伸40 s,共35个循环,最后72 ℃延伸10 min。用质量分数2%琼脂糖凝胶电泳检查引物的特异性。荧光定量PCR检测以β-actin为内参基因,试验体系为20 μmoL·L-1的上、下游引物各1 μL,cDNA目的片段2 μL,2×SYBR Premix Ex Taq酶10 μL,用ddH2O补足至20 μL反应体系。使用SYBR Green染料法,采用2步法,程序为95 ℃ 60 s,95 ℃ 5 s,60 ℃ 34 s,共40个循环,并分析其熔解曲线,检测各引物的特异性。

表2 检测5种细胞因子的PCR引物名称和序列
2 结果与分析
2.1 粪肠球菌黏附IPEC-J2的革兰氏和吉姆萨染色镜检结果
将经粪肠球菌感染后的单层IPEC-J2采用革兰氏染色和吉姆萨染色后进行显微镜镜检,结果显示,粪肠球菌可以黏附到IPEC-J2表面及细胞间的紧密连接处,且细菌在肠上皮细胞上的黏附并不均匀,出现聚集现象(图1)。2种染色方法下所观察到的粪肠球菌黏附IPEC-J2状态具有一致性。
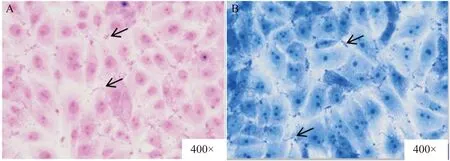
A为革兰氏染色,B为吉姆萨染色。箭头所指为黏附的粪肠球菌。
2.2 粪肠球菌黏附IPEC-J2的间接免疫荧光观察
为了特异性观察粪肠球菌对IPEC-J2的黏附,利用粪肠球菌N41菌株灭活菌免疫家兔制备了多克隆抗血清,用该一抗对爬片上的粪肠球菌进行感作,然后用带FITC标记的羊抗兔二抗处理,同时使用DAPI进行细胞核染色并对IPEC-J2状态进行定位。荧光显微镜下,与未感染粪肠球菌的IPEC-J2(阴性对照)相比,感染粪肠球菌的IPEC-J2的细胞膜上出现明显的绿色荧光(图2),表明带FITC标签的二抗成功与一抗结合,指示出粪肠球菌的存在。进一步观察显示,粪肠球菌并不是均匀黏附在IPEC-J2膜上,而是存在聚集现象。这一结果与染色镜检法一致。

A:IPEC-J2(阴性对照);B:粪肠球菌+IPEC-J2。箭头所指绿色荧光为粪肠球菌。
2.3 场发射扫描电子显微镜对粪肠球菌黏附IPEC-J2的观察
通过场发射扫描电子显微镜对粪肠球菌N41菌株的黏附进行观察,扫描电子显微镜图片显示,作为体外模型的IPEC-J2系与体内肠上皮细胞具有高度的形态学相似性,其顶端具有微绒毛(图3-A);粪肠球菌与IPEC-J2的黏附发生在顶端微绒毛部位(图3-B~C);粪肠球菌的黏附具有聚集性(图3-B~C)。同时观察到,粪肠球通过绒毛屏障与细胞壁结合并发生内陷(图3-D),这是细菌侵入细胞的初始阶段。
2.4 粪肠球菌感染对IPEC-J2炎性因子转录水平的影响
利用荧光定量PCR技术检测了粪肠球菌感染组和空白组IPEC-J2在不同时间段炎性因子转录水平。与对照组相比,感染组IPEC-J2的细胞因子IL-1β、IL-6和IL-8表达呈现出相似的炎症反应规律,其总体趋势为感染后1~4 h炎症反应随着时间而升高,而4~6 h间炎症反应降低,但仍高于空白组肠上皮细胞炎症因子的表达水平(图4-A~C)。同时,研究还发现,不同粪肠球菌菌株对IPEC-J2中炎性因子表达的调节能力不同,其中,粪肠球菌N41菌株对IPEC-J2所引起的炎症水平要高于N8菌株(p<0.05)。相反,粪肠球菌感染后,IPEC-J2中另外一些细胞因子的表达受到抑制,其中IL-12表达水平有显著降低,TGF-β的表达也呈现下降趋势,而粪肠球菌N8感染组的下降幅度均高于N41感染组(图4-D~E)。
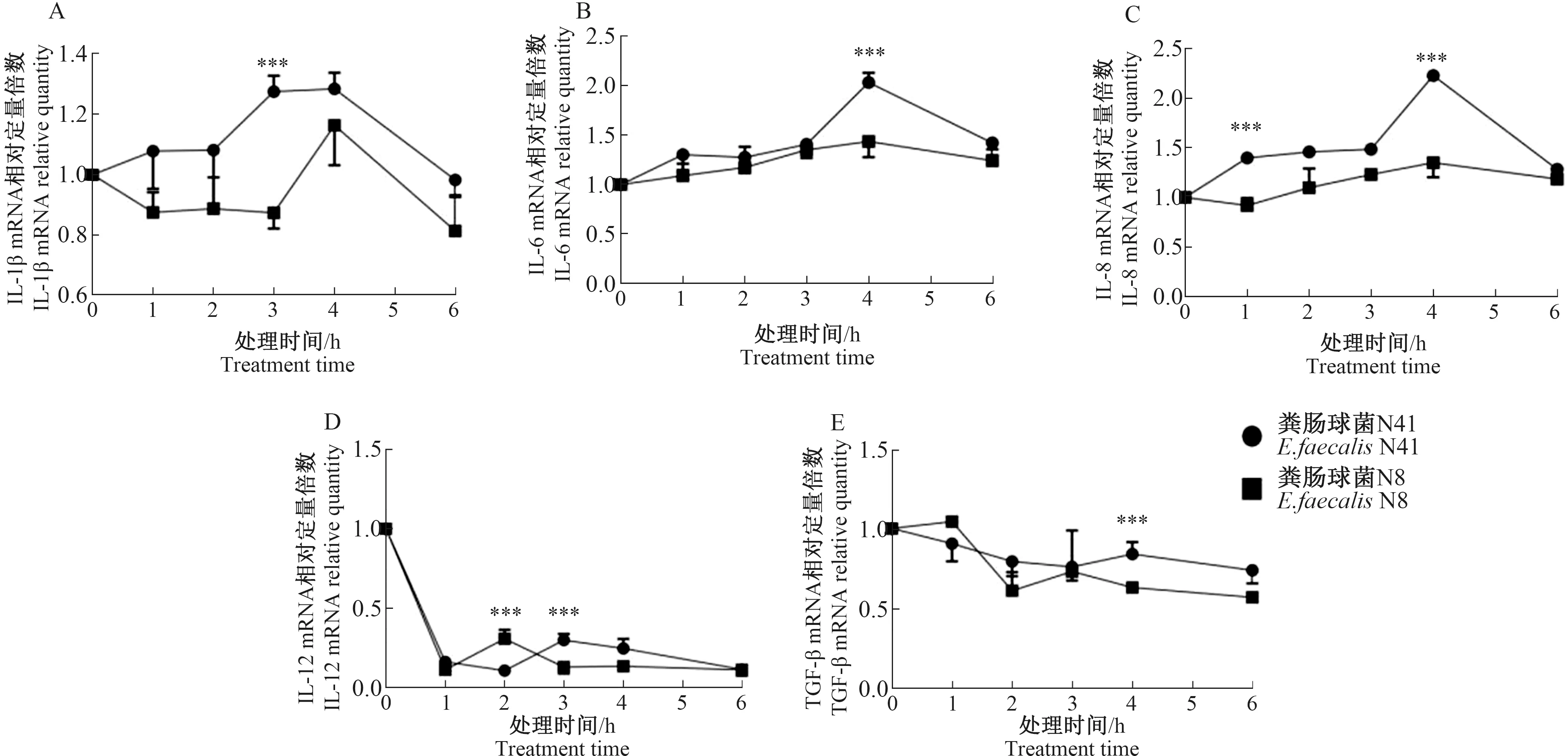
(A)IL-1β;(B)IL-6;(C)IL-8;(D)IL-12;(E)TGF-β。p<0.001标记为***。
2.5 细菌感染IPEC-J2后对上皮细胞间质转化标志物的影响
为了检测粪肠球菌感染对上皮细胞间质转化标志物的影响,用出肠血性大肠杆菌O157∶H7作为阳性对照,以粪肠球菌N41菌株和大肠杆菌O157∶H7分别对IPEC-J2持续感染12 h,检测、观察IPEC-J2上皮标志物转录水平的变化。荧光定量PCR检测结果表明,大肠杆菌O15∶H7增强了IPEC-J2的波形蛋白、蜗形蛋白和β-连环蛋白的mRNA转录水平,而粪肠球菌N41对这3种EMT标志物蛋白的mRNA转录水平影响不大;大肠杆菌O157∶H7促进了IPEC-J2的N-钙黏蛋白的mRNA转录而抑制E-钙黏蛋白的mRNA转录,粪肠球菌则抑制N-钙黏蛋白和E-钙黏蛋白的mRNA转录。针对上述mRNA转录水平变化较大的EMT标志物波形蛋白、蜗形蛋白和β-连环蛋白进行了蛋白水平的检测,结果显示,上述3种标志物蛋白的表达量变化与其mRNA转录水平变化具有较高一致性。大肠连环杆菌O157∶H7上调了波形蛋白、蜗形蛋白和β-连环蛋白的表达,而粪肠球菌N41对波形蛋白、蜗形蛋白和β-连环蛋白的表达量影响较小(图5—图6)。

p<0.05标记为*;p<0.01标记为**;p<0.001标记为***。
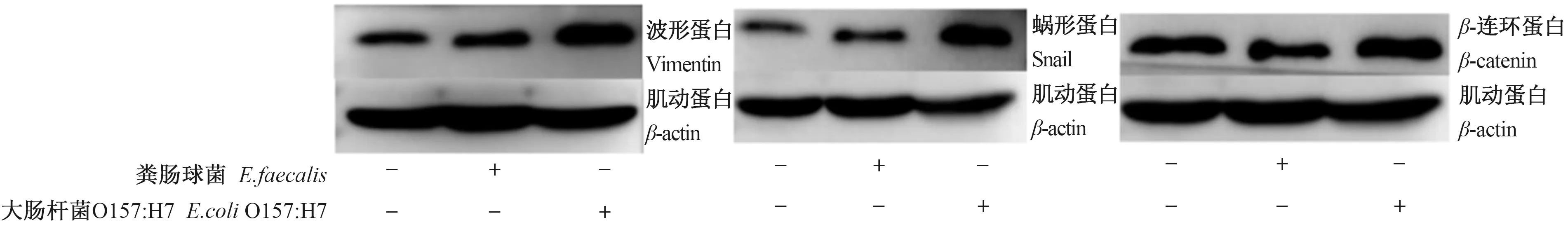
(+)感染猪源粪肠球菌或大肠杆菌O157∶H7;(-)正常细胞。
3 结论与讨论
以不同毒力的猪源粪肠球菌菌株作为研究对象,通过染色镜检、免疫荧光、扫描电子显微镜试验等手段,观察了粪肠球菌对IPEC-J2的黏附,证实了粪肠球菌对IPEC-J2的体外黏附性,并发现了细菌黏附的不均匀性。细菌黏附到宿主细胞的机制有多种,有些细菌可分泌毒力因子,通过蛋白水解作用或激活其黏附活性而特异性地抑制靶连接蛋白(target junction proteins)[9]。在扫描电子显微镜观察中发现,与粪肠球菌接触的细胞表面存在凹陷,这可能是粪肠球菌释放的相关毒力因子如溶细胞素(cytolysin,Cyl)等造成的。溶细胞素也称为细胞溶酶,是一种使粪肠球菌具备溶血性的独特毒素,还能广泛溶解包括革兰氏阳性细菌和真核细胞在内的多种靶细胞[10]。细胞溶素对粪肠球菌的致病性有较大作用,并在多种动物模型及临床试验中证实了细胞溶解素表达与肠球菌感染性增加的关系[11-13]。
机体内多种细胞可以分泌细胞因子,而细胞因子种类众多,它们相互之间通过协同、拮抗、叠加或递进而构成极为复杂的免疫调节网络[14-16]。炎性细胞因子(如TNF-α、IL-1β和 IL-6等)在细菌感染后表达水平升高,在宿主的先天免疫应答中发挥着极其重要的作用,但其表达过高时又会反过来引起机体损伤[17]。LEECH等[18]报道,在抗金黄色葡萄球菌感染的应答中,机体内抗炎细胞因子IL-10表达水平明显上升,且其表达可被促炎因子TNF-α上调。IL-1β主要在摄取抗原抗体复合物时产生,具有较强的促炎作用,并参与中性粒细胞募集。IL-6参与机体急性细菌感染性炎症反应的发生,在刺激Th细胞活化、抑制Treg细胞和B细胞分化中均具有调节作用[19]。趋化因子IL-8是巨噬细胞和上皮细胞等分泌的细胞因子。IL-12是一种具有多种生物活性的细胞因子,能调节T淋巴细胞和NK细胞分化与增殖,诱导IFN-γ生成,促进Th1细胞分化[20]。抗炎因子TGF-β不仅参与组织修复、胚胎发育、炎症反应等过程,能抑制PBMC中IFN-γ和TNF-α的产生,对细胞的免疫功能也具有显著调节作用[21-23]。粪肠球菌虽然是哺乳动物胃肠道的共生细菌,但也是一种机会性致病菌,在某些情况下可引起严重疾病,在此过程中,也有多种细胞因子发挥着作用。本研究分别用2株粪肠球菌感染IPEC-J2后,均能促进炎性因子IL-1β、IL-6和IL-8的表达,且其变化规律基本一致,而毒力较强的N41菌株的促进作用更强。同时,2株粪肠球菌感染后对上皮细胞中IL-12和TGF-β的表达均有一定的抑制作用,尤以IL-12为甚。造成上述变化的原因有可能与菌株的毒力相关,王亚宾等[24]研究已经证实粪肠球菌N41菌株的致病性高于N8菌株,因此其引起的炎症反应会更为强烈。但上述变化对粪肠球菌致病性的确切影响及其机制还有待于进一步探究。
机体细胞发生EMT可使上皮标志物(E-钙黏蛋白、闭合蛋白、桥粒蛋白)的表达降低,而间充质标志物(玻连蛋白,成纤维细胞特异性蛋白,平滑肌肌动蛋白,波形蛋白,纤连蛋白,N-钙黏蛋白等)的表达升高[25]。诱导慢性炎症的微生物病原体可促进EMT的发生[26]。本研究表明,粪肠球菌感染IPEC-J2后,并未对波形蛋白、蜗形蛋白、β-连环蛋白和E-钙黏蛋白的表达水平造成明显影响,甚至下调了N-钙黏蛋白的表达水平,这表明作为条件性致病菌的粪肠球菌对细胞骨架迁移及病理性间质转化的过程并无明显促进作用。

