中华绒螯蟹甲壳肽EsCrus3和EsCrus4表达模式与免疫功能
陈剑平 冯广朋 * 李新苍 *
(1. 上海海洋大学水产与生命学院, 上海 201306; 2. 中国水产科学研究院东海水产研究所, 农业农村部东海渔业资源开发利用重点实验室, 上海 200090)
中华绒螯蟹(Eriocheir sinensis), 俗称河蟹、大闸蟹, 是我国水产养殖主要养殖对象之一。与其他无脊椎动物类似, 中华绒螯蟹依靠先天免疫系统抵御病原微生物的感染[1]。抗菌肽是无脊椎动物免疫系统的重要效应因子, 在清除宿主体内病原微生物过程中发挥关键作用[2]。甲壳动物抗菌肽主要包括甲壳肽(Crustin)、抗脂多糖因子(Anti-lipopolysaccharide factor, ALF)、对虾素(Penaeidin)及溶菌酶(Lysozyme)等家族[3]。
甲壳肽家族为富含半胱氨酸的阳离子抗菌肽,分子量大小在7—14 kD, 序列N端含有信号肽序列,C端含有乳清酸性蛋白(Whey acidic protein, WAP)结构域[4]。WAP结构域内含有8个保守的半胱氨酸,可形成四对二硫键, 又称为“4DSC”结构域, 其在分子内部形成1个疏水核心[5]。在不同甲壳肽信号肽序列和WAP结构域之间的区域常存在序列和结构差异, 根据该区域结构模式不同, 将甲壳肽分为五种主要类型[6]。甲壳动物中常见Ⅰ—Ⅳ型, Ⅴ型甲壳肽则主要存在于膜翅目昆虫中[7]。1个物种通常含有多个甲壳肽分子, 呈现多样的生物学功能。例如, 拟穴青蟹 (Scylla paramamosain)中已报道8个甲壳肽基因, 其中5个Ⅰ型甲壳肽[8—10], 3个属于Ⅱ型甲壳肽[11—13], 它们大多数具有微生物结合活性, 并具有抗细菌、真菌和病毒的功能。中华绒螯蟹中也有2个Ⅱ型甲壳肽[14,15]和2个Ⅳ型甲壳肽[16,17]被报道, 参与不同免疫反应。此外, 对虾中也发现了大量具有抗微生物功能的甲壳肽分子[18—20]。
卵巢是雌性中华绒螯蟹的生殖器官, 对中华绒螯蟹的繁育和养殖具有重要意义。本研究将通过生物信息学分析、基因表达分析、蛋白表达与纯化、免疫学功能验证, 从中华绒螯蟹卵巢组织中鉴定2个Ⅰ型甲壳肽分子, 分析其免疫相关功能, 明确这2个抗菌肽的功能差异及作用, 丰富甲壳动物生殖系统免疫理论。
1 材料与方法
1.1 实验材料
中华绒螯蟹中华绒螯蟹亲蟹, 购于江苏省高邮湖, 雌蟹(97.03±11.09) g, 雄蟹(125.03±10.38) g,于实验室养殖缸中暂养1周[温度(20±3)℃, pH 8.1±0.4], 适应实验环境。实验前挑选附肢完整, 体表无损伤, 活力强的个体作为实验对象。
菌株和载体实验中所用菌株均为本实验室保藏或购买, 9种保藏菌株包括3种革兰氏阳性菌: 金黄色葡萄球菌(Staphyloccocus aureus)、枯草芽孢杆菌(Bacillus subtilis)和巨大芽孢杆菌(Bacillus megaterium), 5种革兰氏阴性菌: 大肠杆菌(Escherichia coli)、嗜水气单胞菌(Aeromonas hydrophila)、溶藻弧菌(Vibrio alginolyticus)、副溶血性弧菌(Vibrio parahemolyticus)和哈维氏弧菌(Vibrio harveyi), 1种真菌: 白色念珠菌(Candida albicans)。大肠杆菌DH5α和DE3感受态细胞购于北京全式金生物技术有限公司。所用pMD19-T载体购于TaKaRa公司(中国大连), pET-32a表达载体购自Novagen公司(德国)。
主要试剂与设备RNAiso Plus、反转录试剂盒、LATaq酶、质粒提取试剂盒、TB Green Premix ExTaq酶、T4连接酶、限制性核酸内切酶购于TaKaRa公司; 胶回收试剂盒购于北京全式金生物技术有限公司; DNase I为Promega(美国)公司产品; 氨苄青霉素(Amp)、异丙基-β-D-硫代半乳糖苷(IPTG)购于上海生工生物工程有限公司; Ni-NTA His Bind Resin购于Merck(美国); 胰蛋白胨、酵母提取物、两种肽聚糖(PGN, 来自于金黄色葡萄球菌和枯草芽孢杆菌)、脂磷壁酸(LTA, 来自于枯草芽孢杆菌)、脂多糖(LPS, 来自于大肠杆菌0111:B4)、β-葡聚糖(来自于海带)和3, 3′, 5, 5′-四甲基联苯胺(TMB)购于Sigma(美国); 其余试剂均为国产分析纯。
主要仪器包括: 梯度PCR仪(Eppendorf, Mastercycler X50s)、荧光定量PCR仪(Thermo, ABI Quant-Studio 6 Flex)、多功能酶标仪(TECAN, SPARK10)、超微量紫外可见光分光光度计(Thermo, NanoDrop One)、多功能成像系统(Bio-rad, Doc XRS+)及微孔板全自动洗板机(BioTek, 50TS)等。
1.2 实验方法
样品采集与总RNA提取将中华绒螯蟹置于冰中麻醉, 用含有预冷抗凝剂(0.14 mol/L氯化钠、0.1 mol/L葡萄糖、30 mmol/L柠檬酸三钠、26 mmol/L 柠檬酸、10 mmol/L EDTA; pH 4.6)的无菌注射器从螯足基部抽取血淋巴, 在4℃时850×g离心15min收集血细胞, 随后加入细胞裂解液吹打均匀, 进行总RNA提取。取血后解剖中华绒螯蟹, 采集心脏、肝胰腺、鳃、胃、肠、卵巢、精巢和肌肉组织, PBS(140 mmol/L氯化钠, 10 mmol/L磷酸二氢钠; pH 7.4) 洗涤2—3次后, 加入细胞裂解液进行组织匀浆, 离心后进行总RNA提取。总RNA提取步骤参考RNAiso Plus使用说明进行。
cDNA合成将DNase Ⅰ添加到总RNA中以去除样品中污染的DNA, 琼脂糖凝胶电泳分析RNA完整性, 超微量分光光度计检测总RNA浓度和纯度。总RNA质量符合要求后, 按照反转录试剂盒(PrimeScriptTMRT Master Mix)的使用说明合成cDNA。
甲壳肽基因cDNA克隆通过对实验室测得的中华绒螯蟹转录组数据分析, 获得2个甲壳肽样分子, 随后使用Primer Premier 5.0软件在基因序列两端分别设计扩增引物(表1), 通过PCR扩增、测序验证基因序列。以中华绒螯蟹卵巢cDNA为模板, 通过PCR扩增目的基因, 反应体系参照LATaqTMVersion 2.0 plus dye说明书配制: LATaq酶25 μL, 灭菌水20 μL, 上下游引物各2 μL(10 μmol/L),模板cDNA(200 ng/μL)1 μL。PCR反应程序: 95℃预变性3min; 94℃变性30s, 53℃退火30s, 72℃延伸40s, 共35个循环; 最后72℃延伸10min。获得的目的片段经过胶回收试剂盒回收纯化后, 连接至pMD19-T载体, 再转化到DH5α感受态细胞内, 送往上海生工测序。
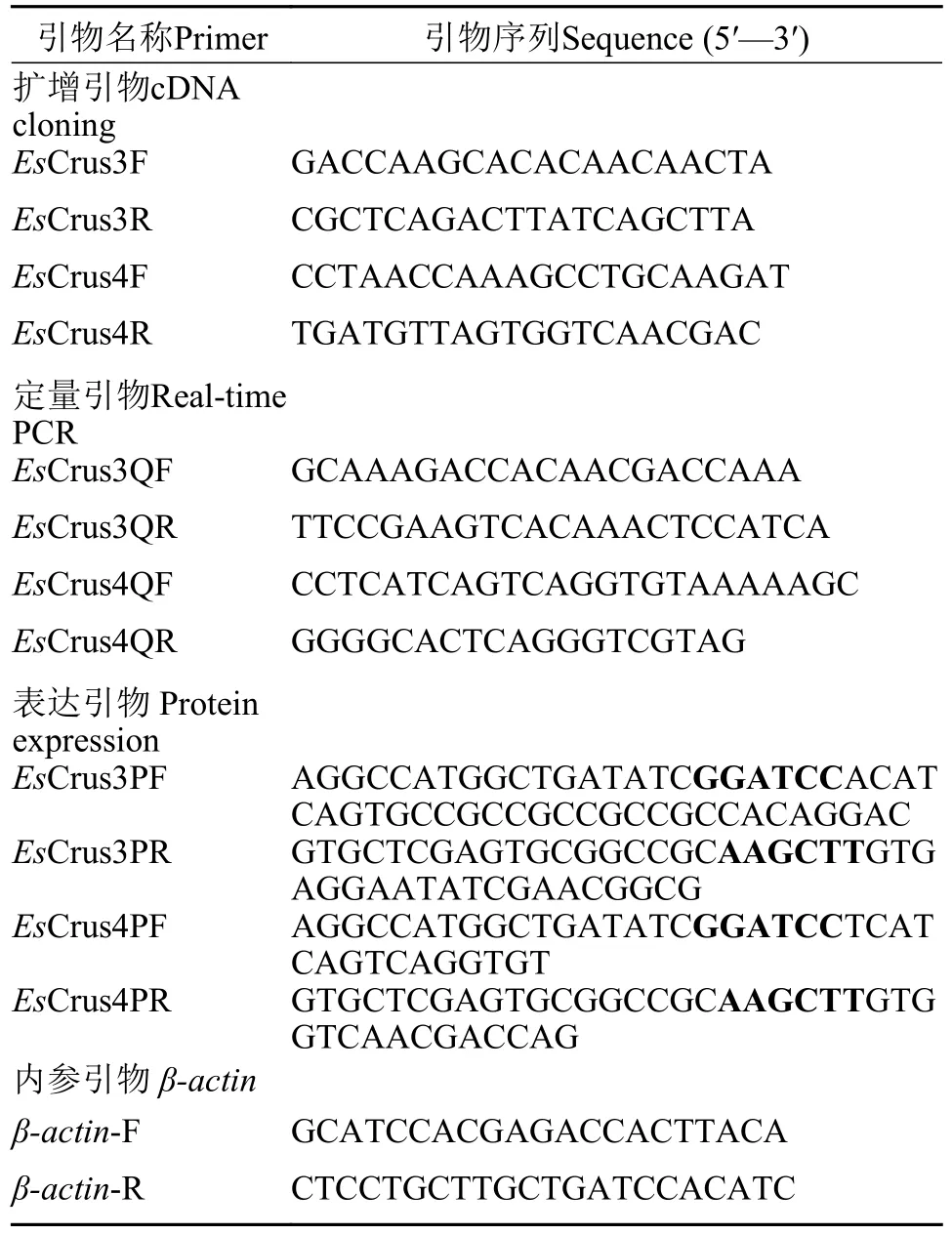
表1 实验所用引物序列Tab. 1 Sequence of primers used in this study
生物信息学分析利用软件Expasy(http://web.expasy.org/translate/)预测EsCrus3和EsCrus4编码的氨基酸序列; 软件BLASTP(http://blast.ncbi.nlm.nih.gov/Blast.cgi/)分析EsCrus3和EsCrus4与其他物种甲壳肽蛋白的相似性。多重序列比对由DNAMAN软件和GeneDoc软件生成。蛋白理论分子量(MW)和等电点(pI)基于在线软件Expasy(http://web.expasy.org/compute_pi/)计算。在线软件Signal IP(http://www.cbs.dtu.dk/services/SignalP/)用于预测蛋白信号肽[21]。MEGA 11软件用于分析不同类型甲壳肽间的进化关系。
甲壳肽基因组织分布分析以合成的中华绒螯蟹不同组织cDNA为模板进行荧光定量PCR反应。20 μL反应体系参照试剂盒(TB Green®Premix ExTaqTMⅡ)说明书配制: TB Green Ⅱ 10 μL、ROX参比染料0.4 μL、上下游引物各0.8 μL (10 μmol/L)、无菌水6 μL、cDNA模板2 μL; 甲壳肽基因定量引物与内参引物见表1。qRT-PCR程序设置如下:95℃ 3min; 95℃ 10s, 60℃ 40s, 40个循环; 60—95℃熔解曲线分析。所有实验均使用单独的模板并设置3次重复。利用公式2-∆Ct分析EsCrus3和EsCrus4在不同组织的相对表达水平。
病原刺激后甲壳肽基因表达模式分析为分析EsCrus3和EsCrus4是否响应病原菌刺激, 本研究首先通过注射病原菌的方式感染中华绒螯蟹, 随后通过qRT-PCR分析它们的表达模式, 实验期间停止喂食。实验组分别注射200 μL的金黄色葡萄球菌 [2×108CFU(Colony-Forming Units)]或200 μL嗜水气单胞菌(2×107CFU), 对照组注射相同体积的PBS。在细菌注射后0、2h、6h、12h、24h及48h,每组的每个时间点分别随机挑选3只蟹, 取卵巢组织提取总RNA, 反转录后进行qPCR检测, 通过公式2-ΔΔCt分析[22]EsCrus3和EsCrus4在不同细菌刺激后的表达模式。
甲壳肽原核重组表达根据EsCrus3和Es-Crus4序列, 设计含有特定酶切位点(BamH Ⅰ和Hind Ⅲ)的表达引物(表1), 随后通过PCR扩增目的片段, 目的片段酶切后与表达载体pET-32a连接; 将阳性质粒转化大肠杆菌(DE3)感受态细胞, 获取表达菌株。阳性菌株培养至对数期时加入0.5 mmol/L的IPTG, 28℃条件下诱导培养12h, 菌液离心后收集菌体, 加入PBS重悬菌体并进行超声破碎。通过聚丙烯酰胺凝胶电泳(SDS-PAGE)分析蛋白表达情况, 随后利用Ni-NTA His Bind Resin纯化蛋白, 蛋白溶度通过Bradford法测定。
微生物结合活性检测微生物结合实验用于评价EsCrus3和EsCrus4与不同类型微生物的结合活性, 实验步骤参照Zhu等[23]报道的方法。重组蛋白(150 μg/mL)分别与实验材料中的9种微生物(2×108CFU)于28℃振荡孵育1h。离心后用TBS(50 mmol/L Tris-HCl和150 mmol/L氯化钠; pH 7.5)洗涤沉淀3次, 并取最后1次洗涤液(Wash)制样。随后菌体中加入200 μL 7% SDS温和振荡10min,离心收集洗脱液(Elution)制样。菌体沉淀(Pellet)经TBS洗涤3次后制样。重组蛋白EsCrus3和EsCrus4作为阳性对照, 通过Western Blot检测蛋白与微生物结合情况。依据洗涤液、洗脱液或沉淀中是否存在目的蛋白, 判断蛋白与微生物的结合活性。
微生物多糖结合实验酶联免疫吸附实验(Enzyme-Linked Immunosorbnent Assay, ELISA)用于评价EsCrus3和EsCrus4与5种不同来源的微生物多糖的结合活性。ELISA操作过程参照文献[24]中方法。取100 μL多糖悬液(20 μg/mL)至96孔板中进行包被, 阴性对照孔中加入等体积TBS。包被结束后加入200 μL BSA(5 mg/mL)于37℃封闭2h, 随后加入TBST(0.05% Tween 20)洗涤4次。取100 μL梯度稀释后的0—1 μmol/L重组蛋白EsCrus3、Es-Crus4或Trx (标签蛋白, 阴性对照), 分别加入洗涤后的96孔板中, 室温孵育3h, TBST洗涤4次。每孔中加入100 μL辣根过氧化物酶标记的His标签抗体(1﹕5000稀释), 于37℃孵育2h, TBST洗涤4次。加入100 μL现配的0.01% TMB发色液, 发色至颜色不再明显变化, 加入50 μL H2SO4(2 mol/L)终止反应, 在450 nm波长处测定吸光度。所有实验操作重复3次,每次实验设置3个复孔。
液体抑菌实验通过液体抑菌实验评价Es-Crus3和EsCrus4抑菌活性, 具体操作参照文献[25]所述方法。分别向96孔板中加入50 μL TBS梯度稀释(0—1 μmol/L)的重组蛋白EsCrus3、EsCrus4或Trx, 再分别加入50 μL PB培养基(1% 胰蛋白胨,0.5% 氯化钠; pH 7.5)稀释的实验材料中所述的9种微生物(1×105CFU)。置于28℃孵育16h, 而后在600 nm波长处测定吸光度, 检测抑菌活性。本实验最小生长抑制浓度定义为与阴性对照相比获得显著生长抑制的最低蛋白质浓度。所有实验重复3次, 每次实验设置3个复孔。
2 结果
2.1 两个甲壳肽的序列特征
从中华绒螯蟹转录组数据中获得的2条甲壳肽样基因序列, 分别命名为EsCrus3和EsCrus4。经基因克隆、测序后, 确认EsCrus3全长567 bp, 开放阅读框(Open Reading Frame, ORF)为351 bp, 编码116个氨基酸(Amino acid, aa), 包含N端信号肽21个aa, C端WAP结构域50个aa(图1A), 成熟肽的理论等电点为5.69, 理论分子量为10.63 kD;EsCrus4全长743 bp, ORF为288 bp, 编码95个aa, 包含N端信号肽20个aa, C端WAP结构域50个aa (图1B), 成熟肽的理论等电点为8.46, 理论分子量为8.19 kD; 两个编码蛋白都含有12个保守的半胱氨酸残基, 8个位于WAP结构域内, 4个位于信号肽和WAP结构域之间, 形成1个富含半胱氨酸残基的结构域(Cysteinerich region, CRR), 根据当前甲壳肽分子的分类标准[6],EsCrus3和EsCrus4都属于典型的Ⅰ型甲壳肽。

图1 EsCrus3 (A) 和EsCrus4 (B) 的cDNA及其编码的氨基酸序列Fig. 1 cDNA and translated amino acid sequences of EsCrus3 (A) and EsCrus4 (B)
2.2 相似性与系统进化树分析
BLASTP分析结果显示,EsCrus3与紫螯青蟹(Scylla tranquebarica)StCrus(AFI56572)的一致性为68.89%, 与岸蟹(Carcinus maenas)CmCrus(CAH25399)的一致性为68.24%, 与锯缘青蟹(Scylla serrata)Ss-Crus(ADW11096)的一致性为66.67%, 与三疣梭子蟹(Portunus trituberculatus)PtCrus(ACM89167)的一致性为58.88%;EsCrus4与三疣梭子蟹PtCrus2(AFU 61578)的一致性为47.30%, 与拟穴青蟹SpCrus4(AUV 47161)和SpCrus3(AUV47160)的一致性分别为44.68%和43.01%。同源比较显示,EsCrus3和Es-Crus4与早期报道的EsCrus1和EsCrus2一致性为37.40%, 除半胱氨酸等少量氨基酸非常保守外, 其余氨基酸保守性很低(图2)。此外,EsCrus3和Es-Crus4的一致性也仅有30.77%。

图2 中华绒螯蟹中的四个甲壳肽的序列比对Fig. 2 The alignment of the four Crustin in the mitten crab
根据BLASTP搜索结果和已报道的甲壳动物含WAP结构域的蛋白, 构建了甲壳类WAP蛋白系统进化树。膜翅目昆虫甲壳肽在文献中常被归为单独类型[7], 本进化树未将此类分子列入分析。在构建的进化树中, 含有WAP结构域的蛋白被分为4组:Ⅰ组(Ⅰ型甲壳肽)、Ⅱ组(Ⅱ型甲壳肽)、Ⅲ组(Ⅲ型甲壳肽或SWD)和Ⅳ组(Ⅳ型甲壳肽或DWD)(图3)。其中, Ⅰ组甲壳肽包含2个独立的分支,EsCrus3和EsCrus4分别属于两个不同的分支。考虑到这两个分支的节点值均大于90, 表明这两个分支都是具有分类意义的簇。虽然EsCrus3和EsCrus4均属于Ⅰ型甲壳肽, 但两者不在同一分类簇, 进化关系较远, 提示EsCrus3和EsCrus4可能具有不同的生物学功能。

图3 EsCrus3、EsCrus4及其他甲壳动物Crustin的系统分析Fig. 3 Phylogenetic analysis of EsCrus3, EsCrus4 and other representative crustacean crustin
2.3 组织分布与表达模式
采用qRT-PCR方法分析了EsCrus3和EsCrus4的组织分布特征, 实验结果显示两者均在卵巢中高度表达(图4)。考虑到两者都是以β-actin作为内参基因分析相对表达水平, 通过比较可知, 这两个基因在卵巢中的表达水平接近。除在卵巢中高度表达外,EsCrus3在心、精巢和肌肉中低水平表达, 而EsCrus4也在心、鳃和肠组织中低水平表达。

图4 EsCrus3 (A) 和EsCrus4 (B) 的组织分布Fig. 4 Tissue distribution of EsCrus3 (A) and EsCrus4 (B)
用金黄色葡萄球菌和嗜水气单胞菌分别刺激中华绒螯蟹后, qRT-PCR分析EsCrus3和EsCrus4在卵巢中的表达模式。结果显示, 两个基因都能在特定时间段响应这两种不同细菌的免疫刺激。Es-Crus3在2种不同细菌刺激后2h显著表达(P<0.05),而后逐渐回落至正常水平(图5A和5B);EsCrus4在金黄色葡萄球菌刺激后12h时显著表达(P<0.05; 图5C),在嗜水气单胞菌刺激后24h时显著表达(P<0.05;图5D), 推测EsCrus3和EsCrus4在抗菌过程中发挥不同的作用。EsCrus3响应病原刺激更迅速, 发挥抗菌作用更早, 而EsCrus4很可能在细菌感染后期参与免疫反应。
2.4 重组甲壳肽蛋白的制备
为进一步探究EsCrus3和EsCrus4的生物学功能, 本研究通过原核表达体系表达了EsCrus3和Es-Crus4成熟肽序列, 随后经镍柱纯化获得目的蛋白。SDS-PAGE电泳分析显示, 在纯化的重组蛋白EsCrus3和EsCrus4泳道中都存在1个特异的电泳条带, 位置介于30—35 kD(图6)。鉴于pET-32a载体本身含有1个Trx标签(-16 kD), 2个蛋白条带位置与预期融合蛋白的大小基本相符, 表明观察到的蛋白条带为预期的重组蛋白EsCrus3和EsCrus4。
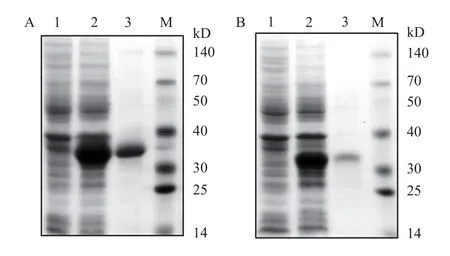
图6 重组蛋白EsCrus3 (A) 和EsCrus4 (B) 的 SDS-PAGE电泳图Fig. 6 SDS-PAGE analysis of recombinant EsCrus3 (A) and EsCrus4 (B)
2.5 重组蛋白EsCrus3和EsCrus4的微生物结合活性
根据文献对微生物结合实验中结合活性的定义[9], 可被SDS溶液洗脱但不能被TBS洗脱的蛋白,具有弱结合活性; 与菌体结合而不能被SDS洗脱的蛋白, 具有强结合活性。实验结果显示重组蛋白EsCrus3和EsCrus4主要存在于SDS洗脱液中, 且发色条带深浅不一, 而TBS洗涤液(阴性对照) 和菌体沉淀样品中除阳性对照外均无目的蛋白条带(图7),表明两种重组蛋白对9种微生物均属弱结合, 并且结合力大小也存在差异。实验结果提示, 重组蛋白EsCrus3和EsCrus4与9种不同的微生物均具有一定的结合活性。

图7 EsCrus3 (A) 和 EsCrus4 (B) 对不同微生物的结合活性Fig. 7 Binding activities of recombinant EsCrus3 (A) and EsCrus4(B) to different microorganisms
2.6 重组蛋白的微生物多糖结合活性
ELISA实验结果显示,EsCrus3对PGN、LTA、LPS和β-葡聚糖都具有结合活性。其中,EsCrus3对PGN和LTA的结合活性较强(图8A, 8B和8C), 对LPS和β-葡聚糖的结合活性较弱 (图8D和8E);Es-Crus4仅对PGN具有结合活性 (图8A和8B)。实验结果表明EsCrus3对多糖的结合活性总体强于Es-Crus4。研究结果进一步揭示了EsCrus3和EsCrus4与不同微生物具有结合活性, 很可能源于它们与不同来源微生物多糖的特异性结合。

图8 EsCrus3和 EsCrus4 对不同微生物多糖的结合活性Fig. 8 Microbial polysaccharide-binding activity is shown by EsCrus3 or EsCrus4
2.7 重组蛋白液体抑菌实验结果
液体抑菌实验结果显示, 重组蛋白EsCrus3和EsCrus4在蛋白浓度范围为0—1 μmol/L条件下, 对9种待检测的微生物均未表现出抑制活性, 表明Es-Crus3和EsCrus4不具有抑制微生物生长的能力。但该实验结果并不排除该蛋白在更高浓度下呈现抑菌效果, 文献报道显示甲壳肽通常抑制微生物能力较弱[9,26]。
3 讨论
文献报道显示, 甲壳肽主要表达于血细胞、鳃和胃等免疫相关组织[9,10,27,28]。本研究从中华绒螯蟹的生殖器官卵巢组织中鉴定了两个甲壳肽同源分子。它们响应金黄色葡萄球菌和嗜水气单胞菌的免疫刺激, 并且对多种病原微生物及多糖具有不同程度的结合活性, 提示这两种甲壳肽在中华绒螯蟹卵巢免疫防御中发挥重要作用。
根据Tassanakajon等[6]提出的分类标准, 可以将甲壳肽分为5种主要类型, 不同类型甲壳肽的区分主要依据信号肽和WAP结构域之间序列差异。在Ⅰ型甲壳肽中, 信号肽和WAP结构域之间仅存在1个CRR结构域; Ⅱ型甲壳肽在此区域有1个甘氨酸富集区(Glycine-rich region, GRR)和1个CRR结构域;Ⅲ型甲壳肽在此区域则只有1个简短的富含脯氨酸和精氨酸的结构域[4]; Ⅳ型甲壳肽无此区域, 但该类分子含有两个WAP结构域[28]; Ⅴ型甲壳肽除CRR结构域外, 还包含1个芳香族氨基酸富集区。中华绒螯蟹早期的研究已鉴定4个甲壳肽分子, 其中Es-Crus1和EsCrus2属于Ⅱ型甲壳肽[14,15], 另外2个Ⅳ型甲壳肽被命名为Es-DWD和Es-DWD1[16,17]。本研究从中华绒螯蟹中鉴定了2个新型甲壳肽, 沿用一般命名规则, 将其分别命名为EsCrus3和EsCrus4,这两个甲壳肽均具有WAP结构域, 并且在信号肽和WAP结构域之间含1个由4个半胱氨酸形成的CRR结构域; 进化分析显示这两个新型抗菌肽与其他Ⅰ型甲壳肽具有更近的进化关系(图3), 这些结果表明EsCrus3和EsCrus4属于典型的Ⅰ型甲壳肽。考虑到EsCrus3和EsCrus4相似性较低, 并且进化分析显示两者分别位于两个不同的分支上, 提示两者很可能具有不同的生物学功能。
中华绒螯蟹EsCrus1和EsCrus2均高表达于血细胞中, 并且它们对革兰氏阳性细菌具有显著的杀灭能力[14,15]。中华绒螯蟹作为一种节肢动物, 其免疫系统与模式动物果蝇具有很高的相似性, 半开放的体液循环体系确保了血淋巴可以覆盖其机体实质组织器官之外的所有部位。EsCrus1和EsCrus2具有信号肽, 提示它们属于分泌性抗菌肽, 在中华绒螯蟹体液免疫中发挥重要作用。本研究发现2个在卵巢组织中高度表达的甲壳肽分子, 它们有着相近的表达水平, 但两个分子所发挥的功能可能存在较大差异。金黄色葡萄球菌[29]和嗜水气单胞菌[30]分别为水产养殖中常见的革兰氏阳性和革兰氏阴性病原菌, 在病原刺激后,EsCrus3响应迅速, 在刺激后2h时显著上调表达, 而EsCrus4则在病原刺激后12—24h时才显著上调表达; 此外,EsCrus3结合微生物多糖的活性显著高于EsCrus4, 推测EsCrus3的抗菌活性很可能要高于EsCrus4, 表明EsCrus3在病原微生物感染时发挥更加重要的作用。由此, 我们推测, 除了免疫组织细胞分泌的免疫组分提供宿主免疫保护外, 非典型免疫组织如卵巢, 也可分泌抗菌肽等免疫组分, 在宿主免疫应答过程中发挥重要作用, 表明中华绒螯蟹体内的多种不同来源的甲壳肽很可能存在协同抗微生物感染作用, 维持机体健康。
早期研究显示Ⅰ型甲壳肽对革兰氏阳性菌表现出抗菌活性。例如, 从岸蟹血细胞中分离的第一个甲壳动物甲壳肽, 只对革兰氏阳性菌具有抑菌活性[27]; 拟穴青蟹中首个甲壳肽 (SpCrus) 可以抑制革兰氏阳性菌, 但不能抑制革兰氏阴性菌[8]。后来的研究显示, 部分Ⅰ型甲壳肽也具有微弱的抗革兰氏阴性菌活性。例如, 蜘蛛蟹 (Hyas araneus) 的HaCru1和HaCru2除对革兰氏阳性菌表现出活性外, 对革兰氏阴性菌和酵母菌也具有较低抑制活性[31]。基于上述报道我们推测,EsCrus3和EsCrus4作为典型的Ⅰ型甲壳肽, 很可能也具有类似的抑菌谱。抗菌肽可以通过多种机制抑制或杀灭病原微生物, 而与病原微生物特异性结合则是抗菌肽执行其抑菌功能的前提条件[32,33], 与病原微生物表面多糖的互作是抗菌肽与病原微生物结合的重要形式[34], 多糖结合实验可说明抗菌肽与微生物结合的分子机理。本研究发现重组蛋白EsCrus3和EsCrus4均具有结合革兰氏阴性菌、革兰氏阳性菌和真菌的能力, 推测这两种抗菌肽可能具有广谱抗菌活性。EsCrus3对多种微生物表面多糖具有特异性结合能力, 这很可能是其与多种微生物结合并具有广谱抗菌潜力的内在原因。相比之下,EsCrus4只结合来自革兰氏阳性菌的PGN。考虑到EsCrus4能结合多种微生物, 推测EsCrus4除结合PGN外很可能还与微生物表面其他组分结合, 这需要更多实验来阐明。此外, 我们还发现EsCrus3和EsCrus4对革兰氏阳性菌来源的多糖结合活性更强, 这很可能是两者对革兰氏阳性菌抑制活性更强的内在原因, 也解释了大多数Ⅰ型甲壳肽可抑制革兰氏阳性菌的内在分子机制。
尽管EsCrus3和EsCrus4都具有结合微生物的能力, 但在本研究中两者预期的抑菌活性却未获得验证, 这可能是因为这两个重组蛋白是通过原核表达获得, 重组蛋白本身并未能获得正确的三维结构,从而影响了抗菌肽的活性。此外, 据报道, 甲壳肽抗菌活性相对较弱[9,26], 本研究使用的最高蛋白浓度也仅为1 μmol/L, 很可能未达到抑菌活性的下限。因此, 要探明这两种蛋白的抑菌性, 还需要借助其他实验手段, 比如利用真核表达系统制备相应的重组蛋白, 来探明其真实的抑菌活性。
总之, 本研究从中华绒螯蟹卵巢中鉴定了2个Ⅰ型甲壳肽基因, 它们均响应细菌的免疫刺激, 并且它们的重组蛋白均具有广谱的微生物结合活性。但相比之下EsCrus3响应病原刺激更迅速、与病原多糖结合能力更强, 表明EsCrus3在卵巢的免疫防御体系中发挥更重要的作用。本研究进一步丰富了无脊椎动物生殖系统免疫防御体系的理论,EsCrus3和EsCrus4序列和功能的差异为新型药物的挖掘提供了基础数据。

