血小板和淋巴细胞比值对程序性细胞死亡蛋白-1抑制剂联合化疗治疗非小细胞肺癌患者的价值
耿彪,孙珍贵,汪丽静,陈兴无
皖南医学院第一附属医院呼吸与危重症医学科,芜湖 241001
尽管分子靶向治疗和免疫治疗极大地提高了肺癌患者的生存期,然而肺癌仍然是我国病死率较高的恶性肿瘤之一,其中非小细胞肺癌(NSCLC)占所有肺癌病理类型的比例最高[1]。由于大多数患者发现肺部肿瘤时已处于疾病晚期,导致无法进行手术根治治疗,患者治疗效果较差、总生存期短。免疫检查点抑制剂(ICBs)因其在肿瘤治疗中的显著临床疗效而备受瞩目。新近的研究发现,抗程序性细胞死亡蛋白-1(PD-1)/程序性细胞死亡蛋白配体1(PD-L1)的抗体帕博利珠单抗或纳武利尤单抗治疗过程中产生的耐药概率约为60%,而靶向细胞毒性T淋巴细胞相关蛋白-4(CTLA-4)的抗体伊匹木单抗治疗患者的有效率仅约为15%。ICBs通过启动并激活肿瘤微环境内的效应T细胞发挥抗肿瘤作用,因此,ICBs的治疗效果与肿瘤免疫微环境特征密切相关,免疫细胞浸润水平失调和免疫细胞功能异常是影响肿瘤免疫疗效的一个重要原因[2]。研究认为免疫治疗的阳性反应通常依赖于肿瘤细胞和肿瘤微环境中免疫调节剂之间的动态相互作用[2]。越来越多研究显示肿瘤微环境的抑制性变化及异质性特点对肿瘤的发生发展、疗效差别及耐药性有巨大影响[3]。肺癌免疫治疗常用的疗效预测标志物主要包括肿瘤细胞PD-L1表达水平、肿瘤浸润性淋巴细胞(TIL),肿瘤细胞高表达PD-L1以及高淋巴细胞浸润往往提示免疫治疗的疗效更为显著[3]。尽管NSCLC患者接受PD-1、PD-L1免疫检查点抑制剂的治疗疗效与肿瘤细胞PD-L1的表达水平相关,但是PD-L1的表达伴随肿瘤发生发展、肿瘤细胞空间表达的异质性而改变,从而限制其对疗效判断的精准性[3]。近年来的研究显示,血小板与淋巴细胞比值(PLR)能够反映全身非特异性系统性炎症的激活情况[4]。多项研究报道表明PLR水平变化与多种恶性肿瘤的肿瘤负荷相关并且影响治疗疗效以及预后[5]。目前关于PLR与PD-1抑制剂联合化疗疗效的关系研究较少,因此,本研究的目的主要探讨治疗前血液PLR对晚期非小细胞肺癌患者接受PD-1抑制剂联合化疗治疗的应用价值,为临床诊疗提供理论参考。
1 资料与方法
1.1 一般资料 回顾性分析2020年1月至2022年1月皖南医学院第一附属医院呼吸与危重症医学科收治的90例晚期NSCLC患者病历资料。纳入标准:(1)经病理学或细胞学诊断为NSCLC;(2)按国际肺癌研究协会(IASLC)第7版肺癌分期为Ⅲ、Ⅳ期;(3)接受6个周期的PD-1抑制剂联合化疗。排除标准:(1)NSCLC伴有驱动基因阳性(表皮生长因子受体、间变性淋巴瘤激酶、C-ros原癌基因1酪氨酸激酶);(2)NSCLC手术后患者。肺鳞癌患者予以帕博利珠单抗200 mg,d1;紫杉醇酯质体,150 mg/m2,d1;卡铂:AUC=5,d1;静脉滴注,每21 d为1个周期。肺腺癌患者予以卡瑞利株单抗 200 mg,d1;培美曲塞:500 mg/m2,d1;卡铂:AUC=5,d1;静脉滴注,每21 d为1个周期。按上述标准,共90例患者纳入研究。
1.2 疗效评定 根据实体瘤疗效评定标准:完全缓解(CR):肿瘤病灶完全消失超过4周;部分缓解(PR):肿瘤最大直径及最大垂直直径的乘积缩小达50%,持续超过4周;稳定(SD):肿瘤两径乘积缩小不超过50%,增大不超过25%,持续超过1个月;进展(PD):肿瘤病灶两径乘积增大>25%,或出现新病灶。以完全缓解和部分缓解为临床有效(CR+PR),稳定和进展为无效(SD+PD)。客观缓解率(ORR)=(CR+PR)/(CR+PR+SD+PD)。疾病控制率(DCR)=(CR+PR+SD)/(CR+PR+SD+PD)
1.3 随访 通过收集肺癌患者的住院及门诊病历、影像学资料以及通讯联系等方式对所有患者进行定期随访。随访内容主要包括患者肿瘤的治疗效果以及预后生存情况。每1个月随访1次,随访时间截至2023年1月31日。
1.4 统计学方法 采用SPSS 22.0统计学软件分析数据。计数资料以例数及百分比表示,组间比较采用χ2检验;采用Kaplan-Meier法评估患者生存率和绘制生存曲线,各组间生存率比较采用Log-rank 检验;采用Cox 比例风险回归模型分析多个因素对生存时间的影响。P<0.05为差异有统计学意义。
2 结果
2.1 患者基线特征 依据大样本荟萃分析[6]表明,PLR值=200是NSCLC患者全身系统性炎症反应的临界值,因此,根据上述结论,90例患者中有43例(47.7%)患者PLR<200,47例(52.3%)患者PLR≥200。年龄≥60岁有57例(63.3%)患者,<60岁有33例(36.7%)患者;男性患者65例(72.2%),女性患者25例(28.7%);吸烟59例(65.6%);肺鳞癌66例(73.3%),肺腺癌24例(26.7%);Ⅲ期患者58例(64.4%),Ⅳ期32例(35.6%);肿瘤低分化20例(22.2%),中分化48例(53.3%),高分化22例(24.5%);PD-L1表达(1%~49%)有34例(37.8%)患者,PD-L1表达(≥50%)有56例(62.2%)患者;使用帕博利珠单抗为66例(73.3%),使用卡瑞利珠单抗为24例(26.7%)。统计分析显示,PLR值与患者的性别、年龄、病理分期、肿瘤分化程度、肿瘤组织学类型、吸烟史、PD-L1表达无相关性。
2.2 PLR与治疗效果的关系 90例患者经过PD-1抑制剂联合化疗治疗后,有18例(20%)患者CR,42例(46.7%)患者PR,14例(15.6%)患者达到SD,另有16例(17.7%)患者发生疾病PD,客观缓解率为66.7%,疾病控制率为82.2%。低PLR组的客观缓解率、疾病控制率分别为79.1%、95.3%,高PLR组的客观缓解率、疾病控制率分别为55.3%、70.2%,统计分析显示,低PLR组经过PD-1抑制剂联合化疗治疗后其客观缓解率(χ2=4.595,P=0.032)、疾病控制率(χ2=9.706,P=0.002)均高于高PLR组。
2.3 PLR与患者PFS、OS的关系 低PLR组患者的中位PFS为15.5个月,中位OS为28.5个月,而高PLR组患者的中位PFS为11.1个月,中位OS为21.3个月,Kaplan- Meier分析显示,低PLR组PFS、OS均比高PLR组延长(见图1A和图1B)。多因素Cox 回归模型分析表明,PLR是影响患者PFS(HR=3.312,95%CI:1.653~2.962)、OS(HR=1.312,95%CI:1.034~3.112)的独立危险因素(见表1、表2)。

表1 90例非小细胞肺癌患者PFS的多因素分析
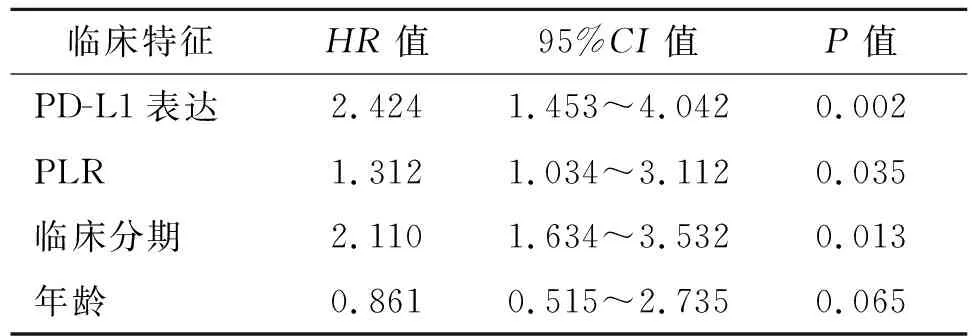
表2 90例非小细胞肺癌患者OS的多因素分析

注:PLR为血小板与淋巴细胞比值;NSCLC为非小细胞肺癌。图1 PLR对NSCLC患者无进展生存率与总生存率的影响
3 讨论
越来越多的基础和临床研究表明,肿瘤与周围环境相互依存,相互促进。肿瘤微环境中的免疫炎症反应失代偿也会影响肿瘤细胞对免疫细胞的免疫应答,从而对免疫检查点抑制剂治疗产生影响。效应性免疫细胞、抑制性免疫细胞等均在不同环节与肿瘤细胞增殖和侵袭增加、耐药性增加和抗肿瘤免疫力降低有关,所以阐明肿瘤微环境网络中各方面协调或抑制免疫反应的机制对判断免疫耐药十分重要。肿瘤微环境中免疫调控细胞、成纤维细胞、淋巴细胞、血小板是参与肿瘤免疫炎症反应调控的重要成员[7]。目前研究已经证实免疫细胞失调是肿瘤进展的关键性因素,肿瘤免疫微环境中的免疫细胞通过分泌多种细胞因子和免疫调控分子,协调抗肿瘤和促肿瘤免疫反应,因此,免疫细胞的分布和组成是发挥调控肿瘤进展的关键性因素。血小板和淋巴细胞是系统性炎症反应的重要组成部分[7]。血小板可以释放多种炎症因子及趋化因子进而对肿瘤微环境进行调控,促进免疫抑制微环境的形成,从而使肿瘤细胞逃脱淋巴细胞的攻击。另一方面,血小板也可以直接和肿瘤细胞发生相互作用,促进肿瘤细胞相互作用从而粘连成团,导致肿瘤细胞对淋巴细胞的攻击发生免疫耐受[8]。研究发现,血小板通过调控多种促肿瘤信号从而促进肿瘤的发生发展、远处转移侵袭,肿瘤患者外周血血小板数目异常增多常常提示肿瘤患者的预后不良[8]。肿瘤细胞可以释放生长因子、白细胞介素6等多种生物活性分子激活血小板。激活的血小板分泌转化生长因子β、血小板源性生长因子等炎症因子促进肿瘤微血管生成,抑制T细胞功能,促进肿瘤细胞增殖和转移[9]。另一方面,血小板可以和肿瘤细胞相互作用,在肿瘤细胞表面形成一层血小板-纤维蛋白负荷物,从而逃避免疫细胞监视和细胞杀伤。淋巴细胞是抗肿瘤免疫的主要功能细胞,起到肿瘤免疫监视、抑制肿瘤浸润的重要作用。淋巴细胞可以通过释放细胞程序性死亡因子诱导细胞死亡,除此之外,淋巴细胞也可以通过协调中性粒细胞、巨噬细胞、T细胞的功能从而建立抗肿瘤免疫反应,因此,肺癌患者外周血循环中淋巴细胞绝对数下降致使淋巴细胞介导的抗肿瘤细胞免疫反应失调[10]。PLR可以反映全身炎症反应的活化情况。免疫炎症反应通过相互关联、相互作用形成肿瘤免疫微环境。研究发现,血液循环中炎症反应相关细胞比例的变化可以预测肿瘤患者的预后。在非小细胞肺癌患者中,高PLR与肿瘤临床病理参数相关,淋巴结转移、远处转移、肿瘤分期越晚则患者的PLR就越高[10]。另一方面,研究也表明PLR升高与晚期肺癌患者接受包括PD-1/PD-L1抑制剂在内的免疫治疗反应不佳相关[11]。本研究同样表明,高PLR患者经过PD-1抑制剂联合化疗后其客观缓解率、疾病控制率比低PLR降低。同时进一步分析了PLR与患者PFS、OS的关系,统计分析发现低PLR组患者的中位PFS为15.5个月,中位OS为28.5个月,而高PLR组患者的中位PFS为11.1个月,中位OS为21.3个月,Kaplan-Meier分析显示,低PLR组PFS、OS均比高PLR组延长。Meta分析表明血液PLR对接受PD-1/PD-L1抑制剂的NSCLC患者的存在预后价值[6]。另一方面,PLR也可以反映肺癌患者术前辅助免疫治疗的疗效判断,肺癌患者PLR升高提示血小板数量异常引起的炎症反应过度增强,淋巴细胞的抗肿瘤功能降低,导致肿瘤增殖和转移等恶性结果[11]。
综上所述,肺癌患者治疗前PLR升高可能是PD-1抑制剂联合化疗治疗NSCLC患者预后不良的危险因素,因此,可根据血液PLR的高低初步判断NSCLC患者接受PD-1抑制剂联合化疗治疗的疗效情况。

