噬菌体疗法在胞内病原菌治疗中的挑战与思考
王凯,张婉,黄云海,张立新,娄春波
(1 中国科学院深圳先进技术研究院,细胞与基因线路设计中心,广东 深圳 518000; 2 上海药明生物技术有限公司,上海 200131; 3 华东理工大学生物工程学院,生物反应器工程国家重点实验室,上海 200237)
胞内病原菌可以侵入并在哺乳动物细胞内生存,通过调节宿主细胞内环境,创造合适的生态位[1‑2]。根据生活史,胞内病原菌可分为专性胞内细菌(obligatory intracellular bacteria)和兼性胞内细菌(facultative intracellular bacteria)。前者只能在宿主细胞内生长和繁殖,如沙眼衣原体(Chlamydia trachomatis)和伯氏柯克氏杆菌(Coxiella burneti);而兼性胞内细菌除了可以寄生在胞内,也可在宿主细胞间隙、血液、淋巴液、组织液等体液中生长繁殖,如结核分枝杆菌(Mycobacterium tuberculosis)、肠沙门氏菌(Salmonella enterica)和单增李斯特氏菌(Listeria monocytogenes)[3‑7]。
由于受到宿主细胞膜的保护,胞内病原菌难以被免疫系统和抗生素接触到,因而不容易被杀死,治疗失败的风险很高,危害人体健康甚至生命安全[8‑10]。以结核病为例,结核病是由胞内致病菌结核分枝杆菌引起的传染性疾病,它是全球第十大死因,也是因单一病原体感染造成的主要死因。据世界卫生组织《2022 年全球结核病报告》,2021 年全球约有1060 万人患结核病,导致大约160万人死亡[11]。目前防治结核病最常用的是化学疗法,利福平和异烟肼是使用最广泛的强效抗结核药物[12‑13],然而随着感染的迅速传播、药物的长期不规范使用,结核分枝杆菌的耐药性问题日益严重。2020~2021 年,耐药结核病发病率上升了3%,且新增45 万例耐利福平结核病新病例,这是多年来首次报告耐药结核病患者数和患者总数同时增加,意味着亟需提出新的包括结核分枝杆菌在内的胞内病原菌防治办法[11]。噬菌体疗法就是富有前途的策略之一[14]。噬菌体对病原菌具有很强的选择性,可以特异性裂解靶细菌而不影响宿主体细胞和其他正常菌群,且治疗效果不因细菌耐受抗生素而改变,因此噬菌体疗法在治疗胞内耐药病原菌引起的疾病方面具有巨大的潜力[15]。近年来,噬菌体疗法在治疗胞内病原菌,尤其是胞内耐药病原菌方面已经有一些成功的案例,展现了其独到的优势,当然也有不尽如人意之处[16‑17]。在这篇综述中,我们将介绍噬菌体疗法应对胞内耐药病原菌的前景及需要克服的困难,并将讨论这一领域未来需要突破的瓶颈以及可能的努力方向。
1 胞内病原菌的感染机制及耐药性
1.1 胞内病原菌的感染机制
胞内病原菌可以通过多种方式跨越细胞膜屏障进入细胞内[18‑19]。对于具有内吞特性的巨噬细胞,胞内病原菌就可以通过细胞本身的吞噬作用进入细胞。以结核分枝杆菌为例,该菌在依次通过鼻、咽、上呼吸道后到达下呼吸道,这里有丰富的巨噬细胞。巨噬细胞通过多种受体识别结核分枝杆菌并将其通过内吞体的形式吞入细胞内[20‑21]。而对于不具有吞噬作用的细胞,胞内病原菌则进化出了其他入侵细胞的策略。如李斯特氏菌利用表面的入侵蛋白InlA 和InlB 分别与其宿主细胞表面受体E‑钙黏蛋白和酪氨酸激酶Met(mesenchymal epithelial transition factor)相互作用,触发宿主细胞内吞效应分子的募集,肌醇磷脂代谢的颠覆和肌动蛋白细胞骨架的重塑,从而导致细菌内吞,这一过程又称作拉链模式[22‑23];志贺氏菌的Ⅲ型分泌器将含有IPAB和IPAC蛋白的结构插入细胞膜,然后诱导细菌‑宿主细胞相互作用部位的细胞骨架重组来入侵上皮细胞[24‑25]。
通过吞噬作用进入细胞的病原菌存在于被称为吞噬体和/或核内体的特殊细胞内区,巨噬细胞倾向于将这些囊泡和溶酶体等融合,通过低pH环境和溶菌酶杀死病原菌[26‑28]。为了生存下来,病原体进化出了相应策略,例如结核分枝杆菌通过分泌的蛋白酪氨酸磷酸酶(protein tyrosine phosphatase)PtpA与巨噬细胞空泡ATP 酶(V‑ATPase)的H 亚单位结合,抑制吞噬小体酸化;还可以通过其表面的脂阿拉伯‑甘露醇聚糖(lipoarabinomannan)阻止吞噬小体成熟,限制吞噬小体‑溶酶体(P‑L)融合从而在巨噬细胞中存活[29‑30]。而布鲁氏菌(Brucellae)、 衣原体(Chlamydia) 和军团菌(Legionellae)会使自身所在的液泡迅速从吞噬溶酶体途径中分离出来,避免被溶解失活[31‑34]。
为了在细胞中栖息和复制,细菌还需要避免被宿主免疫系统消除,因此许多细菌已经进化出包括阻止免疫系统识别胞内病原菌以及主动抑制免疫反应下游信号在内的策略来逃脱免疫系统的惩罚,如单增李斯特氏菌可以通过分泌毒力因子InlC及在细胞感染期间干扰NF‑κB的激活来抑制宿主免疫反应[35‑40]。
总之,胞内病原菌进化出了很多策略才得以跨越细胞膜屏障,并且经受住免疫系统的考验在宿主细胞内生存繁殖。
1.2 胞内病原菌的耐药性
抗生素对胞内病原菌的抑菌活性取决于几个因素,其中就包括抗生素的作用机制和药代动力学特性。若要发挥抑菌作用,抗生素首先必须通过全身运输途径到达受感染细胞所在的组织。其次,抗生素需要穿过细胞膜到达细胞内并在细胞内积累到足够的浓度[41‑44]。
宿主细胞的细胞膜会阻碍抗生素胞内浓度的积累,反过来成为胞内病原菌的有力屏障,而低于致死浓度的抗生素往往容易促进耐药表型的出现,导致抗生素治疗失败[45]。与之相一致的是,在目前发表的工作中,耐药基因在胞内病原菌间水平转移甚少见于报道[46],而与之相反,通过基因突变获得耐药性则更常见。这些突变可能发生在核糖体蛋白编码基因、外排泵编码基因等等,从而对不同作用机制的抗生素产生耐药性,其结果就是出现能够耐受多种抗生素的胞内耐药菌[47‑51]。
此外,胞内病原菌的持续感染还与病原菌进入保持态(persisters)有关。抗生素会引起病原菌的损伤,从而导致其发生生物应激反应,转变为复制代谢减缓的特殊状态, 称为保持态(persisters)。保持态病原菌通常生长缓慢甚至停滞,但其对抗生素耐受性高,并且后续可以重新恢复生长。保持态病原菌的存在可以导致持续性细菌感染,并且与治疗期间出现抗生素耐药性的风险增加有关[42‑57]。
以结核分枝杆菌为例,结核分枝杆菌是危害严重且具有代表性的胞内致病菌。它通过巨噬细胞的吞噬作用进入胞内,在巨噬细胞内生存并将巨噬细胞作为自己扩增的巢穴。它可以通过不同基因的突变耐受多种抗生素,如katG基因突变与异烟肼耐药相关;rpoB基因突变与利福平耐药相关;glpK基因突变与贝达喹啉耐药相关等等[58‑60]。而不同突变位点的积累最终会导致MDR‑TB(multidrug‑resistant tuberculosis)菌株的产生。此外,结核分枝杆菌在感染了支气管的巨噬细胞之后,还会进入肺部间质,引起机体更强烈的天然免疫与适应性免疫,形成肉芽肿组织。肉芽肿组织对结核杆菌扩散起到了限制作用,但同时也限制了抗生素接触结核分枝杆菌发挥抑菌作用,从而导致治疗失败[61‑63]。在冠状病毒大流行之前,结核病一直是因单一病原体感染导致死亡的第一大原因,致死率在艾滋病和梅毒之上。而结核分枝杆菌的耐药性则使得这一病症威胁更大。目前,在世界范围内,各国耐药结核病的治疗成功率通常在50%~75%之间,在可获得数据的最新患者队列中为60%,治愈率仍处于较低水平[11]。
事实上,由胞内耐药病原体引起的感染有着难以治疗、失败风险高且治疗选择有限的特点,严重威胁着人类的生命健康安全。鉴于此,人类需要开发用于消除这些病原菌的新策略。
2 噬菌体疗法及其巨大潜力
噬菌体是指从环境中分离出的一类寄生并侵害细菌的病毒[64]。由于其对靶细菌特异性强作用效果好,噬菌体在发现之初即被用于细菌感染的临床治疗[65]。如1921 年,在法国巴黎Hôpital des Enfants‑Malades医院,首次成功应用噬菌体治愈了儿童痢疾[66]。然而,由于缺乏对噬菌体生物性质的了解以及随后抗生素的兴起限制了噬菌体作为抗菌药物的广泛使用,噬菌体疗法随即只在波兰、苏联等地被研究和应用[67‑68]。然而,随着现在细菌耐药问题日益严峻,且新型抗生素开发速度难以满足临床需求,噬菌体疗法治疗细菌感染再次受到了世界范围内科研人员的广泛重视[69‑70]。
噬菌体通过宿主细菌表面受体特异性识别宿主细菌,然后附着在宿主细菌表面,将自身的遗传物质注入宿主细胞。随后,通过劫持宿主转录翻译机器进行复制包装等一系列活动,形成子代噬菌体,最后裂解宿主细菌,释放子代噬菌体[71],这一过程对于宿主细菌而言是致死性的(图1)。由于独特的作用机制,噬菌体疗法相对于传统的抗生素疗法具有诸多优势。第一,由于噬菌体抑菌机制和抗生素抑菌机制差异很大,所以噬菌体疗法对于胞内耐药病原菌仍然具有显著抑制效果。第二,噬菌体治疗具有较高的安全性和治疗效率。噬菌体对于靶细菌具有显著特异性,不会感染哺乳动物细胞,对人体天然微生物菌群影响小[72]。此外,噬菌体可以在裂解病原菌的同时复制自身,释放出子代噬菌体持续侵染裂解病原菌,直到宿主病原菌密度显著下降,这意味着噬菌体将比传统药物治疗需要更少的剂量就可以获得很好的治疗效果。第三,与抗生素相比,噬菌体的分离更加容易,使用简单廉价的技术就可以将噬菌体从环境中分离出来[73‑74]。细菌也会出现噬菌体耐受表型,如改变表面受体阻碍噬菌体识别和吸附[75]。然而,噬菌体和细菌宿主共存于自然界,噬菌体可以通过共同进化克服细菌的耐受性,因此,理论上总是可以分离出新的噬菌体应对细菌感染[76]。在实际应用中,也可以使用针对同一种病原菌的几种噬菌体的混合剂,称为噬菌体鸡尾酒(phage cocktails),减少噬菌体耐受性的产生[77‑79]。

图1 噬菌体裂解细菌Fig. 1 The process of bacteriophage lysis of bacteria
在后抗生素时代,噬菌体疗法正在成为治疗胞内耐药病原菌感染者的最后手段。2019年,Hatfull小组的Dedrick等[80]报道在临床上使用噬菌体鸡尾酒治疗由耐药脓肿分枝杆菌(Mycobacterium abscessus) 引起的播散性感染(disseminated infection)。该囊性纤维化(cystic fibrosis)患者是一名15 岁的女孩,她在双侧肺移植后出现感染。在该研究中,噬菌体鸡尾酒包括一个原生噬菌体(Muddy)和两个工程化噬菌体(BPsΔ33HTH‑HRM10 和ZoeJΔ45)。噬菌体治疗使患者皮肤结节缩小,胸骨伤口感染改善,腹部淋巴结减少,临床总体改善,没有观察到对噬菌体的耐药性,也没有发生免疫中和反应。这是首次将噬菌体用于治疗人类分枝杆菌感染,也是首次使用工程化噬菌体,证实了工程化噬菌体的安全性及其治疗由胞内病原菌引起的感染的能力。与此相类似,2022年,在Hatfull教授的指导下,Nick等[81]将噬菌体D29_HRMGD40和噬菌体BPsΔ33HTH_HRM10组成的噬菌体鸡尾酒静脉注射给一名患有难治性(treatment‑refractory)脓肿分枝杆菌肺部感染和严重囊性纤维性肺部疾病(severe cystic fibrosis lung disease)的男性。噬菌体在一年的治疗过程中裂解了病原菌,难治性脓肿分枝杆菌肺部感染在一年的时间里被根除,随后进行的肺移植获得成功。龟分枝杆菌(Mycobacterium chelonae)是免疫功能低下患者(immunocompromised patients)慢性播散性皮肤感染的病因。因为长期的抗生素治疗会导致显著的毒性和进一步的抗生素耐药,治疗多重耐药的龟分枝杆菌感染是富有挑战性的。2022 年,Hatfull小组的Little 等[82]报道了使用单一噬菌体(Muddy)结合抗生素和外科治疗来治疗一例播散性皮肤龟分枝杆菌感染的新方法。患者之前接受了广泛的抗菌药治疗与手术清创,然而,其皮肤损伤和活组织检查仍呈阳性,有坏死性肉芽肿和大量分枝杆菌染色的证据。在开始噬菌体治疗后,其皮肤病变有显著改善。此外,治疗后2 个月和5个月的两次活组织检查显示没有肉芽肿。患者没有出现与噬菌体疗法相关的不良反应,已经成功地在家中实施了这种疗法超过6个月。
此外还有一些利用噬菌体治疗胞内病原菌感染的研究,基本都处于临床前研究阶段(表1)。这些研究的结果将为噬菌体疗法的临床实践做出贡献。

表1 噬菌体治疗胞内病原菌感染[16‑17,83‑99]Table 1 Phages against intracellular bacterial infection.
3 噬菌体疗法面临的挑战
虽然噬菌体疗法为治疗胞内耐药病原菌带来了新的希望,但在实际应用中仍然面临着诸多挑战。第一,噬菌体对靶细菌的特异性很强,因此每次使用噬菌体疗法前都要先确定患者感染的病原菌,然后才能根据病原菌筛选出具有特异性的噬菌体进行扩大培养[100‑101],限制了其临床上的大规模应用。第二,由于噬菌体独特的注射侵染机制,噬菌体和病原菌之间存在基因水平转移的可能性,因此在筛选噬菌体时需要尽量选择已测序噬菌体以避免噬菌体将携带的抗生素抗性基因、毒性基因传递给病原菌,从而导致细菌宿主的毒力或耐药性增强[102]。这些因素综合在一起就使得噬菌体治疗通用性不强,难以大规模推广,而且每次使用都可能因为筛选阶段过长而错过最佳治疗时间。第三,筛选好的噬菌体在治疗过程中还需要递送到病灶部位,在这个过程中噬菌体需要经受机体复杂生理环境以及免疫系统的考验。例如,2016 年,Sarker 等[103]曾通过让病人口服两种不同的噬菌体鸡尾酒的方式尝试治疗由致病性大肠杆菌引起的急性脱水性腹泻,结果发现,服用噬菌体鸡尾酒的实验组与服用安慰剂的对照组并没有显著差异。其原因可能是口服的噬菌体颗粒无法在通过低pH 的胃酸环境后存活,存活下来的噬菌体最终可能因为浓度过低导致治疗无效[103]。而采用静脉注射的给药方式又容易受到人体免疫系统的影响,给治疗效果增加了不确定性。2019年,Hatfull 组[80]使用噬菌体疗法成功治疗脓肿分枝杆菌感染。然而在2021 年,该团队使用同样方法对另一位患者进行治疗时,患者对噬菌体产生强烈的中和抗体反应,噬菌体被免疫系统清除,导致治疗失败[104]。
除了上述限制外,开展胞内噬菌体治疗还面临一大难题:噬菌体如何进入真核细胞并有效释放。以噬菌体D29 为例,其头部包含49 000 个碱基对的双链DNA 基因组,平均直径为65 nm,尾长在150 nm 和450 nm 之间,显然并不能通过简单扩散内化(internalization)进入真核细胞并接触到胞内病原菌从而发挥抑菌作用[105‑106]。虽然,理论上噬菌体可以通过吞噬作用、内吞作用、巨胞饮等方式内化进入真核细胞[107],但是这样的进入方式无法保证摄取效率,胞内噬菌体数量可能无法达到足够的抑菌浓度,而且如果噬菌体不能及时从内体中逃逸,将会很快被分解失活[108‑109]。例如,2002 年就有报道指出,将TM4 噬菌体添加到感染了鸟分枝杆菌的巨噬细胞单层中,并不能抑制胞内病原菌,而只有通过载体将噬菌体递送到细胞内才可以有效抑制胞内病原菌[16]。
4 噬菌体疗法的未来展望
噬菌体疗法在治疗胞内耐药病原菌方面具有巨大潜力,但也面临着以下困难:①噬菌体难以高效内化进入真核细胞并有效接触到胞内病原菌;②对噬菌体特异性识别病原菌的机制缺乏深入了解,噬菌体疗法的使用缺乏理性指导;③对免疫系统的角色缺乏充分的认识,免疫反应会影响噬菌体疗法的疗效。因此,我们仍需要投入更多的努力来为噬菌体疗法的胞内应用铺平道路。
4.1 解决噬菌体入胞难题
首先必须要解决的是噬菌体难以高效内化进入真核细胞内且有效释放,并接触胞内病原菌的问题。由于胞内病原菌常存在于宿主细胞内的特殊囊泡结构中,而噬菌体自身并不容易穿膜内化接触到病原菌,因此必须开发行之有效的策略将噬菌体高效内化,并使其可以充分释放,接触胞内病原菌发挥抑菌作用(图2)。第一种策略可以考虑利用无致病性的天然细菌作为载体,将噬菌体运输进细胞。2002年,Broxmeyer等[16]利用非致病性细菌耻垢分枝杆菌(Mycobacterium smegmatis)作为载体,携带噬菌体TM4 进入感染了鸟分枝杆菌(Mycobacterium avium)的巨噬细胞,噬菌体TM4很好地抑制了胞内的鸟分枝杆菌。然而,需要注意的是,只使用一种噬菌体进行治疗容易出现对噬菌体的耐受性,而如果考虑噬菌体鸡尾酒,那么能满足多种噬菌体同时运输的自然载体很难通过筛选得到[110‑111],同时考虑到安全性的问题,尽管天然细菌是目前比较切实可行的载体选择,但还应致力于开发人工合成的有机大分子作为运输噬菌体穿过细胞膜的载体,如壳聚糖‑藻酸盐‑CaCl2化合物体系、聚合物MPs 和脂质体等。2008 年,Ma 等[112]利用壳聚糖‑藻酸盐‑CaCl2将沙门氏菌特异性噬菌体Felix O1微囊化,增加了噬菌体在模拟胃液或胆汁中的稳定性;在此基础上,Agarwal 等[113]使用改良的聚合物MPs 将噬菌体靶向递送到肺部,有效改善了囊性纤维化小鼠的铜绿假单胞菌感染和相关炎症。与其他人工载体相比,脂质体具有良好的细胞穿透特性。2015 年,Neith 等[114]报告了将模式噬菌体λeyfp 和分枝杆菌噬菌体 TM4 有效封装到巨型脂质体中,使得这些噬菌体被真核细胞高效吸收。总之,随着包装效率、包装空间大小以及材料安全性的不断提升,人工载体将助力解决噬菌体入胞释放的难题。
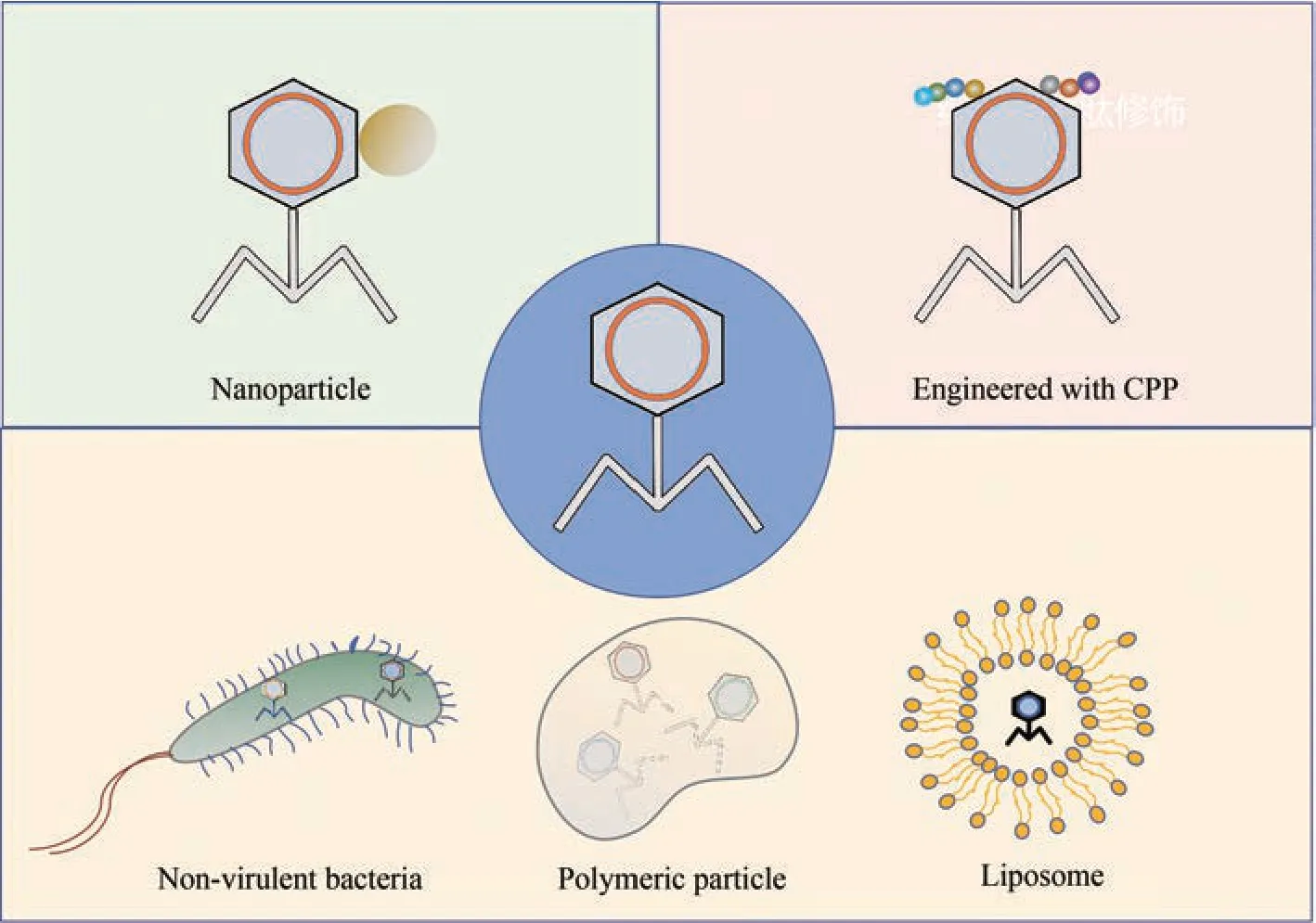
图2 促进细胞摄取噬菌体的策略Fig. 2 Strategies used to facilitate cellular uptake of phage
第二种策略是在对大分子跨膜机制不断认识的基础上,开发新的跨膜方法。例如可以采用细胞穿透肽(cell penetrating peptide, CPP)修饰来促进噬菌体内化到细胞中。细胞穿透肽富含精氨酸和赖氨酸等碱性氨基酸,可以通过易位或内吞进行跨膜转移并将寡核苷酸等大分子运送到细胞中,有效提高噬菌体内化效率[115]。例如Bhattarai等[116]使用常见的细胞穿透肽RGD(Arginine‑Glycine‑Aspartic acid)肽修饰丝状(filamentous)噬菌体M13,与野生型相比,重组噬菌体进入HeLa 299 细胞的内化效率提高了76%。虽然这种方法目前主要用于丝状噬菌体。而丝状噬菌体由于其非裂解性生命周期,不作为理想抗菌剂用于噬菌体治疗。但随着技术的拓展,利用细胞穿透肽修饰来促进噬菌体内化的策略,不失为一种可行的策略。而将来随着对于跨膜运输机制认识的深入,也必将有更多的类似策略被应用到噬菌体穿膜内化上来。
第三种策略可以考虑使用纳米级材料对噬菌体进行修饰,改变噬菌体表面电荷而促进噬菌体的内化效率。例如2019 年,Fulgione 等[117]使用羟基磷灰石(hydroxyapatite, HA)纳米晶体作为噬菌体SRφ1 运载工具来治疗胞内沙门氏菌(Salmonella)感染,数据表明经过24 h 的处理,HA‑SRφ1 复合物能够成功内化到HepG2 细胞的细胞质中,但单独的SRφ1则不能。随后的Zeta电位分析表明,HA 中和了SRφ1 表面的负电荷。2022 年,刘尽尧课题组[118]使用阳离子聚合物通过静电相互作用选择性地覆盖带负电荷的噬菌体头部而不影响带正电荷的尾部,从而产生活力基本不受影响的电荷反转噬菌体。由于纳米帽子的表面正电荷和质子海绵效应,加帽的噬菌体能够进入肠上皮细胞并从内体逃逸进而裂解细胞内藏匿的沙门氏菌 (Salmonella)。将来在不影响噬菌体活性的基础上,研究和开发新的、对人体无害的修饰材料,也是非常可行的发展方向。
4.2 噬菌体受体研究及噬菌体疗法的理性设计
在实现噬菌体内化入胞并有效释放的基础上,噬菌体疗法还应当向更加理性化方向发展。到目前为止,对于细菌表面上参与噬菌体吸附的受体研究甚少见于报道,在使用噬菌体鸡尾酒疗法时的依据往往是根据患者感染的病原菌选择几种有裂解作用的噬菌体混合,对于噬菌体识别怎样的位点、各自识别的位点是否重叠缺乏理性认识,这是导致噬菌体疗法要在筛选噬菌体耗费大量时间以及商用噬菌体鸡尾酒疗效不佳的根源[119],而未来充分研究认识病原菌表面噬菌体识别吸附受体,建立详尽可查的受体信息数据库必将促进噬菌体疗法的实际应用。比如,在此基础上我们就可以理性选择噬菌体,对噬菌体鸡尾酒进行优化设计,Yang等[120]就曾报道将有效地杀死铜绿假单胞菌O抗原缺失突变体的噬菌体phiYY和能够用截短的O 抗原感染突变体的PaoP5‑m1 与另外3 种广泛宿主范围的铜绿假单胞菌噬菌体混合来生成鸡尾酒。噬菌体混合物可有效对抗铜绿假单胞菌的多种临床分离株,并在短期内限制了噬菌体抗性突变体的出现。此外,我们还可以畅想运用合成生物学和基因工程技术以合适的噬菌体为底盘,设计受体结合蛋白及其相关结构域来重构噬菌体特异性并避免耐受性。
4.3 自然界噬菌体资源开发与噬菌体重组改造
虽然噬菌体广泛存在于地球上,然而目前可用于治疗的噬菌体数量较少[121]。因此,在自然界寻找更多的噬菌体,对其进行测序、培养,从而扩大噬菌体资源库是很有必要的。而且值得注意的是,现在噬菌体疗法中使用的噬菌体大多是烈性噬菌体,而温和噬菌体则在自然界更为常见,而且由于温和噬菌体的溶原化特性,使得它们中的很多其实已经得到测序。结合生物信息学预测识别并找出这些温和噬菌体,并尝试对其进行开发,必将进一步扩充治疗可用的噬菌体资源库[122]。
此外,随着基因改造技术及合成生物学技术的发展,对噬菌体资源的开发离不开对噬菌体本身进行工程化改造,构建功能独特的重组噬菌体。例如,可以通过敲除溶原化基因将温和噬菌体改造为烈性噬菌体,然后用来裂解病原菌起到抑菌效果[123]。此外,还可以利用噬菌体可以将遗传物质带入病原菌的特性,使噬菌体携带杀菌效力更强的毒基因或其他基因线路,构建更有效的重组噬菌体[124]。
5 总 结
胞内病原菌可以通过多种方式跨越细胞膜屏障侵入真核细胞内,并进化出包括阻止免疫系统识别以及主动抑制免疫反应下游信号在内的策略来逃脱免疫系统的惩罚,因而不容易被杀死,对人体健康构成严重威胁。目前对抗胞内病原菌的主要手段还是抗生素治疗。然而,胞内病原菌可以通过基因突变获得耐药性。这些突变可能发生在核糖体蛋白编码基因、外排泵编码基因等等,从而对不同作用机制的抗生素产生耐药性,其结果就是出现能够耐受多种抗生素的胞内耐药菌。而半透性细胞膜会妨碍抗生素胞内浓度的积累,亚致死浓度的抗生素往往会促进耐药表型的出现。此外抗生素会引起病原菌的损伤,从而导致其因生物应激反应而变得复制代谢减缓,但对抗生素耐受性高的特殊状态,也会增加病菌出现耐药表型的风险。开发新的抑菌策略来对抗胞内耐药病原菌是很有必要的。
噬菌体从发现之初即被用于细菌感染的临床治疗。然而,由于缺乏对噬菌体生物性质的了解以及随后抗生素的兴起限制了噬菌体作为抗菌药物的应用。随着细菌耐药问题日益严峻且新型抗生素开发速度难以满足临床需求,噬菌体疗法治疗细菌感染再次受到了世界范围内科研人员的广泛重视。由于独特的作用机制,对于胞内耐药病原菌甚至是耐多药胞内病原菌,噬菌体疗法仍然具有显著效果。而且,噬菌体疗法还具有安全性好、副作用小等诸多优点。噬菌体疗法有望成为治疗抗生素耐药性感染患者的最后手段。
噬菌体疗法的应用虽然为对抗细胞内耐药病原体带来了新的希望,但同时也面临着诸多挑战。由于噬菌体对靶细菌的特异性很强,噬菌体疗法往往作为一种定制方案使用,限制了其在临床上的大规模应用。而且,噬菌体和细菌之间存在水平基因转移的可能性,因此在筛选治疗用噬菌体时要避免使用携带抗生素抗性基因、毒性基因的噬菌体,以免导致细菌宿主的毒力增加。如何保证噬菌体在通过复杂的人体环境运输,经受免疫系统考验后保持活性到达病灶部位发挥作用也是需要考虑的问题。除此之外,使用噬菌体疗法对抗胞内病原菌时还需要意识到,噬菌体无法通过扩散进入真核细胞,必须开发相应策略使噬菌体高效率进入细胞并充分接触到细胞内病原菌才能发挥它的能力。针对噬菌体疗法面临的诸多限制,我们进行了相关的思考和讨论。使用促进内吞作用的细胞穿透肽或者能够改变噬菌体表面电荷的纳米材料对噬菌体表面进行修饰,或者使用脂质体或无毒细菌等作为载体都将有助于噬菌体输送到细胞内环境。相信随着对哺乳动物细胞摄取噬菌体机制了解的逐渐深入,还会有更多的内化入胞策略被开发出来。在解决内化入胞问题的基础上,还应当开发包括温和噬菌体在内的噬菌体资源以丰富噬菌体资源库;还可以通过基因编辑的手段增强噬菌体对细胞内感染的治疗功效。总之,胞内耐药病原菌的噬菌体疗法富有前景,大有可为。