固定化脂肪酶对邻苯二甲酸酯污染土壤的修复研究
孙建强,田 露,张安平
(浙江工业大学 环境学院,浙江 杭州 310014)
邻苯二甲酸酯(PAEs)因其增塑料效果好、生产成本低和易于加工等特点,被广泛应用于个人护理产品、食品包装、医疗器械、农用薄膜的制造与生产中[1-2]。PAEs通常以物理方式与塑料产品结合,在制造、储存和使用过程中,很容易释放到空气、水以及土壤等自然环境里[3]。PAEs已被证明是农业土壤中质量分数最多的有机污染物[4],同时农作物中也能检测出PAEs,表明农作物会从污染土壤中吸收PAEs,并通过食物链对人体健康构成威胁[5]。此外,作为一种典型的内分泌干扰物(EDC),PAEs及其代谢产物有生殖和发育毒性,PAEs长期暴露会导致人类生殖、神经和免疫系统的功能障碍[6]。因此,如何有效去除环境中积累的PAEs已成为土壤修复的重点。
目前已有一些学者对土壤中PAEs的污染开展修复研究工作,主要应用物理、化学和生物修复等技术来改变其特性以降低毒性和环境中的质量浓度,其中生物修复法因其高效、安全和廉价等优点,被认为是修复PAEs污染的主要技术[5]。微生物对PAEs的降解主要由多种酶和蛋白质参与,其中加氧酶和水解酶起着关键作用[7]。脂肪酶可作为PAEs酯键的水解酶,在特定条件下提高对PAEs的降解[8],然而游离脂肪酶容易受pH和反应温度等环境条件影响,在实际应用中很容易发生变性导致失活[9]。固定化技术作为一种实用且经济的绿色技术,可以将酶附着到惰性、不溶材料上以保存酶的活性,提高酶的稳定性和适应性[10]。生物炭作为一种经生物质在限氧供应下缓慢/快速热解产生的富含芳香族碳的材料,表现出较强的疏水性,具有高比表面积、孔隙度以及碳质量分数丰富等优点,常被作为固定化酶的载体[11-12]。生物炭固定DnBP降解菌株T7,在6 h内将DnBP的去除率从36.83%显著提高到94.39%[13]。因此,研究制备固定化酶,对于提高降解酶的稳定性和土壤中PAEs的去除率具有重要作用。笔者以邻苯二甲酸二甲酯(Di-methy phthalate,DMP)、邻苯二甲酸二乙酯(Di-ethyl phthalate,DEP)、邻苯二甲酸二异丁酯(Di-iso-butyl phthalate,DiBP)、邻苯二甲酸二正丁酯(Di-n-butyl phthalate,DnBP)、邻苯二甲酸二(2-乙基己基)酯(Di-(2-ethylhexyl) phthalate,DEHP)和邻苯二甲酸二正辛酯(Di-n-octyl phthalate,DnOP)这6种常见的PAEs作为目标污染物,以商品化脂肪酶作为PAEs降解酶,以生物炭作为固定化载体探究固定化脂肪酶的最佳制备条件。同时进一步探究不同环境条件对固定化脂肪酶去除土壤中PAEs的影响,为减少土壤PAEs污染问题提供解决思路。
1 材料和方法
1.1 仪器与设备
三重四级杆型气相色谱质谱联用仪(TQ-8040,日本Shimadzu公司);旋转蒸发仪(德国Heidolph公司);氮吹仪(美国Organomation公司);超纯水仪(美国密理博公司);分析天平(德国梅特勒-托利多公司);冷冻干燥机(山东博科生物);超声波清洗器(SK3210HP,上海科导超声仪器);旋涡混匀仪(SK-1,常州华普达教学仪器有限公司)。
1.2 实验试剂与材料
6种PAEs标准品购自上海阿拉丁公司;2种氘代物质DnBP-d4和DEHP-d4购自上海J&K百灵威公司;色谱纯的正己烷、丙酮,分析纯的无水硫酸钠(Na2SO4,分析纯)、弗罗里硅土(60~100目)购自国药集团化学试剂公司。
实验所用玉米秸秆生物炭由浙江省农业科学院提供,通过限氧控温炭化法在500 ℃环境中热解3 h制得玉米秸秆生物炭,其理化性质如表1所示。脂肪酶(EC 3.1.1.3)购自上海麦克林生化科技有限公司。所用土壤为天然荷塘泥土,经阳光暴晒后,挑选出大颗粒杂质并过40目筛网备用,pH为7.69,密度为1.22 g/cm3,土壤有机质为18.39 g/kg。

表1 玉米秸秆生物炭的理化性质
1.3 实验方法
1.3.1 固定化脂肪酶的制备、优化及表征
在100 mL的三角瓶中加入20 mL溶于磷酸盐缓冲液的脂肪酶溶液和2.0 g生物炭,搅拌均匀后将其振荡培养一定时间(转速为120 r/min),之后用真空泵抽滤去除表面水分,并用磷酸盐缓冲液对固定化脂肪酶表面进行少量多次淋洗,在室温条件下干燥后储存于4 ℃冰箱内备用。为了考察不同pH、反应温度、脂肪酶溶液质量浓度以及固定化时间对酶活的影响,按照表2采用L9(34)正交表设计正交组合实验,确定获得最佳固定化酶的制备条件,采用对硝基苯酚法测定固定化脂肪酶活性[14]。

表2 正交实验因素水平表
通过扫描电子显微镜(SEM,Hitachi SU-8020)对生物炭和固定化脂肪酶样品进行表征分析,首先将样品分别固定于电胶带上,进行喷金预处理,然后用10 kV加速电压的场发射扫描电子显微镜观察拍照。
1.3.2 不同条件下固定化脂肪酶对PAEs降解效果实验
不同土壤pH对PAEs降解效果的影响:使用醋酸、氧化钙和不同pH的磷酸盐缓冲液将土壤pH分别调至5.5,6.5,7.5,8.5,干燥24 h后称取10 g土壤放置40 mL玻璃离心管中,加入100 mg/L的PAEs混合标准品储备液50 μL[15]。待有机溶剂挥发干后,添加磷酸盐缓冲液调节土壤中水的质量分数至45%,在20 ℃黑暗环境中老化24 h后[16],向离心管中加入2%的固定化脂肪酶,旋涡混匀仪120 r/min摇动10 min将土壤与固定化脂肪酶混合均匀,于30 ℃,120 r/min的恒温振荡培养箱中反应5 d后取出,向土壤中加入1 mL丙酮终止反应。将玻璃离心管中的土壤冷冻干燥48 h,等待提取分析,每组处理设置3个平行样。
不同反应温度对PAEs降解效果的影响:称取10.0 g pH为7.5的土壤放置于玻璃离心管中,将其分别置于10,20,30,40 ℃,120 r/min的恒温振荡培养箱中反应5 d后取出,其他操作同上。
不同固定化酶施加量对PAEs降解效果的影响:称取10.0 g pH为7.5的土壤放置于玻璃离心管中,分别加入1%,2%,5%(酶与土壤的质量分数)固定化脂肪酶,其他操作同上。
不同土壤中水的质量分数对PAEs降解效果的影响:称取10.0 g pH为7.5的土壤放置于玻璃离心管中,用磷酸盐缓冲液调节离心管内水的质量分数至30%,45%,60%,其他操作同上。
1.3.3 固定化脂肪酶对PAEs的降解动力学实验
在1.3.2节的最佳实验条件下施加固定化脂肪酶(IL)处理土壤中的PAEs,同时设置对照组(CK),分别在0,1,3,5,7,10,14 d取样并测定PAEs的质量分数。以PAEs剩余的质量分数C表示固定化脂肪酶对PAEs的影响,其计算式为
(1)
式中:C0为t=0时PAEs的质量分数,μg/kg;Ct为t时PAEs的质量分数,μg/kg。
1.3.4 土壤中PAEs的提取
每份冻干土壤样品加入DnBP-d4、DEHP-d4以确定土壤中PAEs的回收率,按照V(丙酮)∶V(正己烷)=1∶1的比例加入20 mL提取试剂,经旋涡混匀仪(2 000 r/min,5 min)混合均匀后,静置于黑暗处12 h以保证充分混合。将该混合物超声(20 ℃,30 min),离心(2 500 r/min,8 min)以收集上清液,该步骤重复3次。将60 mL上清液混合在烧瓶中,旋转蒸发并用正己烷浓缩至2 mL。浓缩样品用经正己烷预处理的玻璃层析柱(填料自下而上为2.0 g无水硫酸钠,10 g佛罗里硅土)纯化。在2 mL棕色进样小瓶中用平稳的氮气吹扫洗脱液,最后用正己烷定容至1 mL。在-20 ℃冰箱内密封保存,等待GC-MS/MS进样分析。
1.4 仪器方法
使用SHIMADZU GC-MS/MS-TQ8040和SH-RXi-5SilMS(30 m×0.25 mm×0.25 μm)色谱柱对6种PAEs进行定量分析。样品(1 μL)以不分流模式注入,载气(高纯氦气)流速设定为1 mL/min,进样温度设置为280 ℃,升温程序:80 ℃保持1 min;10 ℃/min升温至180 ℃并保持1 min;8 ℃/min升温至260 ℃并保持1 min;10 ℃/min升温至300 ℃并保持5 min。检测器为电子轰击离子源(EI源),质谱参数设定:传输线温度280 ℃,离子源温度230 ℃。以多反应监测(MRM)模式对PAEs进行检测分析,相关分析参数如表3所示。

表3 PAEs GC-MS/MS参数
2 结果与讨论
2.1 固定化脂肪酶的制备、优化及表征
采用正交实验法对影响固定化脂肪酶活性的因素进行组合优化,结果如表4所示。对正交实验结果进行分析,由极差R可以看出固定化脂肪酶制备的主次影响因素:脂肪酶质量浓度>反应温度>pH>固定化时间。比较k值大小确定最佳制备条件为A2B2C3D2,即最佳制备条件:缓冲溶液pH为7.5,反应温度为30 ℃,脂肪酶质量浓度为2 g/L,固定化时间为9 h。为了评价固定化酶酶活的稳定性,对最佳制备条件A2B2C3D2进行重复性实验,固定化脂肪酶酶活分别为1 496,1 501,1 475 μg/g,平均酶活为(1 491±14) μg/g,说明该条件下固定化酶酶活较为稳定。

表4 不同条件下固定化脂肪酶酶活的正交实验结果
通过扫描电子显微镜对实验所用玉米秸秆生物炭及上述固定化脂肪酶进行表征,结果如图1所示。生物炭横截面和侧面均观察到良好的孔隙结构,将脂肪酶进行固定化处理后,在图1(c,d)中均能观察到较多小球状颗粒物,证明脂肪酶通过物理吸附能被有效固定在生物炭的表面、孔隙和裂缝中。

图1 玉米秸秆生物炭及固定化脂肪酶的扫描电镜图
2.2 不同条件下固定化脂肪酶对PAEs的降解效果
图2(a)显示了不同pH土壤环境中固定化脂肪酶对PAEs的降解情况。由图2(a)可知:固定化脂肪酶在pH为7.5和8.5的土壤中均具有较高降解活性,其中当pH=7.5时,DMP,DEP,DiBP,DnBP,DEHP,DnOP的去除率分别可达84.25%,64.88%,66.82%,58.75%,49.00%,34.37%。推测不同PAEs降解快慢的差异可能与其侧链长度及污染物本身性质有关[17],Peng等[18]发现比起具有相对较长烷基侧链的DnBP,烷基侧链较短的DMP和DEP更容易被细菌降解,因此在同样的环境条件下,固定化脂肪酶可能对结构相对简单的化合物有更好的促进降解效果,DEHP,DnOP等辛醇水分配系数高的长链PAEs则降解较慢。在土壤pH为5.5和6.5的条件下,PAEs的去除率急剧下降,推测土壤pH可能会影响固定化脂肪酶的降解活性。Kaushal等[19]证明了游离和固定化脂肪酶当pH为4~5时均没有活性,并表明较低pH环境下脂肪酶的结构会发生改变,进而影响脂肪酶的催化活性。此外,土壤pH会影响吸附剂的电荷密度,直接影响污染物在土壤中的去除效果[20]。因此,固定化脂肪酶更适合在中性或偏碱性的土壤中施用,最佳pH为7.5。

a,b,c—不同字母代表不同处理之间具有显著性差异。
图2(b)显示了在10,20,30,40 ℃的反应温度下固定化脂肪酶对PAEs的降解情况。由图2(b)可知:随着反应温度从10 ℃升高到30 ℃,PAEs去除率得到显著提高(p<0.05),并在30 ℃达到最高;去除率为34.33%~84.25%。当反应温度继续升高到40 ℃时,去除率下降到23.65%~74.79%。推测可能与不同反应温度下脂肪酶的活性及其反应程度有关。已知不同酶的最佳催化温度范围有所差异,低于或超过最佳温度范围时,污染物的去除效果会因为酶催化活性的下降而受到影响[21]。Sri等[22]对不同温度壳聚糖固定化脂肪酶(来源于假丝酵母)的水解活性进行了探究,发现当反应温度高于最适条件后,即使稍有升高,也会导致脂肪酶大量失活并减弱对底物的水解活性。Kobayashi等[23]发现在脂肪酶降解物质时,不适宜的反应温度会使酶无法保持良好的蛋白质活性,造成酶催化时间缩短,导致降解效果下降。因此固定化脂肪酶降解PAEs的适宜反应温度为30 ℃。
图2(c)显示了施加1%,2%,5%的固定化脂肪酶对PAEs降解情况的影响。由图2(c)可知:当酶施加量从1%升高到2%时,PAEs去除率得到显著提升(p<0.05),以DnBP和DEHP为例,两者的最高去除率分别可达53.24%和40.72%。随着固定化酶施加量继续增大到5%,发现去除率反而随着酶量的增大而稍有下降。Choi等[24]在0.5%~3.0%酶施加量范围内,发现随着酶施加量的增加初始去除率显著增大,经4 h反应后,酶施加量2%和3%获得了97%的相似最大去除率。虽然也有一些研究为了获得更高的物质去除率采用了更高的酶施加量[25-26],但是在本实验中考虑固定化脂肪酶的施用效益及去除效果,选用2%为最佳固定化酶施加量。
图2(d)显示了在土壤中水的质量分数分别为30%,45%,60%的条件下固定化脂肪酶对PAEs去除情况的影响。由图2(d)可知:PAEs的去除率与土壤中水的质量分数呈正相关。以DnBP和DEHP为例,发现水的质量分数从30%增加到60%的过程中,去除率分别从24.01%和26.15%提高到51.24%和50.72%,且在不同条件下PAEs的去除率有显著性差异(p<0.05)。这可能是由于土壤中水的质量分数增加会使土壤孔径增大,促进污染物和固定化脂肪酶在土壤中的分布与结合[27]。Zhang等[28]通过对比玉米、小麦和水稻对土壤中的PAEs的耐受性,发现淹水条件下土壤中的PAEs有更高的去除率,使得水稻对PAEs更具耐受性。此外,土壤中水的质量分数升高还能促进水解反应,提高土壤微生物的活性并加速污染物质的水解[29]。因此,去除PAEs最佳土壤中水的质量分数为60%。
2.3 PAEs降解动力学分析
根据2.2节,在pH为7.5,反应温度为30 ℃,固定化脂肪酶施加量为2%,土壤中水的质量分数为60%的条件下,探究14 d内固定化脂肪酶对土壤中PAEs的降解,结果如图3所示。
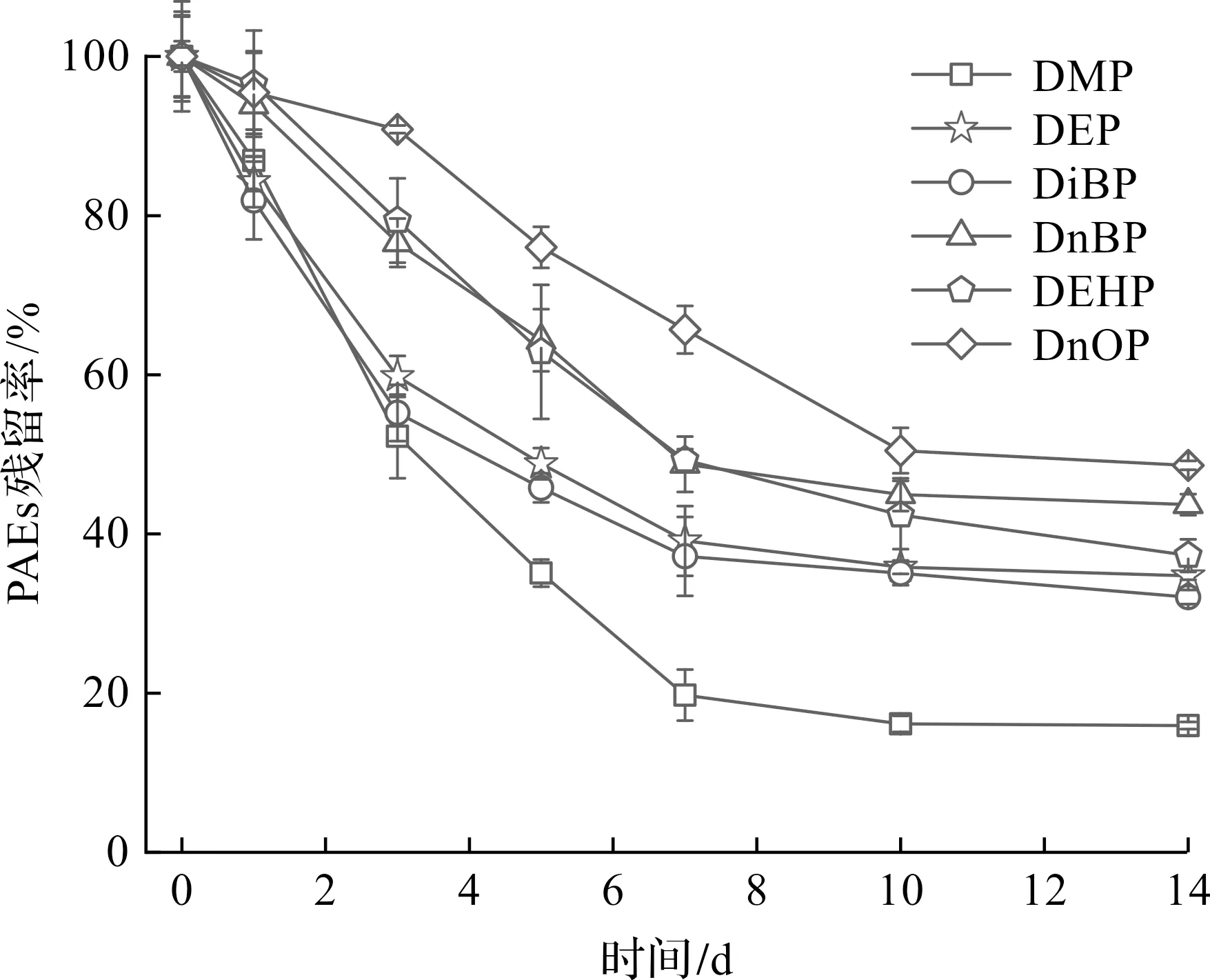
图3 固定化脂肪酶对PAEs的降解效果
为了更深入了解固定化脂肪酶对PAEs的降解行为,采用一级降解动力学模型(Ct=C0×e-kt)对PAEs的残留质量浓度和时间t进行拟合分析[30],其半衰期计算式为
(2)
式中:T1/2为PAEs的半衰期;k为降解速率常数,d-1。降解动力学参数如表4所示。实验结果表明:固定化脂肪酶(IL)对PAEs表现出良好的去除能力。经固定化脂肪酶处理,14 d后土壤中PAEs的残留量为初始的15.93%~48.62%。相比长链PAEs,短链PAEs的去除率更高,这可能是由于PAEs侧酯链的空间效应不同,较长的侧酯链会阻碍固定化脂肪酶与PAEs的结合,从而抑制水解反应[17],因此短链PAEs更容易发生生物降解,而具有较长酯链的PAEs则不易被生物降解。由表5可知:固定化脂肪酶对6种PAEs的降解均符合一级降解动力学模型,经固定化脂肪酶处理,土壤中PAEs的降解速率常数k从0.019~0.035 d-1(CK)显著增大到0.058~0.145 d-1(IL),降解半衰期从19.80~36.48 d显著缩短到了4.78~11.95 d,表明固定化脂肪酶的使用可以提高土壤中PAEs的去除率,尤其是短链PAEs,对于长链PAEs可以考虑先用微生物降解为短链PAEs后,再用固定化酶来处理。
3 结 论
以生物炭为固定化载体,通过物理吸附制备固定化脂肪酶,采用正交实验法确定了固定化脂肪酶的最佳制备条件:pH为7.5,反应温度为30 ℃,脂肪酶质量浓度为2 g/L,固定化时间9 h,此时固定化脂肪酶酶活最高,平均酶活为(1 491±14) μg/g。将此条件制备的固定化脂肪酶施用到PAEs污染土壤中,发现不同的土壤pH、反应温度、固定化酶施加量和土壤中水的质量分数都会对PAEs的去除产生影响,实验结果显示:在pH为7.5,反应温度为30 ℃,固定化脂肪酶施加量为2%,土壤中水的质量分数为60%的条件下,PAEs去除效果最好;14 d后土壤中PAEs的残留量为初始的15.93%~48.62%,降解半衰期从19.80~36.48 d缩短到4.78~11.95 d。实验结果表明:生物炭固定化脂肪酶具有良好的PAEs去除能力,为固定化脂肪酶在实际污染土壤中的应用提供了依据。后续考虑开展田间实验探究固定化脂肪酶在实际土壤环境中对PAEs去除的影响,并通过土壤理化性质,土壤微生物种群等指标的变化,进一步证明固定化脂肪酶的应用潜力。

