整合素β4通过PI3K/AKT/mTOR促进HCC增殖和迁移
唐小龙,曹念蝶,宋雪翼,邵倩倩
(安徽理工大学医学院,安徽 淮南 232001)
肝癌是一种高致死性的恶性肿瘤,其发病率和死亡率在全球范围内均呈现上升趋势[1]。据 2020 年全球癌症发病率、死亡率和患病率数据显示,全球肝细胞癌排名第6,其相关死亡情况也是癌症的常见原因[2]。虽然近年来对于肝癌治疗的研究取得了一些进展,但由于复杂的发生发展机制,肝癌的治疗仍然具有极大的挑战性[3]。因此,寻找新的治疗方法和药物显得至关重要。
整合素β4(integrin β4,ITGB4)是一种跨膜受体蛋白,它在多种恶性肿瘤中被过度表达,包括肝癌[4-5]。有研究证明ITGB4可以促进癌细胞的增殖和迁移,并且与肝癌的预后密切相关[6-7]。在肝癌中ITGB4的高表达水平与较差的预后相关联,其可通过调节细胞外基质附着和细胞周期进程来促进肝癌细胞的侵袭和转移。抑制ITGB4的表达能有效抑制肝癌细胞的增殖和迁移[8-9],说明ITGB4是一个潜在的治疗靶点。
PI3K/AKT/mTOR信号通路是一个广泛存在于各种生物体中的重要信号通路,它参与了多种生物学过程的调控,包括细胞增殖、代谢和凋亡等[10-11]。在肝癌中,PI3K/AKT/mTOR信号通路也被发现与肝癌的发生和发展密切相关,抑制该信号通路可抑制肝癌细胞的增殖和迁移[12-13]。新近研究显示ITGB4可以通过PI3K/AKT/mTOR信号通路来调节细胞凋亡、增殖和迁移等生物学过程[14],但其在肝癌发生发展过程中对增殖和迁移的调控以及机制仍然不明。
本研究旨在探讨ITGB4在HCC进展过程中的生物学效应与机制,利用RNAi和过表达ITGB4的技术,通过克隆形成实验、划痕愈合实验等分析ITGB4对HCC增殖、迁移的影响,并通过Western blot探讨ITGB4调控HCC发生发展的机制,以期更深入了解肝癌的发生发展,为肝癌的治疗提供新的思路和方向。
1 材料与方法
1.1 细胞来源和培养
HepG2和SK-HEP-1细胞系来自明金生物科技有限公司(上海)。Huh7细胞系来自上海青旗有限公司。所有细胞系均使用RPMI 1640培养基(Gibco,美国)进行培养,并添加了15%的胎牛血清(杭州四季青生物工程材料有限公司)。这些细胞系在37℃、保持5%CO2的条件下培养,隔天换液1次,以确保细胞生长的良好状态。
1.2 试剂和化学品
p-PI3Kp85(#4228)、t-PI3Kp85(#4292)、p-AKT(Ser473) (#4060)、t-AKT (#4691)、p-mTOR(Ser2448) (#2971)和t-mTOR(#2972)抗体和Integrin β4 (#14803) XP© Rabbit mAb以及BeyoClickTMEdU-594细胞增殖检测试剂盒主要购自Cell Signaling Technology (美国)和MCE生物有限公司(美国)。所有抗体在使用前用PBS按照一定比例稀释。LV-ITGB4-shRNA1、2、3敲低ITGB4慢病毒来自吉满生物科技(上海)有限公司;ADV-ITGB4过表达腺病毒载体来自通用生物(安徽)有限公司。
1.3 Western blot
用细胞裂解液提取细胞和组织的总蛋白,然后将蛋白与5×蛋白上样缓冲液按4∶1的比例混合,在沸水中变性20min。定量样品注入10% SDS-PAGE胶孔中进行电泳,条件为80mV 30min的浓缩、80min的分离。电泳完成后,将胶内蛋白转移到PVDF膜上,并在5%脱脂牛奶中室温封闭3h。PVDF膜置入TBST溶液中清洗3次,每次10min。将PVDF膜放入一抗工作液中4℃孵育过夜,次日放入二抗工作液中,室温孵育1h,TBST溶液中清洗3次。最后在PVDF膜上均匀涂上显影液,经显影仪检测和拍照。
1.4 细胞增殖分析
将1×105个细胞均匀种植在24孔板中,在37℃ 恒温培养箱中培养24h后,弃培养液并注入500μL含有EdU-594(10μM)的培养液继续培养2h后,用4%多聚甲醛固定细胞15min,0.3%Triton透化10min。根据试剂说明书加入配制好的500μL click反应液避光孵育30min。用含3% BSA的PBS洗涤细胞3次后,DAPI染核10min,洗涤细胞3次后置荧光显微镜下检测红色荧光细胞核的比例,以评估细胞增殖活力。
1.5 划痕愈合实验
将5×105个细胞均匀接种于12孔板中,使其生长至铺满底部。然后用10μL枪头在每个孔中垂直划3道相互平行的痕迹,吸弃培养液后换成无血清培养基,并在0h和48h置显微镜下采图。使用Image J软件测量痕迹大小,以评估细胞的迁移能力。
1.6 Transwell检测
用8μm孔径的Transwell小室进行细胞侵袭分析。将无血清培养基(100μL)中的3×105细胞接种到Transwell的上室;同时在下室中添加含有10%胎牛血清的培养基,总体积为 500μL;37℃培养48h后,去除膜上侧未迁移的细胞;迁移的细胞用甲醇固定30min,结晶紫溶液染色,并在显微镜下观察和拍照。通过计算3个随机视野中的细胞数评估跨膜迁移的情况。
1.7 克隆形成能力分析
取对数生长期的细胞,将细胞用胰蛋白酶消化并吹打成单个细胞。将细胞以1 000个细胞/孔水平接种于6孔板中,并在37℃下培养两周。当细胞形成肉眼可见的集落时,用4%多聚甲醛固定15min,结晶紫染色30min后,拍照并计数细胞集落。
1.8 统计分析
每个实验都至少进行了3次重复,并且数据均以平均值±标准差表示。采用未配对双尾Student’s t检验或单因素方差分析来衡量各数值之间的差异。P<0.05则认为具有统计学意义。所有的分析都使用了SPSS 13.0统计软件。ImageJ 1.44P软件用于免疫印迹的定量分析。
2 结果与分析
2.1 ITGB4在HCC中高表达
应用TCGA数据库分析显示,ITGB4在不同肿瘤中均有一定水平的表达,其中在肝细胞性肝癌(LIHC)中的表达水平比DLBC、KICH等其他类别的肿瘤表达量高(见图1a)。根据TCGA数据库分析,肝细胞性肝癌中ITGB4的表达量也显著高于肝细胞性肝癌的癌旁组织,如图1(b)所示。进一步应用Western blot分析发现ITGB4在HCC细胞株中的表达状况,结果显示HepG2细胞系中ITGB4水平低于Huh7和SK-HEP-1细胞系(P<0.01),但显著高于正常肝细胞系L02 (见图1c)。免疫荧光染色检测结果也证实Huh7细胞系中ITGB4水平高于HepG2细胞系,且ITGB4主要富集于肝癌细胞膜上,部分存在于胞核中(见图1e)。为探讨ITGB4在肝癌中的生物学效应,用ITGB4的3个不同基因序列敲低慢病毒载体转入Huh7中,发现ITGB4-shRNA1转染效率最好,因此应用ITGB4敲低慢病毒(ITGB4-shRNA1)构建了ITGB4敲低表达的肝癌细胞系Huh7ITGB4-(见图1f)。再用ITGB4过表达腺病毒载体构建了ITGB4高表达的肝癌细胞系HepG2ITGB4+,如图1(h)所示。应用ADV-ITGB4过表达腺病毒载体处理后,显著上调了HepG2ITGB4+细胞中ITGB4水平,而构建的Huh7ITGB4-中ITGB4的表达相对于亲代Huh7则显著下调(P<0.01)(见图1i)。
2.2 ITGB4促进HCC细胞增殖
应用EdU-594分析ITGB4对HCC细胞增殖实验的影响,结果如图2(a)所示,与Huh7细胞相比,Huh7ITGB4-细胞中增殖指数阳性率显著下降(P<0.01);而HepG2ITGB4+细胞相对于亲代细胞HepG2,EdU标记阳性率则显著升高(见图2c)。在克隆形成实验中,Huh7ITGB4-较Huh7克隆成团率低,而HepG2ITGB4+细胞相比HepG2克隆形成率则显著升高(P<0.01),结果如图2(e)所示。这些结果说明ITGB4促进了肝癌细胞的增殖。
2.3 ITGB4促进HCC细胞迁移和侵袭
通过划痕愈合和Transwell实验进一步探究ITGB4对HCC迁移和侵袭性能的影响,与Huh7细胞相比,Huh7ITGB4-细胞划痕愈合性能显著下降(P<0.01)(见图3a)。而HepG2ITGB4+细胞划痕愈合性能则比HepG2细胞显著上调(P<0.01)(见图3c)。同样,在Transwell实验中HepG2ITGB4+细胞穿过Transwell的细胞率比HepG2细胞显著增加(P<0.001);而Huh7ITGB4-细胞穿过Transwell的细胞占比显著低于Huh7细胞(P<0.01)(见图3e)。以上结果表明,ITGB4有利于促进HCC细胞迁移和侵袭性能。
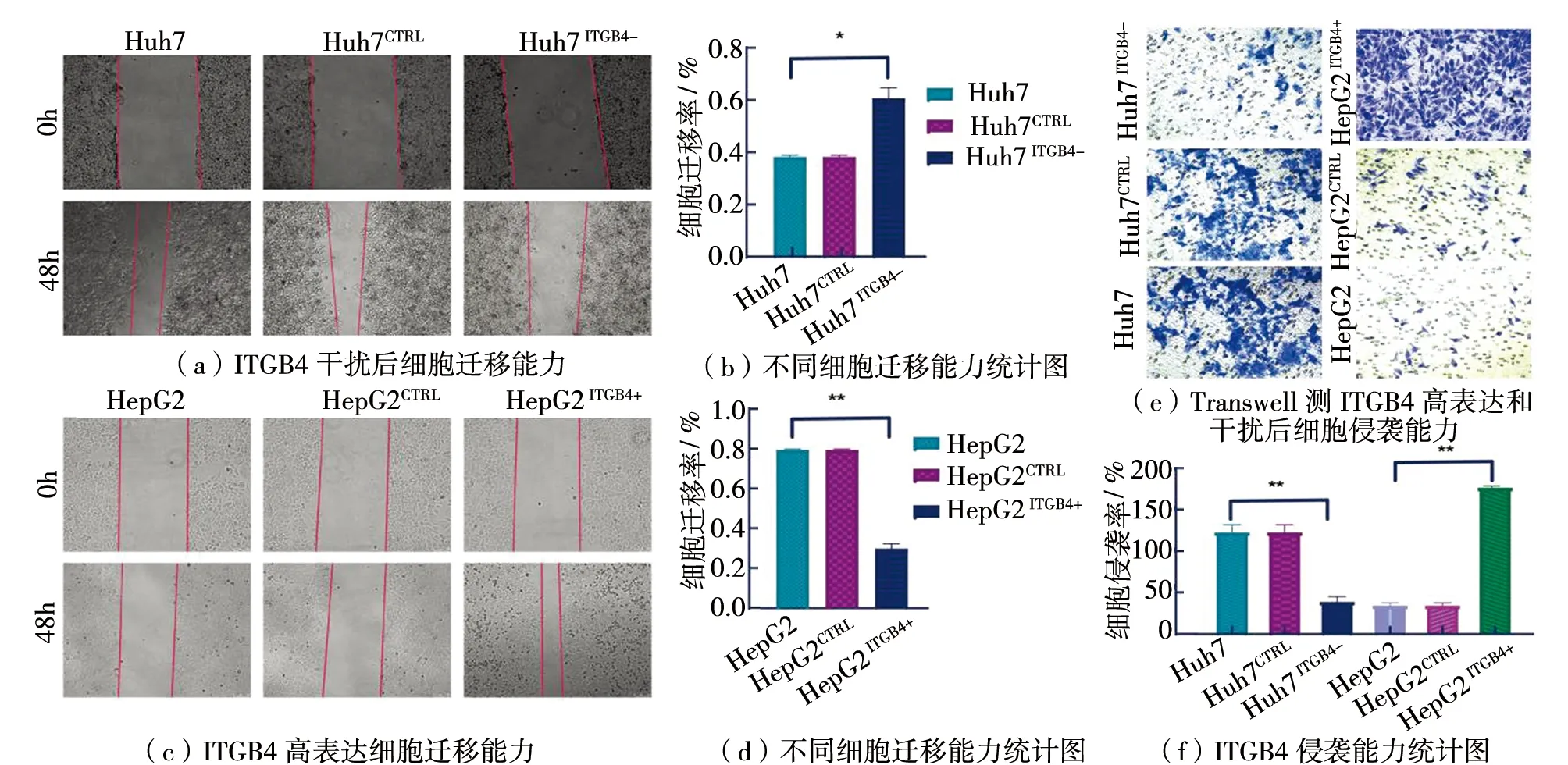
图3 ITGB4促进细胞迁移和增殖
2.4 ITGB4激活PI3K/AKT/mTOR信号通路
为了探究ITGB4介导HCC细胞增殖、迁移和侵袭等生物学效应的具体调控机制,通过Western blot检测PI3K/AKT/mTOR信号通路的活化水平,结果如图4所示,在Huh7和HepG2细胞中,下调ITGB4表达(Huh7ITGB4-)导致p-PI3K、p-AKT和p-mTOR水平显著下调(P<0.01);而上调ITGB4表达(HepG2ITGB4+)导致p-PI3K、p-AKT和p-mTOR水平显著增加(P<0.01)。这些结果表明ITGB4可能通过PI3K/AKT/mTOR介导HCC细胞的增殖、迁移和侵袭等生物学功能。
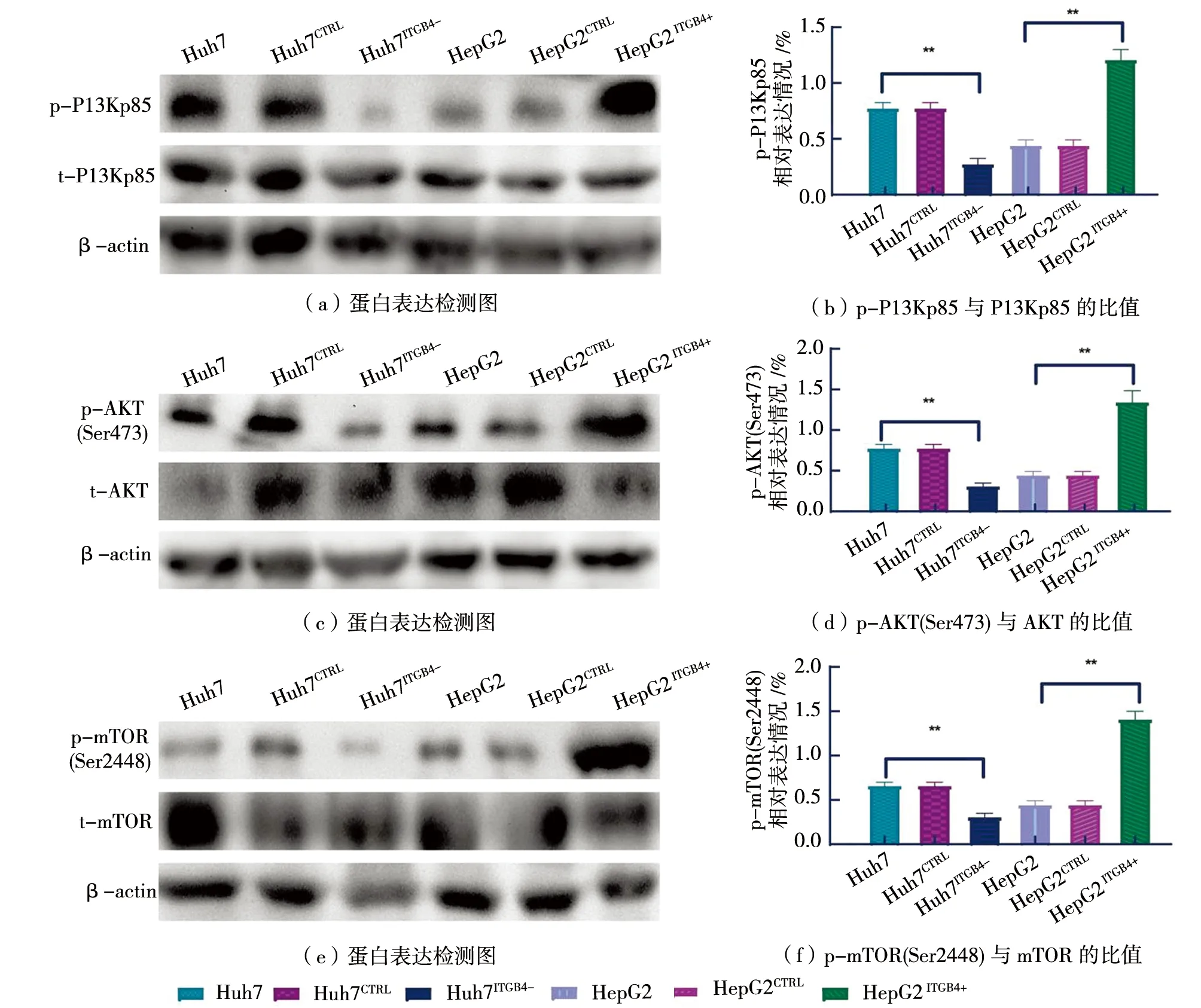
图4 ITGB4可调节PI3K/AKT/mTOR通路的异常激活
2.5 抑制PI3K/AKT/mTOR通路下调HCC的增殖和迁移
为了探讨ITGB4调控PI3K/AKT/mTOR信号通路活化水平的生物学效应,本研究比较了HepG2和HepG2ITGB4+细胞中PI3Kp85、AKT和mTOR的活化水平,结果如图5(a)所示,ITGB4过表达导致p-PI3K、p-AKT和p-mTOR水平增加。进一步应用PI3K/AKT/mTOR信号通路抑制剂(PKI-587)处理显著抑制了HepG2ITGB4+细胞中的PI3Kp85、AKT和mTOR活化(P<0.01)。为了研究PKI-587对HCC增殖与迁移性能的影响,本文分别应用克隆形成实验和划痕愈合实验验证了PKI-587对HepG2细胞增殖和迁移能力的抑制作用。如图5(c)所示,在HepG2ITGB4+细胞中添加PKI-587能有效地抑制HepG2ITGB4+细胞增殖(P<0.01);如图5(f)所示,划痕愈合实验同样证明添加PKI-587处理组显著抑制了HepG2ITGB4+的迁移能力(P<0.01)。这些结果表明,ITGB4可以通过激活PI3K/AKT/mTOR信号通路上调HCC细胞的增殖性能和促进HCC细胞的迁移。

图5 PKI-587逆转了ITGB4诱导的肝癌细胞的增殖,迁移
3 讨论
肝癌是一种高致死性的肿瘤,其发生和发展是一个复杂的多因素共同作用的过程。ITGB4作为一种跨膜糖蛋白受体可介导细胞间或细胞基质之间的粘附,并转导调节基因表达和细胞生长的信号。本研究证实在肝癌细胞中ITGB4的表达量显著高于正常肝细胞,且能通过PI3K/AKT/mTOR信号通路介导肝癌的进展。
已有研究证实,ITGB4在肺癌等多种癌症中都表达上调,然而ITGB4在肝癌组织中的表达状况、具体功能和分子机制还不完全清楚[15]。有文献表明,和其他肿瘤一样,肝细胞癌中也存一定水平的ITGB4表达且显著高于癌旁组织[16]。本研究证实,相对于正常肝细胞,ITGB4在HCC的细胞系中存在不同程度的上调表达。而ITGB4在人肝癌细胞系Huh7和HCCLM3中高表达,并且在这两株细胞株中敲低ITGB4则会抑制HCC的迁移和侵袭[17]。不过也有研究表明相对于高侵袭性HCC细胞株(HLF,MHCC97L,MHCC97H,HCCLM3),ITGB4在低侵袭性Huh7细胞中低表达或不表达。但是也有文献指出ITGB4在肝癌组织中高表达,而在癌旁组织中低表达或不表达[18]。本研究比较的是ITGB4在肝癌细胞和正常肝细胞中的表达量,结果显示相对于正常肝细胞,ITGB4在肝癌细胞Huh7和HepG2中高表达,且在Huh7细胞中的表达量高于HepG2细胞。此外,由于Huh7肝癌细胞在培养过程中具有较高的遗传变异率,不同的代次可能有不同的表达模式,这也可能导致不同研究之间存在一定差异性。总而言之,众多研究均已表明ITGB4在肝癌细胞中普遍存在,有可能在肝癌的进展中发挥重要作用。其中已有文献报道肝癌组织中的ITGB4水平高于癌旁组织,HCC细胞中的ITGB4水平高于正常肝细胞,并且ITGB4的表达与肝癌的分级和侵袭性呈正相关[19]。以上文献报道为本研究结果提供了一定的支撑和验证,未来本课题组将在此研究基础上,进一步收集更多不同组织类型的临床肝癌标本,分析ITGB4的表达及其与患者预后相关指标之间的关系,以探讨ITGB4作为肝癌潜在治疗靶点的价值。
细胞迁移、侵袭和增殖是肝癌恶性进展的重要特征。ITGB4能与ECM基质等成分结合,调节胶原酶等酶的活性,促进肝癌细胞的侵袭和迁移[20]。本研究通过过表达/敲低ITGB4表达实验,结果表明下调ITGB4可以抑制肝癌细胞的增殖、迁移和侵袭;而上调ITGB4则增强了HepG2细胞的相关生物效应,说明ITGB4的表达可以促进肝癌的转移和恶性进展。ITGB4的高表达与肝癌患者的预后不良相关,同时ITGB4还可以通过调节NF-κB信号通路促进肝癌细胞的增殖和迁移[21],这些研究有力地证实了ITGB4在肝癌中的促进作用。
PI3K/AKT/mTOR途径是肿瘤细胞中最为重要的信号途径之一,其异常激活参与了肝癌细胞的生长、迁移和抗凋亡等生物学过程[22]。本研究结果表明ITGB4上调PI3K/AKT/mTOR的激活,且AKT/mTOR信号通路的抑制剂(PKI-587)可以有效抑制ITGB4活化的PI3K/AKT/mTOR信号通路,并逆转了ITGB4介导的HCC增殖、迁移和侵袭;应用RNAi技术沉默ITGB4同样可以有效地抑制HCC细胞中的PI3K/AKT/mTOR通路活化及其驱动的HCC增殖、迁移和侵袭等生物效应,这些研究都支持了本文所述的PI3K/AKT/mTOR信号通路在肝癌中的重要作用。显然,深入探讨ITGB4和PI3K/AKT/mTOR通路之间的相互作用,对治疗和预防HCC的临床应用具有重要意义。
综上可知,ITGB4至少部分参与介导PI3K/AKT/mTOR信号通路的激活,进而参与调控肝癌细胞的增殖和迁移等生物学效应。因此,干预ITGB4表达有望成为治疗该癌症的潜在靶点。未来需要进一步开展相关实验,以探究ITGB4在肝癌治疗中的应用价值,并寻找更加有效的干预策略。

