产淀粉酶芽孢杆菌的分离鉴定、高温驯化及酶学性质研究
张 璋,赵腾飞,李红霞,胡智慧,宋露露
(茅台学院 酿酒工程系,贵州 遵义 564507)
白酒是中国传统的酒精饮料,是世界上最古老的蒸馏酒之一[1-2],以独特的风味在中国倍受推崇,也逐渐受到世界各地的关注和欢迎。白酒生产包括大曲制作、发酵、蒸馏和陈酿[1,3-4]。大曲是白酒发酵重要的发酵剂和糖化剂,主要含有各种微生物及其所分泌的多种水解酶系[5-8]。在繁杂的水解酶系中,淀粉酶能够将淀粉水解并最终产生寡糖单元,广泛应用于酒精、食品、医药、化工、造纸和纺织等行业当中,是最为重要的工业酶制剂之一。淀粉酶由多种细菌、霉菌等微生物产生。在大曲尤其是酱香型白酒的高温大曲中,芽孢杆菌作为优势细菌,更是生产淀粉酶的主力菌种。
在针对芽孢杆菌淀粉酶研究与开发进程中,学者们重点针对淀粉酶产生菌、基因特征、表达方式、酶学性质改造、生产工艺优化等方面进行了研究,取得了大量的研究成果[9-12]。但是针对工业应用多种多样的需求来说,如酱香型白酒的高温酿造环境或者利用低温蒸煮生米作为碳源进行谷胱甘肽的发酵[13-14]等,筛选具有广泛适用性的菌种及对其产酶能力的研究仍在进行之中。如贝莱斯芽孢杆菌淀粉酶定点突变后其稳定性有所增加,但在70 ℃条件下保温30 min时活性仅残余20%左右[15]。地衣芽孢杆菌淀粉酶耐热突变后,最适反应温度提高了10 ℃,但是适用温度范围较小,在60 ℃以下反应仅能保持40%左右的活性[16],针对不同工业的普适性应用仍旧有一定的局限。地衣芽孢杆菌淀粉酶经优化培养后酶活提高到7.9 U/mL[17],仍远远不能满足工业生产对高活性淀粉酶的需求。
本研究从酱香型高温大曲中对芽孢杆菌进行分离筛选,结合菌株形态学观察以及16S rDNA序列测定对菌株种属来源进行鉴定,并以淀粉酶活力作为评价指标,针对高温驯化前后菌株所产淀粉酶的酶学性质进行探讨,以研究高温驯化对菌株生长及其所产淀粉酶酶活的影响以及其在工业生产中的应用潜能。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
酱香型白酒大曲样品:贵州省仁怀市茅台镇某酒厂。
1.1.2 试剂
酵母提取物、胰蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;聚合酶链式反应(polymerase chain reaction,PCR)引物、PCR预混液:生工生物工程(上海)股份有限公司;氯化钠、3,5-二硝基水杨酸、酒石酸钾钠、亚硫酸氢钠、苯酚、氢氧化钠、盐酸、磷酸二氢钠、磷酸氢二钠(均为分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
固体培养基[18]:酵母浸粉5 g/L、蛋白胨10 g/L、氯化钠10 g/L、琼脂20 g/L、可溶性淀粉20 g/L,121 ℃灭菌20 min。
液体培养基[18]:酵母浸粉5 g/L、蛋白胨10 g/L、氯化钠10 g/L,121 ℃灭菌20 min。
1.2 仪器与设备
DHP-9402型恒温培养箱:上海森信实验仪器有限公司;BSD-YX3200型立式智能精密摇床:上海博讯实业有限公司;JNOEC XS-212-202型电子显微镜:上海圆派科学仪器有限公司;FA2004N型电子天平:上海菁海仪器有限公司;UV-5100型紫外可见分光光度计:上海棱光技术有限公司;SIGMA-1-14型低温离心机:美国Sigma-Aldrich公司;S1000TM型PCR扩增仪:美国Bio-Rad公司。
1.3 方法
1.3.1 产淀粉酶芽孢杆菌的富集与分离[18]
称取1 g酱香型白酒大曲样品,加入10 mL生理盐水混匀,置于80 ℃恒温水浴锅中水浴10 min,每隔2 min振荡混匀。水浴结束后取上清液用生理盐水进行梯度稀释。分别选取10-5、10-6、10-7、10-8浓度,以四区划线法接种至固体培养基上,30 ℃培养箱中倒置培养24 h。使用卢戈氏碘液染色后观察筛选平板上单菌落的透明水解圈,并比较透明圈直径(D)和菌落直径(d)的比值(D/d),挑取比值大的菌落进行复筛。
1.3.2 产淀粉酶芽孢杆菌的复筛
将挑取的菌落接种于液体培养基,30 ℃条件下培养16 h制备种子液。将种子液稀释至OD600nm值为0.6,按照2%(V/V)的接种量转接至液体培养基摇瓶中,30 ℃、200 r/min振荡培养。在不同时间点取样,12 000 r/min离心收集发酵上清液。测定发酵上清液中淀粉酶的活力,筛选淀粉酶活性高的菌株。
1.3.3 淀粉酶活力测定
采用3,5-二硝基水杨酸比色法[19]测淀粉酶活性。酶活单位定义:1 mL粗酶液在40 ℃条件下,1 min水解淀粉生成1 μg葡萄糖所需的酶量定义为1个酶活单位,U。
1.3.4 菌株的形态观察及分子生物学鉴定
将菌株接种至固体培养基上,30 ℃培养24 h后挑取单菌落至液体培养基中,30 ℃培养16 h后进行革兰氏染色,显微镜观察细胞形态特征。
采用苯酚氯仿抽提法[20]对目标菌株的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)进行提取。并以此DNA为模板,以通用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')进行16S rDNA的扩增。PCR扩增体系:DNA模板0.5 μL,27F和1492R各2 μL,PCR预混液补足50 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火10 s,72 ℃延伸30 s,循环35次;72 ℃延伸7 min。PCR产物进行琼脂糖凝胶电泳检测后送至生工生物工程(上海)股份有限公司进行测序,测序结果在美国国家生物技术信息中心(national center for biotechnology information,NCBI)采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,比对结果使用MEGA 11.0生物学软件进行比对分析,并利用邻接(neighbor-joining,NJ)法构建系统发育树[21-22],确定菌株的种属。
1.3.5 芽孢杆菌的高温驯化
将筛选得到的菌株在30 ℃条件下振荡培养16 h后,以2%(V/V)的接种量转接至液体培养基,分别于30 ℃、35 ℃、40 ℃、45 ℃进行培养,培养3 h、6 h、9 h、12 h、15 h、24 h时测定菌液在波长600 nm处的吸光度值(OD600nm值)、酶活力,每个时间点测定3次,绘制芽孢杆菌在不同温度条件下的生长曲线和所产淀粉酶的酶活力曲线,并确定驯化点温度。
以驯化点温度将菌株培养至OD600nm值达到0.6时,以2%(V/V)的接种量转接入高于驯化点2.5 ℃的摇瓶内进行培养,培养至OD600nm值达到0.6时再以2%(V/V)的接种量转接入高于驯化点5 ℃的摇瓶内培养,培养3 h、6 h、9 h、12 h、15 h、24 h时测定菌液在波长600 nm处的吸光度值、酶活力,每个时间点测定3次,绘制芽孢杆菌在不同温度条件下的生长曲线和所产淀粉酶的酶活力曲线。
1.3.6 淀粉酶的酶学性质[15-16]
pH对淀粉酶活力的影响:将底物用不同pH值(1、2、3、4、5、6、7、8、9)的缓冲液溶解,测定淀粉酶活力,考察pH对淀粉酶活力的影响,以最高酶活设为100%,计算相对酶活。
淀粉酶的pH稳定性:将酶液用最适pH值缓冲液稀释后,在不同的时间点进行取样,然后在最适反应pH条件下测残余酶活。
温度对淀粉酶活力的影响:按照酶活力测定的方法,分别在20 ℃、30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃、90 ℃条件下测淀粉酶的活力,考察温度对淀粉酶活力的影响。
淀粉酶的温度稳定性:将酶液在最适温度条件下保温,在不同的时间点进行取样,然后在最适反应温度条件下测残余酶活。
2 结果与分析
2.1 产淀粉酶芽孢杆菌的筛选
以菌落的透明水解圈为依据进行初筛,从酱香型白酒大曲中分离得到纯培养菌株350株,其中产淀粉酶水解透明圈的菌株12株,菌落直径及透明圈直径比值见表1。由表1可知,5号菌株、10号菌株和11号菌株的D/d值最高,且5号>10号>11号,因此选择这3株均进行复筛。

表1 筛选产淀粉酶菌株的透明水解圈及菌落直径比值Table 1 Ratio of transparent hydrolytic circle and colony diameter of screened amylase-producing strains
对5号、10号、11号菌株进行摇瓶培养,并分别对其所产淀粉酶进行活性测定,结果见图1。由图1可知,5号菌株产酶酶活在前6 h上升较为平缓,在6~10 h显著上升,10~12 h变化不大,均处于较高水平,在10 h时具有最高酶活332.4 U/mL,12 h后活性有较为明显的下降,24 h时降至最高酶活的21%。10号菌株酶活变化情况与5号菌株相似,在培养10 h时达到最高酶活252.4 U/mL。11号菌株活性总体较低,在12 h处达到最高酶活114.0 U/mL,之后活性快速下降。3个菌株的淀粉酶活力存在较为明显的差异,其活性排列顺序和D/d值保持一致,选择5号菌株为目标菌株进行后续研究,并命名为菌株AmyZ5。不同的菌株具有各异的遗传特性,从而表现出不同的生物活性特征,也正是由于这些催化风格各异的微生物种群之间的微妙平衡和相互结合,才呈现出了各具特色的酿造工艺及风格迥异的白酒产品[23]。
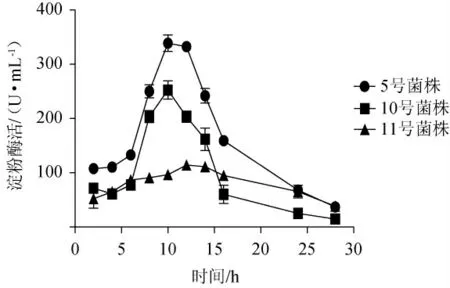
图1 筛选菌株产淀粉酶活性对比Fig.1 Comparison of amylase activities produced by screened stains
2.2 菌株AmyZ5的种属鉴定
2.2.1 菌株AmyZ5的形态特征
菌株AmyZ5在固体培养基上的菌落形态特征和革兰氏染色后细胞的形态特征见图2。由图2A可知,菌株AmyZ5在固体培养基上的菌落呈现淡黄色不透明状态,边缘无规则不平滑,菌落内部湿润且不易被挑起。由图2B可知,菌株AmyZ5的细胞形态为杆状,单细胞,或多细胞首尾相连呈链状排列,可形成椭圆形的芽孢。根据菌株AmyZ5的菌落形态和细胞形态,初步判定菌株AmyZ5为芽孢杆菌属(Bacillussp.)。
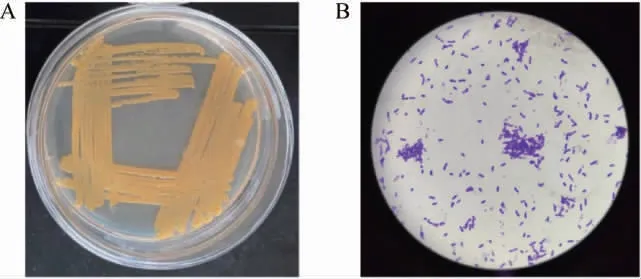
图2 菌株AmyZ5的菌落(A)和细胞(B)形态特征Fig.2 Colony (A) and cell (B) morphological characteristics of strain AmyZ5
2.2.2 菌株AmyZ5的分子生物学鉴定
对扩增得到的16S rDNA序列测序,将测序结果进行BLAST比对分析,结果发现,菌株AmyZ5与贝莱斯芽孢杆菌(Bacillus velezensis)XC1的16S rDNA具有最高的序列同源性。利用MEGA 11.0[21]生物学软件分析菌株AmyZ5和相关菌株的16S rDNA基因,并构建系统发育树,结果见图3。
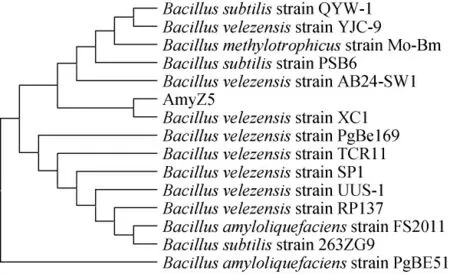
图3 基于16S rDNA基因序列菌株AmyZ5的系统发育树Fig.3 Phylogenetic tree of strain AmyZ5 based on 16S rDNA gene sequence
由图3可知,菌株AmyZ5与Bacillus velezensis同属一个分支,综合菌落形态、细胞形态和分子生物学结果,鉴定菌株AmyZ5为贝莱斯芽孢杆菌(Bacillus velezensis)。
2.3 菌株AmyZ5的高温驯化
2.3.1 菌株AmyZ5在不同温度下的生长情况及酶活力变化
酱香型白酒高温制曲、高温堆积、高温发酵的生产工艺对菌株的生长代谢有较大的影响[24]。由图4A可知,菌株AmyZ5在30~45 ℃条件下均能够生长,但在45 ℃条件下生长量具有较为明显的下降,30 ℃条件下培养15 h菌液OD600nm值是45 ℃时的1.4倍。由图4B可知,虽然菌株AmyZ5能够在较高温度条件下保持生长,但其所产淀粉酶活性则随温度的升高而持续降低。不同培养温度下,淀粉酶最高活性均出现在培养15 h时,但45 ℃时菌株AmyZ5所产淀粉酶活性约为30 ℃时的1/3。芽孢杆菌相比较其他菌种而言,因其较高的耐温性,是高温大曲中的优势细菌。虽然芽孢杆菌能够在较高的温度下存活,但其生物活性相较于最适生长温度来说,会被高温环境所抑制,这对于发酵原料的利用及白酒风味物质的产生有着严重的影响。

图4 不同温度条件下菌株AmyZ5的生长情况(A)及淀粉酶活(B)Fig.4 Growth (A) and amylase activities (B) of strain AmyZ5 under different temperature conditions
2.3.2 菌株AmyZ5高温驯化后的生长情况及酶活力变化
为提高菌株AmyZ5在45 ℃时的生长活力,对其进行高温驯化。培养环境温度的急剧改变,不利于菌种对于环境的适应,从而延长适应期并可能导致菌种生长量的降低。因此采用梯度升温的方式对菌株AmyZ5进行驯化,将驯化后的菌株命名为HTAmyZ5。
由图5A可知,经过驯化,菌株HTAmyZ5在45 ℃条件下培养24 h的OD600nm值是驯化前培养24 h的OD600nm值的1.3倍,更为显著的是对于高温环境适应的时间大大缩短。驯化前菌株AmyZ5在前9 h时生长十分缓慢,而高温驯化后3 h时OD600nm值是驯化前培养3 h时OD600nm值的4.2倍。不仅仅是生长量有了明显的提高,驯化后菌株HTAmyZ5所产淀粉酶的酶活也得到了显著的提高。由图5B可知,驯化后菌株HTAmyZ5所产淀粉酶在9 h时出现最大酶活196.1 U/mL,在12 h时酶活仍保持在97%,在24 h时酶活存留约70%左右。高温驯化后,最高淀粉酶活性(培养10 h时)是驯化前(培养15 h时)的1.9倍。较短的适应期以及较高的生长量和淀粉酶活性,不仅能够提高酿酒原料的利用和转化,还可以大大缩短酿造所用的时间,对于白酒发酵生产具有着积极的意义。
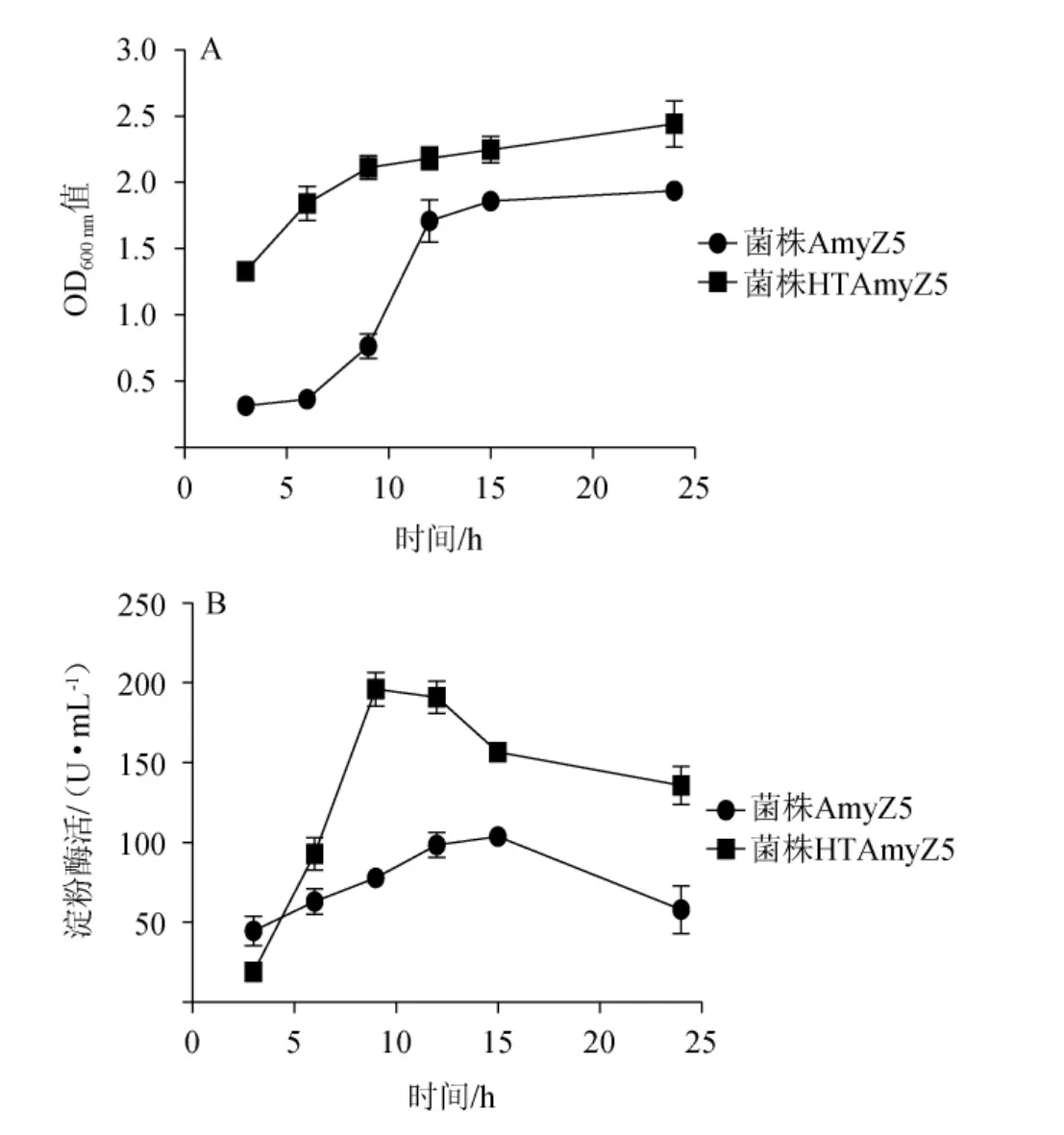
图5 高温驯化前后菌株AmyZ5的生长情况(A)及淀粉酶活(B)对比Fig.5 Comparison of growth (A) and amylase enzyme activities (B) of strain AmyZ5 before and after high temperature acclimation
2.4 菌株AmyZ5和HTAmyZ5产淀粉酶粗酶液的酶学性质分析
2.4.1 菌株AmyZ5和HTAmyZ5产淀粉酶粗酶液的最适反应条件
在酱香型白酒发酵工艺中,高温制曲、高温堆积、高温发酵是独特工艺点及关键控制点[25]。而温度、pH等环境因素对于酶的催化性质也起着决定性的影响[26-27]。由图6A可知,驯化后所产淀粉酶活性的最适反应温度从40 ℃提高至70 ℃,这对于酱香型白酒“三高”发酵工艺中原料的生物转化有着十分有利的作用;同时,在20~90 ℃反应温度之间,相比较菌株AmyZ5所产淀粉酶活性迅速变化的情况而言,菌株HTAmyZ5所产淀粉酶活性均能保持在最高酶活的60%以上,这也为菌株HTAmyZ5淀粉酶提供了可观的工业应用前景[14,28]。由图6B可知,高温驯化并没有改变该贝莱斯芽孢杆菌淀粉酶的最适反应pH,在驯化前后均为pH 3。但菌株HTAmyZ5所产淀粉酶在pH 1~9时活性变化较小,在pH 1~7时活性能够保持在60%以上,在pH9时仍能保持在40%左右。与菌株AmyZ5仅在pH 2~5范围内保持60%以上活性相比,菌株HTAmyZ5在反应温度及pH值的适用范围更为广泛,具有巨大的实际应用潜能。在最适反应条件下,菌株HTAmyZ5所产淀粉酶活性达到322.1 U/mL,为45 ℃培养条件时菌株AmyZ5所产淀粉酶活性的3.1倍。有文献报道称,不同的培养温度对芽孢杆菌分泌淀粉酶的活性有明显影响[29]。菌株HTAmyZ5经过耐高温驯化后,可能由于逐渐升高的培养温度诱导菌株分泌的淀粉酶中耐高温淀粉酶所占比例增加,从而体现为所产淀粉酶的反应温度有所提高。后续会对淀粉酶进行进一步的分离纯化,并调取基因组中相关基因进行异源表达,以研究驯化后淀粉酶最适反应温度发生改变的相关机理。
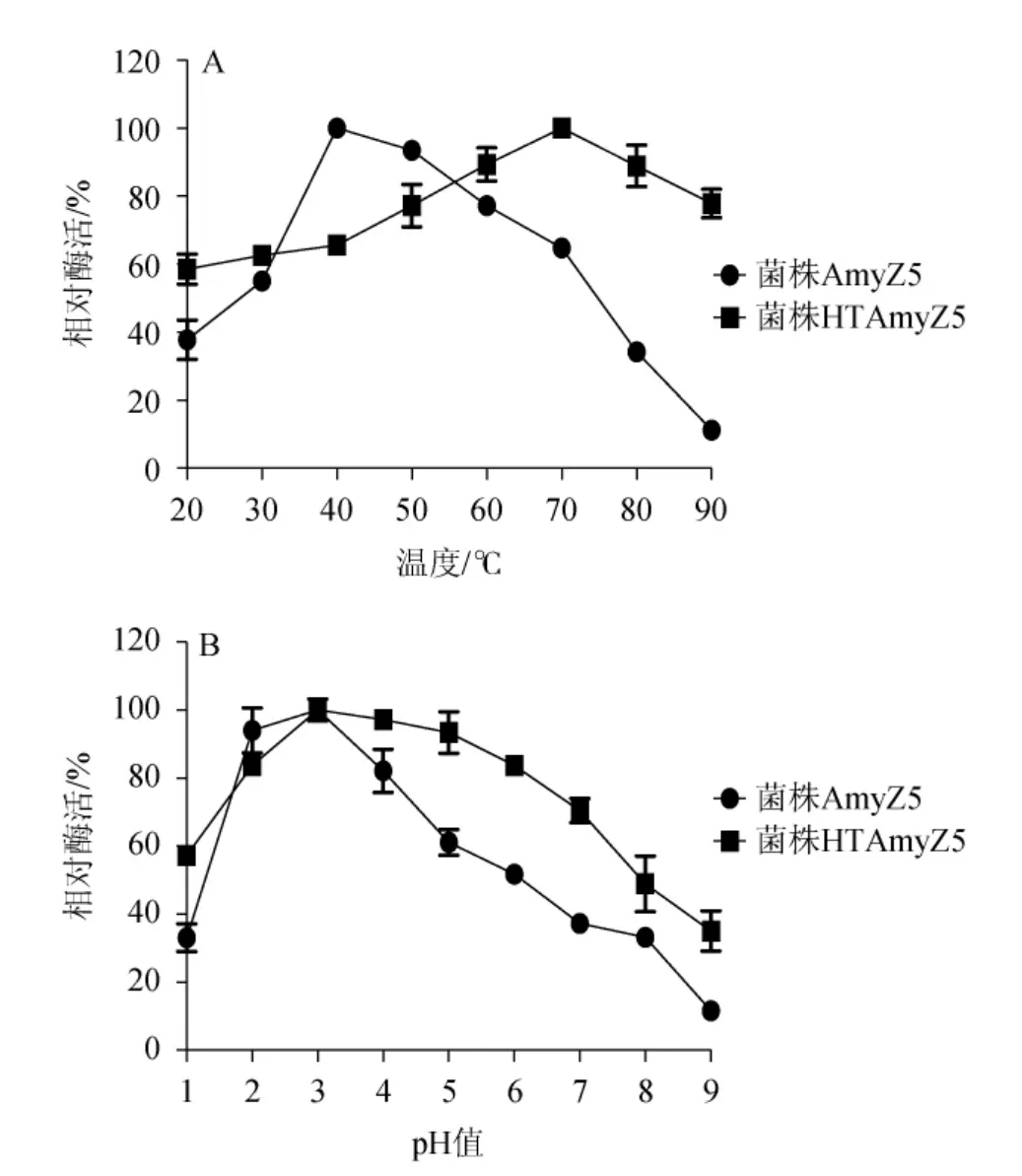
图6 菌株AmyZ5和HTAmyZ5产淀粉酶粗酶液的最适反应温度(A)及pH(B)Fig.6 Optimum reaction temperature (A) and pH (B)of crude enzyme solution of amylase produced by strains AmyZ5 and HTAmyZ5
2.4.2 菌株AmyZ5/HTAmyZ5产淀粉酶粗酶液的稳定性分析
淀粉酶在最适反应温度及pH条件下的稳定性也决定着其在工业发酵生产当中的应用效果。由图7A可知,高温驯化对淀粉酶在其最适反应温度条件下的稳定性有着较小幅度的降低,2 h时菌株HTAmyZ5淀粉酶酶活残余22.2%,相比较菌株AmyZ5淀粉酶的残余酶活下降了36%。持续较高的温度对蛋白质构象有较大的影响[30],这可能是引起菌株HTAmyZ5淀粉酶温度稳定性发生一定下降的原因。而pH稳定性的变化要复杂一些。由图7B可知,在较短的反应时间(0.5 h)内,菌株HTAmyZ5的pH稳定性相比菌株AmyZ5要高;处于较长的反应时间时,菌株HTAmyZ5的pH稳定性则有所降低,但在2 h时两者的残余酶活十分接近。结合温度稳定性及pH稳定性分析,高温驯化对于贝莱斯芽孢杆菌淀粉酶的稳定性没有产生显著改变。
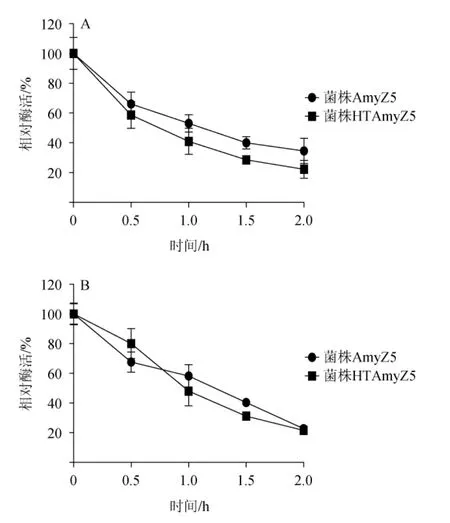
图7 菌株AmyZ5和HTAmyZ5所产淀粉酶粗酶液的温度(A)及pH(B)稳定性Fig.7 Temperature (A) and pH (B) stability of crude enzyme solution of amylase produced by strains AmyZ5 and HTAmyZ5
3 结论
本研究首先利用透明圈法从酱香型高温大曲中分离筛选到一株产淀粉酶芽孢杆菌,通过对其进行形态学观察以及分子生物学鉴定,确定该菌株为贝莱斯芽孢杆菌(Bacillus velezensis),命名为AmyZ5。对其生长环境温度耐受性进行分析后发现,菌株AmyZ5在30 ℃时具有较高的生长量;所产淀粉酶最适反应温度为40 ℃,最适反应pH为3。对AmyZ5菌株进行高温驯化,驯化后菌株HTAmyZ5能够在45 ℃环境下具有较高的生长量,同时大大缩短菌种在高温环境的适应期,培养3 h时OD600nm值比菌株AmyZ5提高了4.2倍;其所产淀粉酶最适反应温度提高到70 ℃,在20~90 ℃范围内活性能够保持在60%以上;最适反应pH仍为3,在pH 1~7范围内活性能够保持在60%以上,在pH 9时仍保留有40%的活性;最高酶活提高了3.1倍,达到322.1 U/mL;稳定性受到高温培养环境的影响有小幅度的降低,但变化并不显著。本试验驯化得到的芽孢杆菌在较高温度环境下能够持续生长并分泌较高活性的淀粉酶,对酱香型白酒发酵高温生产工艺具有较好的适用潜力及潜在的工业应用价值,同时为该菌株在白酒发酵乃至酒糟降解等工业应用方面奠定了一定的科学依据及理论基础。后续将针对该菌种的传代稳定性、所产淀粉酶的基因工程菌异源表达以及淀粉酶结构改造进行更深入的研究。

