原位固化抑制锂硫电池中可溶性多硫化物的研究
李 浩
(商丘职业技术学院交通学院,河南商丘 476005)
随着科技的快速发展,人们对高储能技术的需求一直在稳步增长[1]。锂硫(Li-S)电池以其突出的优越性,包括高理论比能量(2 600 Wh/kg)、低成本、高储量和环境效益成为下一代储能系统最有前途的候选电池之一[2-3]。然而,硫正极存在一些问题,包括硫单质(S8)及其最终放电产物硫化锂(Li2S)导电性差,中间体多硫化物(LiPSs)在电解质中的溶解和扩散,以及硫正极在循环过程中高达70%的体积变化[4],导致容量快速衰减、库仑效率和实际能量密度变低,阻碍Li-S 电池的商业化应用[5]。其中,多硫化物在电解质中的溶解一直是锂硫电池进一步应用的一个难题[6]。一方面,可溶性多硫化物的形成被认为是容量衰减和库仑效率低的主要原因。由于从正极到负极的浓度梯度力,使多硫化物聚集在锂负极侧,与锂金属直接反应并引起“穿梭效应”[7],导致充电效率下降和不可逆活性物质的损失。另一方面,多硫化物的溶解有利于实现高活性材料利用率[8]。由于硫是电子绝缘体,因此S 和Li2S 之间的直接固-固转变在动力学上太慢了。硫的还原只能发生在电子传导相可用的地方。多硫化物的溶解保证了电极中剩余的硫持续暴露在导电材料和电解液中,从而提高了硫的利用率。因此,必须合理控制多硫化物的溶解,以实现高硫利用率和良好的循环稳定性。
通过设计复合材料来封装硫物质已成为解决可溶性多硫化物问题的主流策略[9]。设计的硫正极不仅要将迁移的多硫化物包裹在正极内并阻止它们向负极扩散,还应该提供丰富的电子和离子传导路径以增强氧化还原反应动力学。多硫化物的溶解和扩散可以通过多孔基质的物理限制效应或极性表面的化学吸附效应来缓解。碳材料具有高电导率和可调孔结构,已被广泛用于促进硫氧化还原反应,从而改善硫正极的电化学行为[10]。上述情况中,硫需要预先封装在不具有电化学活性的主体材料中,导致非活性成分含量增加,从而降低电池的能量密度。此外,由于硫正极在循环过程中体积变化大,主体材料经常会发生不可逆的结构坍塌,导致正极性能严重下降。电解质作为多硫化物溶解、迁移和电化学转化的介质,对其改性被认为是解决多硫化物相关问题的另一种有效方法。该方法在大规模工业应用中显示出良好的前景。事实证明,使用具有高锂盐浓度的“盐包液”电解质可有效降低多硫化锂在电解质中的溶解度。如电解质中添加渗透碳纳米颗粒作为分散的纳米电极,提高溶解的多硫化物电化学利用,减轻多硫化物穿梭进而提高锂硫电池的性能。氮掺杂碳点已被用作电解质添加剂,用于构建电化学可恢复的多硫化物保护层,在电极-电解质界面形成凝结层,抑制硫损失。
本文使用对二氯苯(PDCB)引发亲核取代反应来有效阻断多硫化物的溶解和迁移。生成的多硫化物被PDCB 共价固定,同时形成固体多硫聚合物,该材料是随着LiPSs 的生成而不断变化的,因此不会导致正极结构失效。此外,LiPSs-PDCB 复合物具有更低的带隙,在动力学上促进氧化还原过程,显著提高Li-S 电池的容量、倍率性能和循环稳定性。
1 实验
1.1 电解液的制备
普通的锂硫电解液是用溶解在DOL/DME(体积比1∶1)溶剂中的1 mol/L 双三氟甲磺酰亚胺锂(LiTFSI)和1%硝酸锂(LiNO3)制备的。然后,分别在三个10 mL 锂硫电解液的瓶中加入147 mg(1 mmol)、294 mg(1 mmol)和441 mg(1 mmol)的PDCB 粉末,制备成含有0.1、0.2 和0.3 mol/L PDCB 的锂硫电池电解液。
1.2 固体聚硫化物的制备
称取294 mg(1 mmol)PDCB 粉末,将其溶解在10 mL DME 溶剂中,得到0.2 mol/L PDCB 溶液。将摩尔比为5∶1 的S 和Li2S 在10 mL DME 溶剂中混匀,60 ℃下搅拌12 h,得到0.2 mol/L 的Li2S6溶液。固体聚硫化物是通过混合5 mL 的0.2 mol Li2S6溶液和5 mL 的0.2 mol PDCB 溶液,将混合溶液摇匀,静置5 h。然后,将形成的固体离心,并用DME 离心洗涤5 次,随后在60 ℃下真空干燥12 h。上述这些操作是在充满氩气的手套箱中进行的。
1.3 碳纳米纤维@S 正极材料的制备
碳纳米纤维(CNF)@S 采用熔融扩散法制备。0.3 g CNF和0.7 g S 在研钵中研磨30 min 使其混合均匀,然后装入聚四氟乙烯小瓶中,并用密封圈进一步封口,将混合物在155 ℃下加热12 h 并冷却至室温,得到CNF@S 活性材料。
1.4 材料表征
用日本电子JNM-ECZS 的X 射线光电子能谱(XPS)技术测定材料的结构。使用Shimadzu UV 2550 紫外光谱仪进行紫外可见吸收光谱分析。
1.5 电化学表征
80%(质量分数)的活性材料(CNF@S)、10%的导电添加剂(Super-P)和10%的粘结剂(PVDF)在NMP 中混匀制备浆料,刮涂在涂碳铝箔上,干燥并切成直径为12 mm 的电极片。电极中硫的面积质量负载约为1.5 mg/cm2。所有电池组装都在充满氩气的手套箱中进行。电池使用Celgard 2400 隔膜,锂箔作为负极。电解液为上述配置的四种,将30 μL 电解质添加到CR2032 型纽扣电池的隔膜两侧。这些电池在NEWAREBTS-5 V/5 mA 型充放电测试系统上进行测试,温度为25 ℃,恒电流充放电循环设置在1.7~2.8 V 之间。
2 结果与讨论
图1 为原位固化的可视化反应图。选择Li2S6作为LiPSs的代表。Li2S6溶液为棕红色,PDCB 溶液为无色。在含有PDCB 的溶液中加入Li2S6溶液,通过摇晃混合均匀后,静置,Li2S6溶液褪色并生成黄色沉淀,表明两种溶液发生了反应。

图1 可视化反应图
图2 展示了紫外可见光光谱的结果。取原始Li2S6和PDCB-Li2S6瓶中的上清液作实验样品,分别稀释至2 mmol/L,然后进行紫外可见光分析。在Li2S6光谱数据中,260 nm 处表现出一个明显的信号峰。在等摩尔量PDCB 引入后,信号峰未蓝移也未红移,表明其位置没有变化,即说明PDCB 在引入后沉积,并未存在上清液中。同时,260 nm 处的信号峰强度大大降低,可以忽略不计,说明Li2S6也实现了沉积。这两个结果说明Li2S6和PDCB 发生了某种反应,形成不溶性沉积。
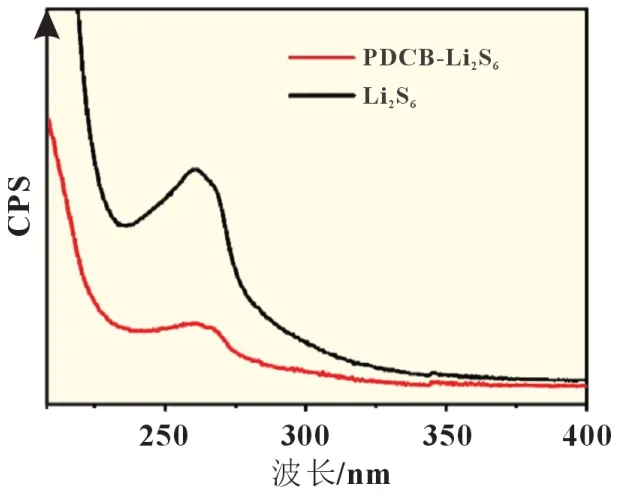
图2 PDCB引入前后Li2S6溶液的紫外可见光光谱图
图3 所示为XPS 光谱。在图3(a)中,结合能以286.4 eV 为中心,原始PDCB 的C 1s 光谱显示了C-Cl 键的明显信号。在图3(b)中,固体聚硫化物的C 1s 光谱中C-Cl 键消失,取而代之的是在285.6 eV 的结合能下清楚观察到的C-S 键信号。上述结果证明了在多硫化物和PDCB 之间的亲核取代反应。因此,当LiPSs 形成时,在电池电解液中的PDCB 将捕获并共价固定LiPSs 在有机硫结构中,进而实现液体LiPSs 的原位固化。这种方法有效地阻止了多硫化物向阳极的扩散。

图3 PDCB和PDCB-Li2S6的XPS谱图
进一步将CNF@S 作为正极组装成纽扣电池,电解液为上述制备的四种,硫含量控制在1.5 mg/cm2左右。首先,考虑到液体多硫化物在提高活性材料利用率和氧化还原动力学方面的作用,在本策略中,并非所有多硫化物都转化为固体有机硫,即添加到电解液中的PDCB 浓度低于基于亲核取代的化学计量出的多硫化物和PDCB 之间反应的用量。图4 所示为含有不同浓度PDCB 的电池循环性能。可以得出结论,当选用含有0.2 mol/L PDCB 的电解液时,电池在放电容量方面表现出最优的性能。具体来说,在氧化还原反应过程中最初产生的多硫化物被PDCB 固化,在硫电极表面形成固体拦截层,用于将随后形成的多硫化物固位在正极内。通过这种方式,可以在不牺牲活性材料利用率和氧化还原反应动力学的情况下解决多硫化物的溶解和扩散问题,从而在硫利用率和容量保持之间取得良好的平衡。因此,以下部分的电化学测量中使用的均为PDCB 含量为0.2 mol/L 的电解液。
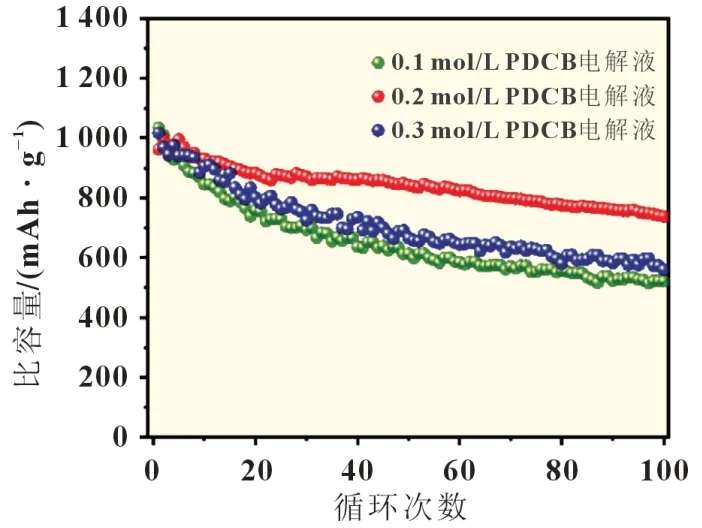
图4 不同浓度的PDCB电池的0.2 C循环性能
图5 显示了稳定的长循环性能。含有PDCB 的锂硫电池即使在1C下也能表现出781 mAh/g 的初始比容量,稳定循环超过130 次后仍具有690 mAh/g 的比容量,平均每次衰减率仅为0.09%,远优于不含PDCB 的锂硫电池0.32%的平均衰减率。而且,含有PDCB 电池的库仑效率稳定在97%以上,该结果表明固化层的构建是实现稳定转化锂硫电池的关键。

图5 含有和不含有PDCB电池的1 C长循环性能
循环伏安(CV)曲线用来描述电极在放电和充电过程中的电化学性能,出现的不同峰表示电极反应中包含多个相转化。图6 为含有和不含有PDCB 电池的循环伏安曲线,曲线为典型的锂硫电池CV 曲线。位于高电位和低电位的两个还原峰为S8向长链LiPSs 的转变以及由长链再向短链的LiPSs转换过程,随着硫的还原逐步进行,最终产物为Li2S。在2.4 V 左右出现的氧化峰与Li2S 的分解有关。含有PDCB 电池的氧化还原峰大幅度正向移动,呈现出氧化还原反应过程中较小的极化,表明更快的反应动力学。

图6 含有和不含有PDCB电池的循环伏安图
图7 为PDCB 引入前后的能级图。为了进一步了解含有PDCB 电池的动力学进展的起源,对关于LiPSs 的代表Li2S6以及它的复合物PDCB-Li2S6单体进行了第一性原理计算。为了揭示分子的氧化还原性质,分析了最低未占分子轨道(LUMO)和最高被占分子轨道(HOMO)的能级。与含有相同硫原子的相应的Li2S6相比,PDCB-Li2S6单体提供了更高的HOMO 和更低的LUMO 能量,这表明在放电和充电过程中硫物质的氧化还原提高。值得注意的是,上述模拟只提供热力学结果,而工作的Li-S 电池中PDCB-Li2S6和Li2S6处于动力学控制下,不同浓度和空间分布随充放电深度而变化。然而,上述模拟结果为从根本上理解PDCB 改性过程对硫氧化还原反应的化学反应提供了可能性。

图7 PDCB引入前后的能级图
因此,含有PDCB 的电池必然具有优异的倍率性能。如图8 所示,在电流由0.1C逐渐增加到2C的过程中,含有PDCB 的电池的平均放电比容量分别为1 216、1 050、880、788、682 mAh/g。电流密度立即恢复到0.1C时,含有PDCB电池的放电比容量变为1 051 mAh/g,不含有PDCB 电池的放电比容量仅剩601 mAh/g,表明PDCB 不仅成功地抑制了多硫化物的穿梭,还提高了多硫化物的转化动力学。

图8 含有和不含有PDCB电池的倍率性能图
3 结论
面对锂硫电池中难以解决的可溶性多硫化物问题,通过引入添加剂实现多硫化物的原位固化是可行的策略。本文通过引入PDCB 与多硫化物亲核取代形成不溶性聚硫化物,附着在硫物质表面,抑制后续产生的多硫化物溶解。同时,PDCB-LiPSs 单体具有较低的能级,进而实现快速的氧化还原动力学。因此,引入PDCB 后的锂硫电池具有更高的质量比容量、更低的极化、更好的循环性能和更好的倍率性能。本研究提供了一种新策略,通过将溶解的多硫化物转化为固态聚硫化物来解决锂硫电池中可溶性多硫化物的穿梭和转化问题。

