生鲜乳中优势嗜冷菌对UHT乳蛋白浓度的影响
王 辉,邵 伟,张少颖,王富兰,王 帅,武亚婷,范 雪,赵艳坤
(1.新疆农业大学动物科学学院/新疆肉乳用草食动物营养实验室,乌鲁木齐 830052;2.新疆农业科学院农业质量标准与检测技术研究所/新疆农产品质量安全实验室,乌鲁木齐 830091)
0 引 言
【研究意义】在生鲜乳低温贮藏过程中,嗜冷菌成为优势菌,随贮藏时间的增加而快速生长繁殖,开始代谢产生耐热的脂肪酶和蛋白酶,这些酶经巴氏杀菌甚至超高温灭菌后仍能保留一部分活性[1-4],蛋白酶水解乳蛋白将带来苦味、异味、果味和酵母味[5]等非正常风味,导致生鲜乳和乳制品质量的改变。对解决嗜冷菌分泌的蛋白酶导致UHT乳中蛋白水解而改变产品质量有重要意义。【前人研究进展】嗜冷菌分泌的蛋白酶经巴氏杀菌后都有较强的恢复能力,经77℃/15s加热处理仍可以保留55%~65%的活性,即使超高温140℃/5s 处理后,也有一定的活性残留。恢复活性的蛋白酶残留在产品中,缓慢作用于牛乳蛋白,分解α-酪蛋白和κ-酪蛋白,失去稳定作用,酪蛋白胶束聚集,轻微的出现少量蛋白质沉淀,严重的会导致UHT乳在贮存过程中出现蛋白质凝胶和乳清析出现像[6-7]。【本研究切入点】UHT乳作为众多乳制品中的重要角色,其货架期严重的受到嗜冷菌的影响。嗜冷菌影响奶制品货架期,需要分析嗜冷菌影响奶制品品质。【拟解决的关键问题】可视鉴定优势嗜冷菌的产蛋白酶能力,研究BCA蛋白定量与UHT乳样本稀释浓度间的最优线性关系,分析嗜冷菌分泌的耐热蛋白酶引起蛋白水解这一现象与温度、细菌添加量之间的关系,为延长UHT乳货架期提供依据。
1 材料与方法
1.1 材 料
嗜冷菌计数平板琼脂MPC购自北京路桥技术股份有限公司,营养肉汤和磷酸盐缓冲液(PBS)均购自北京路桥技术股份有限公司,高蛋白脱脂奶粉购自内蒙古伊利实业股份有限公司,UHT乳购自新疆西域春乳业有限责任公司,BCA蛋白定量试剂盒够自新疆鼎枫生物科技有限公司,磷酸盐缓冲液(PBS),葡萄糖蛋白胨水均购自北京路桥技术股份有限公司,天根细菌基因组提取试剂盒购自天根生化科技(北京)有限公司。
1.2 方 法
1.2.1 原料乳中嗜冷菌的分离纯化
原料乳收集之后需要对其进行酸盐缓冲液对原料乳进行梯度稀释,对稀释后的原料乳进行混培,取1 mL奶样与9 mLPBS混合震荡均匀制成10-1梯度稀释液,每个样品做原液和10-1至10-5稀释梯度,每个稀释梯度吸取1 mL于培养皿中,每个稀释梯度做两个平行,将嗜冷菌计数琼脂培养基冷却至40℃的嗜冷菌计数琼脂培养基,缓慢倒入培养皿,充分摇匀、静置凝固,置于6.5℃培养箱中培养10 d[8]。10 d后将平板取出,仔细观察其菌种菌落形态、颜色、光滑程度等,并按其菌落形态编号进行嗜冷菌纯化保存备用[9]。
1.2.2 嗜冷菌基因组DNA提取与PCR反应
样品中基因组DNA采用天根细菌基因组试剂盒按照说明书方法提取,以2%琼脂糖凝胶电泳检测DNA的完整性、纯度、片段大小及浓度[10]。
嗜冷菌16S rDNA序列根据文献[10]设计合成引物,引物序列选择嗜冷菌通用引物,引物序列为:16S(F)5′-AGAGTTTGATCMTGGCTCAG-3′;16S(R):5′-CGGYTACCTTGTTACGACTT-3′PCR反应体系:根据文献报告[11]确定25 μL的PCR最佳反应体系和反应程序。PCR反应体系25 μL:2×Taq·Mix12.5 μL,上、下游引物(10 μmol/mL)各1 μL,模板DNA为2 μL,无菌水为8.5 μL。PCR反应程序:95℃预变性5 min;95℃变性30 s;54℃退火30 s;72℃延伸2 min;循环35次;72℃延伸10 min;冷却4℃。PCR扩增产物可参考《分子克隆试验指南(第三版)》[12]使用浓度为2.0%的琼脂糖凝胶进行电泳检测。将扩增后的16S rDNA序列送至北京鼎国昌盛生物技术有限责任公司测序。所得扩增序列登陆(www.ncbi.nlm.nih.gov/)应用BLAST程序与数据库中的已有细菌16S rDNA序列同源相似性分析[13]当待检菌株的身份鉴定%ID>99代表鉴定结果准确,%ID>90代表同源性较强[14-15]。
1.2.3 脱脂乳平板法鉴定假单胞菌的产蛋白酶能力
3 g脱脂高蛋白奶粉+2.35 g嗜冷菌平板计数琼脂+100 mL蒸馏水,搅拌均匀,121℃高压灭菌15 min,冷却至40℃倒入培养皿,静置冷却,制成含3%脱脂高蛋白脱脂奶粉的乳平板。在乳平板中心做一圆孔,圆孔中注入30 μL活化好的菌液,将乳平板21℃培养25 h, 观察是否形成蛋白水解圈[16]。
1.2.4 BCA蛋白浓度测定标准曲线的制作
通过BCA蛋白试剂盒测定不同嗜冷菌添加量、储存温度、时间点的乳蛋白含量,在碱性条件下,蛋白将Cu2+还原为Cu+,Cu+与BCA 试剂形成紫蓝色的络合物,测定其在562 nm 处的吸收值,根据标准曲线,计算消化产物蛋白的浓度。
BCA工作液的配置:将试剂A与试剂B按照体积比50∶1比例混合,配成BCA工作液。如:50 mL试剂A与1 mL试剂B混合,配制成51 mL BCA工作液。
(1)将总体积为20 μL的待测样品注入到96孔酶标板中,每样3份。向微孔板中加入200 μL BCA工作液,混匀,37℃放置30 min。
(2)测定562 nm处的吸光值,并记录读数。以不含标准溶液的样品吸光值作为空白对照。
(3)以A562吸光值为纵坐标,样品含量作为横坐标,绘制标准曲线。表1
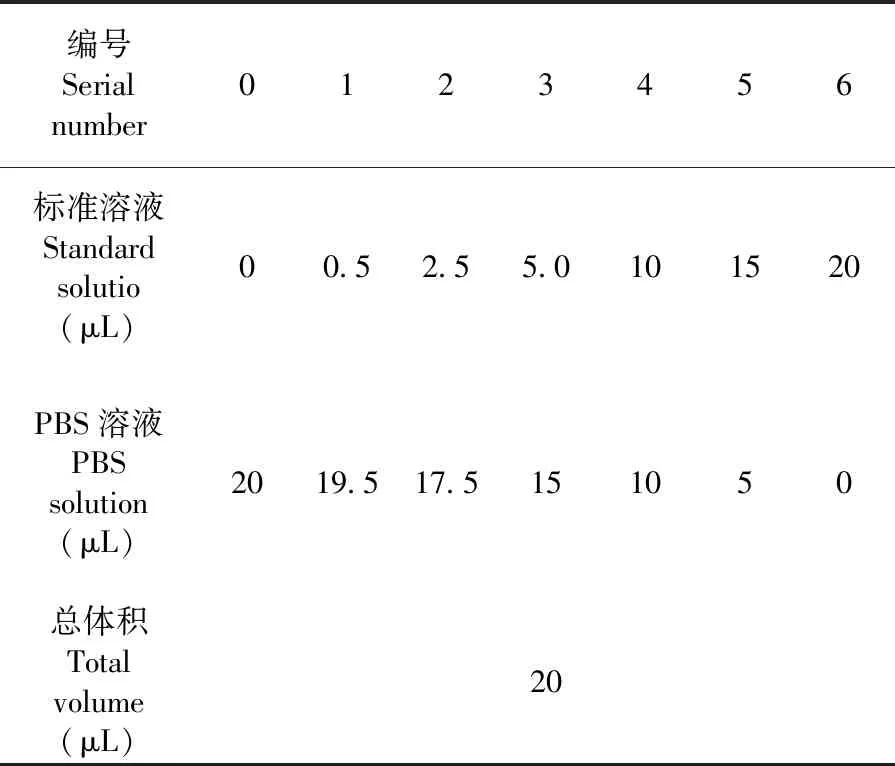
表1 标准曲线制作
1.2.5 不同稀释倍数的UHT乳在蛋白浓度测定试验中的线性关系
设计UHT乳稀释PBS磷酸缓冲液中的稀释倍数为8、12、16、20、24、28倍,制作线性关系图。
1.2.6 UHT乳中蛋白浓度变化与嗜冷菌添加量和储存温度的关系
选择同一批次的UHT乳为基础液态奶。
将产蛋白酶能力最强菌株的磁珠复活在嗜冷菌平板计数琼脂上21℃恒温培养25 h,用PBS缓冲液冲洗培养皿上的菌落,将菌液转至空无菌玻璃管中,将菌液调至酶标仪450 nm波长下吸光值为0.5,将菌量调整为103、104、105CFU/mL。
取200 mL UHT乳加入无菌锥形瓶共计9瓶,共分为3组,每组3瓶,每组分别接入103、104、105CFU/mL的菌液1 mL。放入不同温度下4、7及21℃培养168 h(7 d),每隔24 h取样测定1次,测定样品中蛋白浓度。
1.2.7 假单胞菌胞外蛋白酶对UHT乳中蛋白质的影响
取15 mL UHT乳于无菌瓶中,共3份,每份添加1 mL 105CFU/mL的菌液后密封,置于21℃的恒温箱中,培养7 d后,除去上层乳样,留沉淀部分。
2 结果与分析
2.1 嗜冷菌筛选及鉴定结果
研究表明,经过培养、纯化,在33份生鲜乳样品中,筛选出212株嗜冷菌,其中11株菌所占比例较大,确定为优势嗜冷菌。图1
图1 嗜冷菌PCR鉴定的凝胶电泳图谱
2.2 假单胞菌产蛋白酶能力脱脂乳平板法鉴定
研究表明,透明圈的大小反应了菌株分泌胞外蛋白酶的能力。其中99号菌的产蛋白能力最强,其次是93号菌和36号菌,最后为6号菌产蛋白酶的能力最弱,其余菌株产蛋白酶能力极弱,选择产酶能力最强的99号菌株做为原料乳中具有的代表性的优势嗜冷菌进行后续试验。测序后所得到的基因序列通过BLAST数据库比对并建系统发育树,99号菌株与假单胞菌同源性达到100%,确定99号菌株为假单胞菌。图2,图3,表2

图2 乳平板鉴定结果

图3 进化树构建结果
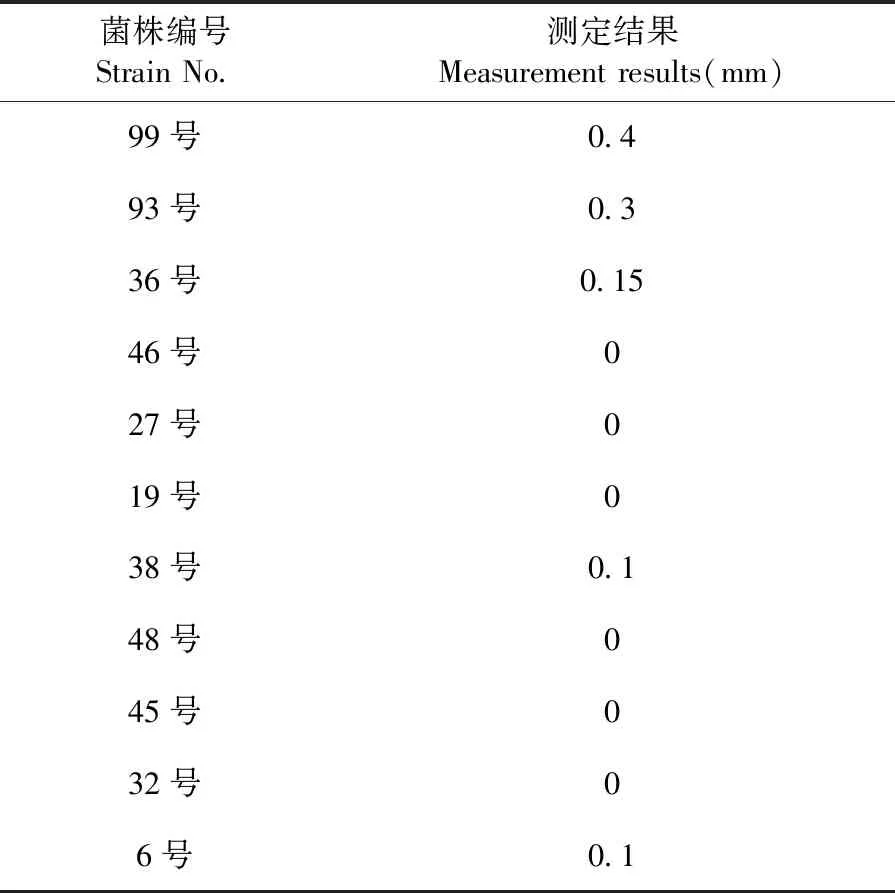
表2 乳平板鉴定结果
2.3 BCA蛋白浓度测定标准曲线结果
研究表明,标准曲线线性关系良好,相关系数R2达到0.993 3。图4

图4 蛋白浓度测定标准曲线
2.4 UHT乳不同稀释倍数对蛋白浓度测定影响
研究表明,UHT乳在28倍稀释浓度下,相关系数R2达到了0.998,线性关系最好,后续蛋白浓度测定试验均采用经过稀释28倍的UHT乳。图5~10
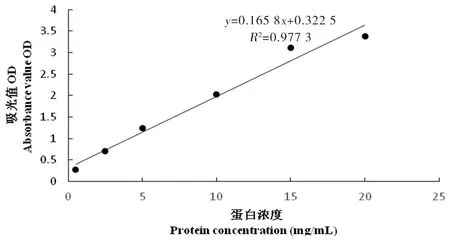
图5 8倍稀释浓度标准曲线
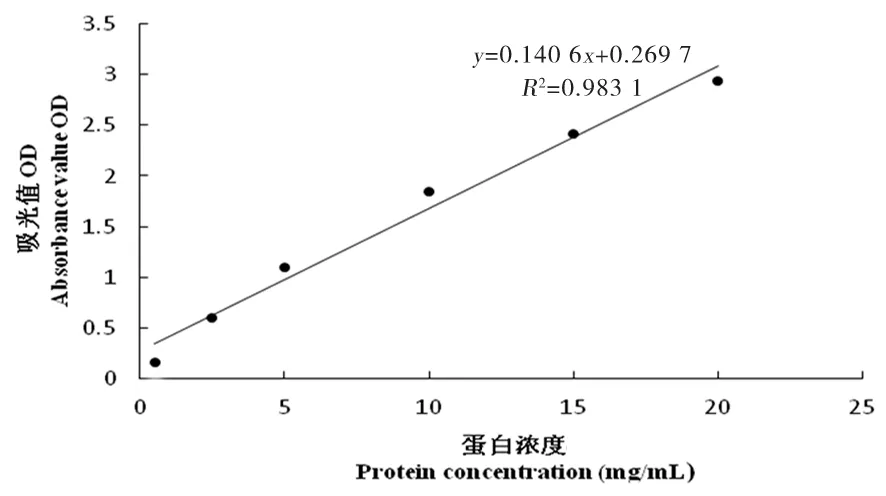
图6 12倍稀释浓度标准曲线
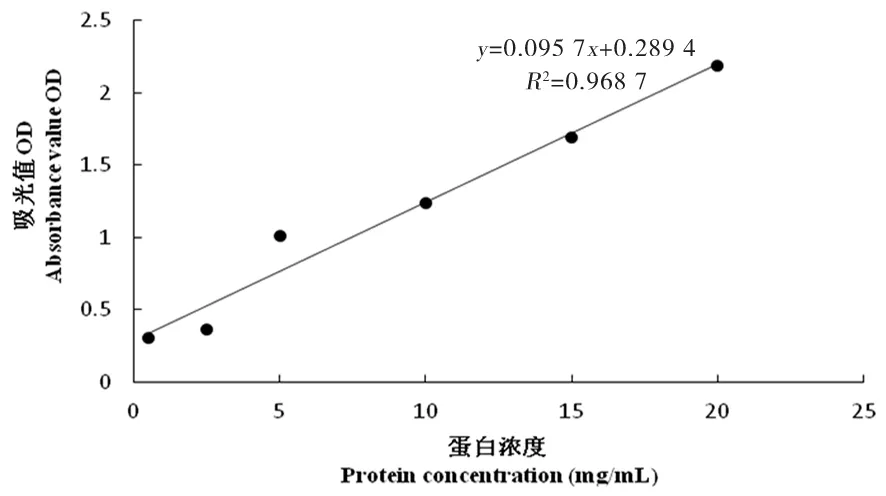
图7 16倍稀释浓度标准曲线
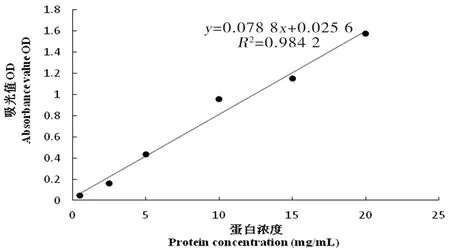
图9 24倍稀释浓度标准曲线

图10 28倍稀释浓度标准曲线
2.5 蛋白浓度与储存温度和接菌量的关系
研究表明,细菌添加量为103CFU/mL的试验组在第7 d时,21℃条件下蛋白浓度0.136 mg/mL度显著(P<0.05)低于7℃条件下的蛋白浓度0.143 mg/mL,4℃试验组随着时间的推移蛋白浓度的变化差异不显著(P>0.05)。当样品乳添加菌量为104CFU/mL时,7℃蛋白浓度在第6 d出现显著(P<0.05)下降,蛋白浓度为0.143 mg/mL,在第7 d为最低值0.141 mg/mL;21℃时蛋白浓度在第3 d开始显著(P<0.05)下降,在第5 d时蛋白总浓度极显著(P<0.01)下降,并在第7 d达到最低值0.137 mg/mL。当样品乳菌液浓度为105CFU/mL在21℃条件下储存第7 d时,蛋白浓度在所有试验组中达到最低值0.128 mg/mL,蛋白浓度极显著(P<0.01)低于103CFU/mL试验组在相同条件下的蛋白浓度0.136 mg/mL。图11~13

注:按蛋白浓度由高到低a、b、c、d、e(P<0.05),按顺序排序,字母相同为不显著(P>0.05),大写字母为极显著(P<0.01)。下同
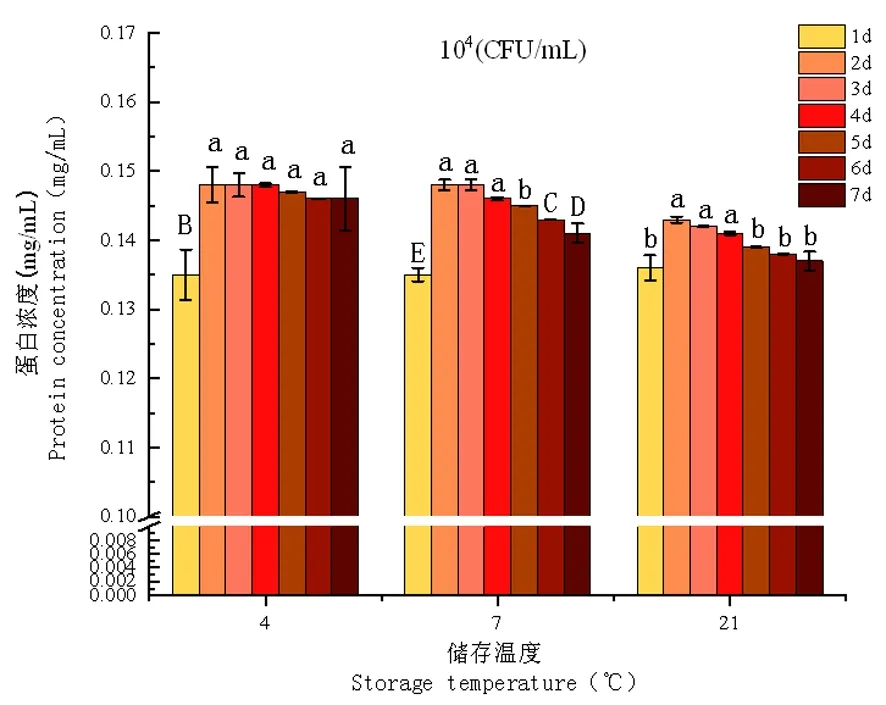
图12 104CFU/mL接菌量下UHT乳蛋白浓度变化

图13 105CFU/mL接菌量下UHT乳蛋白浓度变化
2.6 样品在不同条件下蛋白浓度的显著性
研究表明,4℃条件储存下,添加菌量为103、104、105CFU/mL的试验组蛋白浓度变化差异均无显著性(P>0.05);添菌量在103CFU/mL时,21℃试验组的蛋白浓变化差异度极显著(P<0.01);在添菌量在104CFU/mL时,7℃和21℃试验组的蛋白浓度变化差异显著(P<0.05);在添菌量在105CFU/mL时,21℃试验组蛋白浓度变化差异极显著(P<0.01)。
2.7 假单胞菌胞外蛋白酶导致的UHT乳中蛋白质沉淀
研究表明,假单胞菌蛋白酶水解了酪蛋白胶粒外层的κ-casein后,蛋白胶粒的稳定性遭到破坏,造成牛奶在贮存过程中出现沉淀、凝胶、蛋白水解等,缩短牛奶的货架期。添加1 mL含105CFU/mL假单胞菌菌液的UHT乳在21℃的恒温箱中培养7 d后,UHT乳出现了明显蛋白沉淀。图14

图14 胞外蛋白酶导致的乳蛋白沉淀变化
3 讨 论
3.1生鲜乳作为嗜冷的优良培养基,在低温下得益于生鲜乳的营养成分可迅速繁殖[11],其代谢产生的耐热蛋白酶,破坏乳中营养成分,改变蛋白质结构使结构发生变性[4]。
结合16Sr DNA序列同源性分析鉴定出嗜冷菌212株,其中11株假单胞菌为优势嗜冷菌,此前报道的假单胞菌是对乳制品品质影响最主要的因素[17-18]与试验结果一致。
嗜冷菌菌株之间产蛋白酶能力有所不同,为保证试验的可靠性与准确性,试验采用乳平板可视鉴定法鉴定出产蛋白酶能力最强的菌株为99号菌株假单胞菌,其产生的耐热蛋白酶可分解培养基中的蛋白质,出现明显的水解圈,魏超[19]等研究结果与试验结果相符。
储存温度升高时,乳样品内的蛋白浓度相应的降低[20]。试验中,添加菌量为103、104和105CFU/mL的试验组,均在储存温度为21℃时达到蛋白总量最低值,与相关文献[21-23]报道相一致。
3.2试验添加嗜冷菌模拟被污染的生鲜乳,随着添菌量的加大和时间的延长,添加菌量为105CFU/mL试验组在第7 d时,最低蛋白浓度为0.128 mg/mL,极显著(P<0.01)低于103CFU/mL试验组的第7 d蛋白浓度0.136 mg/mL,与王娇等[24-25]通过在灭菌原料乳中接入经筛选得到的优势嗜冷菌菌株,检测得到随着反应时间的增加,得到乳中蛋白浓度明显降低的结果与试验得到结论一致。
3.3生鲜乳中的嗜冷菌来源主要是因其生产环节的污染导致生鲜乳在运送的过程中会出现大量繁殖,从而使乳品质遭到破坏[26-27]。但运送过程中的储存温度,对嗜冷菌的生长繁殖也非常重要。试验中,在4℃条件储存下的103、104和105CFU/mL的试验组蛋白浓度变化差异均无显著性(P>0.05),蛋白浓度变化平稳。而在21℃储存条件下,3组试验组的蛋白浓度都有显著和极显著的变化。在2℃下贮藏和运输的生鲜乳生产的UHT乳要比在6℃下贮藏运输的生鲜乳生产的UHT乳的保质期要长[28],应尽量将生鲜乳避免光线下保存以及在4℃以下贮藏为最佳;与洪青等[29]所阐述的生鲜乳进入贮存罐迅速冷却到4℃是抑制乳中嗜冷菌生产蛋白酶从而达到预防乳制品蛋白降解。
应避免乳制品在生产环节中受到细菌的污染,生鲜乳采集过程中奶牛乳房和挤奶设备的清洗和消毒是必不可少的,更要避免运输和加工过程的二次污染[30-31],尽快运输到工厂,防止嗜冷菌大量的繁殖代谢,使原料乳中嗜冷菌含量保持在最低水平,减少蛋白酶的产生,从而延长UHT乳的货架期[32-33]。
4 结 论
在33份生鲜乳样品中,共筛选出212株嗜冷菌。假单胞菌为生鲜乳中优势嗜冷菌,分离率为5.19%。99号菌株假单胞菌产蛋白酶能力最强,在UHT乳样品接菌量相同的情况下,储存温度高的试验组蛋白浓度明显低于低温储存的试验组,UHT乳低温储存的重要性。在储存温度相同时,乳样品接菌量越大,相同时间内的蛋白浓度越低。

