铜锑钢抗氧化性能的第一性原理研究
伍 斌 卢冠杰 董 瀚 史 文 王 洋
(1.上海大学 材料科学与工程学院,上海 200444; 2.上海大学 计算机工程与科学学院,上海 200444)
耐候钢长期应用于大气环境,提高其耐蚀性一直是研究热点。通过在低合金钢中添加不同的合金元素能够显著提高钢材的大气稳定性和耐蚀性。低碳耐酸钢是一种掺杂锑等合金元素的低合金钢,研究表明,锑在酸性溶液中能够抑制阳极溶解和氢脆,从而降低腐蚀速率[1]。Chen等[2]研究了不同含锑量的低合金钢在高浓度氯化物溶液中的腐蚀行为,发现添加锑元素可以在钢表面形成保护性Sb2O5氧化膜,后续学者又在含锑钢基础上添加Cu元素以进一步提高钢材的耐蚀性。Park等[3]通过电化学和失重试验研究了含铜锑低合金钢的腐蚀行为,结果表明腐蚀产物层中存在金属(Fe、Sb和Cu)的氧化物。此外,研究发现低合金钢中的Cu在酸性溶液中能够通过形成保护性的CuO从而提高钢的耐蚀性[4]。大量试验证明Sb和Cu能够形成氧化物提高钢材耐蚀性,并且在提升耐蚀性方面具有协同作用,但对于两者氧化物形成过程的微观机制的研究尚无详细报道。
基于密度泛函理论(density functional theory, DFT)的第一性原理计算可以从原子尺度研究合金的氧化机制。吸附是材料腐蚀的起始阶段,减弱腐蚀介质在材料表面的吸附及降低材料表面活性等一直是腐蚀领域研究的重点。Blonski等[5-6]利用密度泛函理论结合热力学研究了O原子和O2分子在Fe(100)表面吸附的电子、磁性和结构性质,并提出O2在Fe(100)表面吸附时发生解离。Tan等[7]研究了O原子在Fe(110)上的吸附,探究了O原子吸附引起的衬底原子和电子结构的变化,并对吸附物O原子的电子性质进行了分析。Chen等[8]通过计算O2和H2O在Fe(100)表面吸附的相互作用,讨论了钢筋的腐蚀机制和腐蚀产物的形成过程。陈建辉等[9]研究了Nb表面氧的吸附和扩散行为,分析了覆盖度对O结合能的影响。
本文以含铜、锑耐候钢作为研究对象,通过第一性原理方法计算了O原子在α-Fe(100)纯表面及Sb、Cu掺杂表面的吸附能,功函数和bader电荷等,研究了Sb和Cu掺杂对铜锑钢表面氧化行为的影响以及两者金属氧化物形成的微观机制。
1 计算模型和方法
1.1 计算方法
铁素体性质和表面性质的计算均使用平面波基组和周期性边界条件求解Kohn-Sham方程,采用广义梯度近似(generalized gradient approximation, GGA)的Perdew-Burke-Ernzerhof(PBE)描述电子的交换关联函数,Ion cores采用投影缀加波方法(projector augmented-wave, PAW)描述[10-11]。布里渊区k点用Monkhorst-Pack方法以Gamma点为中心采样。在所有O原子的表面吸附计算中,平面波截断能取450 eV,k点取9×9×1。电子自洽计算的收敛标准为10-4eV,当体系中每个原子的应力小于0.1 eV/nm时,弛豫终止。本文非静态计算允许所有原子弛豫。除特殊说明外,所有计算结果均是在VASPsol[12-13]方法模拟的水溶液环境中获得的,水的介电常数为标准值80 F/m[14]。
1.2 理论模型
本文使用bcc型Fe晶胞,晶格常数为a=b=c=0.344 nm,与其他文献的计算值(0.345 nm)相差在1%以内[15];在此基础上构建p(2×2)的基体模型a=b=0.566 nm,c=2.275 nm,与其他文献的计算值相同[16-17]。由于铁素体具有铁磁性,需要考虑磁性对计算结果的影响。根据相关文献,确定Fe磁矩为2.32 μB[18-19],Sb磁矩为3.15 μB[20],Cu磁矩为2.00 μB[21],O磁矩为0.04 μB[22]。
1.3 吸附位点
根据Blonski等[23]的研究,α-Fe(100)表面吸附O原子时存在3个稳定吸附位点,分别是顶位T、桥位B和洞位H。因此对于纯α-Fe(100)表面,本文主要考虑了T、B和H 3种位点的吸附,如图1(a)所示。当原子X(Sb或Cu)发生掺杂时,单原子吸附位点发生变化,结合纯表面的吸附位点,排除位置相近或者对称的位点,本文认为X掺杂体系表面存在4种特征吸附位点,分别为掺杂原子顶位X和表层Fe顶位T、桥位B和洞位H,如图1(b)所示。Sb、Cu共掺时,存在4种吸附位点:顶位Sb、顶位Cu、桥位B和洞位H,如图1(c)所示。
2 计算结果与分析
2.1 O原子在α-Fe表面的吸附
含氧介质在体系表面吸附的倾向性可以通过吸附能进行判断,O原子在掺杂表面的吸附能计算公式为[24]:
Eads=EO/slab-(Eslab+EO)
(1)
式中:EO/slab为O原子与表面模型发生吸附后的总能量;Eslab为表面模型的能量;EO为孤立O原子的能量。吸附能可以反映表面对原子吸附能力的强弱,吸附能越低,即吸附能绝对值越大,说明表面对原子的吸附能力越强。
在实际环境中,含氧介质多以O2分子存在,结合Chen等[8]对O2分子在α-Fe表面的吸附位置的研究结果, 本文计算了6种吸附位置的吸附能,图2和表1分别为6种吸附态的O2分子在α-Fe(100)表面的吸附模型及吸附能。分析发现,O2分子横放于H位点的能量最低,体系最为稳定。此时O2分子会发生解离形成两个O原子进行单独吸附[8],鉴于其他工作[7,23,25]通过O原子吸附研究氧化行为的可行性,本文通过计算O原子在掺杂表面的吸附能探究Sb和Cu掺杂对氧化行为的影响。

表1 O2分子在α-Fe(100)表面不同位点的吸附能Table 1 Adsorption energy of O2 molecule at different sites on α-Fe(100) surface eV
图2 O2分子在α-Fe(100)表面吸附的稳定模型(红色为O原子)Fig.2 Stable models of O2 molecule adsorption on α-Fe(100) surface (red being O atom)
为了确定O原子在纯表面吸附的优先位点,计算了不同覆盖度下O原子在纯表面不同位点的吸附能, 结果如图3所示。图中,覆盖度定义为吸附原子与表面原子的个数比。从图3可以看出,在所有覆盖度下H位点的O原子吸附能均最低,此时O原子的吸附概率最高,其他文献也有类似结果[17,23,26]。因此后续计算将H位点作为O原子的吸附位点。
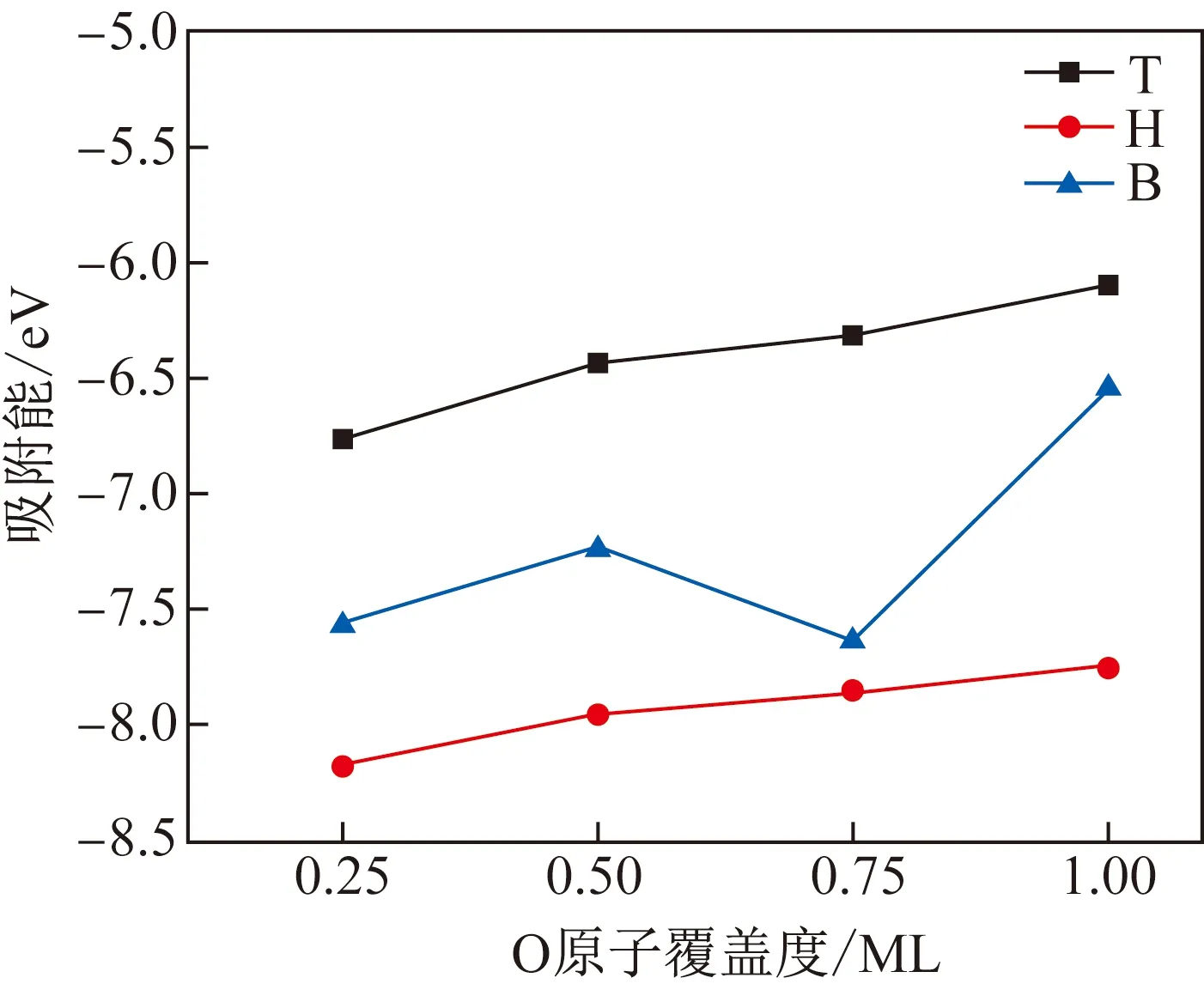
图3 O原子在α-Fe(100)表面不同位点的吸附能Fig.3 Adsorption energy of O atoms at different sites on α-Fe(100) surface
2.2 掺杂原子对O原子在α-Fe表面吸附行为的影响
不同覆盖度下O原子在未掺杂和掺杂不同元素的α-Fe(100)表面的吸附能和吸附距离如图4所示。发现未掺杂与Cu掺杂体系表面O原子的吸附能曲线变化规律相似,均随着覆盖度的增加而逐渐增大,两者O原子的吸附距离也有相似变化规律。这是由于吸附距离增大,O原子远离表面导致吸附行为不易发生,吸附能增大。对比Sb掺杂和Sb、Cu共掺体系表面的吸附能曲线,发现O原子的吸附能都呈现先上升后下降的趋势,吸附距离也有相似变化规律。

图4 O原子在未掺杂和掺杂不同元素的α-Fe(100)表面的吸附能(a)和吸附距离(b)Fig.4 Adsorption energy(a) and dasorption distances(b) of O atoms on α-Fe(100) surfaces not doped and doped with different elements
综上,Sb和Cu掺杂均明显提高了O原子的吸附能,减弱了O原子在基体表面的吸附效果,进而抑制了基体表面的氧化,当两者原子共掺时该作用更明显。
2.3 掺杂原子对O原子在α-Fe表面功函数的影响
当腐蚀介质在基体表面吸附后,金属和吸附体产生电荷迁移,从而对基体表面电子稳定性产生影响。电子稳定性可以反映基体表面发生阳极反应和阴极反应的容易程度,即发生电化学腐蚀的容易程度。功函数可以表征表面电子转移的势垒,其数值大表示电子稳定性高,不易失去电子。功函数的计算公式为[27]:
Φ=Evacuum-EFermi
(2)
式中:Evacuum为真空能级;EFermi为费米能级;Φ代表功函数。
图5是不同覆盖度下O原子在不同掺杂体系表面吸附的功函数。分析发现,当O原子未吸附时,Sb在α-Fe(100)表面掺杂会降低表面功函数,使得体系表面电子稳定性下降。Cu掺杂和Sb、Cu共掺体系的功函数大于未掺杂体系,说明Cu掺杂能提高体系的电子稳定性,当Sb、Cu共掺时该作用更明显。

图5 O原子在未掺杂和掺杂不同元素的α-Fe(100)表面吸附的功函数Fig.5 Work function of O atom adsorption on α-Fe(100) surfaces not doped and doped with different elements
当O原子吸附时,随着覆盖度的增加,未掺杂和Cu掺杂体系表面的功函数缓慢增大,说明O原子吸附有利于提高表面电子稳定性;Sb掺杂和Sb、Cu共掺体系表面的功函数快速增大,特别是在高氧环境下表面电荷稳定性显著提高。此外,进一步比较发现共掺体系中Sb对功函数的影响大于Cu。
2.4 掺杂原子对O原子在α-Fe表面电荷分析的影响
表2是不同覆盖度下O原子在不同掺杂体系表面吸附的bader电荷分析。电荷分析揭示了表面原子与外加原子之间键合的静电性质,可以分析原子的成键效果[28-29]。由表2可知,Fe、Sb和Cu均提供电子,O原子则接受电子。

表2 O原子在未掺杂和掺杂不同元素的α-Fe(100)表面吸附的原子电荷量Table 2 Atomic charge of O atoms adsorption on α-Fe(100)surfaces not doped and doped with different elements
从表2可见,未掺杂体系中Fe原子失电子量随着覆盖度的增大而增大,O原子得电子量增大。Sb掺杂体系表面Fe和O原子之间的电荷转移程度减弱,同时O和Sb原子的电荷转移量随着覆盖度的增大而快速增大,说明Sb和O原子成键形成氧化物的概率明显增大。掺杂Cu后,O原子得电子量明显下降,Fe失电子量幅度与未掺杂的情况接近,Cu失电子量幅度处于较低水平,说明Cu掺杂可以抑制O原子得电子。
当Sb、Cu共掺时,对比Sb掺杂体系发现,O原子在0.50~0.75 ML覆盖度下得电子量增大,在1.00 ML覆盖度下得电子量减少;Sb原子在0.25~0.75 ML覆盖度下失电子幅度增大,在1.00 ML下失电子量减小。对比Cu掺杂体系发现,O原子在0.25~1.00 ML得电子量增大;Cu原子在0.25~0.75 ML失电子幅度增大,在1.00 ML下失电子量减小。这说明共掺时Sb和Cu的协同作用促进Sb和Cu失电子,提高了含锑氧化物和含铜氧化物的形成概率,且含锑氧化物的形成概率大于含铜氧化物。
3 分析讨论
吸附能和吸附距离计算结果表明,Sb和Cu掺杂能增大O原子在基体表面的吸附能,从而阻碍O原子在基体表面吸附,抑制α-Fe(100)表面氧化。这与Zhang等[30]研究得出的Sb能够减缓钢表面氧化的结果一致。
功函数计算结果表明,Sb掺杂使得体系表面空松,在未吸附环境中其功函数低于未掺杂体系,致使表面电子稳定性降低,更易发生电化学腐蚀。该规律与Yang等[31]及Chen等[2]的研究结果一致,即在反应初期含锑钢的腐蚀速率增大。当O原子在体系表面吸附时,掺杂体系表面功函数增大,电子稳定性提高,减缓了表面电化学腐蚀。
Bader电荷分析证明,Sb、Cu共掺时两原子的协同作用会进一步增强两者的氧化成键效果,促进大量含锑氧化物和少量含铜氧化物的形成,并抑制含铁氧化物形成。Oku等[32]通过Fe-Sb合金的氧化试验发现,氧化锑峰先于氧化铁峰出现,与计算得出的含锑氧化物先于含铁氧化物形成的结果一致。
Ji等[4]对铜锑钢在模拟酸性溶液中的腐蚀机制进行了研究,认为第(i)阶段铁在界面区域发生腐蚀溶解;第(ii)阶段形成含铁氧化物;第(iii)阶段金属元素在钢表面形成Sb2O5和CuO氧化物;第(iv)阶段Sb和Cu氧化物作为保护层存在于基底上提高耐蚀性,如图6所示。从本文计算结果来看,更可能是在第(ii)阶段含锑氧化物先于含铁氧化物生成,并且含锑氧化物可以抑制含铁氧化物的生成。在第(iii)阶段含铜氧化物生成,其形成过程相较于含锑氧化物和含铁氧化物更为缓慢。

图6 铜锑钢在酸性环境中的腐蚀机制[4]Fig.6 Corrosion mechanism of copper-antimony steel in acidic environment[4]
4 结论
(1)O原子在Fe(100)表面最稳定的吸附位点为H位点。
(2)Sb和Cu在纯表面的掺杂能够明显增大O原子的吸附能,Sb和Cu共掺该作用更显著。元素掺杂减弱了O原子在体系表面的吸附效果,表面氧化倾向降低,同时O原子在掺杂表面吸附会增加体系表面的功函数,提高电子稳定性。
(3)随着O原子覆盖度的增加,Sb和O原子之间成键能力增强,Cu和O原子之间电荷作用略有增强,Sb、Cu共掺时成键能力进一步增强。Sb和Cu掺杂均会减弱Fe和O原子之间相互作用,抑制Fe和O原子成键。
(4)在含氧环境中,Sb、Cu共掺会抑制基体表面氧化,两者的协同作用会使Sb与O原子反应形成大量含锑氧化物,Cu与O原子反应形成少量含铜氧化物。由于表面氧化倾向降低,原子之间发生竞争性氧化,抑制含铁氧化物形成。

