原发性肾病综合征儿童外周血CD14 单核细胞TLR2 的表达及其与IL-7 表达水平的相关性分析
彭文娟,刘京涛,李晓琳
(三门峡市中心医院儿科,河南 三门峡 472000)
儿童原发性肾病综合征(Idiopaticnephrotic syndrome,INS)是儿科最常见的肾小球疾病,占小儿肾病综合征总数的90%以上,典型表现为大量持久的蛋白尿、高度水肿、低蛋白血症及高脂血症等症状[1]。INS 的常见病因为感染、遗传、免疫等因素,患者肾脏一般不能完全恢复为正常功能且复发率也比较高。病程延长,是患病儿童肾脏发生衰竭的较为重要的原因之一[2]。多数肾小球肾炎的发病机制是免疫炎症功能紊乱[3]。Toll 样受体2(Tolllike receptor 2,TLR2)为Toll 样受体(Toll-like receptors,TLRs)家族成员,结构上属于Ⅰ型跨膜受体蛋白,其通过识别与病原有关的分子模式和某些内源性配体,从而导致信号转导,炎症介质被释放[4]。既往研究显示,Toll 样受体可能通过炎性反应这一途径介导肾组织的损伤过程,且与INS 病情活动具有相关性[5-6]。白细胞介素-7(Interleukin-7,IL-7)主要通过IL-7 受体α 链发挥作用,可以调控并维持免疫细胞分化、发育和增殖,在感染、肿瘤、自身免疫性疾病中扮演着关键的角色[7]。既往研究显示,IL-7 可以强化CD14 单核细胞的功能,在INS 中发挥促进炎症的效果、诱导疾病进展的作用[8]。基于此,我们推测INS 外周血CD14 单核细胞TLR2 与IL-7 等炎症因子可能通过某种机制相互调节,共同参与了INS 发生、发展。本研究探讨INS外周血CD14 单核细胞TLR2 的表达及其与IL-7表达水平,分析二者相关性,以期为临床治疗提供一定的理论基础。
1 资料与方法
1.1 一般资料 选择2019 年1 月到2021 年1 月在本院收治的112 例被确诊的INS 患儿作为观察组,其中男53 例,女59 例,年龄2~16 岁,平均(8.22±2.78)岁。病理学分类:微小病变(Minimal changing disease,MCD)49 例,系膜增生性肾小球肾炎(Mesangial prolif-erative glomerulonephritis,MsPGN)27 例,膜性肾病(Membranous nephropathy,MN)19 例,局灶节段性肾小球硬化(Focal segmental glomerulus sclerosis,FSGS)17 例。纳入标准:(1)符合《儿童常见肾脏疾病诊治循证指南》[9]诊断标准;(2)血清白蛋白含量低于25 g/L,24 h 尿蛋白定量超过50 mg/(kg·d),尿蛋白大于3+,伴有水肿等临床症状;(3)肾脏生物检查组织学切片肾小球总数超过20 个;(4)不伴其他自身免疫性疾病。排除标准:(1)先天性或遗传性肾病综合征患儿;(2)继发于糖尿病、乙肝丙肝、多发性骨髓瘤等继发性肾病综合征患儿;(3)合并严重疾病,如自身免疫、肝脏和造血系统等疾病;(4)对本研究所用药物过敏的患儿;(5)临床资料不完整患儿。对照组另选同期体检的健康儿童112 例,其中男54 例,女58例,年龄3~15 岁,平均(8.84±2.51)岁。本研究通过医院伦理委员会,患者及家属了解并同意。
1.2 主要试剂和设备 FACS Calibur 流式细胞分析仪购自美国Becton-Dickinson 公司;流式专用试管购自上海百赛生物有限公司;罗氏cobas6000 C501 全自动生化仪购自德国罗氏公司;医用低速离心机购自德国Heraeus 公司;小鼠抗人CD14 单抗(荧光素PC-5 标记)、IgG2a 同型对照、FITC 标记小鼠抗人TLR2 单抗均购自北京百奥莱博科技有限公司;所用ELISA 试剂盒均购自北京索莱宝科技有限公司;所用免疫比浊法试剂盒均购自上海酶联生物科技有限公司。
1.3 INS 患儿外周血CD14 单核细胞TLR2 检测方法 采集所有患儿清晨空腹静脉血3 mL,置于EDTA 管中,具体检测步骤:首先,取三支样品测定管并标记为A、B、C,加入抗凝血剂100 μL,再加入受体封闭剂5 μL。涡旋器振荡,混匀并在暗室中孵育10 min;然后,在A、B 管中均加入PE-IgG2a 5 μL,在B、C 管中均加入FITC-CD14 20 μL,最后在A、C 管中分别加入FITC-IgG1 20 μL、PE-TLR2 5 μL,振荡混匀,室温暗室培养20 min;A、B、C 管中均加入500 μL 红细胞裂解液后,振荡混匀并在室温下避光10 min;最后,进行离心,转速1 500 r/min,离心半径15 cm,离心5 min,弃上清液,加入PBS 液2 mL,振荡混匀,再1 500 r/min,离心5 min,弃上清液,加入PBS 液500 μL,振荡混匀,应用FACS Calibur 流式细胞仪上机检测,同时建立无标记抗体的阴性对照。在运行机器之前,使用标准荧光微球调整仪调节对应的变异系数。测试后,使用Cell quest 软件进行检测。TLR2 的表达率计算方式为:CD14 和TLR2 抗体染色的双阳性细胞百分比。
1.4 INS 患儿血清学指标检测方法 采集所有患儿清晨空腹静脉血5 mL,使用低温离心机进行离心,转速2500 r/min,离心半径15 cm,离心10 min,吸取其上清液,然后将其放于-80 ℃冰箱中保存待测。
应用罗氏cobas6000 C501 全自动生化仪,采用免疫比浊法测定血浆高敏C-反应蛋白(High sensitive c-reactive protein,hs-CRP)、免疫球蛋白G(Immunoglobulin G,IgG)、免疫球蛋白M(Immunoglobulin M,IgM)水平;采用ELISA 检测法测定血清白介素-7(Interleukin-7,IL-7)、白介素-6(Interleukin-6,IL-6)、白介素-8(Interleukin-8,IL-8)及肿瘤坏死因子-α(Tumer necrosis factor-alpha,TNF-α)水平,操作过程严格按照试剂盒说明进行。
1.5 统计学处理 采用SPSS 22.0 软件对所得数据进行分析,满足正态分布的计量资料均以()表示,采用t 检验分析比较两组间差异性;计数资料均以率(%)表示,分类资料之间比较采用χ2检验;采用Pearson 相关性分析INS 患儿外周血CD14 单核细 胞TLR2 的表达及其与IL-7、hs-CRP、IgG、IgM 表达水平的相关性;绘制受试者工作特征曲线(Receiver operating characteristic curve,ROC),计算ROC 曲线下面积(Area under curve,AUC),评估TLR2、IL-7 对INS 患儿发病的预测价值,P<0.05为差异有统计学意义。
2 结果
2.1 观察组和对照组血清hs-CRP、IgG、IgM 水平比较 两组血清hs-CRP、IgG、IgM 水平比较具有统计学差异(P<0.05),见表1。
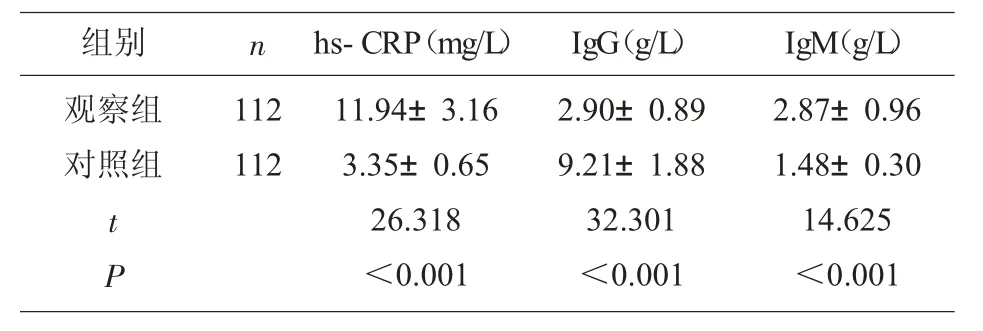
表1 两组血清hs-CRP、IgG、IgM 水平比较
2.2 两组TLR2、IL-7、IL-6、IL-8、TNF-α 表达水平比较 观察组外周血CD14 单核细胞TLR2、IL-7、IL-6、IL-8、TNF-α 表达水平均显著高于对照组(P<0.05),见表2。

表2 两组TLR2、IL-7、IL-6、IL-8、TNF-α 表达水平比较
2.3 INS 患儿TLR2 与IL-7 表达水平的相关性分析 INS 患儿外周血CD14 单核细胞TLR2 与IL-7表达水平呈正相关(r=0.479,P<0.001),见图1。
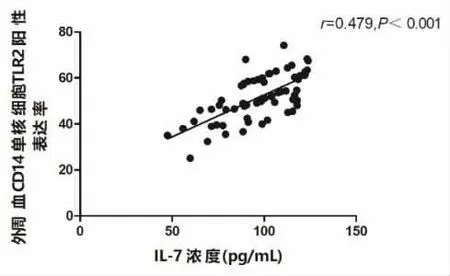
图1 INS 患儿TLR2 与IL-7 表达水平的相关性分析
2.4 INS 患儿TLR2、IL-7 与hs-CRP、IgG、IgM、IL-6、IL-8、TNF-α 相关性分析 INS 患儿外周血CD14 单核细胞TLR2 与hs-CRP、IL-6、IL-8、TNFα 呈正相关(P<0.05);血清IL-7 与IgG 呈负相关,与hs-CRP、IL-6、IL-8、TNF-α 呈正相关(P<0.05);而TLR2、IL-7 与IgM 均无相关性(P>0.05)。见表3。

表3 INS 患儿TLR2、IL-7 与hs-CRP、IgG、IgM、IL-6、IL-8、TNF-α 相关性分析
2.5 ROC 曲线分析TLR2、IL-7 对INS 患儿发病的预测价值 TLR2、IL-7 及联合检测预测INS 患儿发病的AUC 分别为0.714、0.674、0.908。见图2、表4。

图2 TLR2、IL-7 对INS 患儿发病的预测价值ROC 曲线图
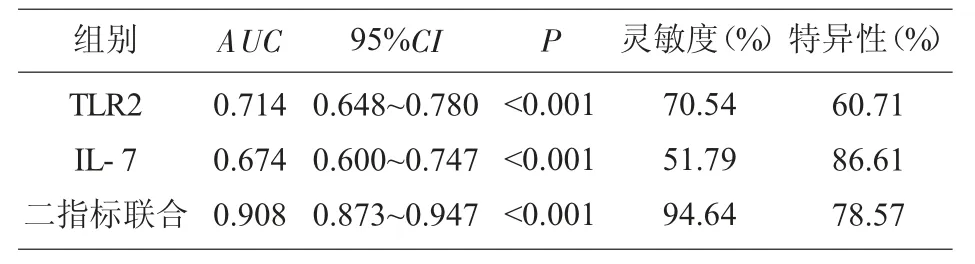
表4 TLR2、IL-7 及联合指标的ROC 曲线分析
3 讨论
INS 是儿童常见的肾小球疾病,其主要原因是肾小球毛细血管及基底膜的通透性增加,大量血浆蛋白经尿流失,肝脏合成脂蛋白增加,这些因素综合导致了儿童肾衰竭的发生[10]。目前,INS 的病因和发病机制尚未完全清楚。已有研究显示,机体细胞和体液免疫功能异常可能是导致发病主要原因,且TLRs 对INS 的发生、发展起重要作用[11]。本研究分析了INS 患儿的一般资料,发现血清hs-CRP、IgM 水平高于对照组,IgG 水平低于对照组。已有研究显示,hs-CRP 是一种非常敏感的炎症标志物。当机体发生炎症感染,或者遭体液介导的免疫应答导致的组织损伤时,血液中的CPR 在很长一段时间内保持在高水平[12]。而IgM 是一种高分子蛋白,其不容易通过肾小球滤过膜,当机体发生炎症反应时其浓度上调。所以IgM 的增加也可能与INS 患儿的继发感染有关。IgG 降低可能与INS 患儿加速分解、尿中丢失增加、淋巴细胞合成的减少和免疫抑制剂的应用相关[13-14]。结合本研究说明,hs-CRP、IgM 及IgG 可以分别以不同的方式参与儿童INS 的发病,并在发病中起到一定作用。
TLR2 是特异的I 型跨膜受体和病原模式识别受体,在炎症反应、细胞信号的传达、衰亡中扮演着重要的角色[15]。IL-7 是趋化因子家族中的成员之一,是骨髓基质细胞分泌的糖蛋白细胞因子,分子量为25KD,能够促进趋化因子分泌、募集炎症因子[16]。既往研究显示,IL-7 可以加速INS 患儿CD14单核细胞炎症细胞因子的分泌。IL-7 刺激的CD14单核细胞均可通过直接或接触的方式,诱导IL-6分泌从而使INS 患儿CD4+T 细胞活化[17]。本研究结果显示,INS 患儿外周血CD14 单核细胞TLR2、IL-7、IL-6、IL-8、TNF-α 表达水平均显著高于对 照组,且TLR2 与IL-7 表达水平呈正相关性。分析原因,这可能是由于INS 患儿机体TLR2 识别了某些内源性抗原,通过细胞内信号转导途径诱导人单核细胞激活NF-кβ,核内的相关基因被启动,传导出相应的mRNA,从而合成IL-7、IL-6、IL-8、TNFα 等细胞因子并释放到胞外,引起炎症反应。既往研究显示,TLR2 与其配体结合以后,激活下游信号转导分子,引起炎性因子的释放,使肾小球基底膜通透性增强,导致大量蛋白尿的产生[18]。结合本研究说明,外周血CD14+单核细胞TLR2、IL-7 与INS 的发生有密切关系,TLR2 可以通过炎性反应这一途径参与并调控肾组织的损伤过程。
本研究结果还显示,INS 患儿外周血CD14 单核细胞TLR2 与hs-CRP、IL-6、IL-8、TNF-α 呈正相关;血清IL-7 与IgG 呈负相关,与hs-CRP、IL-6、IL-8、TNF-α 呈正相关。既往研究显示,TLRs 还可以刺激和调节B 淋巴细胞表面标志物的表达,促进B 淋巴细胞增殖、细胞因子分泌和Ig 分泌功能[19]。结合本研究说明,T 淋巴细胞亚群和细胞炎症因子均可能参与INS 的发生和发展。T 淋巴细胞分泌的细胞因子在INS 患儿机体内会出现异常表达,其表达结果与健康儿童不同,同时还会介导相关细胞的免疫应答过程,在儿童体内进而引发超敏反应。通过ROC 曲线分析发现,TLR2、IL-7 联合检测INS 患儿发病的灵敏度、特异度最高,AUC 面积最大,且有较好的灵敏度和特异性,具有较大预测价值,提示外周血CD14 单核细胞TLR2、IL-7 在INS 发病中均起到一定作用。
综上所述,INS 患儿外周血CD14 单核细胞TLR2、IL-7 表达水平均明显上调,且两者具有正相关性,TLR2、IL-7 联合检测对判定INS 发病具有较高的预测价值。但本文还存在一定的不足之处,可进一步探讨INS 患儿外周血CD14 单核细胞TLR2调控的信号通路,以期为临床诊断和治疗INS 患儿提供可靠依据。

