管氏肿腿蜂毒液过敏原3基因的克隆及表达分析
汪斌伟,樊晓红,吴朝妍,朱家颖
(西南林业大学生物多样性保护学院,云南省森林灾害预警与重点实验室,昆明 650224)
膜翅目昆虫作为种类繁多的有毒动物类群之一,其毒液含有丰富多样的蛋白和多肽(Beckage and Gelman,2004;Danneelsetal.,2010;Diasetal.,2014)。其中,大多数社会性膜翅目昆虫的毒液能引起过敏反应,特别是对于敏感人群(Bilò,2011;Wormetal.,2014)。现有研究表明,社会性膜翅目昆虫毒液内含的磷脂酶A(Phospholipase A)、透明质酸酶(Hyaluronidase)、酸性磷酸酶(Acid Phosphatase)、抗原5(Antigen 5)等是导致人类过敏的致敏成分(Mǜller,2002;Spillneretal.,2014)。例如,胡蜂Polybiapaulista毒液磷脂酶A1能水解sn-1位的1, 2-二酰基-3-甘油磷脂的酯键,将这些底物转化为相应的溶质化合物并释放脂肪酸(Santosetal.,2007);黑腹虎头蜂Vespabasalis磷脂酶A1能够破坏生物膜的磷脂结构,引发严重的溶血,并导致动物的心功能障碍和死亡(Houetal.,2016)。
寄生蜂是一类膜翅目中的重要天敌昆虫,毒液作为该类群的关键寄生因子之一,具有调控寄主生长发育、抑制寄主免疫反应、影响寄主营养代谢等生理功能,在寄主体内发挥重要作用(Beckage and Gelman,2004;Kim-Joetal.,2019;Yangetal.,2021;李丽芳等,2021)。目前,通过对隶属茧蜂科Brcaoindae、姬蜂科Ichneumonidae、金小蜂科Pteromalidae等近10个科的20多种寄生蜂毒液组分进行鉴定(李丽芳等,2021),获得了上百种毒液蛋白,但是仅探明了丝氨酸蛋白酶同源物、钙网蛋白、RhoGAP等少数毒液蛋白的功能(Poiriéetal.,2014;Moreau and Asgari,2015;Wuetal.,2020;Huangetal.,2021;Quicke and Butcher,2021;李丽芳等,2021)。通过比较寄生蜂与社会性膜翅目蜂类之间的毒液组分发现,它们存在较大差异(Poiriéetal.,2014;Dashevsky and Rodriguez,2021)。如,寄生蜂毒液不像社会性膜翅目蜂类毒液一样富含致敏蛋白成分,仅酸性磷酸酶、过敏原3(Allergen 3)等个别致敏蛋白在寄生蜂毒液中被鉴定到,且除酸性磷酸酶普遍存在寄生蜂毒液中外,其他种类的致敏蛋白仅在少数寄生蜂(如,菜蛾盘绒茧蜂Cotesiaplutellae、丽蝇蛹集金小蜂Nasoniavitripennis和谷象金小蜂Anisopteromaluscalandrae)中被鉴定到(许俊峰和韩召军,2008;Dorémusetal.,2013;Perkinetal.,2015)。但是,目前尚不清楚这些寄生蜂毒液致敏蛋白的生理功能。
本文以天牛、小蠹虫等重要蛀干害虫的外寄生蜂—管氏肿腿蜂Sclerodermaguani为研究对象,在前期研究发现过敏原3(SgA3)为该蜂主要毒液组分之一的基础上(Zhu,2016),通过RT-PCR扩增SgA3基因的开放阅读框(Open reading frame,ORF)序列,分析其时空表达特征,原核表达并纯化SgA3重组蛋白,以期为今后进一步探究该毒液蛋白的生理功能奠定基础。
1 材料与方法
1.1 供试虫源
管氏肿腿蜂的饲养参照Zhuetal.(2013)的方法,利用刚化蛹的黄粉虫Tenebriomolitor作为寄主在室内进行继代饲养,利用蘸有20%蜂蜜水的脱脂棉球饲养成蜂。
1.2 SgA3基因克隆及序列分析
取羽化1~5 d的管氏肿腿蜂雌蜂,采用Trizol法提取其总RNA。利用分光光度计和1%琼脂凝胶电泳检测总RNA的浓度、质量和完整性,利用逆转录试剂盒RevertAid First Strand cDNA Synthesis Kit (Thermo Scientific),参照试剂盒说明书合成cDNA模板,产物置于-20℃保存备用。基于前期实验室从管氏肿腿蜂毒液器官转录组数据中获得的SgA3基因序列(Zhuetal.,2016),利用Primer Premier 5软件(Premier Biosoft International)设计PCR引物(正向引物5′-ATGATAAGATACG CGACATACGGT-3′和反向引物5′-TTATTTTACGT GATAGATTGGTTCGCCGATCC-3′)扩增SgA3基因的ORF序列。扩增PCR体系(25 μL):cDNA模板2 μL,正反向引物各1 μL,12.5 μL dNTP,8.5 μL ddH2O。PCR扩增条件为:94℃预变性3 min,94℃变性30 s,65℃退火30 s,72℃延伸1 min,设置循环35次;72℃终延伸10 min。利用1%琼脂糖凝胶电泳检测PCR产物后,测序由铂尚生物技术(上海)有限公司完成。
使用DNASTAR 7.1(Burland,2000)对测序得到的SgA3基因序列进行拼接和翻译,分析基因编码蛋白的预测分子量和等电点。采用BlastP(https://blast.ncbi.nlm.nih.gov/Blast.)对序列进行同源比对搜索,结构域使用SMART(http://smart.embl-heidelberg.de/)进行预测,信号肽利用SignalP 5.0(https://services. healthtech.dtu.dk/service.php?SignalP-5.0)预测,采用ClustalX 1.83进行多序列比对分析(Chennaetal.,2003)。
1.3 SgA3基因的表达特征分析
分别收集不同发育阶段(卵、早期幼虫、晚期幼虫、老熟幼虫、白茧蛹、黄茧蛹、黑茧蛹、羽化1~25 d雌蜂)的管氏肿腿蜂以及羽化1~5 d的管氏肿腿蜂雄成虫、雌成虫不同组织(毒液器官、卵巢、残体)于1.5 mL离心管中,液氮冷冻处理并充分研磨后加入Trizol(Invitrogen)试剂,-80℃保存备用。每个样品设置3个生物学重复。参照1.2的方法,提取每个样品的总RNA,采用逆转录试剂盒并以总RNA为模板合成相应的cDNA。依据1.2中获得的SgA3基因ORF序列,设计基因特异性引物(正向引物5′-CCATCTTCAAGTCCAAGTTC-3′和反向引物3′-CAACGGTAGCCAATTCATC-5′)。以18SrRNA基因作为内参(正向引物5′-TGGGCCGGTACGTTTA CTTT-3′和反向引物5′-CACCTCTAACGTCGCA ATAC-3′),采用qPCR(Real time fluorescence quantitative PCR,qPCR)技术,分析在不同发育阶段、雄蜂以及雌蜂不同组织中SgA3基因的表达特征。qPCR反应体系(20 μL)为:Bestar©qPCR mastermix(DBIR Bioscience)10 μL,正反向引物(10 μmol/L)各0.5 μL,cDNA 1 μL,ddH2O 8 μL。qPCR反应程序为:95℃预变性30 s;95℃变性5 s,60℃退火40 s,循环45次。
1.4 SgA3基因的原核表达
参照韩开健等(2021)的方法,运用PAS(PCR-based Accurate Synthesis)方法合成含有StuⅠ和HindⅢ酶切位点的SgA3基因(韩开健等,2021),利用限制性内切酶双酶切后依靠同源碱基互补配对,链接到表达载体pSUMO-Mut(南京钟鼎生物技术有限公司)。表达载体经菌落PCR及测序验证构建成功后,构建重组表达质粒,转入大肠杆菌Escherichiacoli表达菌株BL21(DE3)感受态细胞中进行原核表达。表达菌株经测序验证正确后置于LB(Lysogeny broth)培养液,37℃ 220 rpm振摇培养至菌体OD600为0.6~0.8,加入终浓度为0.5 mM异丙基-β-D-硫代半乳糖苷(Isopropyl-beta-D-thiogalactopyranoside,IPTG)再次诱导培养。取1 mL培养物离心弃上清,用100 μL PBS(Phosphate-buffered saline)缓冲液重悬菌液后离心弃上清,菌体沉淀经PBS再次重悬,对重悬液进行超声波破碎后,离心取上清液与沉淀。利用Ni-IDA -Sepharose CL-6B亲和层析柱纯化重组表达蛋白,将其收集后在PBS(pH7.4)中透析过夜后,加入PBS重悬。利用12% SDS-PAGE(Sodium dodecyl sulphate polyacrylamide gel electrophoresis)检测获得的菌液上清、沉淀中以及纯化后的蛋白,考马斯亮蓝R-250进行染色,过夜保存后利用脱色液脱色处理,对凝胶进行拍照观察并分析目标蛋白表达情况。
1.5 数据统计与分析
所获得的数据利用Excel进行整理。依照Q-GENE法计算基因的相对表达量(Mulleretal.,2002;Simon,2003)。采用SPSS软件进行LSD多重比较分析基因相对表达量的差异显著性(P<0.05),并使用Graphpad prism 8软件进行制图。
2 结果与分析
2.1 SgA3基因的克隆及序列分析
克隆得到长为699 bp的SgA3基因ORF序列,编码233个氨基酸,预测相对分子量为26.18 kDa,等电点8.42。信号肽预测结果显示,SgA3氨基酸序列N端1~23位氨基酸为信号肽序列。结构域分析发现,SgA3氨基酸序列中具有1个CAP(Cysteine-rich secretory proteins, antigen 5, and pathogenesis-related 1 protein)结构域,属于半胱氨酸分泌蛋白。多序列比对分析发现,SgA3与丽蝇蛹集金小蜂、粉蝶盘绒茧蜂、红火蚁和常见黄胡蜂过敏原3的氨基酸序列一致性分别为50.44%、50%、48.89%和47.83%(图1)。
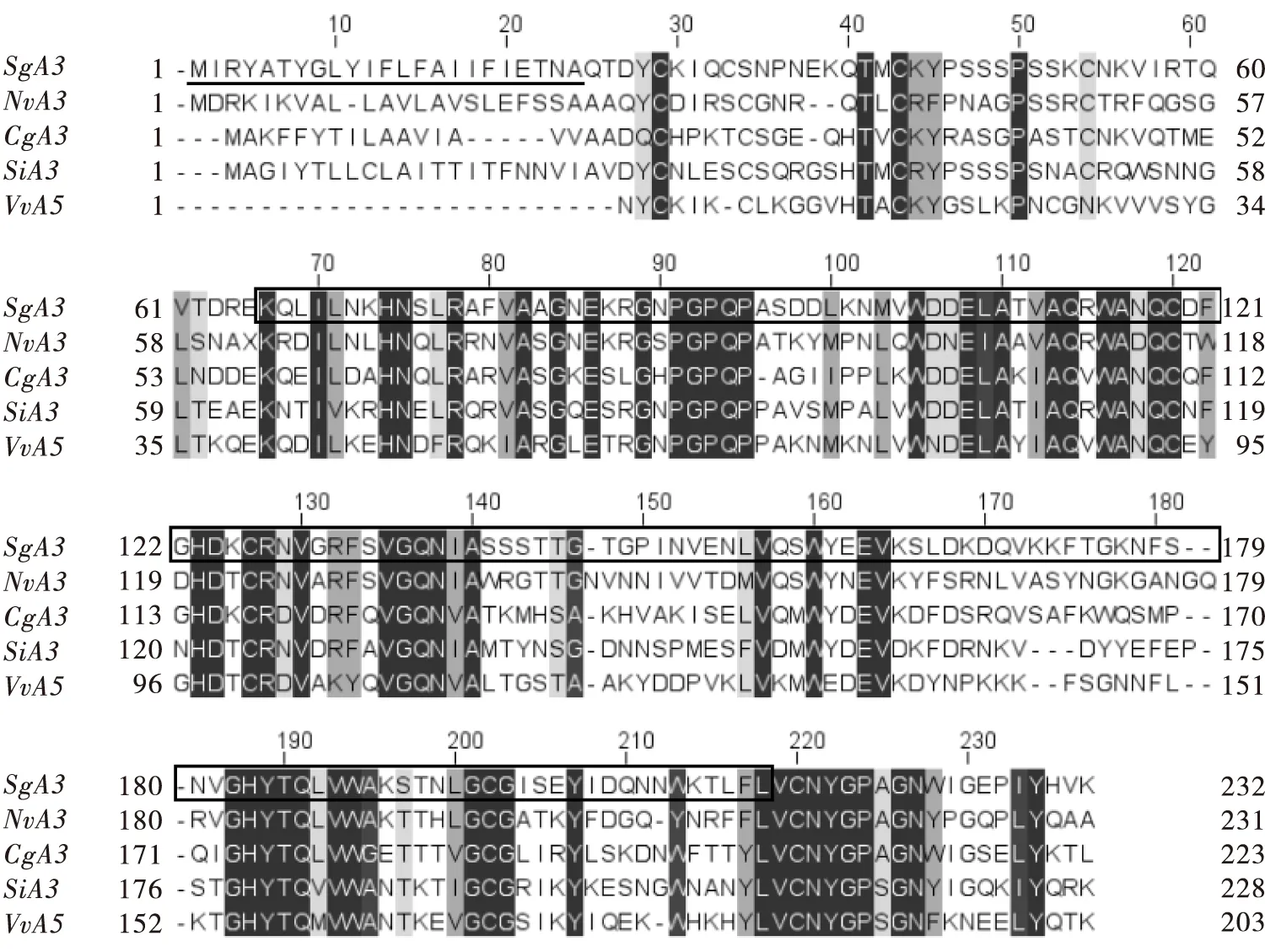
图1 SgA3与其他昆虫过敏原3的多序列比对Fig. 1 Multiple alignment of SgA3 and allergen 3 of other insects注:下划线区域为信号肽,方框为CAP结构域,深色阴影标记的是保守位点。Sg,管氏肿腿蜂;Nv,丽蝇蛹集金小蜂(XP_031786258);Cg,粉蝶盘绒茧蜂(XP_044593958);Si,红火蚁(XP_011165202);Vv,常见黄胡蜂(CAB42887)。Note:Signal peptide was underlined. CAP domain was indicated in box. Dark shading indicated conserved sites. Sg, Sclernderma guani; Nv, Nasonia vitripenni (XP_031786258); Cg, Cotesia glomerata (XP_044593958); Si, Solenopsis invicta (XP_011165202); Vv, Vespula vulgaris (CAB42887).
2.2 SgA3基因的表达特征分析
在不同发育阶段,SgA3基因的表达量有所不同(图2)。从黑茧蛹期开始,SgA3基因呈现高表达,其表达量显著高于卵期和幼虫期。SgA3基因在黑茧蛹期到5日龄成虫之间的表达量逐渐升高,在5日龄成虫中达到最高,在其后的成虫阶段表达量逐渐降低。
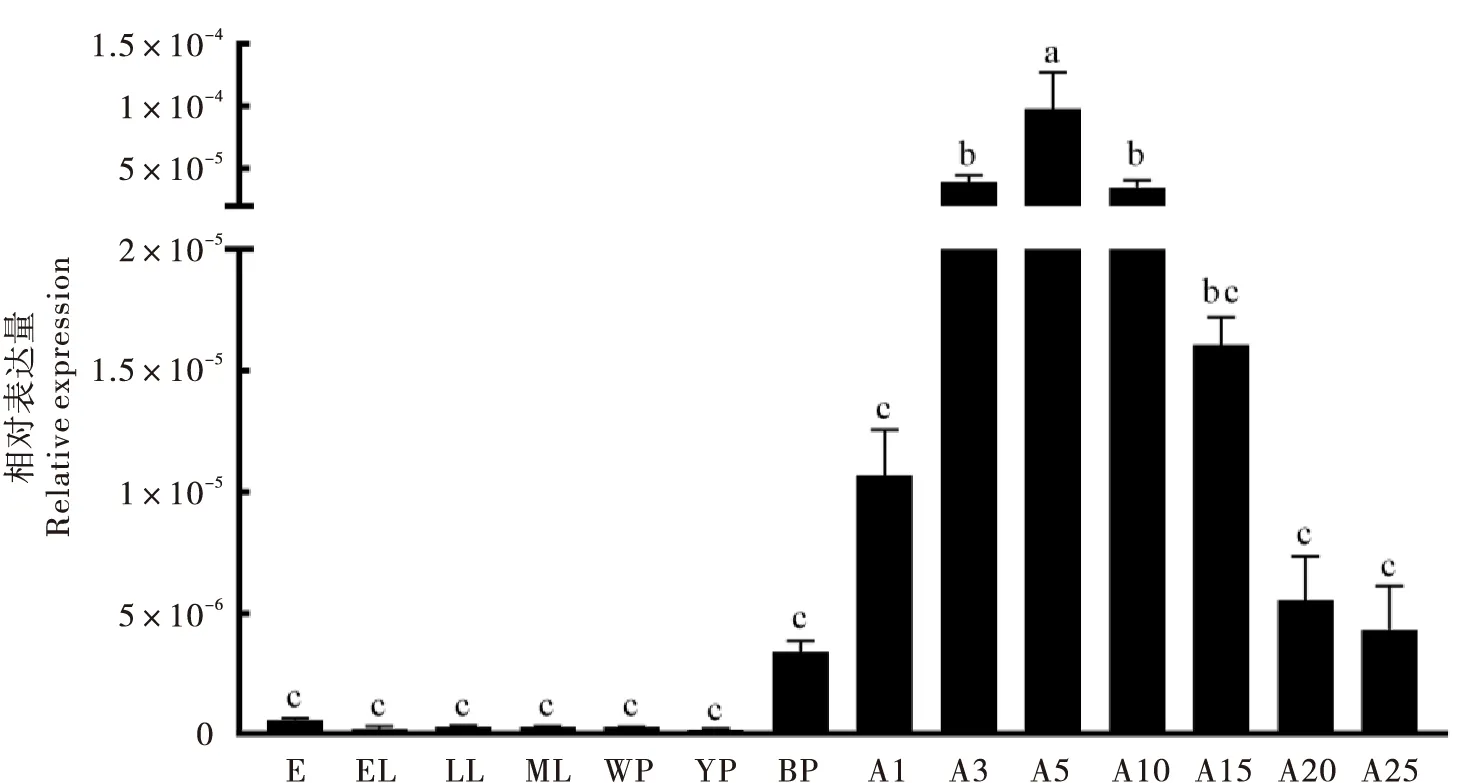
图2 SgA3基因在不同发育阶段的相对表达量Fig.2 Relative expression profiles of SgA3 gene at different developmental stages注:E,卵;EL,早期幼虫;LL,晚期幼虫;ML,老熟幼虫;WP,白茧蛹;YP,黄茧蛹;BP,黑茧蛹;A1~25,羽化1~25 d的雌成虫。数据为平均值±标准差。柱上不同字母表示不同发育阶段基因相对表达量存在显著差异。Note:E, egg; EL, early larva; LL, late larva; ML, mature larva; WP, pupa in white cocoon; YP, pupa in yellow cocoon; BP, pupa in black cocoon; A1~25, female adult after emergence 1~25 days. Data in the figure were mean±SD. Different letters above the bars indicated significant difference gene expression levels among different developmental stages.
在雌成虫不同组织中,SgA3基因在毒液器官中高表达,在卵巢中基本不表达,毒液器官中的表达量显著高于残体和卵巢中的表达量(图3)。尽管SgA3在雄成虫中有一定的表达量,但其表达量显著低于雌成虫毒液器官中的表达量。
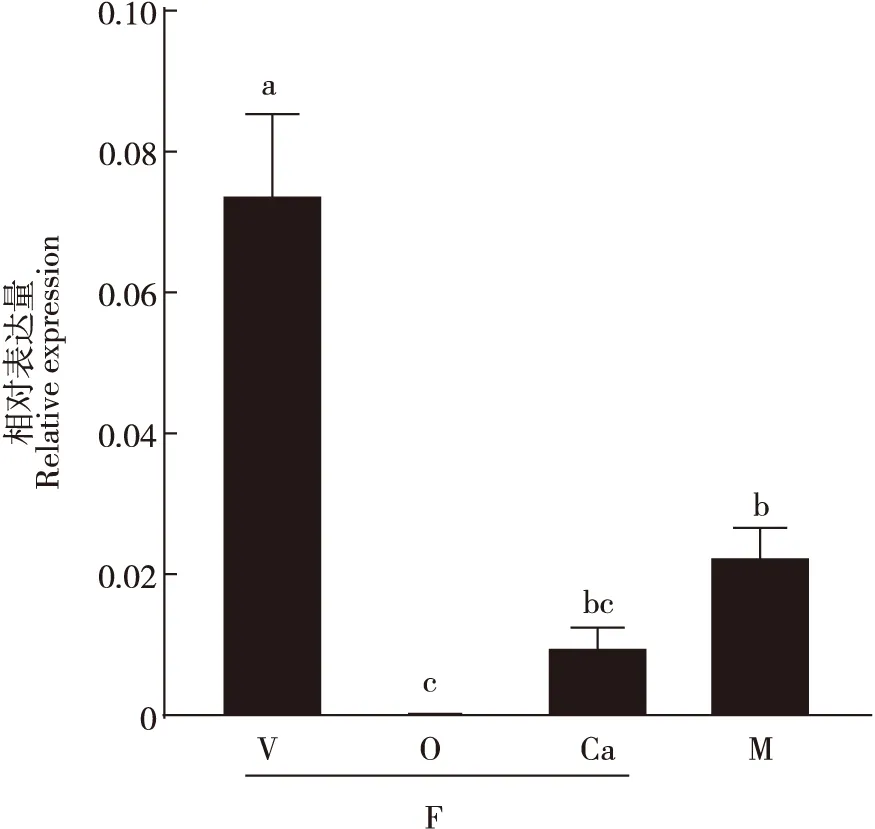
图3 SgA3基因在不同组织中的相对表达量Fig.3 Relative expression levels of SgA3 gene in different tissues注:F,雌成虫;M,雄成虫;V,毒液器官;O,卵巢;Ca,残体(除去毒液器官和卵巢)。数据为平均值±标准差。柱上不同字母表示不同组织中的基因相对表达量存在显著差异。Note:F, Female adult; M, Male adult; V, Venom apparatus; O, Ovary; Ca, Carcass (without venom apparatus and ovary). Data in the figure were mean±SD. Different letters above the bars indicated significant difference gene expression levels among different tissues.
2.3 SgA3基因的原核表达
将去除信号肽的SgA3基因ORF序列插入到pSUMO-Mut原核载体中,转化大肠杆菌后,利用IPTG进行诱导表达并纯化(图4)。SDS-PAGE电泳结果显示,利用大肠杆菌表达得到重组SgA3融合蛋白,并且存在于沉淀中,约36 kDa。将表达标签切除后,得到分子量与理论分子量相符的SgA3重组蛋白,约26 kDa。电泳检测结果显示,纯化得到的为切除表达标签后的高纯度SgA3重组蛋白。
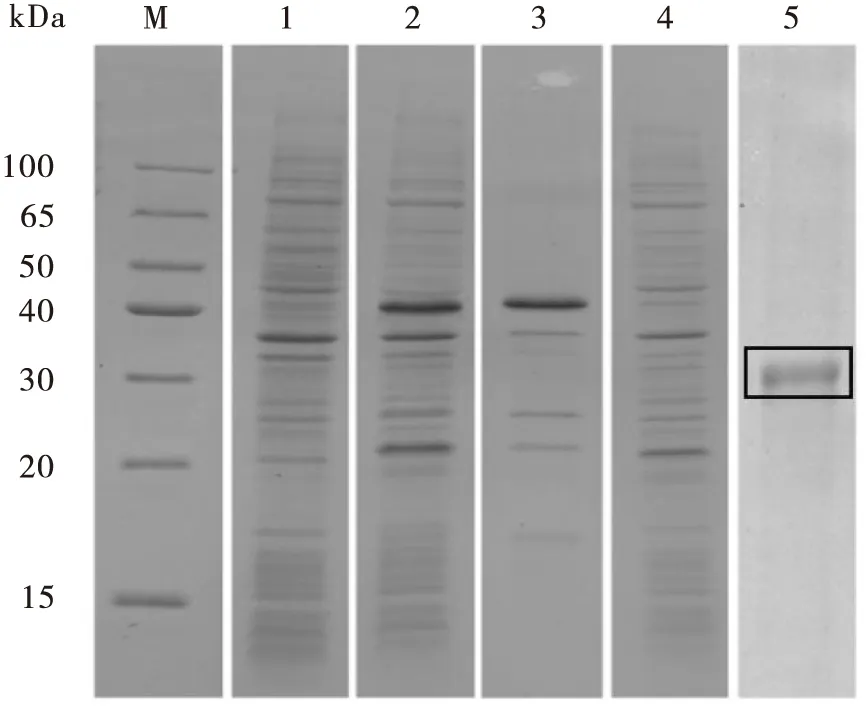
图4 SgA3基因原核表达SDS-PAGE及Western blot检测Fig.4 SDS-PAGE and western blot analysis of prokaryotic expression of SgA3 gene注:M,标准蛋白;1,未诱导的表达产物;2,诱导后的表达产物;3,诱导表达的沉淀;4,诱导表达的上清;5,表达标签切除后纯化的蛋白(方框内)。Note:M, Protein marker; 1, Total protein of un-induced Escherichia coli; 2, Total protein of induced E. coli; 3, Precipitate of total protein after induction; 4, Supernatant of total protein after induction; 5, Purified protein after SUMO tag been excised (in the box).
3 结论与讨论
氨基酸序列分析发现,克隆得到SgA3基因氨基酸序列中具有保守的CAP蛋白结构域,所以SgA3为该家族成员(Perkinetal.,2015;Laurinoetal.,2016)。而且,信号肽分析结果显示,SgA3氨基酸序列中存在信号肽,表明其为分泌蛋白。多序列比对分析发现,SgA3与丽蝇蛹集金小蜂、粉蝶盘绒茧蜂、红火蚁和常见黄胡蜂过敏原3的氨基酸之间具有较高的一致性,且均属于CAP家族蛋白,该家族成员通常具有细胞外内分泌或旁分泌功能(Kingetal.,1987;Hoffman,2006)。有研究证实,过敏原3为红火蚁和常见胡蜂V.vulgaris毒液中的高丰度蛋白,能使人类会引起严重的过敏反应(Hoffmanetal.,1988;Blanketal.,2010;Potiwat and Sitcharungsi,2015)。由于SgA3以及红火蚁和常见黄胡蜂毒液过敏原3的氨基酸序列之间高度保守,推测SgA3也能引起人类的过敏反应,但需要进一步证实。
基因表达特征结果表明,SgA3基因从成熟黑色茧中的蛹期开始逐渐呈现高表达,于成虫5日龄时表达量最高,随后表达量逐渐降低。该表达特征与管氏肿腿蜂抗凝血酶III、丝氨酸蛋白酶同源物等相似,表明SgA3基因的表达与毒液器官的发育密切相关(Wuetal.,2020;韩开健等,2021;李丽芳等,2021)。在不同组织中,SgA3基因在毒液器官中高度表达,再次证实前期蛋白质谱分析发现的SgA3是管氏肿腿蜂毒液中的高丰度蛋白组分(Zhu,2016)。此外,SgA3基因在雄成虫中的表达量显著低于毒液器官中的表达量,这是由于SgA3基因为毒液蛋白编码基因且雄性无毒液器官所致。
本研究成功利用pSUMO-Mut载体对SgA3基因进行了原核表达,得到重组蛋白。产物经SDS-PAGE电泳结果显示,重组表达蛋白主要存在于沉淀中。这是由于大肠杆菌表达系统不能完成SgA3重组蛋白的翻译后修饰所致,后期需要进一步采用合适的溶液来对重组蛋白进行复性,或者采用酵母、昆虫细胞等表达系统来进行表达,获得可溶性的重组表达蛋白,进而开展其生理功能研究(Seismannetal.,2010;Borodinaetal.,2011)。但是,将表达标签切除后,可以纯化获得高纯度的SgA3重组蛋白,其可以用于制备抗体来进一步研究SgA3基因的表达特征,并为该毒液蛋白后续生理功能探究奠定基础。

