双核芳基Os(Ⅱ)配合物的合成及诱导肿瘤铁死亡机制
郭冰莲 李 季 吕梦迪 薛旭玲 刘红科
(南京师范大学化学与材料科学学院,南京 210023)
卵巢癌是全球女性第六大常见癌症和第七大癌症死亡原因,其30年总生存率低于1%,急需寻找高效的治疗方法[1-2]。在铂类药物临床取得巨大成功的推动下,多年来,人们一直在研究金属配合物用于抗癌治疗剂[3]。半夹心Os(Ⅱ)配合物采用典型的“琴凳”几何形状结构,具有六元η6配位的芳烃配体,具有良好的抗癌活性,很多研究者将它视作潜在的抗癌药物[4]。多核芳基金属配合物与单核配合物的抗癌机制明显不同,可以通过多种机制发挥作用,可以降低耐药现象[5]。Liang 等用芳烃锇(Ⅱ)配合物与二甲双胍联合使用,通过葡萄糖代谢重编程作为在低血糖条件下进行癌症治疗的新策略[6]。Sadler 等合成的碘化芳烃Os(Ⅱ)配合物中的Os—I 键在水溶液中可以被谷胱甘肽(GSH)激活,在体内外均显示出良好的抗癌性能[7]。Xue 等合成的芳烃Os(Ⅱ)姜黄素配合物,光激发后氧化为Os(Ⅲ),造成DNA 和线粒体损伤,诱导癌细胞凋亡[8]。Guo 等构建的Os4配合物在808 nm 激光的照射下具有极高的光热转换能力,靶向人黑色素瘤细胞中的线粒体,在体内外充当抗肿瘤光热治疗剂[9]。研究表明芳基Os(Ⅱ)配合物在抗肿瘤方面具有巨大的潜在价值。
Stockwell 于2012 年首次报道的铁死亡是一种铁依赖性的非凋亡性细胞死亡[10],其核心事件是过度活性氧(ROS)介导的脂质过氧化,在铁催化作用下,可以将内源性H2O2转化为羟基自由基(·OH),ROS 的产生和积累进一步导致脂质过氧化物(LPO)的聚集并破坏癌细胞的细胞内氧化还原平衡,最终导致质膜损伤和细胞死亡[11-14]。Guo 等设计合成靶向线粒体的环金属铱(Ⅲ)配合物MitoIrL2,在缺氧光照下引起肿瘤细胞LPO 的积累、线粒体形态收缩、谷胱甘肽过氧化物酶4(GPX4)下调,诱导多种细胞铁死亡协同细胞凋亡[15]。Zhao等报道了一种含有新的手性吡啶RAS 选择性致死配体Ir(Ⅲ)复合物Ir1,靶向GPX4 和ErbB,诱导人纤维肉瘤细胞铁死亡[16]。铁死亡已经成为一种重要的肿瘤抑制机制,有望通过将该机制转化为有效的癌症治疗方法,用于癌症的化疗、免疫治疗等[17]。
我们设计、合成了一种双核环状芳基金属锇配合物[Os(η6-bip)(1,3-bib)Cl]2Cl2(bib-Os),其中η6-bip=η6-联苯,1,3-bib=1,3-二(1H-咪唑-1-基)苯。通过MTT 法检测配合物的抗癌活性。结果表明配合物bib-Os 对A2780 细胞具有一定的细胞毒性和选择性,电感耦合等离子质谱(ICP-MS)和透射电子显微镜(TEM)结果表明配合物bib-Os 能够分布在细胞的线粒体中,诱导肿瘤细胞ROS 水平升高。配合物bib-Os 诱导A2780 细胞明显的铁死亡,显示出LPO积累、GSH 消耗、GPX4 下调等现象。配合物bib-Os是首例诱导肿瘤铁死亡的芳基锇配合物,为锇类金属基抗肿瘤药物提供了一种新的治疗方法。
1 实验部分
1.1 实验试剂、仪器和方法
实验所有的化学药品及试剂主要有顺铂(能源化学)、Ag(CF3SO3)(安耐吉)、1,4-二碘四氟苯(安耐吉)、咪唑(安耐吉)、二甲亚砜(DMSO),均为市售分析纯,可直接使用,无需提纯,根据文献方法制备二聚前体[(η6-bip)OsCl2]2和1,3-二(1H-咪唑-1-基)苯(1,3-bib)[18]。生化试剂主要有3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、Dulbecco 优化的细胞培养基(DMEM)、RIPA 裂解缓冲液(碧云天,中国)、链霉素和青霉素、胰蛋白消化酶-EDTA、BCA 蛋白定量试验(凯基,中国)、SDS-PAGE 样品加载缓冲液(6×)(碧云天,中国)、荧光素(FITC)标记山羊抗兔lgG(H+L)(碧云天,中国)。
在室温下用Bruker AVANCE 400 光谱仪记录1H NMR 谱图。UV-Vis 数据采用PerkinElmer Lambda 365 紫外可见光谱仪进行收集。使用LabServ K3 多功能酶标仪检测细胞毒活性。在PerkinElmer 240C 元素分析仪上测量C、H 和N 的含量。用型号为BD FACSverse(美国)的流式细胞仪进行流式检测。用型号为A1 Nikon(日本)的激光共聚焦显微镜(LCSM)进行成像。采用电感耦合等离子体质谱仪(ICP-MS,X Series 2,Thermo Fisher)测定金属Os元素在细胞内的含量。使用Hitachi H-7650透射电子显微镜(TEM)进行细胞成像。在Mini-Protean Tetra System(BIORAD) 上进行蛋白免疫印迹(Western Blot)实验。
1.2 bib-Os的合成
将配体1,3-bib(0.042 g,0.2 mmol)和二聚前体[(η6-bip)OsCl2]2(0.083 g,0.1 mmol)加入到两颈烧瓶中,抽真空充氩气后加入8 mL 无水二氯甲烷溶液,在室温下搅拌约48 h,TLC 跟踪检测完全反应后,减压除去溶剂得到配合物bib-Os,用硅胶(V二氯甲烷∶V甲醇=1∶10)柱层析纯化后,真空干燥,得到0.1 g浅黄色粉末,产率为80%。1H NMR (DMSO-d6,400 MHz):δ10.22(4H,s,Him),8.90(2H,s,Hbz,1,3-bib),7.96(4H,t,Him),7.71(4H,m,Hbz,1,3-bib),7.68(2H,m,Hbz,1,3-bib),7.67(4H,s,Hbz,1,3-bib),7.51(4H,s,Hbz,η6-bip),7.35(6H,m,Hbz,η6-bip),6.97(4H,d,J=5.7 Hz,η6-bip),6.71(4H,t,J=5.4 Hz,η6-bip),6.46(2H,t,J=5.4 Hz,η6-bip),其中Him表示咪唑基上的氢,Hbz表示苯基上的氢。ESI-MS(+,m/z):[bib-Os-Cl-]+理论值1 215.7,实验值1 217.0,[bib-Os-2Cl-]+理论值590.0,实验值591.2。元素分析按C48H44N8O2Cl4Os2(%)的计算值(%):C 44.79,H 3.45,N 8.71;实验值(%):C 44.73,H 3.54,N 8.67。
1.3 配合物亲脂性
采用摇瓶法测定配体、二聚前体及配合物bib-Os 的亲脂性(lgPo/w),并采用UV-Vis 进行分析。将生理盐水(0.9%)和正辛醇摇匀饱和4 d,将(10 μL,10 mmol·L-1)配合物溶解于生理盐水(0.9%)中,并加入等体积的正辛醇,振荡过夜。8 000 r·min-1离心8 min 后分成两相,用UV-Vis 吸收光谱测定辛醇有机相和水相的化合物含量,计算脂水分配系数:Po/w=co/cw=Ao/Aw,其中A为吸光度。
1.4 细胞培养
MCF-7(人乳腺癌细胞)、A2780(人卵巢癌细胞)、A549(人肺癌细胞)、LO2(人正常肝细胞)等细胞系来源于中山大学实验动物中心。细胞放在含10%胎牛血清、含1%的链霉素(100 μg·mL-1)和青霉素(100 U·mL-1)的DMEM 培养基中常规培养。在每个实验中,用DMSO(φ=1%)处理的细胞作为空白对照组。
1.5 细胞毒性
细胞毒性试验采用MTT法测定配体1,3-bib、二聚前体、配合物bib-Os 及对照药物顺铂对癌细胞(A2780、MCF-7、A549)和正常细胞LO2 的毒性。活细胞线粒体中的琥珀酸脱氢酶能还原外源性黄色MTT,生成不溶于水的蓝紫色结晶甲臜,此沉淀在细胞中可用DMSO溶解,在一定细胞数范围内,MTT结晶形成的量与细胞数成正比[19],之后用酶标仪在492 nm 波长处检测细胞光密度(OD)值,即可获得细胞毒性。
在恒温37 ℃、CO2体积分数5%的培养箱中培养细胞,将含有细胞(5×104mL-1)的DMEM 培养基100 μL 接种到96 孔板中,培养过夜。向每孔加入100 μL 不同浓度梯度的药物,共孵育48 h 后,每孔加入20 μL MTT 溶液(5 mg·mL-1),再孵育4 h。小心去除培养基,每孔加入150 μL DMSO。摇板振荡5 min,使用酶标仪读取492 nm处的吸光度。引用的IC50值为平均值±标准差。所有情况下DMSO 的最大浓度(φ)均控制在1%。
为了观察ROS 清除剂N-乙酰半胱氨酸(NAC)、铁离子螯合剂去铁胺(DFO),铁死亡抑制剂Ferrostatin-1(Fer-1)是否能够抑制配合物引起的细胞死亡,在加入配合物bib-Os 前先和NAC(1 mg·mL-1),Fer-1(10 μmol·L-1)及DFO(2 μmol·L-1)共孵育1 h,再通过MTT法检测最终细胞毒性。
1.6 细胞摄取实验
通过测量金属锇含量测定配合物bib-Os 在A2780 细胞的摄取和分布。将细胞(1×106mL-1)接种到100 mm培养皿中培养过夜。移除旧培养基,加入含有4 μmol·L-1的配合物bib-Os 的DMEM 培养基,继续孵育8 h 后用胰蛋白酶收集细胞,用PBS 洗涤3次,离心收集细胞(2 000 r·min-1,5 min)。细胞在RIPA裂解缓冲液中裂解,并根据商业化说明书使用线粒体/核分离试剂盒(凯基,中国)提取细胞核、线粒体和细胞质部分。在95 ℃下进行消解,先用100 μL浓硝酸消化2 h,再用30%过氧化氢50 μL 消化1.5 h,最后用50 μL 浓盐酸消化1.5 h,使这些组分完全均质消解。最后,用超纯水(Milli-Q)将溶液稀释至最终体积为2 mL,样品中的金属锇Os 含量由ICP-MS测定。
1.7 TEM观察线粒体形态变化
取对数生长期的A2780细胞(1×106mL-1)接种培养于100 mm细胞培养皿中,培养过夜。移除旧培养基,加入含有4 μmol·L-1配合物bib-Os 的DMEM 培养基,继续孵育24 h,磷酸盐缓冲液(PBS)洗涤3 次,用含2.5%戊二醛的PBS(固定液)固定细胞4 h,小心使用刮刀收集细胞,然后用2%锇酸后固定,梯度酒精脱水,树脂包埋,超薄切片,饱和醋酸铀染色30 min,柠檬酸铅染色5 min,室温25 ℃下,在透射电镜JEOL JEM-1230(80 kV)上观察并进行拍摄。
1.8 线粒体膜电位检测
取对数生长期的A2780 细胞以每孔5×105个的密度接种培养于6 孔板中,培养过夜。更换含有不同浓度(0、2、4、8 μmol·L-1)配合物bib-Os 的DMEM培养基,继续孵育24 h,PBS 洗涤3 次,收集细胞,加入500 μL 的JC-1 工作液混合均匀,室温避光孵育20 min,收集细胞用JC-1 染色缓冲液洗涤2 次,并加入500 μL JC-1 染色缓冲液重悬细胞。随后立即使用流式细胞仪检测,使用FlowJo 7.6 软件处理数据。对JC-1 单体,λex=488 nm,λem=(535±20) nm;对JC-1聚合体,λex=525 nm,λem=(570±20)nm。
1.9 细胞内ROS检测
2,7-二氯荧光素二乙酸酯(DCFH-DA)是一种可以自由穿透细胞膜的自身无光的ROS 检测试剂,进入细胞后,被细胞内的酯酶水解,经胞内的ROS 氧化生成有荧光的2,7-二氯荧光素(DCF),通过检测DCF的荧光就可以知道细胞内的ROS水平[19]。
(1) LCSM 成像:将处于对数生长期的A2780 细胞接种在共聚焦小皿中(细胞密度为每孔2×105个),培养过夜。更换含有4 μmol·L-1配合物bib-Os 的DMEM 培养基,继续孵育24 h,PBS 洗涤2 次。每孔加入500 μL DCFH-DA 探针(10 μmol·L-1),室温孵育30 min 后用PBS 洗涤2 次,用LCSM 观察细胞荧光强度,从而检测细胞内ROS 水平。对于DCFH-DA 探针,λex=488 nm,λem=(530±30)nm。
(2)流式细胞术:取对数生长期的A2780 细胞以每孔2×105个接种培养于6孔板中,培养过夜。更换含有不同浓度(0、2、4、8 μmol·L-1)配合物bib-Os 的DMEM 培养基,继续共孵育24 h 后移除培养基,用无血清DMEM 培养基洗涤2 次,再向6 孔板中加入1mL DCFH-DA 探针(10 μmol·L-1),在37 ℃孵育30 min。收集细胞,用无血清培养基清洗以去除多余的染料。用流式细胞仪检测ROS 的产生情况,以FlowJo 7.6软件进行数据处理。
1.10 细胞脂质过氧化水平检测
(1)流式细胞术:取对数生长期的A2780 细胞以每孔2×105个的密度接种培养于6 孔板中,培养过夜。更换含有不同浓度(0、2、4、8 μmol·L-1)配合物bib-Os 的DMEM 培养基,继续孵育24 h,结束后移除培养基,用DMEM 洗涤培养基3 次,然后向6 孔板中加入1 mL BODIPY-C11(2 μmol·L-1),室温避光继续孵育30 min 后,PBS 洗涤并收集细胞,PBS 重悬。随后立即使用流式细胞仪检测,使用FlowJo 7.6 软件处理数据。对于BODIPY-C11探针,λex=488 nm,λem=(520±30)nm。(2) LCSM:取对数生长期的A2780 细胞以每孔2×105个接种培养于35 mm 细胞培养皿中,培养过夜。更换含有配合物bib-Os(4 μmol·L-1)的DMEM培养基,继续孵育24 h,结束后移除培养基,用DMEM 洗涤培养基3 次,然后向培养皿中加入1mL BODIPY-C11(5 μmol·L-1),室温避光孵育30 min 后,用PBS 洗涤3 次。加入Hoechst 33342 探针,室温避光条件下继续孵育45 min,PBS 缓冲液洗涤细胞2次,随后立即使用LCSM 观察细胞荧光强度,从而检测细胞内脂质过氧化水平。对BODIPY-C11探针,λex=581 nm,λem=(591±30) nm;对Hoechst 33342 探针,λex=405 nm,λem=(460±30)nm。
1.11 总GSH水平检测
取对数生长期的A2780 细胞以每孔2×105个的密度接种培养于6孔板中培养过夜。更换含有配合物bib-Os(4 μmol·L-1)的DMEM 培养基,继续孵育(0、4、6、16、24 h),PBS洗涤,用细胞刮刀收集细胞,离心(1 800 r·min-1,5 min),吸尽上清液,加入3 倍细胞沉淀体积的蛋白去除剂,充分涡旋。在液氮和37 ℃水浴下2 次快速冻融,冰上放置10 min,随后离心(10 000 r·min-1,10 min),取上清液按GSH 检测试剂盒操作说明在LabServ K3酶标仪上进行测定。
1.12 蛋白免疫印迹(Western Blot)技术检测GPX4蛋白
取对数生长期的A2780 细胞接种培养于100 mm 细胞培养皿中培养过夜。更换含有不同浓度的配合物bib-Os(0、4、8 μmol·L-1)的DMEM 培养基,继续孵育6 或12 h,收集细胞并用PBS 洗涤2 遍,用RIPA 裂解缓冲液在冰上处理30 min(每5 min 振荡1次)。裂解物离心20 min(13 400 r·min-1,4 ℃),收集上层蛋白清液。然后根据BCA 蛋白定量实验测定上层蛋白清液中蛋白质浓度。加入6×SDS-PAGE 样品加载缓冲液(碧云天,中国),95 ℃加热6 min,-80 ℃保存。用免疫印迹(12%丙烯酰胺凝胶)检测30 μg 蛋白中各目标蛋白的表达情况。利用PVDF膜转印蛋白(200 mA,1 h),跨膜后用脱脂牛奶(5%PBST)封闭,与按比例稀释的一抗(抗GPX4)溶液4 ℃下孵育过夜。膜用PBST 洗涤3 次,再用FITC 偶联的二抗避光室温孵育1 h。用过氧化酶偶联的相应二抗继续孵育1 h,膜在脱色振动筛中洗涤3 次。1∶1 混合配制发光液,反应1 min 显影曝光。最后用ImageJ软件对蛋白表达进行定量分析。
2 结果与讨论
2.1 配合物bib-Os的合成及其表征
多核芳基Os(Ⅱ)配合物与单核配合物相比,包含更多的离子,因此,它们的脂溶性和水溶性与单核配合物有很大区别。为了合成高抗肿瘤活性的配合物,我们选择1,3-bib 为桥联配体,与联苯锇芳基前驱体[(η6-bip)OsCl2]2在室温下反应,构建了双核环状芳基Os (Ⅱ)配合物[Os(η6-bip)(1,3-bib)Cl]2Cl2(bib-Os)(图1),并通过1H NMR(图S1 和S2,Supporting information)对其结构进行表征。

图1 配合物bib-Os的合成路线Fig.1 Synthetic route of complex bib-Os
2.2 配合物的亲脂性
亲脂性是评估生物活性分子的ADMET 特性(吸收、分布、代谢、排泄和毒性)所需的化合物最重要的物理化学参数之一,它描述了药物通过生物膜并与血液蛋白质和受体结合的能力[20]。采用正辛醇/水分配系数(lgPo/w)对配合物的亲脂性进行了研究和评价。图2 数据显示,与配体1,3-bib(lgPo/w=0.89)和二聚前体[(η6-bip)OsCl2]2(lgPo/w=0.23)的脂溶性相比,配合物bib-Os的亲脂性最高(lgPo/w=1.52),表明配合物易于进入细胞。

图2 摇瓶法测定化合物1,3-bib、[(η6-bip)OsCl2]2和bib-Os的脂溶性Fig.2 Determination of lipophilicity of 1,3-bib,[(η6-bip)OsCl2]2,and bib-Os by shaking flask method
2.3 配体1,3-bib和配合物bib-Os的细胞毒性
通过MTT 法研究了配体1,3-bib 和配合物bib-Os 对人源肿瘤细胞株MCF-7,A549,A2780 和正常细胞LO2 的体外细胞毒性。结果如表1 所示,配体1,3-bib 对细胞无毒性(>200 μmol·L-1),与金属锇前体配位后所得的配合物活性显著增加,其抑制肿瘤细胞增殖效果与顺铂(CDDP)相当甚至超过顺铂。配合物bib-Os 对正常肝细胞LO2 基本没有毒性(IC50>100 μmol·L-1),明显小于顺铂(IC50=16.1 μmol·L-1),对A2780 细胞(IC50=4.2 μmol·L-1)的抗增殖活性相较于A549 细胞(IC50=18.3 μmol·L-1)和MCF-7 细胞(IC50=7.4 μmol·L-1)更好,活性约为顺铂的3.3倍。因此配合物bib-Os 对A2780 细胞具有最佳的抗肿瘤活性和选择性,接下来我们将选择bib-Os 在A2780细胞中进行进一步生物学性能研究。
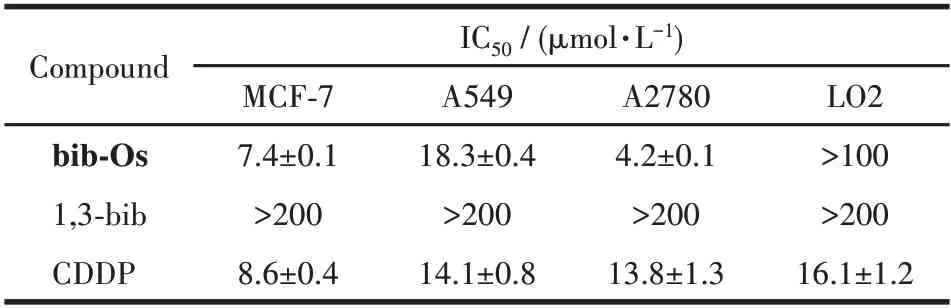
表1 1,3-bib、配合物bib-Os及顺铂对不同细胞株的IC50值Table 1 IC50 values of 1,3-bib,bib-Os,and cisplatin for different cell lines*
2.4 配合物bib-Os的细胞摄取分布
细胞器的靶向性有望提高药物靶向性治疗效果。小分子可以通过细胞膜的被动扩散进入细胞,富集在不同的亚细胞器上,更有助于我们了解细胞摄取机制和抗肿瘤作用机制[21]。为了研究配合物bib-Os在细胞内的分布情况,我们采用电ICP-MS检测金属配合物的吸收和分布。实验结果如图3 所示,配合物bib-Os(4 μmol·L-1)与细胞共孵育8 h 后即可进入细胞,具有良好的过膜性。大约有55%配合物bib-Os 分布在细胞质中,33%分布在线粒体中,仅有9%分布在细胞核中。结果表明,配合物bib-Os 不仅可以透过细胞膜进入细胞中,与亲脂性实验结果相符合,并且可以分布在线粒体中。
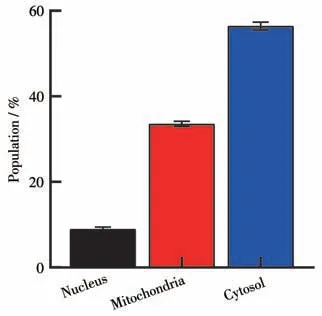
图3 ICP-MS测定配合物bib-Os处理A2780细胞各组分中金属锇的含量Fig.3 Determination of osmium content in each component of A2780 cells treated with complex bib-Os by ICP-MS
2.5 TEM观察线粒体形态变化
不同于传统的细胞死亡方式,铁死亡的形态学特征包括线粒体体积减少、线粒体外膜断裂、线粒体嵴减少或缺失[22]。为了检测配合物bib-Os 对线粒体的损伤情况,我们用TEM 观察了配合物bib-Os处理后的线粒体形态的变化。结果如图4 所示,未经药物处理的细胞显示出边界完整的细胞质、细胞核以及线粒体内外膜与脊的形态(图4 Control)。当配合物bib-Os 作用于A2780 细胞24 h 后,细胞线粒体出现了明显的损伤,即肿胀变圆,线粒体脊结构消失(图4 bib-Os),与铁死亡阳性药物Erastin引起的线粒体变化相似,且线粒体损伤程度强于Erastin。实验结果表明,配合物bib-Os 能诱导A2780 细胞线粒体的损伤,初步判断配合物引起肿瘤细胞死亡方式为铁死亡。
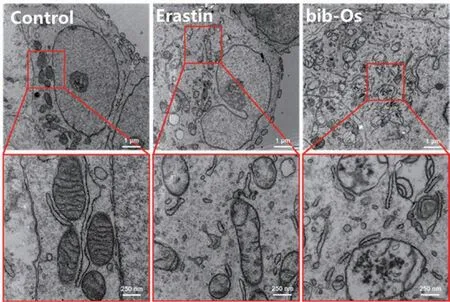
图4 配合物bib-Os诱导A2780细胞中线粒体的形态变化的TEM照片Fig.4 TEM images for the morphological changes of mitochondria in A2780 cells induced by bib-Os
2.6 线粒体膜电位检测
线粒体损伤后,线粒体膜电位会丧失,在这个过程中,线粒体膜间隙的凋亡因子通常会渗漏到细胞质中,最终导致细胞凋亡[23]。近年来,有研究报道金属配合物可以通过损伤线粒体膜电位最终导致细胞死亡[24-28]。基于配合物bib-Os 可分布在细胞线粒体中,为了进一步确定其抗癌机理,我们对细胞线粒体的膜电位情况进行了研究。JC-1 探针是一种线粒体膜电位依赖性荧光探针,当线粒体具有较高的膜电位时,它会聚集在线粒体的基质中形成聚合体(J-aggregates),产生红色荧光(590 nm);当线粒体膜电位下降时,JC-1 会从线粒体基质中释放出来,形成显绿色荧光的单体(monomer,525 nm),据此可以检测化合物对线粒体膜电位的影响[29]。结果如图5 所示,4 μmol·L-1配合物bib-Os 作用于A2780 细胞3 h 后,与未经药物处理的细胞相比,绿色荧光的细胞数有所增多(3.83%增至24.7%),而红色荧光的细胞数逐渐减少,说明经药物处理后细胞线粒体膜电位有所降低。并且随着配合物浓度的增加到8 μmol·L-1,绿色荧光的细胞数增至53.2%,意味着配合物bib-Os 能引起线粒体膜电位下降,并随浓度增加而加强。因此,细胞可能是通过线粒体损伤的方式发生了死亡。
2.7 胞内ROS的检测
线粒体是一种双膜结合的亚细胞器,是细胞的能量工厂[24]。作为ROS 生成和铁代谢的主要部位,线粒体在诱导铁死亡中起着核心作用[14]。配合物bib-Os 可作用于线粒体部位,诱导线粒体损伤,引起整个细胞氧化还原能力的变化,且NAC 实验证明配合物bib-Os 可以诱导细胞产生ROS 从而杀伤肿瘤细胞,我们用DCFH-DA 作为细胞内ROS 指标,采用流式细胞术和激光共聚焦成像法检测不同处理后细胞内ROS 水平的变化。DCFH-DA 被细胞内ROS 氧化后会生成绿色荧光物质,因此我们使用了LCSM(图6A)直观地检测了药物处理后细胞内ROS的生成。与空白对照组相比,配合物bib-Os 共孵育后绿色荧光强度明显增亮,表明配合物可以诱导A2780 产生ROS。此外,我们进一步用流式细胞术进行检测。结果表明,使用2 μmol·L-1的配合物bib-Os 与A2780 细胞共孵育4 h 后,细胞内的ROS平均荧光强度MFI值从63.9上升到526,增加了7.23倍,随着浓度继续提高至8 μmol·L-1,细胞内平均荧光强度增加到1 424,增加了约21.3 倍,胞内ROS 水平上升幅度非常明显(图6B、6C)。该结果清楚地揭示了配合物bib-Os 可以诱导细胞内ROS的产生,这可能是诱导细胞死亡的关键因素之一。

图6 (A)配合物bib-Os诱导A2780细胞产生ROS的LCSM图像;(B、C)流式细胞仪检测不同浓度的配合物bib-Os与A2780细胞共孵育后引起的内部ROS水平变化Fig.6 (A)LSCM images for ROS production in A2780 cells induced by bib-Os;(B,C)Flow cytometry diagrams for the changes of ROS in A2780 cells after co-incubation with bib-Os at different concentrations
2.8 加ROS 抑制剂或铁死亡抑制剂后配合物的细胞毒性
NAC 是一种巯基抗氧化剂,可清除细胞中的H2O2和·OH[30]。Fer-1 是一种抑制脂质氧化并随后抑制铁死亡的小分子化合物,DFO 是一种铁离子螯合剂,可结合细胞中游离的铁离子[31]。基于此,通过降低细胞中ROS 和铁离子水平及抑制铁死亡过程的方式,可以研究配合物bib-Os 对A2780 的抗肿瘤机制。我们分别以NAC、Fer-1 和DFO 为阴性对照进行实验。结果如图7 所示,A2780 细胞预先用NAC(1 mg·mL-1)、Fer-1(10 μmol·L-1)或者DFO(2 μmol·L-1)处理后,可以明显提高细胞存活率,降低细胞毒性。结合以上结果,我们认为配合物bib-Os可以通过诱导细胞产生ROS 和铁死亡通路来抑制肿瘤生长。

图7 NAC、Fer-1及DFO与A2780细胞共孵育后对配合物bib-Os抗增殖活性的影响Fig.7 Effects of NAC,Fer-1,and DFO on the antiproliferative activity of complex bib-Os after co-incubation with A2780 cells
2.9 细胞脂质过氧化水平检测
作为细胞膜的主要成分,脂质在从膜运输到信号转导的各种生物学功能中发挥着重要作用。铁死亡是一种由过度脂质过氧化驱动的铁依赖性调节细胞死亡形式,与肿瘤的发展和治疗反应有关[32]。此外,在脂质过氧化过程中产生的LPO 不仅可以进一步诱导ROS 的产生,还可以降解为能够共价修饰蛋白质和核酸的反应性化合物[33]。为了进一步研究配合物bib-Os 诱导A2780 死亡的机理,我们使用脂质过氧化探针(BODIPY 581/591 C11)对bib-Os 处理的细胞内脂质过氧化水平进行了检测。实验结果表明,8 μmol·L-1的配合物bib-Os 处理细胞24 h 后,细胞内的脂质过氧化水平即平均荧光强度MFI 从67.2 上升到229.0,增加了2.41 倍,胞内脂质过氧化水平明显上升(图8A)。此外,我们还使用了LCSM更加直观地观察细胞脂质过氧化现象。如图8C 所示,与未加配合物bib-Os 的对照组相比,药物组的荧光强度明显提高,从而进一步验证了配合物可以诱导A2780发生脂质过氧化。

图8 (A、B)流式细胞仪检测不同浓度的配合物bib-Os处理A2780细胞内部脂质过氧化水平变化;(C、D)LCSM研究配合物bib-Os诱导A2780细胞发生脂质过氧化Fig.8 (A,B)Flow cytometry diagrams for lipid peroxidation levels in A2780 cells treated with bib-Os at different concentrations;(C,D)LCSM images for lipid peroxidation in A2780 cells induced by bib-Os
2.10 总GSH水平检测
GSH 是细胞中含量最高的硫醇,是一种重要的抗氧化剂和自由基清除剂,可将有害毒素转化为无害物质并将其排出体外[34],在许多细胞功能中起着关键作用,GSH 变化也是铁死亡的标志之一[35]。为了研究配合物bib-Os对细胞中GSH 水平的影响,我们以时间梯度(0、4、6、12、24 h)使用同等浓度的配合物bib-Os对A2780细胞进行共孵育培养,结果如图9所示。与未经药物处理的细胞相比,4 μmol·L-1配合物bib-Os处理细胞4 h后GSH 水平由4.67下降为3.21,当孵育时间提高至24 h后,细胞内GSH水平下降为1.19。因此,随孵育时间延长,配合物bib-Os导致细胞内GSH 含量逐渐降低,表明配合物bib-Os可以引起肿瘤细胞GSH含量的下降。

图9 配合物bib-Os不同孵育时间对A2780细胞内GSH水平的影响Fig.9 Effects of different incubation times of complex bib-Os on GSH level in A2780 cells
2.11 细胞铁死亡信号通路
在铁死亡过程中,铁相关的脂质过氧化氢会积累达到致死水平[36-37]。其特征在于一种硒酶(GPX4)引起的脂质过氧化物酶修复活性的丧失,通过将磷脂和胆固醇氢过氧化物还原为无毒脂质醇来保护细胞免受铁死亡。因此,在一定条件下使GPX4 酶失活,会引起LPO 积累从而导致细胞死亡[38]。我们通过蛋白免疫印迹实验检测GPX4 蛋白含量的表达情况,进一步验证细胞铁死亡。如图10A 所示,2 μmol·L-1配合物bib-Os 作用于A2780 细胞24 h 后,GPX4 表达量有微弱的降低,当配合物浓度增至8 μmol·L-1时,GPX4 表达量明显下降约50%,表明随着浓度增大,配合物bib-Os 的抑制效果显著增加。此外,我们又研究了药物处理后GPX4 的时间依赖性。当4 μmol·L-1配合物bib-Os 对A2780 细胞处理6 h后,GPX4没有出现明显的变化,当作用时间进一步延长达到12 h 后,GPX4 表达量相较于12 h 的空白对照显著降低了51%,当配合物浓度增加至8 μmol·L-1时,GPX4含量出现了类似更加明显的趋势(图10B)。结果表明配合物bib-Os 可以随浓度梯度和时间梯度抑制GPX4的表达,诱导癌细胞铁死亡。

图10 蛋白免疫印迹分析配合物bib-Os的(A)浓度梯度和(B)时间梯度对A2780细胞中铁死亡信号分子GPX4的影响Fig.10 Effect of(A)concentration gradient and(B)time gradient of complex bib-Os on the iron death signaling molecule GPX4 in A2780 cells by Western blotting analysis
3 结 论
我们用1,3-bib 作配体合成并表征了一种新型环状芳基锇金属配合物bib-Os,并研究了配合物的抗肿瘤增殖活性及其诱导细胞死亡的作用机制。研究结果表明,与顺铂相比,配合物bib-Os 表现出更高的细胞毒性和选择性,对正常细胞的细胞毒性较低。配合物bib-Os 的脂溶性较好,进入细胞后,部分可分布在线粒体中,诱导细胞内产生大量ROS并引起线粒体损伤膜电位下降,且在加入ROS 的清除剂NAC 之后,配合物的抗肿瘤活性受到抑制。配合物bib-Os 引起细胞脂质过氧化积累、GSH 代谢及铁死亡相关的蛋白GPX4 表达量下降,诱发肿瘤细胞铁死亡。总之,这是目前芳基锇配合物诱发抗肿瘤细胞铁死亡的首例报道,拓展了锇配合物诱导肿瘤细胞死亡方式,这些结果将为锇类金属抗肿瘤药物的研究与发展提供一定的指导意义。
Supporting information is available at http://www.wjhxxb.cn

