高温胁迫下黑龙江茴鱼幼鱼肝脏组织结构变化及转录组表达特征
丰超杰,刘霞飞,张颖,吕伟华,韩世成,张永泉,许式见,马波*
(1.上海海洋大学 水产与生命学院,上海 201306;2.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150076;3.大连海洋大学 水产与生命学院,辽宁 大连 116023;4.杭州千岛湖鲟龙科技股份有限公司,浙江 衢州 324000)
温度是影响鱼类生长、代谢过程中最重要的环境胁迫因子之一[1]。鱼类作为变温动物,由于缺乏自身体温调节机制,水温可直接或间接影响鱼类正常生命活动[2]。温度变化可引起鱼类机体新陈代谢、免疫应答等生命活动发生紊乱,从而引发疾病甚至死亡[3]。近年来,随着全球气候变暖,夏季连续高温对鱼类的生长存活产生了诸多不良影响,研究者开始广泛关注鱼类应对高温或热胁迫下的生理调控机制[4]。对细鳞鲑(Brachymystaxlenok)[5]、大菱鲆(Scophthalmusmaximus)[6]、哲罗鲑(Huchotaimen)[7]及虹鳟(Oncorhynchusmykiss)[2]等冷水性鱼类的研究表明,急性温度变化可引起鱼类机体稳态调节失衡,导致肝脏、鳃及肠等器官组织损伤并失去生理调节功能。
RNA测序(RNA-Seq)又称转录组测序技术,指在生物的某一发育时期或特定条件下组织或细胞所转录的全部RNA,包括mRNA和非编码RNA[8]。目前,转录组测序技术已在罗非鱼(Oreochromismossambicus)[9]、虹鳟[10]和细鳞鲑[11]等多个水生生物中得到广泛应用,从分子水平上解释了这些鱼类在特定生存环境条件下的生理调控机制。
黑龙江茴鱼(Thymallusarcticusgrubei)隶属于鲑形目(Salmoniformes)鲑科(Salmonidae)茴鱼属(Thymallus),主要分布于中国黑龙江、牡丹江、乌苏里江及松花江等流域[12]。黑龙江茴鱼肉质细嫩、味道鲜美且营养丰富,是黑龙江省特有的经济物种。近年来,由于过度捕捞、环境污染及栖息地被破坏等因素影响,黑龙江茴鱼的野生资源量急剧下降,已被列入《中国濒危动物红皮书鱼类》[13]。作为冷水性鱼类,黑龙江茴鱼对外界环境水温变化较为敏感,尤其是全球环境变暖的大趋势下,高温胁迫对其正常生理代谢产生较大的负面影响。目前,尽管在国内已开展了黑龙江茴鱼人工繁殖[14]及种质鉴定[15]等研究工作,但有关黑龙江茴鱼应对高温胁迫的分子调控机制尚未见报道。肝脏在鱼类的物质代谢、免疫防御等生命活动中扮演着极为重要的角色。本研究中,探究了在持续高温胁迫下黑龙江茴鱼幼鱼肝脏组织的病理变化及转录组表达特征,以期为探索黑龙江茴鱼在高温胁迫下的响应机制提供科学参考。
1 材料与方法
1.1 材料
黑龙江茴鱼幼鱼采集自中国水产科学研究院黑龙江水产研究所渤海试验基地。选取健康状况良好、体表无明显外伤且个体相近的黑龙江茴鱼幼鱼240尾,体长为(5.25±0.25)cm,体质量为(1.73±0.23)g。试验鱼置于全自动温控循环水养殖系统中暂养7 d,期间光暗比为12 h∶12 h,水温为(11±0.5)℃,pH为(6.91±0.08),溶解氧≥6 mg/L。每天换水一次,每次换水量为总体积的20%。每天8:00和17:00各投喂1次,日投喂量为鱼体质量的2%~3%。试验前禁食24 h,试验期间不投喂。
1.2 方法
1.2.1 试验设计 基于课题组前期的研究发现,黑龙江茴鱼分别在8、11、14、17 ℃不同温度的循环水系统中养殖30 d时,17 ℃组鱼的体长和体质量增长缓慢且死亡率较高,为11 ℃组的两倍多。为此,本试验中设置11 ℃对照组(control,C)和17 ℃高温组(heat,H),每个处理组设置3个平行,每个平行放养40尾鱼。以1 ℃/h的升温速率进行升温,直至达到目标温度。在达到目标温度后的1、6、12、24、48 h对高温组和对照组分别进行采样,从每组随机取18尾,即每个平行取6尾。使用麻醉剂(MS-222)麻醉后,从每个平行取3尾鱼的肝脏组织混合后,置于-80 ℃超低温冰箱中保存,用于转录组测序;每个平行余下3尾鱼的肝脏组织于Bouin氏液中固定,48 h后转入体积分数为70%的乙醇中保存,用于组织结构观察。
1.2.2 肝脏石蜡切片制作 取固定后的肝脏组织样品分别经过流水冲洗、乙醇脱水、二甲苯透明和石蜡包埋等处理后进行切片,制作成厚度为5~6 μm的组织切片,HE染色后用中性树脂封片,在Nikon(Eclipse Ci-L)光学显微镜下观察并拍照。
1.2.3 RNA提取及转录组测序 为了减少个体之间的差异,各处理组转录组测序设置3个生物学重复。使用Trizol试剂从解冻黑龙江茴鱼肝脏组织混合样品中分别提取RNA,采用Aglient 2100生物分析仪系统,检测各RNA样品的纯度、浓度及完整性等。转录组测序由欧易生物医学科技有限公司(上海)完成,利用Illumina HiSeq 2500平台进行高通量测序。
1.2.4 测序数据质控、组装测序及基因功能注释
为了保证信息分析的准确性,对原始数据(raw reads)进行过滤后,采用Trinity软件Paired-end的拼接方法得到Transcript序列,根据序列同源性及长度,挑选出最长的一条作为Unigenes;之后再利用CD-HIT软件聚类去冗余得到一套最终的Unigenes,以此作为后续分析的参考序列。利用Diamond软件对Unigene进行NR、KOG、GO、Swiss-Prot、eggNOG及KEGG数据库比对(E<10-5),筛选具有最高序列同源性的蛋白,从而得到功能注释信息。利用HMMER 3.0软件在Pfam数据库中进行Unigenes功能分析。
1.2.5 差异基因的表达和聚类分析 采用RSEM软件中bowtie 2获取每个样本中比对到Unigenes上的clean reads数,同时采用Express软件计算Unigenes的表达量(FPKM值)。利用DESeq2软件包对各个样本基因的counts数目进行标准化处理,分析基因表达水平。为了控制假阳性率,将P<0.05且|log2(fold change)|>1作为显著性差异基因的筛选标准,并对不同养殖时间得到的差异基因进行聚类分析。
1.2.6 差异基因的富集分析 对差异基因进行GO富集分析,对其功能进行描述(结合GO注释结果)。利用KEGG数据库对差异基因进行Pathway分析(结合KEGG注释结果),并用超几何分布检验方法计算每个Pathway条目中差异基因富集的显著性。
1.2.7 qPCR验证 为验证转录组数据的准确性,在转录组分析结果中选取6个差异基因进行实时荧光定量PCR。使用与转录组测序同批次的RNA进行反转录,获得相应的cDNA,稀释后每个样本设置3次重复试验,以β-actin为参考基因。使用NCBI Primer BLAST设计引物(表1)。反应程序:95 ℃下预变性 3 min;95 ℃下变性 5 s,60 ℃下退火 15 s,72 ℃下延伸 30 s(收集荧光),共进行40个循环;最后在72℃下再延伸2 min。用熔解曲线分析PCR产物的特异性。

表1 引物及序列Tab.1 Primers and sequences
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示。利用荧光定量PCR仪系统软件分析PCR结果,计算基因相对表达量(2-ΔΔCt),采用SPSS 20.0软件进行单因素方差分析(one-way ANOVA)。
2 结果与分析
2.1 肝脏组织结构的病理变化
对两组黑龙江茴鱼幼鱼的肝脏组织结构进行观察,光镜下对照组鱼的肝脏肝板结构清晰,排列规则,肝细胞质均匀,细胞核呈规则圆形,位于细胞中央,肝血窦形态正常,分布于肝细胞之间(图1A)。高温17 ℃组,随着胁迫时间的延长,肝脏表现出不同程度及形式的损伤,与对照组相比,在胁迫1 h时,肝细胞结构比较清晰,未见其他明显变化(图1B);在胁迫6 h时,肝脏基本结构无明显异常,胞核呈圆球形,位于细胞中央,但有极少量的肝细胞核萎缩变形(图1C);在胁迫12 h时,少量肝细胞胞质出现空泡化,肝细胞核萎缩程度加重,位于细胞边缘,肝血窦间隙收缩(图1D);在胁迫24 h时,肝细胞形状不规则,肝细胞核萎缩变性加剧,较多肝细胞空泡化,肝血窦不清晰(图1E);在胁迫48 h时,肝脏组织结构进一步被破坏,细胞间界限杂乱模糊,大量肝细胞出现空泡化及细胞核萎缩,严重的甚至出现溶解(图1F)。
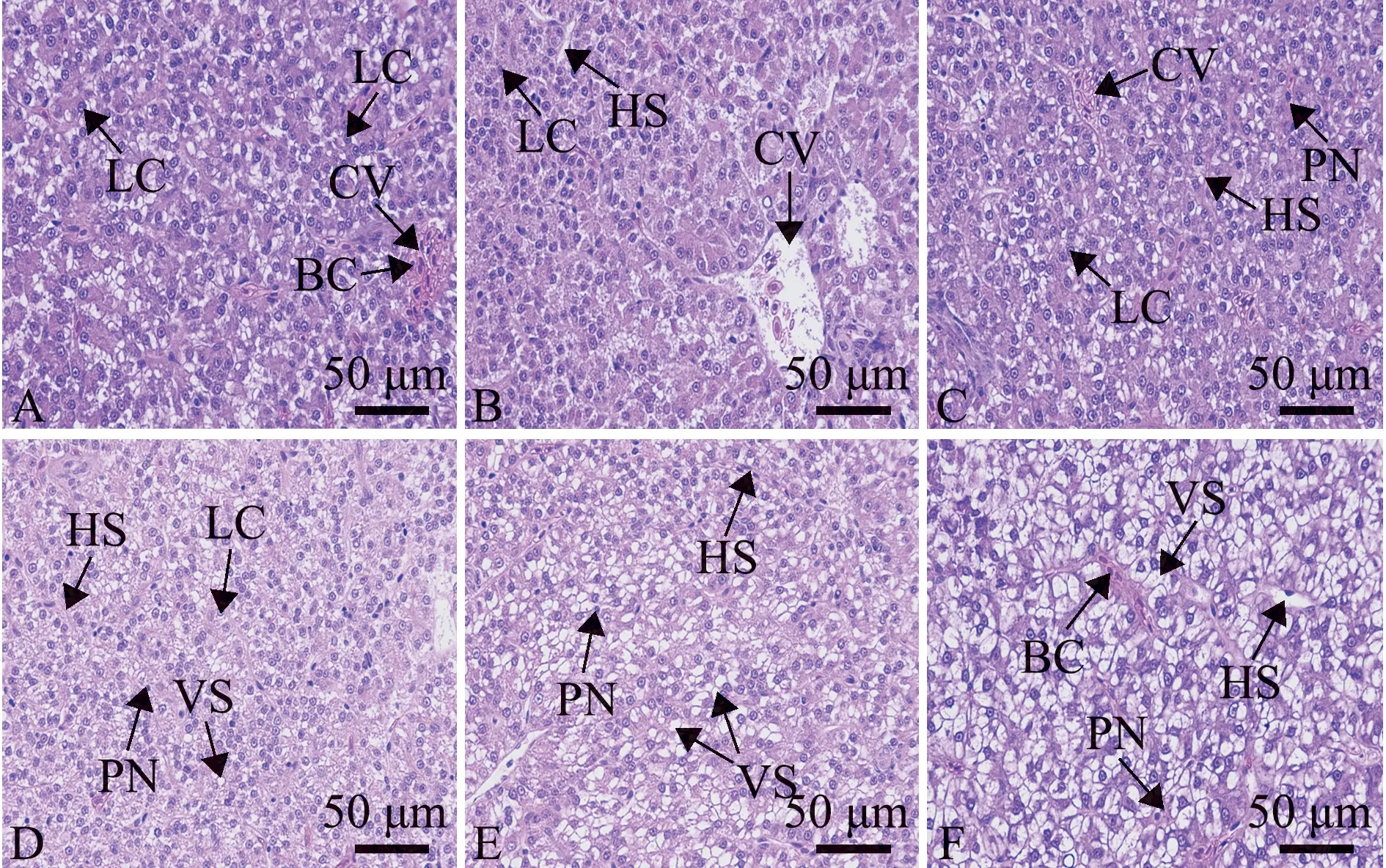
A—肝脏(对照组);B—肝脏(17 ℃高温胁迫1 h);C—肝脏(胁迫6 h);D—肝脏(胁迫12 h);E—肝脏(胁迫24 h);F—肝脏(胁迫48 h)。VS—空泡;PN—核固缩;CV—中央静脉;LC—肝细胞;BC—红细胞;HS—肝血窦。A—liver (control group);B—liver (17 ℃ temperature stress for 1 h);C—liver (stress for 6 h);D—liver (stress for 12 h);E—liver (stress for 24 h);F—liver (stress for 48 h).VS—cavitation;PN—nuclear condensation;CV—central vein;LC—hepatocytes;BC—red blood cell;HS—hepatic sinusoid.图1 高温胁迫下黑龙江茴鱼的肝脏结构(HE×400)Fig.1 Liver histological structure of Thymallus arcticus grubei under high temperature stress
2.2 测序数据组装
对黑龙江茴鱼幼鱼肝脏组织的30个样本进行测序,共获得214.44 Gbp的clean data,过滤后各样本中的有效数据量分布为6.82~7.50 Gbp。去除低质量、冗余及接头序列后,各样本平均GC含量为49.45%,Q30碱基分布为93.48%~96.06%,说明测序质量较好,可为后续的组装提供可靠的原始数据(表2)。原始数据已上传至NCBI-SRA数据库(PRJNA907151)。

表2 测序数据统计Tab.2 Summary of RAN-seq data
采用Trintiy软件对clean reads进行组装,共获得的Unigenes总数目为106 347条 reads,N50长度为2 262 bp,序列平均长度为1 268.96 bp,最长序列为58 563 bp,最短序列为301 bp(表3)。

表3 转录本拼接结果统计Tab.3 Statistics of transcript splicing results
利用bowtie 2将clean reads比对到Unigenes,总比对率为88.08%~89.94%,多位点比对率为29.94%~32.35%,单一位点比对率为56.94%~59.30%(表4)。这表明,拼接数据结果可靠,可进一步进行注释与富集分析。

表4 Reads与Unigenes比对结果统计Tab.4 Comparison results statistics of reads and Unigenes
2.3 转录组注释
为获得Unigenes全面信息,将全部Unigenes(106 347个)分别在7个公共数据库中进行序列比对。从表5可见,在氨基酸序列数据库(NR)被注释的Unigene序列数最多,有59 039个,其次是GO、eggNOG和经过注释的蛋白质序列数据库(Swissprot),分别有36 876、46 437、41 177个Unigenes获得功能注释,Pfam和蛋白质直系同源数据库(KOG)分别有33 058和30 154个Unigenes被注释,而KEGG数据库被注释的Unigenes序列数最少,只有15 077个。

表5 数据库注释结果Tab.5 Database annotation results
将拼接所得的 Unigene与NR蛋白数据库进行同源性比对,相似序列所占比例前5的物种分别有虹鳟、大西洋鲑(Salmosalar)、褐鳟(Salmotrutta)、鲱形白鲑(Coregonusclupeaformis)和银大麻哈鱼(Oncorhynchuskisutch)等,均为鲑科鱼类(表6)。
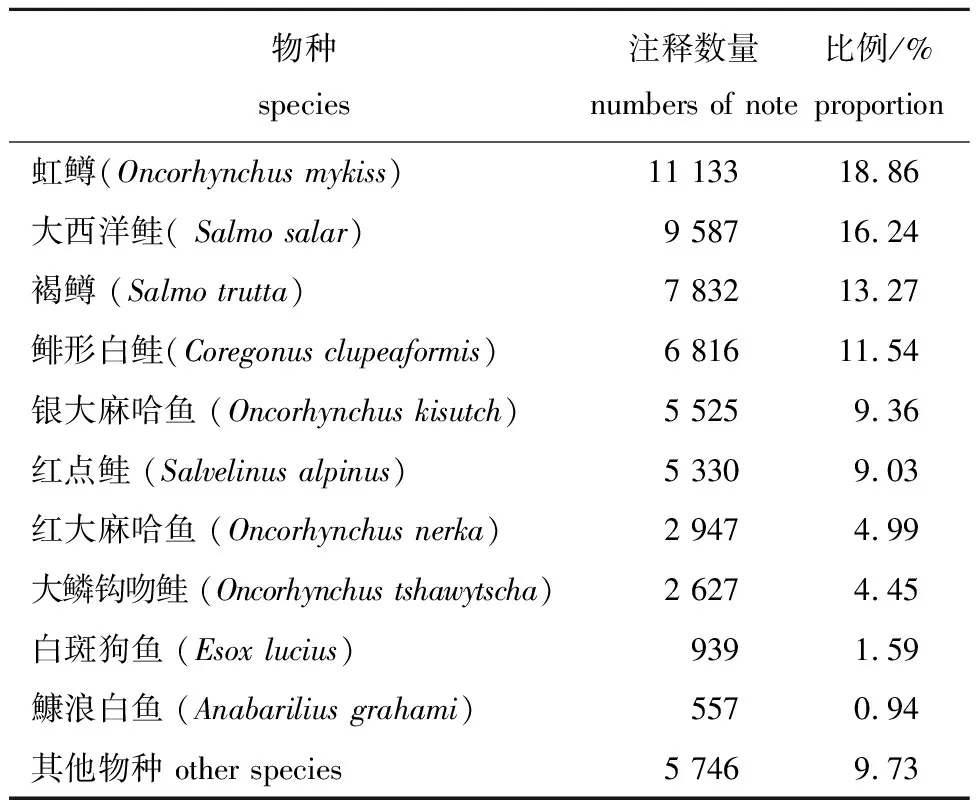
表6 NR注释top 10物种分布Fig.6 Top 10 species distribution in NR notes
2.4 差异基因的表达与聚类
使用DESeq对差异基因进行分析,以P<0.05且|log2(fold change)|>1作为阈值来筛选差异基因。结果显示,随胁迫时间的延长,差异基因的数量呈先升高后下降的趋势,且在各时间段下调的差异基因(DEGs)数均多于上调的DEGs。在胁迫24 h时,差异基因数显著高于其他4个时间点,差异基因数量为7 148个,包括3 653个上调基因与3 495个下调基因(图2(d));胁迫1 h时,有602个差异基因,包括180个上调基因与422个下调基因(图2(a));胁迫6 h时,有921个差异基因,包括206个上调基因与715个下调基因(图2(b));胁迫12 h时,有1 203个差异基因,包括399个上调基因与804个下调基因(图2(c));胁迫48 h时,有1 022个差异基因,包括321个上调基因与701个下调基因(图2(e))。

图2 差异基因火山图Fig.2 Volcano map of differentially expressed genes
为了验证各处理组3个生物学重复DEGs的可靠性,对各处理组差异基因进行聚类热图分析。结果显示,高温组(H)和对照组(C)在不同高温胁迫时间的差异基因分别聚类,同组样本不同重复的表达相似(图3)。
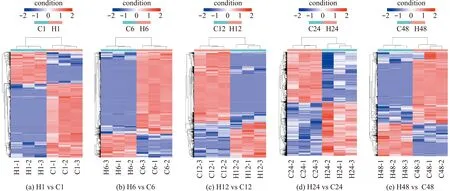
图3 差异基因聚类图Fig.3 Cluster map of differentially expressed genes
2.5 差异基因的GO富集
将DEGs比对到GO数据库进行功能分类,结果显示,随着胁迫时间的延长,富集到GO数据库的DEGs数呈先升高后下降的趋势(图4),在胁迫24 h时DEGs数最多(2 786个),其中935个基因上调,1 851个基因下调,且随胁迫时间的延长,差异表达下调基因均多于上调基因(图4(d))。在不同胁迫时间下,DEGs富集到GO三大类别(BP、CC和MF)中,其中生物过程(BP)的DEGs数量最多,主要由代谢过程、细胞过程、生物调控和单生物过程组成;富集在细胞成分(CC)的DEGs数量次之,主要由细胞膜、细胞组分和细胞器组成;富集在分子功能(MF)的基因数量最少,主要由催化活性和细胞结合组成(图4)。

图4 GO富集分析结果(前 30)Fig.4 Go enrichment analysis(top 30)
DEGs随高温胁迫时间的延长,在BP中,胁迫前期(1~6 h)糖酵解过程、丝氨酸合成甘氨酸过程、碳水化合物代谢过程和基因表达过程等显著富集;胁迫中期(12~24 h)脂蛋白脂质氧化和细胞合成过程显著富集;胁迫后期(48 h)基因表达过程和糖酵解过程显著富集。在CC中,胁迫前期吞噬体、内质网、核糖体及线粒体呼吸链复合物显著富集;胁迫中期细胞外基质和溶酶体腔显著富集;胁迫后期核糖体和吞噬囊泡显著富集。在MF中,胁迫前期ATP结合、连接酶活性、氨基酸结合及核糖体结构成分显著富集;胁迫中期肌球蛋白结合、肝素结合和丝氨酸酶活性显著富集;胁迫后期ATP结合、核糖体结合和连接酶活性显著富集(图4)。
2.6 差异基因的KEGG通路富集
将DEGs比对到KEGG数据库进行富集(P<0.05且q<0.05),结果显示,胁迫1 h时,差异基因共富集到170个通路中,其中,显著富集的通路有37个,糖酵解/糖异生(ko00010)、内质网中的蛋白质加工(ko04141)及p53信号通路(ko04115)等通路显著富集(图5(a));胁迫6 h时,差异基因共富集到264个通路,其中,显著富集的通路有47个,糖酵解/糖异生(ko00010)、核糖体(ko03010)及吞噬体(ko04145)等通路显著富集(图5(b));胁迫12 h时,差异基因共富集到253个通路,其中,显著富集的通路有46个,糖酵解/糖异生(ko00010)、乙醛酸与二羧酸代谢(ko00630)及核糖体(ko03010)等通路显著富集(图5(c));胁迫24 h时,差异基因共富集到329个通路,其中,显著富集的通路有30个,蛋白质消化吸收(ko04974)、ECM受体(ko04512)及吞噬体(ko04145)等通路显著富集(图5(d));胁迫48 h时,差异基因共富集到238个通路,其中,显著富集的通路有26个,乙醛酸与二羧酸代谢(ko00630)、半胱氨酸与蛋氨酸代谢(ko00270)及糖酵解/糖异生(ko00010)等通路显著富集(图5(e))。

图5 KEGG显著富集结果(前 20)Fig.5 KEGG significant enrichment results(top 20)
DEGs在胁迫前期(1~6 h),糖酵解/糖异生(ko00010)、乙醛酸与二羧酸代谢(ko00630)、果糖与甘露糖代谢(ko00051)、半胱氨酸与蛋氨酸代谢(ko00270)、内质网中的蛋白质加工(ko04141)和核糖体(ko03010)等通路显著富集;在胁迫中期(12~24 h),蛋白质消化吸收(ko04974)、ECM受体(ko04512)、抗原加工与呈递(ko04612)、AMPK信号通路(ko04152)及乙醛酸与二羧酸代谢(ko00630)等通路显著富集;在胁迫后期(48 h),乙醛酸与二羧酸代谢(ko00630)、糖酵解/糖异生(ko00010)、半胱氨酸与蛋氨酸代谢(ko00270)、PPAR信号通路(ko03320)和抗原加工与呈递(ko04612)等通路显著富集(图5)。在急性高温胁迫过程中,随着胁迫时间的延长,差异基因主要在免疫应激和能量代谢等调控过程中显著富集。这表明,黑龙江茴鱼幼鱼肝脏组织产生了大量参与调控代谢和应激等相关的活动过程。
2.7 RT-qPCR验证
随机选择6个差异基因,利用RT-qPCR相对定量法检测高温组与对照组幼鱼不同养殖时间下的差异基因表达情况。结果显示,随着养殖时间的延长,黑龙江茴鱼幼鱼的HSP70、HSP90a、DNAJA2及CASP9 mRNA表达水平总体上呈上调的趋势,而GAPDH和MDH1的mRNA表达水平则呈下调的趋势,其变化趋势与转录组测序结果一致,表明测序结果可靠(图6)。
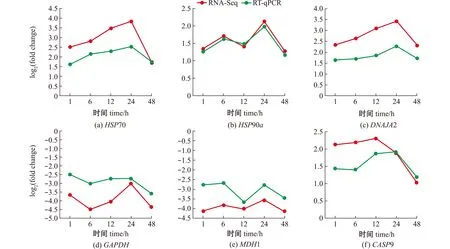
图6 qPCR检测RNA-Seq结果Fig.6 Validation of RNA-Seq data using qPCR
3 讨论
3.1 温度胁迫对鱼类肝脏组织结构的影响
肝脏(或肝胰腺)是鱼类进行物质代谢和免疫防御的重要枢纽之一,在温度胁迫过程中,肝脏对于机体减少或免受热应激的伤害具有极其重要的作用[16]。研究表明,高温胁迫会引起鱼类肝脏组织结构变化,以及肝细胞空泡化、细胞核偏移和细胞溶解等,造成肝脏基本功能受损,进而导致机体代谢紊乱并损害健康[17]。周彦静等[18]通过电镜观察虹鳟肝脏组织发现,在持续高温胁迫下肝脏出现淤血、肝窦不清晰、肝细胞水泡变性甚至溶解。张思敏等[19]对许氏平鲉(Sebastesschlegelii)高温处理12 h后发现,与对照组相比,高温处理组肝细胞杂乱分布,肝细胞出现空泡化及细胞核萎缩,严重的甚至出现溶解,表明高温导致鱼类肝脏细胞受损。本研究中,高温胁迫下黑龙江茴鱼幼鱼肝脏组织结构已经发生了明显的病理损伤,在17 ℃高温胁迫12~48 h时,其肝脏组织结构出现了不同程度的核萎缩变形及空泡化现象,且在胁迫48 h时部分肝细胞出现溶解,这与虹鳟和许氏平鲉在高温胁迫下肝组织病变症状相似。这表明,在17 ℃急性高温胁迫下,黑龙江茴鱼幼鱼肝脏组织在胁迫12 h时已经受到微弱损伤,随着胁迫时间的延长肝脏组织损伤持续加剧。
3.2 温度胁迫对鱼类应激反应的影响
维持蛋白质的功能构象对于机体抵抗各种环境应激至关重要。鱼类在急性高温胁迫下机体细胞许多酶和蛋白质的功能和结构被破坏,使蛋白质变性和错误折叠,形成对机体细胞有害的物质[20]。分子伴侣在蛋白质合成的折叠、组装及对变性蛋白质的修复和降解等过程中起着重要作用[21]。本试验中,差异基因显著富集在核糖体、内质网蛋白质加工及抗原加工与呈递等蛋白质合成与降解通路上。核糖体和内质网是细胞内蛋白质合成、转运及修饰的细胞器,抗原加工与呈递是清除、降解变性蛋白质的重要生理过程[22]。富集在以上通路中的差异基因主要为热休克蛋白家族基因(HSPs)。
研究表明,HSPs在高温胁迫下大量表达,以维持细胞内稳态和提高机体应激耐受性。魏亚丽等[20]对高温下尼罗罗非鱼(Oreochromisniloticus)进行转录组分析时发现,参与肝脏内质网相关性降解过程的HSP70和HSP90表达显著上调,进而维持细胞稳态。对虹鳟的研究发现,热休克蛋白具有高度的调节作用,在急性热胁迫下,HSP70和HSP90均显著上调表达[10]。在短期急性高温胁迫下,细鳞鲑肝脏中HSP70基因上调表达,随胁迫时间的延长,因肝脏组织受损HSP70基因表达显著下调[11]。张晨光等[23]研究证实,急性高温胁迫下,翘嘴鳜(Sinipercachuatsi)肝脏HSP70和HSP90基因相对表达量呈先上升后下降的变化趋势,分别于胁迫12 h和24 h时升至最高值,在胁迫后期由于肝脏氧化损伤较严重,引发免疫水平降低,从而引起基因表达显著下调。本研究中,黑龙江茴鱼幼鱼在17 ℃温度胁迫下,热休克蛋白家族基因HSP40、HSP70和HSP90的mRNA均显著上调表达,随胁迫时间的延长,HSPs基因表达量呈先升高后下降的趋势,并于胁迫24 h时达最高值,与上述研究结果一致。推测可能是因为热休克蛋白对细胞的保护作用只能在一定时间范围内,在短期的急性高温胁迫下,可以通过诱导产生大量HSPs蛋白提高机体耐受性,以应对高温胁迫对细胞的损伤;随着胁迫时间的延长,机体内平衡被打破,肝脏组织损伤程度加剧,使HSPs基因表达量显著降低,合成的分子伴侣蛋白不足以修复损伤并维持细胞内稳态。此外,对肝脏组织结构观察发现,在胁迫48 h时损伤最严重,而在转录组分析中发现差异基因数在胁迫24 h时最高,这可能与肝脏组织在胁迫24 h后损伤程度加剧有关。
3.3 温度胁迫对鱼类能量代谢的影响
温度变化可能对鱼类机体新陈代谢过程产生影响,在一定的温度范围内,鱼类需消耗更多的能量以抵抗温度胁迫带来的压力[24]。对草鱼(Ctenopharyngodonidella)在高温胁迫下的转录组研究发现,高温胁迫对精氨酸与脯氨酸代谢、脂肪酸代谢及糖酵解/糖异生等代谢过程有显著影响[25]。对细鳞鲑在急性高温胁迫下的转录组研究也发现,与代谢过程相关的酶基因下调表达,进而抑制能量代谢过程[11]。许氏平鲉在急性高温胁迫下,高温组的MDH和NADH等代谢相关基因表达下调,糖代谢过程受抑[26]。红鳍东方鲀(Takifugurubripes)在热胁迫下,富集在能量代谢途径上的差异基因表达出现下调[27]。与上述研究结果一致,本研究中,表达下调的差异基因(MDH、GAPDH和GRHPR)主要富集在代谢途径中的糖酵解/糖异生、果糖与甘露糖代谢、乙醛酸与二羧酸代谢及半胱氨酸与蛋氨酸代谢等代谢通路,表明在17 ℃高温下,黑龙江茴鱼幼鱼机体能量代谢水平受阻。而尼罗罗非鱼[20]和胡瓜鱼(Osmerusmordax)[28]在高温胁迫后,其代谢水平明显上调,这可能是由于鱼类种类的差异在受到温度胁迫后存在不同的适应机制。
本研究中还发现,差异基因通过富集在代谢信号通路上,相互作用共同应答高温胁迫,如PPAR和AMPK信号通路。研究表明,PPAR信号通路与动物免疫和代谢有关,在脂质氧化过程中具有重要作用[29]。对大黄鱼(Larimichthyscrocea)在高温胁迫下的转录组分析发现,差异基因显著富集到PPAR信号通路中,调控糖和脂肪代谢[30]。在高温胁迫下,大口黑鲈(Micropterussalmoides)呼吸频率加快,耗氧量增加,肝糖原或脂肪被大量氧化分解,从而造成肝细胞空泡化,甚至细胞核萎缩[31]。本试验中,黑龙江茴鱼幼鱼在17 ℃高温胁迫12 h后,表达上调的差异基因富集在AMPK和PPAR信号通路,此结果与对大黄鱼和大口黑鲈的研究结果一致。推测此时机体能量可能处于比较低的水平,通过增加对脂肪酸的氧化分解来补充能量,进而维持机体内稳态,这与本试验中黑龙江茴鱼幼鱼肝脏细胞在胁迫12 h后出现不同程度的核萎缩变形及空泡化结果一致。
4 结论
1)在17 ℃高温胁迫下,黑龙江茴鱼幼鱼肝脏组织结构随胁迫时间的延长损伤程度加剧,说明高温胁迫能引起黑龙江茴鱼幼鱼肝脏组织受损。因此,在黑龙江茴鱼养殖生产中,应密切关注温度的变化,降低高温胁迫对鱼体生理机能的影响。
2)黑龙江茴鱼幼鱼肝脏中响应急性高温胁迫的差异基因主要富集在能量代谢和应激反应过程相关的通路上。

