novel-m0287-3p调控斜纹夜蛾中肠蜕皮激素受体的表达
钟其恩,岑永杰,马 康,彭亚楠,郑思春
(华南师范大学生命科学学院昆虫科学与技术研究所,广州市昆虫发育调控与应用研究重点实验室,广州 510631;梅州市华师昆虫发育生物学与应用技术重点实验室广梅园研发中心,广东梅州514779)
1993年,Ambros和Lee等人在线虫Caenorhabditidelegans中发现了第一个miRNA(lin-4),它通过调控胚胎后期的发育基因lin-14从而调控了线虫幼虫从L1期到L2期的转换。在此后的一年中,又相继发现了100多个有关人类细胞、果蝇drosophilid以及线虫的非编码小分子RNA,掀起了miRNA研究的浪潮(Leeetal., 1993; Reinhartetal., 2000; Chenetal., 2004; Zhouetal., 2009)。而miRNA的生物合成受到严格的调控,其表达具有组织和时空特异性的特点。一个miRNA成熟体的形成主要经历4个阶段:miRNA基因首先在RNA聚合酶II的作用下形成约为1 000 bp左右的初级转录产物pri-miRNA,该产物具有帽子结构和Poly A尾巴,二级结构呈长发卡结构(Cullen, 2004; Leeetal., 2004; Kimetal., 2005)。接着pri-miRNA在Drosha酶作用下,形成具有70 bp左右不完全互补配对的茎环结构的miRNA前体(pre-miRNA)(Lundetal., 2004; Lucas and Raikhel, 2013)。细胞核内的pre-miRNA经转运蛋白复合物运送到细胞质后,由Dicer酶识别并剪切形成长度22 bp左右的双链miRNA。双链miRNA分子中较稳定的一条链通过与基因沉默复合体RISC结合,最终组装成与靶基因结合的miRNP复合物(Martinezetal., 2002; Yietal., 2003; Miskaetal., 2005; Bartel, 2009; Marcoetal., 2010)。
在生物体内,miRNA与靶基因之间的关系并非简单的专一关系,靶基因和miRNA相互结合的位点可以是单个也可以是多个,两者的调控关系复杂且精密(Shenetal., 2008; Formanetal., 2008; Duursmaetal., 2008; Brodersen and Voinnet, 2009; Shinetal., 2010)。研究表明,miRNA 5′端可以通过完全和不完全的配对方式,结合到靶基因mRNA的非编码区(UTR)或者编码区(CDS),从而发挥其对基因调控的功能(Wightmanetal., 1993; Leeetal., 1993; Lytleetal., 2007; Orometal., 2008; Shenetal., 2008)。一般认为,当以完全互补配对的形式结合时,miRNA通过降解mRNA而下调靶基因的表达;当以不完全互补配对的形式结合时,miRNA则通过抑制mRNA翻译而抑制基因表达(Buchan and Parker, 2007; Lelandaisetal., 2010)。此外,miRNA调控基因表达的方式可以是正调控或负调控,在不同的细胞周期,这种调控具有不同的效应。如在G1/G0阻滞期,miRNA启动基因的表达;而在细胞分裂期,它们抑制基因的表达。miRNA的这种激活和抑制效应在细胞周期中可持续切换(Vasudevan and Steitz, 2007; Vasudevanetal., 2007; Orometal., 2008)。
昆虫的生长与发育主要受到蜕皮激素和保幼激素两大激素的协同调控,miRNA也参与了这些重要的生命过程的调控。在果蝇的幼虫末期和预蛹期,体内高滴度的蜕皮激素诱导let-7、miR-100和miR-125的表达,同时抑制miR-34的表达,而保幼激素的作用则刚好相反(Bashirullahetal., 2003; Sempereetal., 2003)。另一方面,蜕皮激素能够通过抑制miR-14的表达而增强其信号强度,更有利于调控变态发育(Varghese and Cohen, 2007)。在家蚕Bombyxmori中,miR-281能够抑制蜕皮激素受体B构型的表达,所以miR-281在幼虫蜕皮阶段时期维持在一个较高的水平;而在家蚕化蛹阶段,受蜕皮激素的影响,miR-281表达量降低(Jiangetal., 2013)。在斜纹夜蛾中,miR-14-3p通过靶向蜕皮激素级联基因ECR和E75而参与调控蜕皮激素信号通路(Luoetal., 2020)。然而,未见有novel miRNA参与调控蜕皮激素信号通路的报道。
基于miRNA在调控昆虫的生命过程中的重要作用,实验室对斜纹夜蛾幼虫中肠和头部组织的miRNA进行了深度测序与建库,总共发现了530个 miRNA,其中包含了413个新的miRNA,占总数的77.92%(Zouetal., 2020)。为了进一步研究这些大量的novel miRNA在斜纹夜蛾体内的功能与调控机制,选择其中一个表达量较高的novel-m0287-3p作为研究对象,并利用生物信息学与分子生物学实验相结合的方法进行相关研究。结果表明,novel-m0287-3p在斜纹夜蛾体内通过调控蜕皮激素受体而影响发育,可能是潜在的防治害虫的核酸分子,具有重要的应用价值。
1 材料与方法
1.1 实验材料
1.1.1供试昆虫
实验所用的斜纹夜蛾幼虫和Spli-221细胞株来自中山大学昆虫研究所。斜纹夜蛾幼虫在温度27±1℃、相对湿度70%±5%和光周期12 h光照∶12 h黑暗条件下,采用人工饲料饲养。而Spli-221细胞株在含有10%胎牛血清(FBS)昆虫培养基(SF-900 Ⅲ SFM, GIBCO,Invitrogen,USA)中于28℃恒温培养,每隔2~3 d观察细胞生长状况,并以1∶3的比例稀释培养基后传代培养。
1.1.2实验主要试剂
Taq酶/Ex-Taq DNA聚合酶、DNA限制性内切酶、T4连接酶、pMD′18-T载体、dNTP、RT-PCR试剂盒、荧光定量PCR试剂盒均购自TaKaRa公司(中国);质粒提取试剂盒及Gel Extraction Kit分别为美国Omega和美国Axygen公司的产品;FuGENE©HD转染试剂及荧光素酶的检测试剂盒Dual Luciferase kit购自美国Promega公司;用于细胞培养的胎牛血清和优化培养基Opti-MEM以及SF900-Ⅲ(GIBCO,美国)培养基购自Life公司(美国)。novel-m0287-3p mimic和novel-m0287-3p agomir (模拟体类似物)及阴性对照NC (negative control,序列为5′-UUCUCCGAACGUGUCACGU TT-3′,为无义小片段)均由上海吉玛基因股份有限公司合成。
1.2 实验方法
1.2.1总RNA及蛋白的提取
总RNA的提取按照TaKaRa公司的RNA抽提试剂盒(Trizol Reagent)的方法并加以优化。向组织材料中加入1 mL Trizol Reagent并充分研磨后于冰上静置5~10 min,继而加入氯仿∶异戊醇=24∶1(V/V)200 μL,剧烈震荡15 s后冰上放置10 min,于12 000 rpm和4℃离心20 min。将上层水相转移到新的离心管中,加入等体积预冷异丙醇,上下颠倒混匀,-20℃放置30 min。再次离心20 min,弃上清。加入600 μL 75%乙醇上下颠倒洗涤RNA,离心5 min,弃上清。重复上述洗涤步骤一次。开盖于室温晾干沉淀15 min,最后用DEPC水溶解RNA,保存于-80℃。
1.2.2反转录
根据TaKaRa公司的PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒说明书进行mRNA的反转录。miRNA的反转录采用加尾法,miRNA首先在polyA聚合酶的作用下合成聚腺苷酸尾巴,再由oligo-dT逆转录引物反向合成cDNA。具体步骤参考TaKaRa公司的Mir-XTMmiRNA First-Strand Synthesis and SYBR©qRT-PCR试剂盒说明书操作。
1.2.3实时荧光定量PCR(qPCR)分析
qPCR实验按照TaKaRa公司的2×SYBR©Premix EX TaqTMKit试剂盒的说明书进行。当用目的组织mRNA的cDNA作为qPCR模板时,以斜纹夜蛾核糖体蛋白49基因(ribosomal protein 49 gene,rp49) (GenBank登录号: XM_022963351)为内参基因。反应条件为:95℃预变性5 min,1个循环;95℃ 5 s,60℃ 20 s,40个循环;最后95℃ 60 s;50℃ 30 s;95℃ 30 s,1个循环。miRNA引物设计用premier 5.0软件完成,本研究使用相关PCR的引物序列如表1所示。

表1 本研究所使用的引物
1.2.4细胞转染及荧光素酶检测
转染前一天,将1 mL密度为2×105/mL的斜纹夜蛾Spli-221细胞加入12孔板的单孔中,培养细胞至密度达到80%~95%后进行转染。转染时,每孔用50 μL Opti-MEM培养基稀释1 μg质粒/0.5 μg模拟体(mimics)和3 μL的FuGENE©HD转染试剂,充分混匀并于室温放置10~15 min;定时收集细胞用于检测。用于构建双荧光素酶检测的psicheck-2载体(Promega,美国)内部含有LUC(萤火虫荧光素酶)和RLUC(海肾荧光素酶)基因,将斜纹夜蛾EcRb13′UTR的两个靶位点片段分别构建到海肾荧光素酶基因的3′UTR区域后,将载体分别与novel-m0287-3p mimics和NC mimics共转染Spli-221细胞,使用Promega公司的Dual Luciferase kit试剂盒检测荧光素酶活性。
2 结果与分析
2.1 novel-m0287-3p的鉴定及其靶基因预测与分析
实验室前期通过对斜纹夜蛾幼虫的中肠和头部组织中miRNA的测序、建库和分析,获得了一系列miRNA序列(Zouetal., 2020)。本研究选择了一个含量较高的novel-m0287-3p作为研究对象。为了开展其功能研究,首先确定novel-m0287-3p是否是一个新的miRNA。通过RNAfold(http://rna.tbi.univie.ac.at/cgi-bin/RNAWebSuite/RNAfold. cgi)分析,发现novel-m0287-3p前体的二级结构符合miRNA前体二级结构特征,具有典型的茎环结构(图1-A)。novel-m0287-3p前体序列为:5′-AAATGCAAATTGTTGAATACATGACAAAATCCTGTA ATAGCATACATCATGATTTTGTCAAGTATTTCGCAAT TTTTATTC-3′,novel-m0287-3p成熟体序列(5′-TGATTTTGTCAAGTATTTCGCA-3′)位于发夹结构的一个茎区,长度为22 bp,这与已知动物体内Dicer酶的加工特征相一致。随后将novel-m0287-3p成熟体序列与miRBase数据库(miRBase, http://www.mirbase.org)中已知的miRNA进行比对(图1-B),未发现有相似的miRNA。由此,可以确定novel-m0287-3p为新的miRNA。
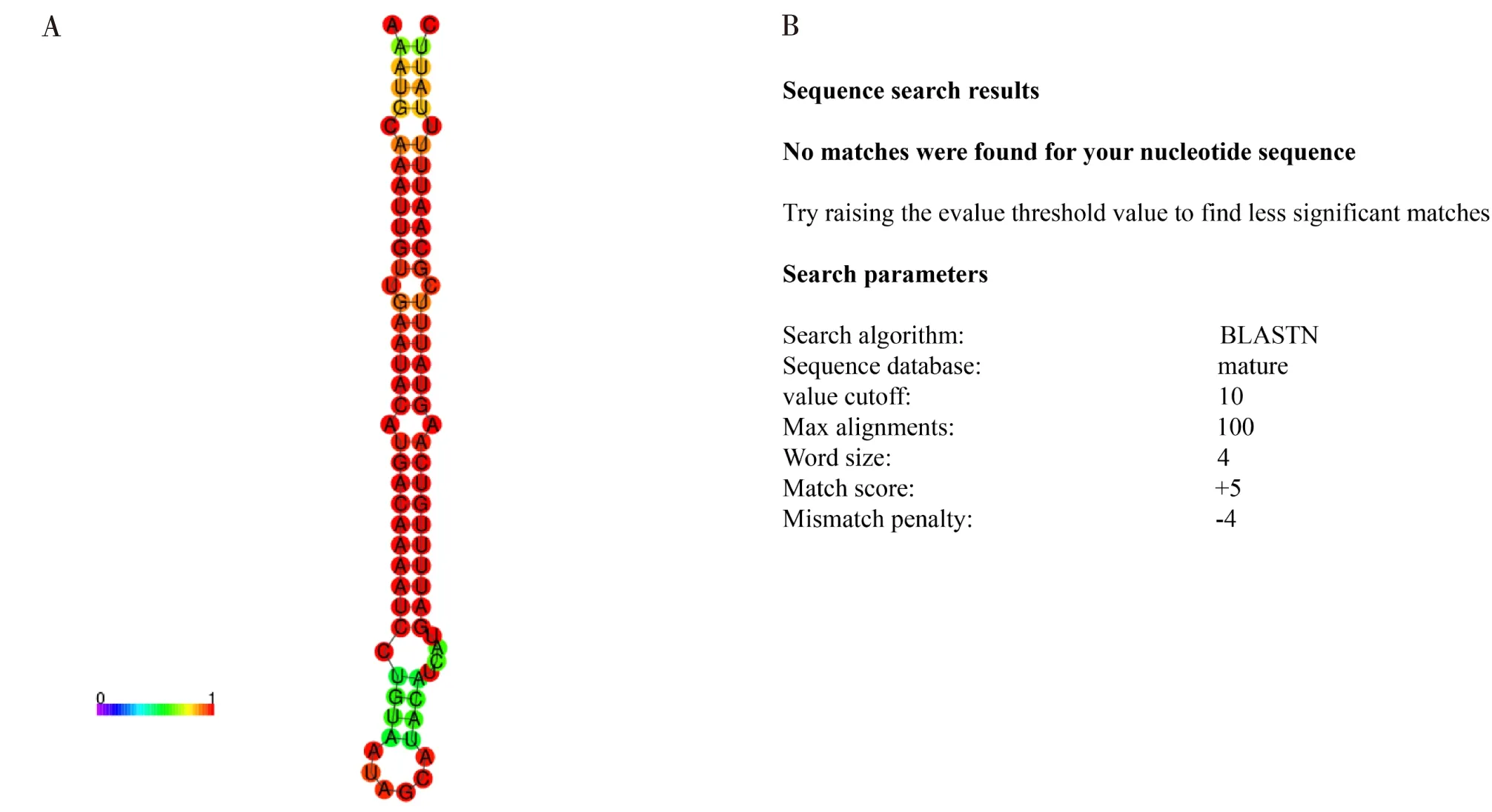
图1 novel-m0287-3p前体二级结构预测及与miRBase数据库比对结果Fig.1 Prediction of the secondary structure of novel-m0287-3p precursor and the results of comparison in the miRBase database注:A,novel-m0287-3p前体的二级结构;B,novel-m0287-3p成熟体序列在miRBase数据库中比对的结果。Note: A,Secondary structure of the novel-m0287-3p precursor; B, Results of the novel-m0287-3p mature sequence alignment in the miRBase database.
2.2 novel-m0287-3p对斜纹夜蛾生长发育的影响
为了研究novel-m0287-3p对斜纹夜蛾生长发育的影响,分别选取斜纹夜蛾4龄第1天以及6龄第3天生长状况相一致的幼虫进行体腔注射novel-m0287-3p agomir(模拟体类似物)。每头幼虫注射10 μg agomir。与对照组相比,4龄第1天的幼虫注射novel-m0287-3p agomir后,其体重增长明显减慢,说明其生长受到抑制(图2-A);而novel-m0287-3p agomir处理后的6龄幼虫化蛹发生滞后(图2-C),与正常虫相比较,虫的发育延缓一天进入蛹期。综合以上结果,推测novel-m0287-3p可能参与调控营养代谢,致使斜纹夜蛾生长缓慢;也可能直接参与调控蜕皮激素信号通路,而影响斜纹夜蛾蜕皮及变态发育。

图2 注射novel-m0287-3p对斜纹夜蛾4龄和6龄幼虫发育的影响Fig.2 Effects of novel-m0287-3p injection on the development of the 4th instar (A) and the 6th instar (B) of Spodoptera litura注:A,注射novel-m0287-3p后4龄幼虫的体重变化;B,4龄幼虫注射novel-m0287-3p 72 h后的表型变化;C,注射novel-m0287-3p后对6龄幼虫化蛹的影响;(1),6龄第4天;(2),6龄第5天;(3),6龄第6天;(4),蛹期;NC,模拟体的阴性对照;novel-m0287-3p,novel-m0287-3p模拟体类似物。Note: A, Changes in body weight of 4th instar larvae after injection of novel-m0287-3p; B, Phenotypic changes of 4th instar larvae injected with novel-m0287-3p for 72 h; C, Effects of injection of novel-m0287-3p on pupation of 6th instar larvae; (1), 6LD4; (2), 6LD5; (3), 6LD6; (4), Pupation; NC, Negative control; novel-m0287-3p, novel-m0287-3p agomir; L, Larval; D, Day.
2.3 预测ECR是novel-m0287-3p的靶基因
由于novel-m0287-3p延后了幼虫的蜕皮,因此分析novel-m0287-3p是否可能靶向蜕皮激素信号通路基因。蜕皮激素信号通路中的关键基因蜕皮激素受体存在两种构型EcRA(XM_022963763)和EcRb1(XM_022963759),并且两种构型的3′UTR是一样的(Luoetal., 2020)。通过PITA和RNAhybrid两个软件分析发现,novel-m0287-3p在EcRb1的3′UTR中可能存在两个结合位点,分别处于3′UTR上的3 055及4 195位点(图3-A、B)。

图3 novel-m0287-3p在EcRb1 3′UTR的两个结合位点Fig.3 Two binding sites in the EcR 3′UTR for novel-m0287-3p
将预测得到的2个长度为100 bp、包含了可能与novel-m0287-3p结合位点的EcR3′UTR片段克隆到psi-check2质粒中,并与合成的novel-m0287-3p模拟物共转染到Spli-221细胞中。如果novel-m0287-3p能结合到上面预测靶位点,则novel-m0287-3p进入到细胞后,海肾荧光素酶mRNA会被降解或者抑制翻译,海肾荧光素酶的活性因而降低。结果显示,与对照组相比,海肾荧光素酶活性降低(图4-A、B),说明novel-m0287-3p能与靶基因EcR3′UTR结合,负调控靶基因EcRb1的表达。
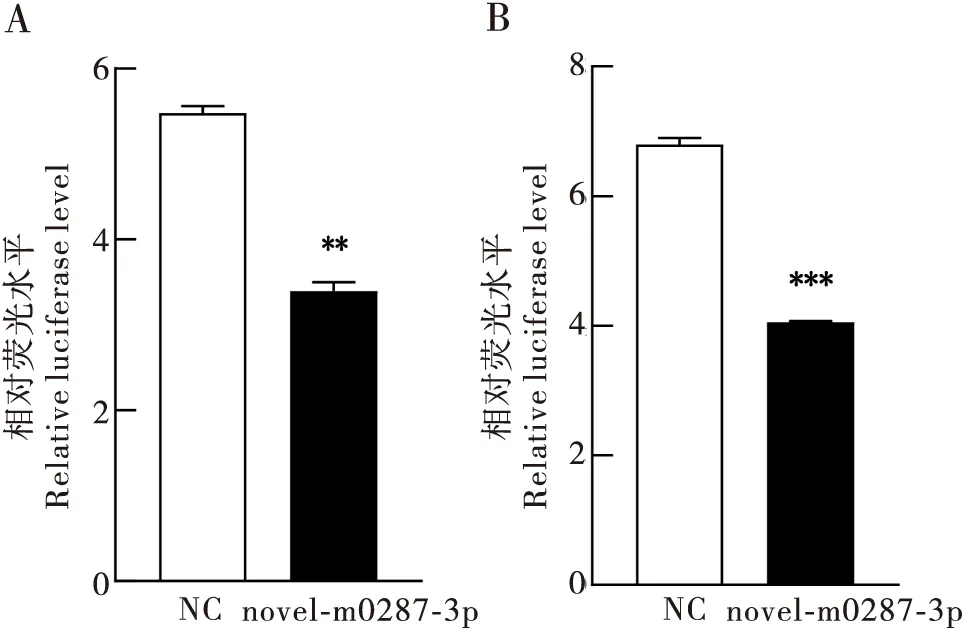
图4 novel-m0287-3p作用EcR 3′UTR的双荧光素酶活性测定Fig.4 Determination of dual luciferase activity with theEcR 3′UTR regulated by novel-m0287-3p注:A,novel-m0287-3p与EcR 3′UTR上的3 055位点作用后的荧光强度;B,novel-m0287-3p与EcR 3′UTR上的4 195位点作用后的荧光强度;NC,模拟体类似物的阴性对照;novel-m0287-3p,novel-m0287-3p模拟体类似物;**表示同一处理时间处理组与对照组间差异显著P<0.01;***表示差异极显著P<0.001,独立样本t检验。Note:A, Fluorescence intensity of novel-m0287-3p interacting with site 3 055 on EcR 3′UTR; B, Fluorescence intensity of novel-m0287-3p interacting with site 4 195 on EcR 3′UTR; NC, Negative control; novel-m0287-3p, novel-m0287-3p mimics; ** showed significantly difference between treatments and control groups by student’s t test at 0.01 level; ***showed significantly difference between treatments by student’s t test at 0.001 level.
2.4 novel-m0287-3p和EcRb1在中肠中表达
为了进一步研究novel-m0287-3p和EcR在虫体中的关系,选取龄期最长的6龄幼虫作为研究对象,分别提取6龄第1天、第3天及第5天的斜纹夜蛾不同组织(头部、中肠、脂肪体和表皮)的总RNA,反转录后通过实时荧光定量PCR分析两者转录水平,分别以snRNAU6和rp49作为novel-m0287-3p和EcRA、EcRb1的内参基因。结果显示,在斜纹夜蛾6龄幼虫的这3个时期的组织表达谱中,novel-m0287-3p都在中肠具有最高的表达量,而在其他组织几乎无表达,表明novel-m0287-3p主要是在中肠调控相关基因表达(图5-A);相同地,EcRb1在中肠中的表达量也比其他组织高,而EcRA在中肠的表达量相对较低,说明EcRb1为中肠EcR的主要表达形式(图5-B、C)。表达谱分析的结果暗示两者在斜纹夜蛾中肠可能存在互作关系。

图5 novel-m0287-3p与EcRb1在斜纹夜蛾幼虫的不同组织的表达谱分析Fig.5 novel-m0287-3p and EcRb1expression levels at different tissues of Spodoptera litura larvae注:A,novel-m0287-3p在各个组织的相对表达量;B,EcRb1在各个组织的相对表达量;C,EcRA在各个组织的相对表达量;L,幼虫期;D,天;FB,脂肪体;MG,中肠;HD,头部;EP,表皮。Note:A, Relative expression of novel-m0287-3p in various tissues; B, Relative expression of EcRb1 in various tissues; C, Relative expression of EcRA in various tissues; L, larva; D, day; FB, Fat body; MG, Midgut; HD, Head; EP, Epidermis.
2.5 novel-m0287-3p抑制EcRb1表达
虫体内novel-m0287-3p与EcRb1表达谱的结果暗示了novel-m0287-3p可能调控EcRb1表达。为了进一步研究两者间的关系,选取4龄第1天、生长状况一致的斜纹夜蛾幼虫进行体腔注射novel-m0287-3p,每头幼虫注射10 μg miRNA。注射novel-m0287-3p 72 h后检测中肠的EcRb1表达水平。结果显示,注射novel-m0287-3p后,斜纹夜蛾中肠EcRb1的mRNA水平发生下调(图6)。说明novel-m0287-3p能够抑制斜纹夜蛾幼虫EcRb1的表达。
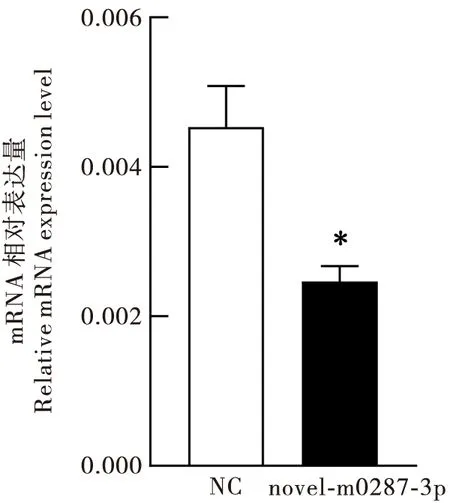
图6 注射novel-m0287-3p后斜纹夜蛾中肠的EcRb1表达水平分析Fig.6 Analysis of EcRb1 mRNA level in the Spodopteralitura midgut after novel-m0287-3p injection注:NC,模拟体类似物的阴性对照;novel-m0287-3p,novel-m0287-3p模拟体类似物;*表示同一处理时间处理组与对照组间差异显著P<0.05,独立样本t检验。Note:NC, negative control;novel-m0287-3p, novel-m0287-3p mimics; *showed significantly difference between treatments and control groups by student’s t test at 0.05 level.
3 结论与讨论
斜纹夜蛾的miRNA数据库表明虫体中存在大量novel miRNA(Zouetal., 2020),其功能不详。而miRNA的鉴定方法主要有3种:克隆构建cDNA文库法,生物信息学预测和高通量测序法。在研究早期为了寻找和鉴定未发现的miRNA,主要通过克隆技术构建cDNA文库,基因克隆适合生物体内丰度较高miRNA的研究,而对于那些只在某些特定组织和细胞表达或者表达量低的miRNA则不适合(Chenetal., 2008; Zhouetal., 2009)。本研究在实验室前期对斜纹夜蛾幼虫中肠组织的miRNA高通量测序的基础上,选择其中一个本底表达量比较高的novel-m0287-3p进行了序列鉴定和功能研究。通过RNAfold分析novel-m0287-3p的前体结构,并将其成熟体序列与miRBase数据库的miRNA比对,确定novel-m0287-3p是一个全新的miRNA(图1)。
目前,用来进行miRNA靶基因预测的生物信息学网站和软件多种多样,但主流的主要有以下几种:TargetScanS、miRanda、PITA、RNAhybrid。尽管每个软件之间的算法不尽相同,但遵循的原理基本一致,大体上分为以下几点:(1)miRNA与靶基因结合形成二级结构间的热力学稳定性;(2)miRNA种子区域和靶基因的互补性;(3)靶基因及其靶位点在同源物种中的保守性;(4)miRNA与靶基因结合形成二级结构的复杂程度(Lewisetal., 2004;John, 2004;Krüger and Rehmsmeier, 2006)。本实验使用PITA和RNAhybrid两个在线软件共同对novel-m0287-3p进行靶基因预测,求其交集基因以提高结果的精准度。预测发现novel-m0287-3p可能靶向蜕皮激素信号通路基因EcRb1(图3)。
为了进一步探究novel-m0287-3p的功能,本研究通过采用基因沉默技术,用novel-m0287-3p模拟体类似物分别注射4龄与6龄幼虫,皆得到了幼虫生长发育受到抑制的结果(图2),并且发现在这些虫中的EcRb1表达量下降(图6)。进一步通过双荧光素酶报告系统证明了novel-m0287-3p结合于EcRb13′UTR的两个位点(图4)。表明EcRb1是novel-m0287-3p的靶基因之一。蜕皮激素是调控昆虫蜕皮与变态发育的重要因素,其受体EcR的表达下降将导致昆虫不能正常蜕皮而生长延缓,甚至死亡。因此,本研究证明了novel-m0287-3p在调控昆虫发育中的功能,同时也证明了斜纹夜蛾中所存在的大量novel miRNA是具有功能的。
已有研究表明miRNA调控EcR的表达。在家蚕中,马氏管特异性表达的miR-281调控靶标基因Bm-EcR的表达(Jiangetal., 2013);在果蝇中,miR-14通过靶向基因EcR而调控蜕皮激素信号通路(Varghese and Cohen, 2007);在棉铃虫Helicoverpaarmigera中,针对靶基因Ha-EcR设计的人造miRNA可以影响棉铃虫的正常生长和产卵量(Yogindran and Manchikatla, 2016)。本研究的结果表明novel-m0287-3p通过结合3′UTR而调控EcR的表达。这些结果表明了不同物种中的EcR受不同miRNA的调控。由于每个基因有可能受多个miRNA的调控,因此,仅novel-m0287-3p不能完全抑制EcR的表达(图6),这可能是注射novel-m0287-3p不能完全控制斜纹夜蛾蜕皮的原因(图2)。同时,通过预测,本研究发现novel-m0287-3p可能靶向相关营养代谢通路基因。因此,注射novel-m0287-3p后的斜纹夜蛾发育延缓也可能是营养代谢受到影响的缘故,这需要后续实验的进一步验证。
本研究中利用荧光定量PCR的方法分析了novel-m0287-3p和EcRb1的时空表达谱(图5),发现novel-m0287-3p具有中肠特异性表达的特点,表明novel-m0287-3p在主要是在中肠调控靶基因而发挥作用,可能调控EcR在中肠的表达量较高的基因EcRb1。两者的时空表达谱以及结合实验表明两者在中肠发生关系,而调控围食膜的发育。通过向斜纹夜蛾幼虫血淋巴注射novel-m0287-3p agomir及其阴性对照NC agomir,并对中肠中EcRb1的mRNA表达量进行检测后发现,与对照相比,注射novel-m0287-3p后斜纹夜蛾体内EcRb1的mRNA水平发生下调,说明所注射的novel-m0287-3p能够运输至中肠,抑制中肠内EcRb1的表达。
综上所述,本研究通过表达谱分析、结合实验和敲除实验,证明了novel-m0287-3p对斜纹夜蛾中肠EcRb1表达的调控,从而证明了novel-m0287-3p在斜纹夜蛾发育中的功能。

