长链非编码RNA SLC26A4反义RNA 1通过Notch信号抑制乳腺癌细胞增殖与转移
姜春峰 张娜 邢鑫 张玉萍 宋蕾
乳腺癌是女性最常见的恶性肿瘤,是女性肿瘤相关死亡的最主要原因[1]。尽管乳腺癌诊治方面取得了较大进展,但预后仍不理想[1-2]。全面了解乳腺癌转移进展机制对改善病人预后具有重要意义。长链非编码RNA(long noncoding RNA,lncRNA)表达失调参与多种恶性肿瘤进展和转移[3]。有研究发现,SLC26A4反义RNA 1(SLC26A4 antisense RNA 1,SLC26A4-AS1)与乳腺癌病人预后显著相关[4]。SLC26A4-AS1是一种具有抗肿瘤功效的新型LncRNA分子,在甲状腺癌伴随淋巴结转移组织表达缺失严重,可以通过促进TP53减弱MAPK通路活性抑制甲状腺乳头状癌细胞的增殖和侵袭[5-6]。Notch信号通路调控关键靶基因转录活性,是多种癌症的治疗靶点[7]。本研究基于Notch信号通路探究SLC26A4-AS1调控乳腺癌增殖、迁移和侵袭的潜在机制。
对象与方法
一、对象
2017年6月~2020年12月期间收治原发性乳腺癌病人40例,均经病理组织学检查确诊,术前均无肿瘤治疗史,收集乳腺癌组织及对应癌旁组织(距离癌组织边缘5 cm以上)。本研究获得我院伦理委员会批准和病人知情同意。本试验所用的正常乳腺上皮细胞MCF-10A以及乳腺癌细胞系T47D、MDA-MB-231、MDA-MB-468和MCF7均购自中国科学院上海生物化学与细胞生物学研究所。
二、方法
1.试验试剂:脂质体Lipofectamine®3000购自美国Thermo公司;RPMI-1640培养基、胎牛血清等购自美国Gibco公司;pcDNA3.1空载和pcDNA3.1-SLC26A4-AS1过表达载体购自安徽通用生物系统有限公司;引物合成自苏州金唯智生物科技有限公司合成;反转录试剂盒One Step PrimeScript cDNA Synthesis Kit购自大连宝生物有限公司。
2.组织、细胞培养及处理:收集乳腺癌组织及距离肿瘤5cm以上的癌旁组织,各40例。用RPMI-1640培养基复苏细胞,按照1∶9的比例加入10%的FBS;加入1%的双抗,放置于37 ℃,5% CO2恒温培养箱培养。待细胞生长至密度达约50%~60%时,将2.5 μg空载和SLC26A4-AS1过表达载体pcDNA3.1-SLC26A4-AS1分别与转染试剂混合孵育15分钟,转染进MCF7细胞。转染后48小时收集细胞用于后续试验。细胞分组为:control、pcDNA3.1组、pcDNA3.1-SLC26A4-AS1组和pcDNA3.1-SLC26A4-AS1+Notch激动剂组。
3.荧光定量PCR(qRT-PCR)实验:细胞转染48小时后,吸取Trizol试剂800 μl加入每孔细胞中,提取细胞总RNA,反转录合成cDNA并进行荧光定量qRT-PCR检测。SLC26A4-AS1的表达使用GAPDH作为内参,定量结果采用2-ΔΔCt表示。引物序列如下:
SLC26A4-AS1-F:5'-GGCTCCTAGAACCCACTC-3',
SLC26A4-AS1-R:5'-CCTCTGGCTCGCAGGTCAT-3';
Notch1-F:5'-TGCCAGACCAACATCAAC-3',
Notch1-R:5'-CTCATAGTCCTCGGATTGC-3';
Hes1-F:5'-ATTCCTCGTCCCCGGTGGCT-3',
Hes1-R:5'-CAGCTTGGAATGCCGCGAGCT-3';
GAPDH-F:5'-AAGAAGGTGGTGAAGCAGGC-3',
GAPDH-R:5'-TCCACCACCCAGTTGCTGTA-3'。
4.细胞增殖实验:按照1×104/孔的密度将细胞接种至96孔板,待密度达到50%左右进行转染,每组5个重复。在转染0、24小时、48小时、72小时收集细胞,加入浓度为5 μg/μl的MTT溶液,孵育4小时利用DMSO终止反应。酶标仪测定细胞吸光度值(OD490),分析细胞增殖能力。
5.细胞划痕实验:取密度为5×105/ml细胞接种至六孔板,每组重复3个。待细胞长满后使用无菌10 μl的Tip枪头,垂直于孔板在细胞划痕,显微镜拍照;继续培养24小时后再次拍照。根据划痕愈合区域分析细胞迁移能力。
6.细胞侵袭实验:用含有1%FBS的培养基重悬细胞至密度1×105/ml,取100 μl细胞接种至含有基质胶的小室上室,下室加入含有10% FBS的培养基孵育24小时。4%多聚甲醛固定30分钟,结晶紫染液染色15分钟,显微镜拍照,分析细胞侵袭能力。
三、统计学分析

结果
3.SLC26A4-AS1对Notch信号的影响:control组和pcDNA3.1组MCF7细胞中Notch1的相对表达量分别为1.000±0.231和1.121±0.207,差异无统计学意义;pcDNA3.1-SLC26A4-AS1组MCF7细胞中Notch1的相对表达量为0.475±0.146,低于pcDNA3.1组(P<0.01)。control组和pcDNA3.1组MCF7细胞中Hes1的相对表达量分别为1.000±0.231和1.121±0.207,差异无统计学意义;pcDNA3.1-SLC26A4-AS1组MCF7细胞中Hes1的相对表达量为0.531±0.142,低于pcDNA3.1组(P<0.01)。
4.SLC26A4-AS1对乳腺癌细胞增殖的影响:control组和pcDNA3.1组MCF7细胞活力比较差异无统计学意义。pcDNA3.1-SLC26A4-AS1组MCF7细胞活力低于pcDNA3.1组(P<0.01)。pcDNA3.1-SLC26A4-AS1+Notch激动剂组MCF7细胞活力高于pcDNA3.1-SLC26A4-AS1组(P<0.01)。见图1。

图1 SLC26A4-AS1对MCF7细胞增殖的影响
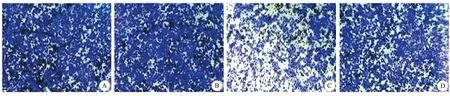
A:control组:镜下可见大量细胞穿膜并聚集;B:pcDNA3.1组:镜下可见大量细胞穿膜并聚集;C:pcDNA3.1-SLC26A4-AS1组:镜下可见细胞穿膜并聚集,与pcDNA3.1组和pcDNA3.1-SLC26A4-AS1+Notch激动剂组比,穿膜细胞几乎减半;D:cDNA3.1-SLC26A4-AS1+Notch激动剂组:镜下可见大量细胞穿膜并聚集
讨论
LncRNAs具有组织表达特异性,不同肿瘤组织中LncRNAs表达模式存在差异,大量的LncRNAs已被证明在乳腺癌进程中发挥调控作用,如H19、HOTAIR、MALAT1以及一些新鉴别的RACGAP1P、CBR3-AS1等[8-9]。SLC26A4-AS1是SLC26A4的反义非编码转录本,在甲状腺癌和胶质瘤中表达异常缺失,作为抑癌因子发挥功效[5-6,10]。SLC26A4-AS1可以同时与DDX5和E3连接酶TRIM25相互作用,通过泛素-蛋白酶体途径促进DDX5的降解,同时抑制多个DNA双链断裂(DSBs)修复基因的表达[6]。SLC26A4-AS1还被发现在基底型乳腺癌发生DNA甲基化[11]。有学者鉴别乳腺癌特异性lncRNAs时发现SLC26A4-AS1处于竞争性内源性RNA(competing endogenous RNAs,ceRNA)网络调控细胞分裂和周期的枢纽节点,其在乳腺癌组织中低表达有效预示病人预后不良[4]。本研究收集原发性乳腺癌病人癌组织及对应癌旁组织,qRT-PCR检测显示SLC26A4-AS1在乳腺癌组织表达下调;同时检测还发现,SLC26A4-AS1在乳腺癌细胞中表达明显低于正常乳腺上皮细胞,这与Wu等[4]测序结果吻合,暗示SLC26A4-AS1可能参与乳腺癌发展。为进一步探究SLC26A4-AS1影响乳腺癌恶性表达及潜在作用机制,在乳腺癌细胞MCF7中转染pcDNA3.1-SLC26A4-AS1质粒上调其表达,检测显示,增强SLC26A4-AS1表达减弱MCF7细胞增殖能力、抑制细胞迁移和侵袭的发生。以上说明SLC26A4-AS1能够抑制乳腺癌细胞增殖和转移,缓解乳腺癌恶性表型。
Notch信号异常激活在肿瘤的启动和维持中发挥着重要作用[12]。哺乳动物基因组编码4个Notch受体(Notch1-4),其中Notch1是一种Ⅰ型跨膜异二聚体受体,被报道与肿瘤发生发展密切联系[7,12]。Notch1通过与Notch配体(Delta、Jagged)产生相互作用启动Notch信号传导,通过蛋白酶切水解,激活下游基因靶标Hes1、Hes5、Hey1、Hey2等的转录[12-13]。lncRNAs分子通过Notch信号途径间接或直接调控肿瘤细胞的转移、增殖分化以及耐药。Linc00514通过促进Jagged1介导的Notch信号通路,增加乳腺癌细胞IL-4和IL-6的分泌,诱导肿瘤相关巨噬细胞M2极化,加速乳腺癌转移[14]。FEZF1-AS1可能作为miR-34a的内源性海绵上调Notch1表达,从而促进胶质瘤细胞转移[15]。本研究发现,乳腺癌细胞MCF7中过表达SLC26A4-AS1明显降低Notch1和Hes1表达,失活Notch信号。另外,在过表达SLC26A4-AS1的基础上加入Notch激动剂处理MCF7细胞,检测发现激活Notch信号通路明显缓解了过表达SLC26A4-AS1对MCF7细胞增殖、迁移和侵袭的抑制作用,说明SLC26A4-AS1可以通过调控Notch信号通路抑制乳腺癌细胞增殖、迁移和侵袭。
本研究结果表明,SLC26A4-AS1在乳腺癌组织和细胞中呈低表达,SLC26A4-AS1过表达能够抑制乳腺癌细胞的增殖、迁移和侵袭能力,其中分子机制可能与介导激活Notch信号通路有关。

