pH响应/H2O2自供型金属过氧化物在肿瘤化学动力学治疗中的应用
高铭英,赵婷婷,姜 宇,马佳悦,韩育衡,李妍妍,王 霆
(东北林业大学化学化工与资源利用学院,黑龙江 哈尔滨 150040)
1 前 言
癌症(恶性肿瘤)作为最复杂的疾病之一,目前依然是造成人类死亡的主要原因。根据联合国最新的预测,截至2030年,全球的癌症死亡总人数将达到1320万[1]。常见的癌症治疗策略主要包括手术切除、化学药物治疗、放射治疗、消融治疗、免疫治疗和光学治疗(包含光动力疗法和光热疗法)等。其中,手术切除、化学药物治疗、放射治疗、消融治疗和免疫治疗等技术已经应用于临床实践,并且取得了一定的疗效,但它们都还存在着诸多问题(比如容易引起强烈的并发症、产生严重的毒副作用、缺乏靶向性等),有待进一步解决。
与人体正常的器官组织相比,肿瘤病灶区的局部微环境(tumor microenvironment,TME)一般会呈现一些特异性,如局部微酸性、富含过表达的H2O2、组织乏氧等[2]。当前,根据肿瘤区域的这些特征,人们设计了多种多样的能够响应TME(如低pH敏感、H2O2响应、低氧靶向等)的生物医药材料,并将该材料作为药物载体应用于肿瘤治疗[3]。然而,通过对纳米材料自身的巧妙设计实现基于TME区域特异性激活的高效肿瘤治疗策略目前依然面临着巨大的挑战。化学动力学疗法(chemodynamic therapy,CDT)是一种新型前沿的肿瘤治疗技术,近些年来发展非常迅速[4]。CDT无需借助O2和外部能量(光能或超声)即可进行治疗,能被肿瘤内源性刺激激活,这使得该技术更适用于具有弱酸性、高H2O2浓度和低O2含量的TME,对光学治疗敏感性差的深部肿瘤组织具有高度的选择特异性[5,6]。然而遗憾的是,当前CDT的治疗效果严重受限于肿瘤区域H2O2含量和离子(Fe2+、Cu+等)代谢水平,因而如何提高肿瘤病灶区H2O2和具有催化活性的金属离子的浓度是实现高效CDT治疗的关键。
金属过氧化物(metal peroxides,MO2,M为Ca,Cu和Mg等)是人们最新开发出来用于治疗肿瘤的生物纳米材料,在TME中具有低pH响应、快速分解和自供H2O2等特点,可以显著提升肿瘤病灶区H2O2水平,使肿瘤细胞发生金属离子过载,通过芬顿或类芬顿反应使活性氧自由基(reactive oxygen species,ROS)急剧增多,同时释放的某些金属离子也会抑制细胞线粒体电子传递链协同杀死肿瘤细胞,因此MO2在应用于肿瘤CDT时表现出了巨大的优势[7]。本文首先介绍CDT的基本概念和治疗原理,接着总结MO2纳米材料的种类及应用于肿瘤CDT治疗时的反应原理与机制,并评述近年来国内外报道的不同pH响应/H2O2自供型MO2纳米材料的研究进展情况,最后展望这类材料在肿瘤治疗领域的应用前景和发展趋势,并指出存在的挑战,为该类材料未来发展提供借鉴性研究思路。
2 化学动力学疗法的概念和治疗原理
CDT是一种新兴的基于ROS杀伤肿瘤细胞的治疗技术,主要机制是基于芬顿或类芬顿反应,利用纳米材料催化肿瘤区域过表达的H2O2,以产生高细胞毒性的羟基自由基(·OH)等强氧化性活性物种,用该活性物种破坏细胞生物大分子如脂质、蛋白质和DNA,引发细胞死亡,从而达到肿瘤治疗的目的[8,9]。芬顿和类芬顿反应在形成ROS的过程中主要依赖金属催化剂离子与H2O2之间的相互作用,无需O2和外部能量的输入[10]。
正常体内的H2O2来源一般有几种,如主要是在细胞新陈代谢时,胞内各种物质的氧化分解过程中产生;线粒体呼吸链电子传递过程中存在电子漏途径,漏出的电子并没有参与正常三磷酸腺苷合成的能量代谢过程,而是与O2反应,产生超氧阴离子(·O2-),最后通过链式反应进一步还原为H2O2,这些H2O2在细胞新陈代谢、信号传递和机体免疫等方面都发挥着重要作用[11]。由于肿瘤细胞的基因活性、细胞受体信号传导和线粒体功能与正常细胞有异,因而该细胞间隙或内部往往会比正常细胞产生更多的H2O2(浓度为0.1~1.0 mmol/L)[12-14]。CDT技术正是利用这些过量表达的H2O2,以肿瘤局部微环境的弱酸性为反应条件、过渡金属材料为纳米催化剂,诱使细胞内发生芬顿或类芬顿反应,催化H2O2产生·OH等强氧化性ROS物种,引发肿瘤细胞凋亡。CDT不需要外界光能或超声能量刺激,也不需要O2参与,有望克服肿瘤光/声动力疗法(目前基于ROS治疗最常用的技术)遇到的一些难题,比如肿瘤组织内光穿透深度不足和乏氧环境下单线态氧生成效率低下等。
近些年,可用于肿瘤CDT的纳米材料受到了广大科研工作者们的强烈关注[15-17]。譬如,最经典的CDT纳米材料是Fe3O4纳米粒子,主要利用Fe3O4纳米粒子中的Fe2+与H2O2在酸性条件下发生芬顿反应,如式(1)和式(2)所示[18]:
Fe2++H2O2→Fe3++·OH+OH-
(1)
Fe3++H2O2→Fe2++·O2H+H+
(2)
可以看出,H2O2与Fe2+反应后生成Fe3+、·OH和OH-。与其他类型的ROS相比,·OH能够以更高的速率去攻击和氧化大多数有机分子,对细胞造成更大的破坏[19]。此外,还有一些其他过渡金属离子(如Mn2+、Ti3+、Cu2+和Co2+等),也可以作为类芬顿反应的催化离子,用于实现肿瘤CDT[20-23]。
3 不同类型的金属过氧化物材料
MO2可以认为是H2O2分子中的2个氢原子被金属离子取代后的产物,因此可以看成是H2O2的衍生物,主要包括CaO2、CuO2和MgO2等。MO2材料在水中或加热条件下可以缓慢分解释放O2,而在酸性条件下可以与水快速发生反应,生成金属氢氧化物(或金属离子)和H2O2,表现出强烈的氧化作用[24],如式(3)~式(5)所示[15]:
MO2+2H2O→M(OH)2+H2O2
M=Ca,Cu,Mg,Zn,etc.
(3)
M(OH)2+2H+→M2++2H2O
(4)
2H2O2→O2+2H2O
(5)
反应中生成的H2O2产物:① 会直接导致肿瘤细胞内的氧化应激水平增加;② 可以进一步与解离出来的或者通过外源性添加的过渡金属离子(比如Cu+、Fe2+、Mn2+和Co2+等)发生芬顿或类芬顿反应生成·OH,实现CDT;③ 可以被机体内过氧化氢酶或一些纳米酶材料(如MnO2纳米颗粒)催化分解而产生氧气,用于提高光/声动力疗法和放射疗法等O2依赖治疗技术的疗效。此外,上述反应过程释放的过量金属离子有时候也能起到抑制肿瘤细胞生长与增殖的作用,例如CaO2释放的Ca2+引起细胞钙超载[25]和ZnO2释放的Zn2+会抑制细胞线粒体电子传递链的活性[26],从而起到协同杀死肿瘤细胞的效果。
3.1 过氧化钙(CaO2)
Ca2+广泛存在于机体各种细胞中,在体内各项生理活动如维持细胞膜生物电位、细胞增殖等中均扮演着重要的角色。在肿瘤细胞内,由于过氧化氢酶表达下调,氧化应激水平的增加会改变一些蛋白质的功能,导致钙相关的离子通道脱敏,引发Ca2+在肿瘤细胞内发生不可控积累,因而肿瘤细胞内Ca2+浓度高于正常细胞[27,28]。CaO2纳米材料是最先开发出来也是研究最多的一类用于肿瘤治疗的MO2材料,该材料可以在酸性条件下分解为Ca2+和H2O2,Ca2+本身具有一定的化学惰性,很难像Fe2+或Mn2+催化剂一样直接与H2O2发生芬顿反应,但CaO2分解生成的H2O2可对芬顿反应产生显著的促进作用[29]。此外,释放的过量Ca2+会诱使肿瘤细胞的细胞质内Ca2+异常积累,引起细胞发生钙超载,从而加剧诱导细胞死亡[25]。
2020年,Han等[30]将合成的Fe3O4纳米粒子与CaO2纳米粒子结合在一起,联合花青素Cy7近红外染料荧光标记技术,采用透明质酸(hyaluronic acid,HA)稳定剂进行共包覆,构建了一种新型的基于CaO2的H2O2自供型用于增强CDT疗效的纳米诊疗平台(CaO2-Fe3O4@HA NPs)。该纳米体系特异性响应肿瘤弱酸环境,首先与H2O反应生成H2O2,其中的Fe3O4组分进一步将H2O2转化为·OH,诱导肿瘤细胞死亡,增强CDT治疗效果,如图1所示。利用体系中Fe3O4纳米粒子的T2型磁共振增强和Cy7染料的近红外荧光性能,也实现了实时监测材料的靶向肿瘤富集效果和体内CDT可视化治疗。
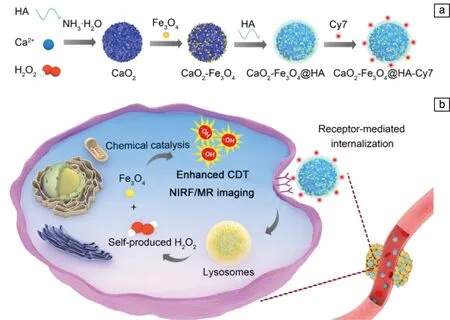
图1 CaO2-Fe3O4@HA NPs的合成过程示意图(a)和化学动力学疗法机理示意图(b)[30]Fig.1 Schematic diagram of synthetic procedures (a)and schematic illustration for the chemodynamic therapy mechanism (b)of CaO2-Fe3O4@HA NPs[30]
2021年,Yan等[31]将光敏分子Ce6、MnO2与黑色素纳米颗粒整合在一起,修饰具有靶向肿瘤细胞表面受体CD44功能的HA,制备了MCMnH纳米材料,并将该纳米材料和CaO2纳米颗粒联用,组装到壳聚糖温敏性水凝胶里,得到了一种多重TME刺激响应的诊疗材料平台。受益于体系中使用的CaO2纳米颗粒在弱酸下可分解产生大量H2O2的特性,该纳米平台在近红外辐射下不仅能产生强烈的光热转换效应,还可以显著促进光敏剂产生单线态氧,同时MnO2分解产生的Mn2+可以进一步发生芬顿反应产生大量ROS,从而同时提高CDT、光动力疗法和光热疗法联合抗肿瘤的作用。此外,MCMnH+CaO2纳米平台还显示出优异的磁共振和红外光热成像能力,为监测治疗过程提供了多种可视化方案。同年4月,Chen团队[32]设计并合成了具有多酚化合物单宁酸(tannic acid,TA)和Fe3+配位化合物TA-Fe纳米涂层的CaO2纳米药物(CaO2@TA-FeⅢ),该药物合成方法简单便捷,易于快速大量合成。应用于肿瘤治疗时,CaO2@TA-FeⅢ纳米药物可以靶向到达肿瘤部位,其中包含的CaO2纳米球会逐渐发生解离,生成的H2O2与纳米涂层中被TA还原生成的Fe2+发生芬顿反应,产生的·OH诱导肿瘤细胞发生氧化应激,促进“钙超载”过程的发生,从而加速肿瘤细胞死亡。体外细胞和动物体内的实验结果表明,CaO2@TA-FeⅢ纳米体系能够有效杀伤肿瘤细胞,显著抑制肿瘤生长,具有优异的肿瘤治疗效果,在肿瘤治疗领域具有广阔的应用前景。
3.2 过氧化铜(CuO2)
与Fe2+催化的芬顿反应相比,Cu2+催化的类芬顿反应在弱酸性或者中性条件下都可以高效地发生,且反应速率更快,可达到Fe2+芬顿反应速率的160倍[33]。Cu2+与H2O2产生的类芬顿反应过程如式(6)和式(7)所示[34]:
Cu2++H2O2→Cu++·O2H+H+
(6)
Cu++H2O2→Cu2++·OH+OH-
(7)
可以看出,Cu2+与H2O2反应后生成Cu+、·O2H和H+;而Cu+可与H2O2继续反应,生成Cu2+、·OH和OH-。此外,Cu+也可以来源于Cu2+与肿瘤内高浓度的谷胱甘肽(glutathione,GSH)之间发生的氧化还原反应,如式(8)所示:
Cu2++GSH→Cu++GSSG(氧化型谷胱甘肽)
(8)
在2019年,Lin等[35]将聚乙烯吡咯烷酮作为保护剂,加入Cu2+和H2O2在碱性条件下反应,得到了粒径为5 nm左右的CuO2纳米点,并将该纳米点开发为一种用于肿瘤CDT的纳米药物。研究表明,该CuO2纳米点在小鼠尾静脉注射后能够通过肿瘤组织特有的高通透性和滞留效应被动靶向富集到肿瘤组织内,并特异性地响应肿瘤弱酸微环境,逐渐分解为Cu2+和H2O2,进一步发生类芬顿反应产生大量·OH,·OH通过诱导溶酶体脂质过氧化而影响溶酶体膜渗透功能,从而介导肿瘤细胞凋亡,实现了H2O2自供型CDT,如图2所示。这项工作首次将CuO2材料开发为一种新型的H2O2自体供给型的CDT纳米药物,该药物具有肿瘤被动靶向、体内特异性可降解等优点,有效解决了当前很多CDT纳米材料应用时面临的肿瘤内H2O2不足等问题,对今后开发其他类型的用于肿瘤治疗的MO2材料具有启示意义。
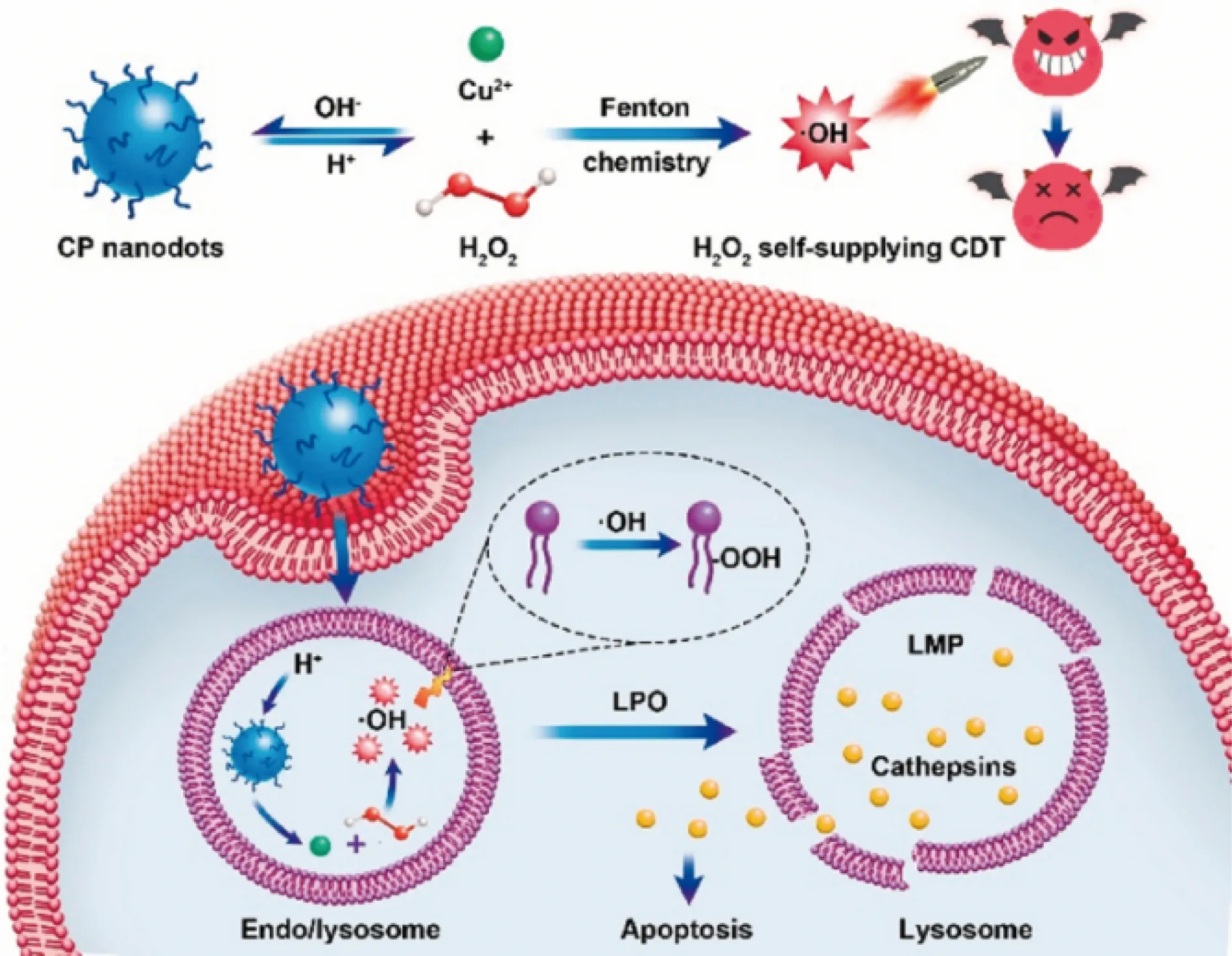
图2 CuO2纳米点的合成和化学动力学疗法机理示意图[35]Fig.2 Schematic illustration for the synthesis and chemodynamic therapy mechanism of CuO2 nanodots[35]
2021年,Hou等[36]将丝胶蛋白作为稳定剂,在碱性条件下采用一步过氧化的方法,合成了装载有化疗药物阿霉素(Dox)的CuO2纳米载体(SS-CuO2@Dox,SCD),该纳米载体通过自供H2O2和递送Dox药物实现肿瘤CDT/化疗协同治疗,如图3所示。在动物体内的实验发现,经尾静脉注射后,该SCD可以通过高通透性和滞留效应靶向富集到肿瘤区域,并在肿瘤弱酸性环境下,特异性分解生成H2O2和Cu2+,实现基于类芬顿反应的肿瘤CDT应用。同时,Dox在肿瘤内的成功释放所产生的化疗效果可以与CDT协同作用,显著增强了CuO2纳米载体对肿瘤的治疗效率。
3.3 过氧化镁(MgO2)
镁是人体必需的一种矿物常量元素,几乎会参与体内所有新陈代谢过程及生命活动,大部分成年人体内镁的总含量为20~28 g,其中有60%以上存在于骨头和牙齿中,约27%分布于软组织,多以活泼的Mg2+-ATP形式存在。MgO2材料具有弱氧化性,在酸性条件下与H2O反应生成Mg2+和H2O2,对芬顿或类芬顿反应的发生有促进作用[37]。
2019年,Tang等[38]首次将MgO2开发为一种具有TME响应性和生物降解性的肿瘤治疗纳米药物,如图4所示。他们采用转铁蛋白对合成的MgO2纳米片(transferrin-modified magnesium peroxide nanosheets,TMNSs)进行表面修饰,提出了一种利用肿瘤细胞与正常细胞代谢微环境的差异性(如肿瘤微酸环境、过氧化氢酶含量低等),使用TMNSs纳米药物将ROS特异性递送给肿瘤细胞,而不会对正常细胞造成损害的分子动力学治疗新策略。该纳米片具有较高的比表面积,能够高效负载转铁蛋白,并在微酸性和低过氧化氢酶活性的TME中更快地与质子反应,释放无毒的Mg2+,产生高浓度的H2O2促进肿瘤细胞死亡,并破坏转铁蛋白结构释放Fe3+,进而通过芬顿反应产生剧毒·OH杀伤肿瘤细胞。难能可贵的是,TMNSs在TME和正常组织中都能降解,生成的物种(Mg2+、O2和H2O)均无毒无害,因而具有优异的生物相容性。因此,该研究提供了一种崭新的利用生物可降解的MgO2纳米前药选择性地将ROS递送给肿瘤细胞的治疗策略,有望实现更加安全的临床治疗。
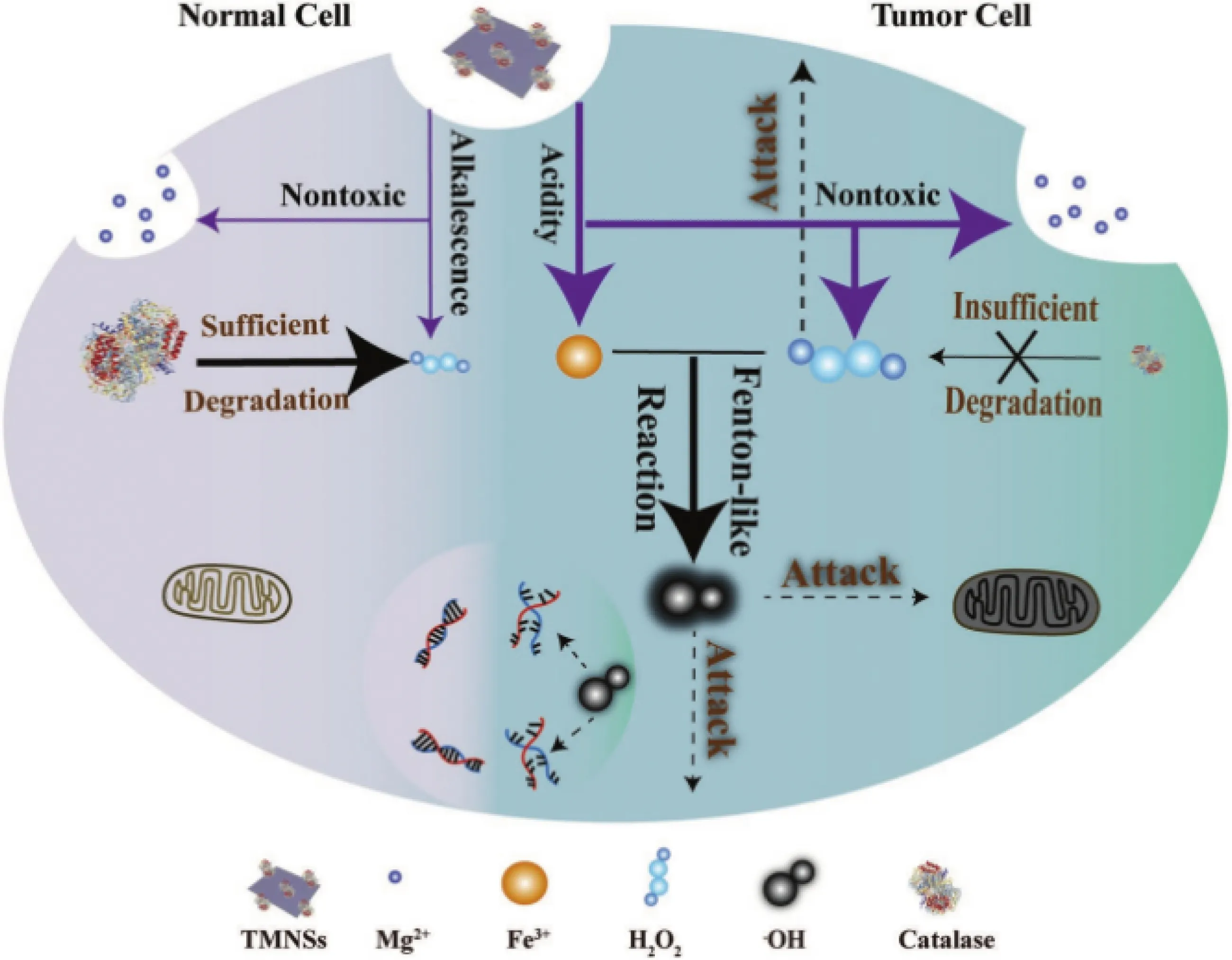
图4 基于MgO2的纳米药物用于肿瘤治疗示意图[38]Fig.4 Schematic diagram of MgO2-based nanodrug for tumor therapy[38]
3.4 过氧化锌(ZnO2)
Zn2+是生命必需的一种微量金属离子,在机体的生长发育、促进细胞免疫功能等方面都有着非常重要的作用。然而,锌元素在肿瘤细胞内的积累会抑制细胞线粒体末端氧化和呼吸作用,诱导线粒体凋亡,因而表现出抗细胞增殖作用,还可以依靠激活细胞内的特定信号通路起到抑制肿瘤侵袭和迁移的作用。因此,含锌的一类材料通过这些作用机制可以表现出很强的抗肿瘤能力[39]。
2019年,Lin团队[26]设计合成了一种掺杂顺磁锰(Mn)的基于聚乙烯吡咯烷酮修饰的过氧化锌纳米颗粒(Mn-ZnO2NPs),并将该纳米颗粒用于肿瘤组织细胞内的ROS增强剂和生成剂,如图5所示。Mn-ZnO2NPs被选择性地内化到肿瘤细胞后,在溶酶体弱酸环境下进行分解,不仅实现了外源性H2O2的可控传递,而且释放的Zn2+也可以通过抑制电子传递链增加线粒体内·O2-和H2O2的产生,增加了内源性活性氧的产生,从而协同治疗肿瘤。此外,微酸性条件刺激释放的Mn2+拥有T1型磁共振增强性能,使得Mn-ZnO2NPs材料具有可特异性激活的磁共振成像能力,这有助于监测体内材料的解离和后续的治疗过程。
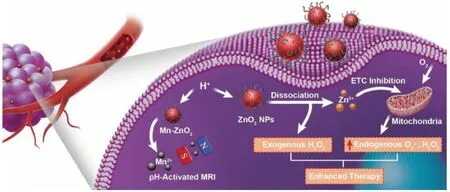
图5 Mn-ZnO2 NPs用于增强氧化应激肿瘤治疗示意图[26]Fig.5 Schematic illustration of the Mn-ZnO2 NPs for enhanced oxidative stress-based tumor therapy[26]
2021年,Zhang团队[40]通过液相反应将卟啉类光敏剂(sinoporphyrin sodium,SPS)负载到合成的ZnO2纳米粒子上,得到的纳米体系SPS@ZnO2NPs可作为一种TME响应的多功能纳米药物,用于荧光成像引导的分子动力学疗法和光动力疗法协同治疗肿瘤,如图6所示。在弱酸性的TME中,SPS@ZnO2NPs分解为H2O2和内源性Zn2+,同时释放装载的SPS光敏分子,在630 nm激光照射之下,产生有毒的1O2引发光动力治疗效果。肿瘤细胞内H2O2水平的升高不但急剧增加了细胞氧化应激负担,也协同消耗了胞内的GSH,从而增强了光动力疗法的作用。这种双模式联合治疗策略可以通过产生大量ROS来破坏溶酶体和线粒体,选择性地诱导肿瘤细胞凋亡。此外,体内外的毒理实验证实了这种多功能纳米药物没有明显的细胞毒性和体内全身性毒性,表现出优异的生物安全性,具有良好的临床转化价值。
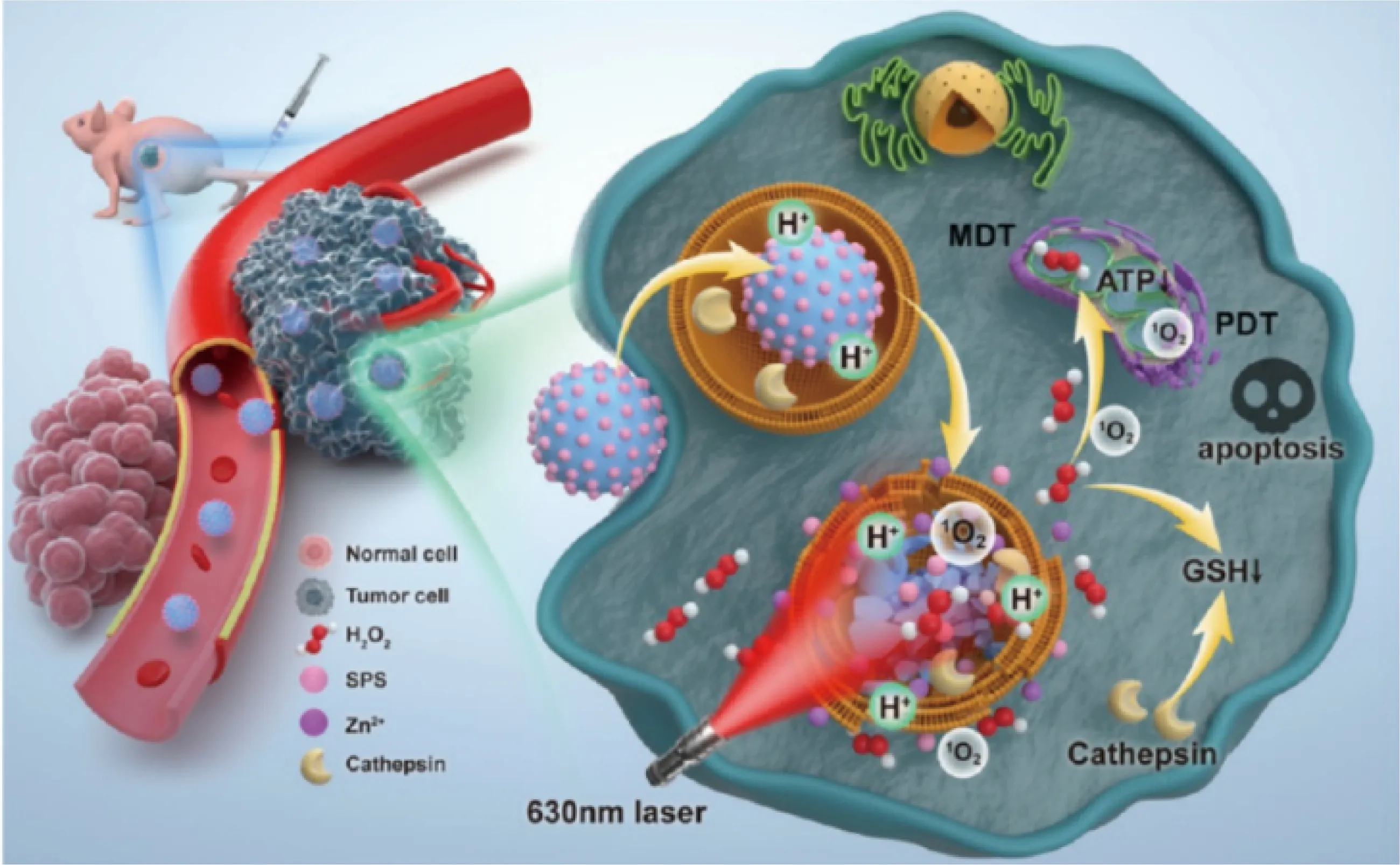
图6 SPS@ZnO2 NPs用于荧光成像引导的分子动力学疗法和光动力疗法的应用示意图[40]Fig.6 Schematic diagram of SPS@ZnO2 NPs for fluorescence imaging-guide molecular dynamic therapy (MDT)and photodynamic therapy (PDT)[40]
4 结 语
金属过氧化物(metal peroxides,MO2,M为Ca,Cu和Mg等)是非常有应用前景的H2O2自供型肿瘤治疗材料,可在弱酸微环境中响应性分解,产生的H2O2不仅可以直接提升细胞内外的氧化应激水平,还可以与过氧化氢酶或纳米酶材料反应生成O2,缓解肿瘤乏氧状态,改善局部微环境。此外,MO2材料可以作为一种新型多功能纳米载体,采用特定的化学手段进行修饰,与光敏剂分子、酶或化疗药物相结合,通过联合光/声动力疗法、光热疗法、化学药物疗法以及免疫治疗等多种治疗手段,获得更优异的协同治疗效果。然而,目前基于此类材料用于肿瘤治疗的研究尚处于初步阶段,仍然存在许多关键问题和挑战有待进一步解决:① 大多数合成的MO2材料都不是特别的稳定,这对于其体内应用、大批量生产和长期保存都是不利的,因此需要开发新方法提高MO2材料的稳定性;② 纳米材料的表面性质(如形貌、尺寸和电荷情况)会影响它对靶向肿瘤的渗透率,目前报道的MO2材料大多数都是球形,形貌比较固定单一,缺乏其他形貌(比如纳米棒、多孔结构等)、尺寸、电荷性质探索和主动靶向性修饰提高肿瘤内富集等方面的报道;③MO2材料具有应用于多种方式联合治疗的潜力,在生物学领域应用仍有待进一步探索,如目前主要应用于联合化学动力学疗法、光动力疗法和光热疗法等领域,有关结合磁热、气体治疗或免疫治疗方面的研究不多;④ 对MO2材料在实际应用时的生物安全性和长期体内毒性方面的考察还远远不够,考虑到MO2材料弱酸响应降解的特性,该材料有可能会被正常细胞内吞,溶酶体微酸环境也会使它降解,产生的H2O2和金属离子对正常细胞也会造成一定毒性,因此对MO2材料体内给药剂量、代谢途径及毒理方面的研究很关键。尽管仍有许多问题有待研究,MO2纳米材料的开发给肿瘤治疗带来了新的策略,为成像技术和多种治疗手段的联合提供了新的、强有力的生物材料平台。希望MO2纳米药物在生物医学领域的应用研究能够得到更加广泛的关注和快速的发展,早日应用于临床实践,最终使广大患者受益。

