金银花根际土壤放线菌分离及其抑菌活性测定
苏柏茵,杨翠凤,陆燕雯,冼思蔓,梁 忠,蓝 丹
(百色学院农业与食品工程学院,广西百色 533000)
药用植物是一类具有入药用途的植物,在根系存在着植物和微生物之间的相互作用,它们的相互作用可改善土壤环境,从而成为有利于植物生长的资源。植物与这些微生物关系密切,在长时间的自然演变中双方形成了互惠共生体系[1]。大量研究表明,根际微生物无论在种类还是数量上都具有多样性的特征,且远多于根际外土壤的微生物[2]。另外,一些研究表明,药用植物的根际中微生物较多,尤其是活性放线菌[3],综合药用植物的功效,其根际被推测可能拥有更多的生防菌株[4]。
放线菌(Actinomycetes)是原核微生物,革兰氏染色呈阳性,在培养基上菌落呈放射状,故得名放线菌,以孢子繁殖,其菌丝呈分支状,分类有气生菌丝和基内菌丝,在土壤中广泛分布,主要分类有链霉菌属、小单孢菌属、小双孢菌属、马杜拉菌属等,土壤中90%以上属于链霉菌属。放线菌是具有潜力的微生物资源,其价值主要来自其次级代谢产物,可应用于抗生素、维生素、酶制剂等,应用的抗生素大约70%由放线菌产生,如链霉素、卡那霉素、庆大霉素等,与人类日常的生活与生产关系密切[5]。在一些极端环境下,如干旱、潮湿、盐碱地、重金属污染、辐射污染区、地热地区等,发现新型放线菌已成为研究的一大热点[6]。
土壤中含有大量放线菌,是放线菌的主要来源。以分离技术来说,人们分离出的放线菌仅占自然界放线菌总量的10%~20%。因此,土壤放线菌资源的新菌种分离也是重要的研究方向。本试验采用金银花(Lonicera japonicaThunb.)根际土壤作为试验材料,对其中的放线菌资源进行分离,并对分离出的放线菌进行抗菌活性筛选。
1 材料与方法
1.1 材料
土壤样品采自金银花根际土壤,金银花高35~40 cm,整株植株健康,无明显病害,样品取自金银花根部5~15 cm 耕作层土壤,样品装于一次性无菌袋中,带回实验室放于置物架上风干。
高氏一号培养基:磷酸氢二钾0.5 g,七水硫酸铁0.01 g,硝酸钾1 g,七水硫酸镁0.5 g,氯化钠5 g,琼脂20 g,可溶淀粉20 g,无菌水1 000 mL,pH 调至7.2~7.4。LB 培养基:LB 肉汤25 g、无菌水1 000 mL、琼脂15~20 g。培养基配制好后立即高温高压灭菌(121 ℃,20 min),放置备用。
抑菌活性测试菌株:金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌。
1.2 方法
1.2.1 金银花根际土壤样品预处理 采集的土壤在室温下风干6 d,然后取出5 g土壤样品放入盛有45 mL无菌水的三角瓶内,置入摇床(设定180 r/min,30 min)混匀,使土壤充分悬浮[7]。用移液枪取1 mL上清液,加入9 mL 无菌水中,依次按10-1、10-2、10-3、10-4、10-5倍梯度稀释。本次试验取10-3、10-4、10-5的样品溶液涂布于高氏一号培养基。
1.2.2 菌株分离与纯化 将涂布土壤稀释液的平板置于28 ℃恒温箱,培养5~7 d 后观察菌落生长情况和菌落特征,挑选肉眼可辨别的放线菌接种于高氏一号培养基纯化培养。
1.2.3 抑菌活性研究 放线菌发酵液制备:从培养好的已纯化放线菌培养基中挑取菌丝,置于高氏一号液体培养基中进行摇床培养,摇床设定28 ℃,180 r/min 转速,培养5 d。
细菌种子液制备:采用平板划线法,在LB 培养基上37 ℃培养24 h,之后用接种环将细菌接种于LB液体培养基的试管,摇床培养2 h,设定温度37 ℃,180 r/min 转速。
待测细菌平板处理:分别从上述制备的种子液中吸取100 μL 金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌置于平板上,均匀涂布至微干。
放线菌抑菌特性研究采用滤纸片法[8]:用无菌镊子将滤纸片(直径6 mm,厚度0.7 mm)浸入放线菌发酵液中,取出并在瓶内壁除去多余的液体,将纸片放到接好靶标菌的平板上,每个处理3 次重复,以无菌水代替发酵液浸泡滤纸片作为对照,28 ℃培养48~72 h。
1.2.4 拮抗菌16S rDNA 的鉴定 鉴定使用Biospin细菌基因组DNA 提取试剂盒提取筛选出的拮抗菌DNA,以 通 用 引 物27F(5′-AGAGTTTGATCCTGG CTCA-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)扩增拮抗菌株16S rDNA 序列。
PCR 反 应 体 系 为40 μL,包 括2×Phanta Max Master Mix 20 μL,10 μmol/L上游引物1 μL,10 μmol/L下 游 引 物1 μL,DNA 模 板1 μL,ddH2O 补 足 至40 μL。PCR 扩增在Biometra Easy Cycler Gradient 中进行,程序为95 ℃预变性3 min;95 ℃完成变性15 s,56 ℃复性15 s,72 ℃延伸30 s,共35 个循环;最后72 ℃延伸5 min。PCR 扩增产物委托擎科生物科技有限公司进行测序,最后将测序结果在NCBI 网站进行BLAST-N 比对,然后利用MEGA5.05 软件构建NJ系统进化树。
2 结果与分析
2.1 放线菌菌落形态
从金银花根际土壤分离获得的7 株放线菌菌落多为白色(1 株为粉色,1 株为灰色),圆形,表面干燥,不光滑,呈干粉样,凸起或扁平,部分有可溶性色素产出,如图1 所示。
2.2 抑菌活性
图2 为滤纸片法筛选抑菌活性菌株的结果。经筛选,4 号和7 号放线菌对金黄色葡萄球菌、枯草芽孢杆菌具有拮抗作用,2 株放线菌对金黄色葡萄球菌的抑菌作用效果相当,抑菌圈直径均为4.5 mm(表1);2 株放线菌对枯草芽孢杆菌均具有抑菌作用,其中4 号放线菌对枯草芽孢杆菌产生的拮抗效果较好,抑菌圈直径达6.5 mm。
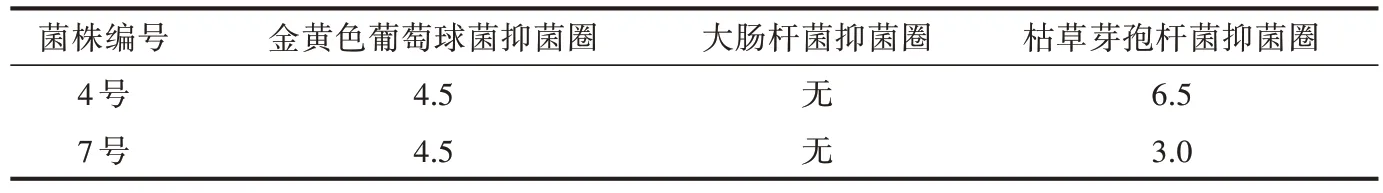
表1 产生拮抗作用的放线菌的抑菌圈直径 (单位:mm)
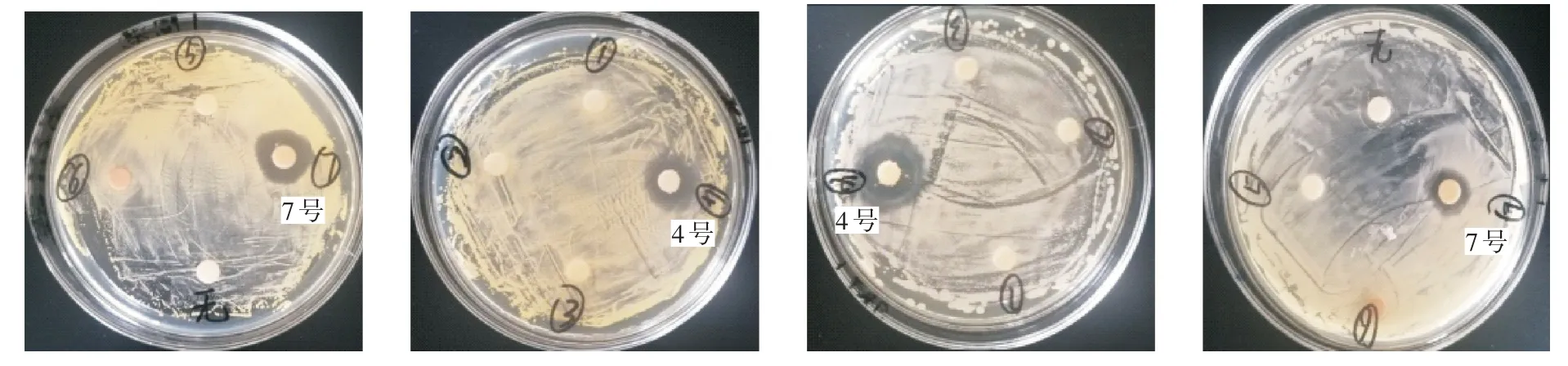
图2 滤纸片法筛选抑菌活性菌株
2.3 拮抗菌株的分子鉴定
对拮抗菌株进行16S rDNA 分子鉴定,结果见图3。结果表明,4 号放线菌与黄三素链霉菌(Streptomyces flavotricini)菌株的亲缘关系最近,聚为一个分支,一致性为100%;7 号放线菌与加纳链霉菌(Streptomyces gardneri)菌株的亲缘关系最近,聚为一个类群,经鉴定,黄三素链霉菌和加纳链霉菌均属于链霉菌属,一致性为100%。
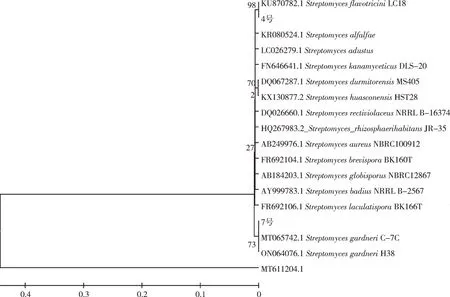
图3 基于16S rDNA 构建NJ 系统发育树
3 讨论
自植物根际土壤中分离的具有拮抗作用的放线菌大多为链霉菌属,其次为小单孢菌属、小双孢菌属等其他属[9-11]。研究人员从艾草[12]、枸骨[13]、木豆[14]等中草药的根际土壤中能够分离获得具有抑菌活性的放线菌菌株,甚至是广谱性抑菌的活性菌株,因此,从药用植物根际土壤分离筛选有益菌株是发掘具有抑菌作用的活性菌株的有效途径。与内生菌不同的是,根际的分泌物使得附近的土壤微生物富集,分布在根际的放线菌的丰富度依赖于土壤所处环境的理化性质。研究发现,最利于这些菌株生长的成分往往来自邻近植物根际的土壤浸液。此外,土壤中的有机质会影响放线菌的富集度,有机质越多,其他细菌便会和放线菌形成竞争性关系导致该区域的放线菌的富集度下降,因此在一些极端土壤环境下更有可能发现新型放线菌[15]。本试验共分离出7 株放线菌,经初筛与复筛,4 号和7 号这2 株放线菌对金黄色葡萄球菌、枯草芽孢杆菌2 种病原细菌产生了抑菌圈,即具有拮抗作用。经分子鉴定,结果表明4 号为黄三素链霉菌,7 号为加纳链霉菌。

