基于线粒体tRNAleu~COII和COI的贵州东方蜜蜂群体遗传分析
周文才 李应 姚丹 万炜 詹洪平 黎华君 贺兴江 冉曜琦 于瀛龙 韦小平
DOI:10.3969/j.issn.2095-1191.2023.06.023
摘要:【目的】明确贵州省东方蜜蜂群体的遗传结构和遗传多样性,掌握其遗传现状,为贵州省东方蜜蜂的遗传资源评价及保护利用提供参考依据。【方法】基于线粒体tRNAleu~COII和COI片段对贵州省内19个采样点的1282群东方蜜蜂进行遗传分析,计算单倍型多样性(Hd)、平均核苷酸差异数(K)和核苷酸多样性(π)等遗传多样性指数,采用中性检验(Tajima᾿s D和Fu᾿s Fs)评估群体扩张情况,通过计算遗传分化系数(Fst)、构建系统发育进化树和分子方差分析评估其遗传分化,并开展环境因子相关分析以明确遗传分化的作用因子。【结果】贵州东方蜜蜂在线粒体tRNAleu~COII片段上的Hd介于0.5421~0.9167,π介于0.00174~0.00527,K介于0.611~1.854,其中台江、雷山、麻江、罗甸、紫云、晴隆和威宁等7个采样点发生过群体扩张;在线粒体COI片段上的Hd介于0.5710~0.9109,π介于0.00109~0.00261,K介于0.874~2.084,其中松桃、江口、印江、台江、石阡、雷山、罗甸、紫云、黔西、晴隆和威宁等11个采样点发生过群体扩张。贵州东、西部东方蜜蜂群体间存在中度遗传分化(在tRNAleu~COII片段上的Fst=0.04±0.02,在COI片段上的Fst=0.07±0.04),贵州西部东方蜜蜂群体内也存在中度遗传分化(在tRNAleu~COII片段上的Fst=0.04±0.02,在COI片段上的Fst=0.07±0.03)。相关分析结果显示,贵州西部东方蜜蜂组群的遗传分化程度与海拔呈弱相关,但与温度、湿度等环境因子呈显著正相关。【结论】贵州省东方蜜蜂在线粒体tRNAleu~COII和COI片段上的遗传多样性处于较高水平,主要归功于蜂群数量大和饲养方式较原始;贵州东方蜜蜂整体上呈现中度遗传分化,且西部东方蜜蜂组群内部的遗传分化程度较东部东方蜜蜂组群更高,主要与温度和湿度等环境因子密切相关,是其为适应所处环境而进化产生,而非海拔因素造成。
关键词:东方蜜蜂;tRNAleu~COII片段;COI片段;遗传多样性;遗传分化;环境因子
中图分类号:S891.8 文獻标志码:A 文章编号:2095-1191(2023)06-1819-10
Population genetic analysis of Apis cerana in Guizhou based on mitochondrial tRNAleu-COII and COI
ZHOU Wen-cai, LI Ying, YAO Dan, WAN Wei, ZHAN Hong-ping, LI Hua-jun,
HE Xing-jiang, RAN Yao-qi, YU Ying-long*, WEI Xiao-ping*
(Institute of Integrated Agriculture Development,Guizhou Academy of Agricultural Sciences,
Guiyang,Guizhou 550006,China)
Abstract:【Objective】The purpose of the study was to clarify the population genetic structure and genetic diversity of Apis cerana in Guizhou, to understand its genetic status, and to provide a reference basis for the evaluation, conservation and utilization of Apis cerana genetic resources in Guizhou. 【Method】Genetic analysis was conducted on 1282 populations of A. cerana from 19 sampling sites in Guizhou based on mitochondrial tRNAleu-COII and COI fragments. Genetic diversity indexes such as haplotype diversity (Hd), the average nucleotide difference (K) and nucleotide diversity (π) were calculated. Tajima’s D and Fu’s Fs neutral tests were carried out to evaluate population expansion. Genetic differentiation was assessed by calculating the genetic differentiation coefficient (Fst), constructing phylogenetic evolutionary trees and molecular variance analysis, and environmental factor correlation analysis was carried out to clarify the role of factors in genetic differentiation. 【Result】The Hd of A. cerana in Guizhou on the mitochondrial tRNAleu-COII fragment ranged from 0.5421 to 0.9167, π ranged from 0.00174 to 0.00527, and K ranged from 0.611 to 1.854, with colony expansions occurring in seven sampling sites, including Taijiang, Leishan, Majiang, Luodian, Ziyun, Qinglong, and Weining. On the mitochondrial COI fragment, Hd ranged from 0.5710 to 0.9109, π ranged from 0.00109 to 0.00261, and K ranged from 0.874 to 2.084, with population expansion occurring at 11 sampling sites, including Songtao, Jiangkou, Yinjiang, Taijiang, Shiqian, Leishan, Luodian, Ziyun, Qianxi, Qinglong, and Weining. There existed moderate genetic differentiation (on tRNAleu-COII fragment, Fst=0.04±0.02, on COI fragment Fst=0.07±0.04) between A. cerana populations in the eastern and western of Guizhou, and moderate genetic differentiation (on tRNAleu-COII fragment, Fst=0.04±0.02, on COI fragment, Fst=0.07±0.03) within A. cerana populations in the western part of Guizhou. The results of correlation analysis showed that genetic differentiation of A. cerana colonies in western Guizhou was weakly correlated with altitude, but significantly positively correlated with environmental factors such as temperature and humidity. 【Conclusion】The genetic diversity of A. cerana in Guizhou is at a high level in mitochondrial tRNAleu-COII and COI fragments, which is mainly attributed to the huge population size and primitive rearing methods. Guizhou A. cerana as a whole show moderate genetic differentiation, and the degree of genetic differentiation within the western A. cerana populations is higher than that of the eastern A. cerana, which is mainly closely related to the environmental factors, such as temperature and humidity, and arises from their evolution to adapt to the environment they live in rather than due to altitudinal factors.
Key words: Apis cerana; tRNAleu-COII fragment; COI fragment; genetic diversity; genetic differentiation; environmental factor
Foundation items: Guizhou Science and Technology Plan Project (QKHJC〔2019〕1453);Construction Project of China Agriculture Research System (CARS-44-SYZ-22);Guizhou Academy of Agricultural Sciences Project (QNKYQNKJJJ〔2020〕08,QNKYZZZY〔2022〕16)
0 引言
【研究意義】东方蜜蜂(Apis cerana)是我国本土蜂种,广泛分布在除内蒙古和新疆外的我国其他地区,具有善于利用零星蜜粉源、耐低温、抗螨等优良特性,在维持生物多样性、维护生态系统平衡及粮食安全等方面发挥着重要作用(杨冠煌,2009)。贵州地处云贵高原东段,属亚热带湿润季风气候,自东向西海拔逐渐升高,省内有东方蜜蜂51万群,占全国总量的10%,是我国东方蜜蜂的主产区之一(韦小平等,2020)。开展贵州省本土东方蜜蜂群体遗传分析,既是掌握蜂种资源的基础性工作,也是蜂种资源保护与利用的前提。【前人研究进展】《中国畜禽遗传资源志 蜜蜂志》将贵州省东方蜜蜂划分为云贵高原中蜂和华中中蜂,其中,云贵高原中蜂分布于贵州省西部,华中中蜂分布在贵州省东部(国家畜禽遗传资源委员会,2011)。至今,国内已有诸多学者基于形态、微卫星遗传分子标记等开展了贵州东方蜜蜂群体遗传分析,但得出的相关研究结果存在明显差异。徐祖荫(1986,2009)利用7个形态标记均值将贵州东方蜜蜂划分为东部的山地生态型和西部的云贵高原生态型,以织金—册亨、赫章—盘县为界限;杨冠煌(2001)基于12个形态标记均值将东方蜜蜂划分为华中生态型和云贵高原生态型;骆群等(2015)利用32个形态标记进行多元化统计分析,但未发现贵州省东方蜜蜂发生种群分化;于瀛龙等(2017)利用31个微卫星位点对贵州省东方蜜蜂进行分析,也未发现贵州省东方蜜蜂发生遗传分化。此外,有学者通过线粒体tRNAleu~COII、COI及COII等片段分别开展了我国西藏、广西、重庆、浙江、云南等地的东方蜜蜂遗传多样性研究(姬聪慧等,2017;刘意秋等,2018;曹联飞等,2021;周姝婧等,2021),证实山脉、高原等自然隔离条件,以及人为干扰造成的基因交流等是塑造东方蜜蜂群体遗传结构的主要因素,东方蜜蜂不同地理群体间遗传分化明显,且蕴藏着丰富的遗传多样性,其研究结论对东方蜜蜂遗传资源保护与合理开发利用具有基础性指导意义,但针对于贵州省本土东方蜜蜂群体的研究仅赵金玉等(2022)对79只贵州省东方蜜蜂进行线粒体COI~COII片段分析。【本研究切入点】线粒体tRNAleu~COII和COI片段是目前广泛应用于蜜蜂遗传多样性研究的有效手段,但鲜见应用于贵州省东方蜜蜂的系统研究。【拟解决的关键问题】基于2个线粒体片段tRNAleu~COII和COI对贵州全省范围内的东方蜜蜂开展大样本量群体遗传分析,以期明确贵州省东方蜜蜂群体的遗传结构和遗传多样性,掌握其遗传现状,为贵州省东方蜜蜂的遗传资源评价及保护利用提供参考依据。
1 材料与方法
1. 1 样本采集
东方蜜蜂样本采自贵州省19个主要县(市),共1282群(表1),样本量介于10~176群/采样点。东方蜜蜂样本均采自健康蜂群,为减少引种、育王等对代表性的影响,蜂群以半野生的饲养蜂群为主。采集后的样本以无水乙醇处理后-20 ℃保存备用。
1. 2 试验方法
每个蜂群取1只工蜂,利用UNIQ-10柱式试剂盒、SanTaq PCR Mix扩增试剂盒[生工生物工程(上海)股份有限公司]从工蜂胸部提取基因组。为提高结果可靠性,本研究扩增2个经典的线粒体片段tRNAleu~COII(1~352 bp)和COI(1~799 bp),扩增条件参照Garnery等(1992)、Zhao等(2014)的研究方法。PCR扩增产物送至生工生物工程(上海)股份有限公司分别进行单向、双向测序,测序结果经人工检查,若存在严重双峰现象则需重新测序。
1. 3 统计分析
利用ClustalX进行测序序列比对,并将序列数据上传至NCBI以确定其单倍型(Larkin et al.,2007);通过DNAsp 5.0计算单倍型多样性(Hd)、平均核苷酸差异数(K)和核苷酸多样性(π)(Librado and Rozas,2009),以及Tajima᾿s D(Tajima,1989)和Fu᾿s Fs(Fu,1997);使用Arlequin 3.11计算不同采样点间的遗传分化系数(Fst),并进行分子方差分析(Excoffier and Lischer,2010;张桂宁等,2022);利用MEGA 7.0的邻接法(Neighbor-joining,NJ)基于Kimura双参数(Kimura 2-parameter,K2P)构建系统发育进化树(Kumar et al.,2016),外群选用Apis mellifera(GenBank登录号KX908209)的对应片段。采用GenAlex 6.5进行遗传分化与海拔等环境因子的相关分析(Peakall and Smouse,2012),其中,海拔数据来源于实地测量,其余主要环境因子数据来源于中国气象信息网站,包括:月平均气压、月平均气温、月平均最高气温、月平均最低气温、每月最高气温≥30 ℃日数、每月最高气温≥35 ℃日数、每月最低气温≤2 ℃日数、每月最低气温≤0 ℃日数、月平均相对湿度及月平均降水量。
2 结果与分析
2. 1 贵州东方蜜蜂遗传多样性与历史动态
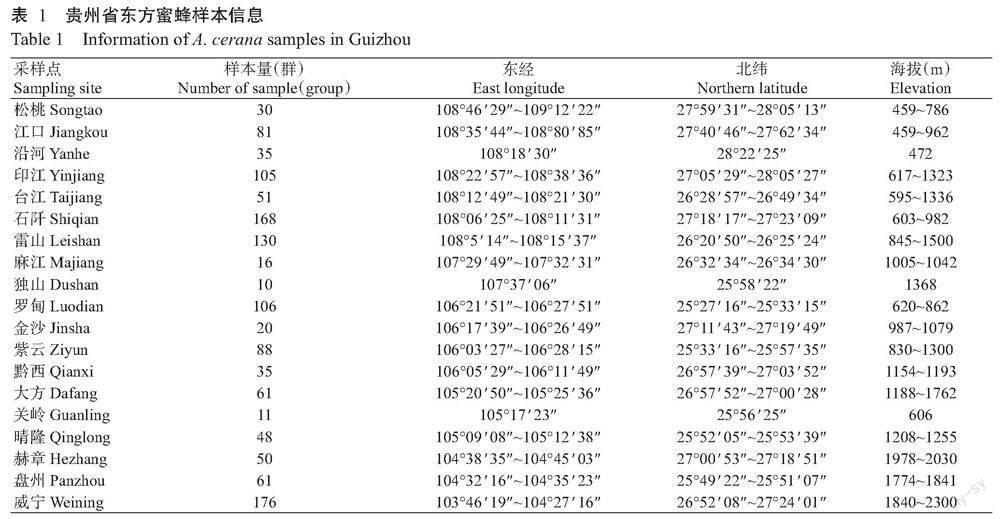
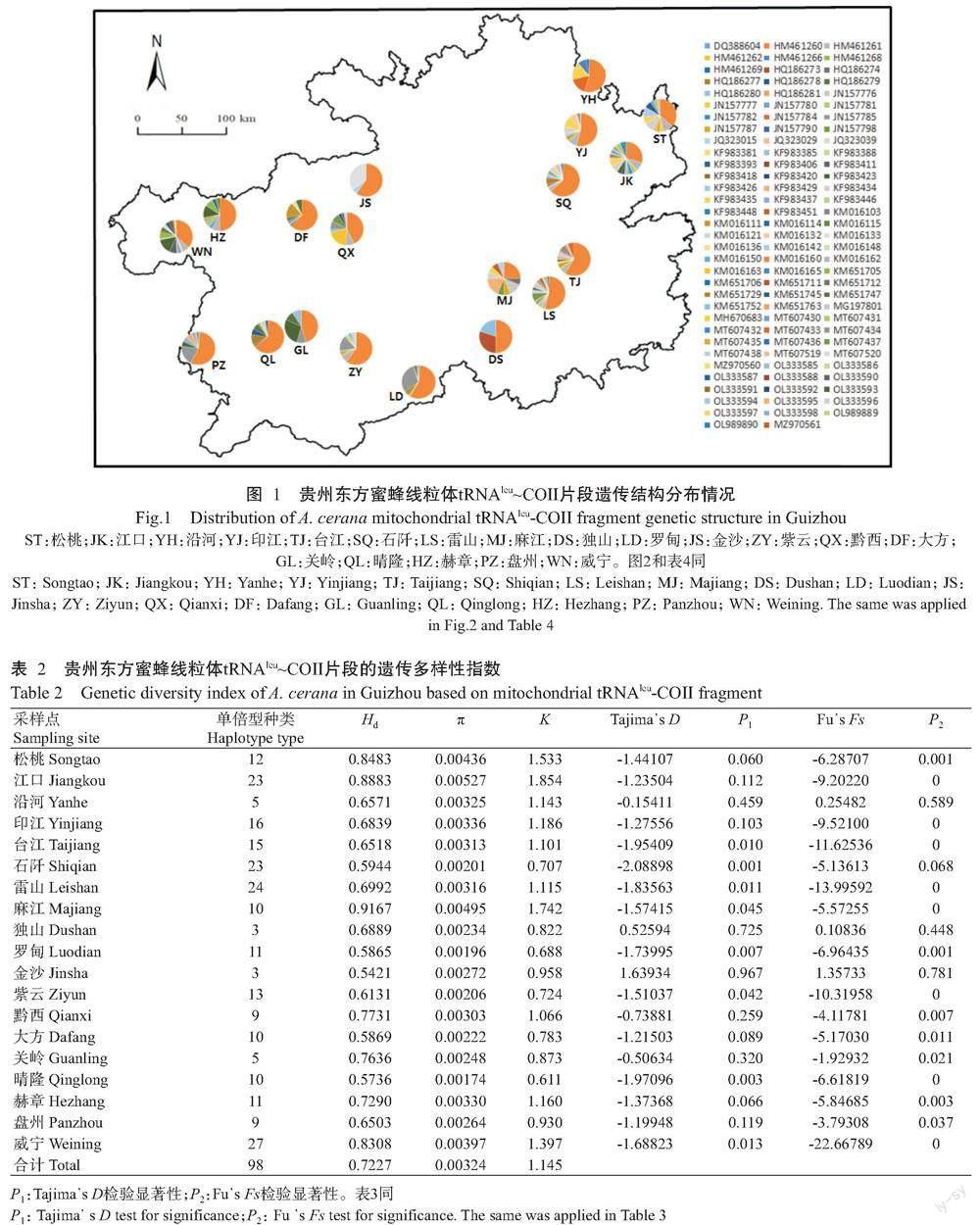
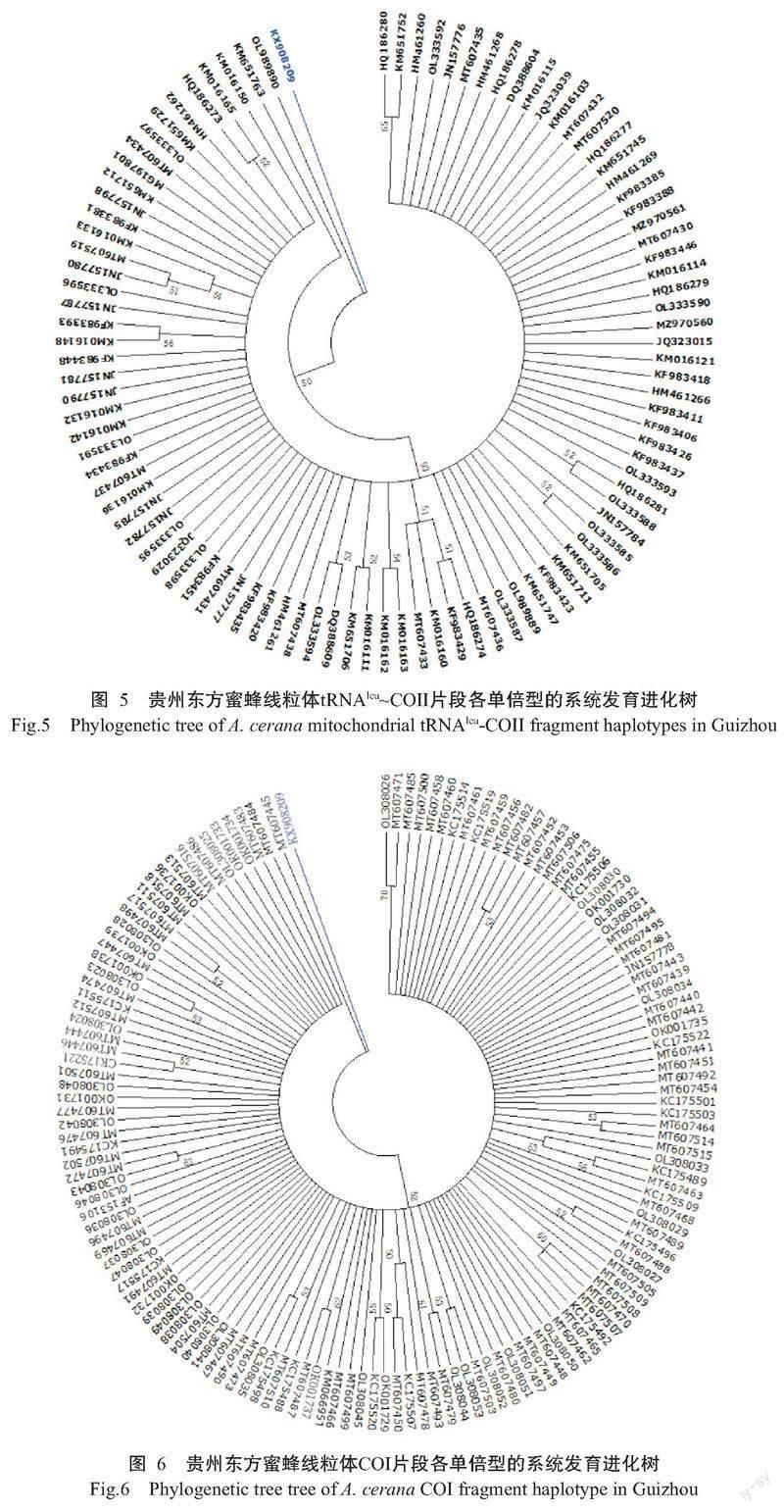
在贵州东方蜜蜂线粒体tRNAleu~COII片段上共发现98种单倍型(图1),其中28种为新发现单倍型,对应的GenBank登录号分别为MT607430~MT607438、MT607519~MT607520、MZ970560~MZ970561、OL333585~ OL333588、OL333590~OL333598及OL989889~OL989890。各采样点的单倍型种类介于3~27种,Hd介于0.5421~0.9167,π介于0.00174~0.00527,K介于0.611~1.854,其中台江、雷山、麻江、罗甸、紫云、晴隆和威宁等7 个采样点发生过群体扩张,中性检验(Tajima᾿s D,Fu᾿s Fs)呈显著性负值(表2)。
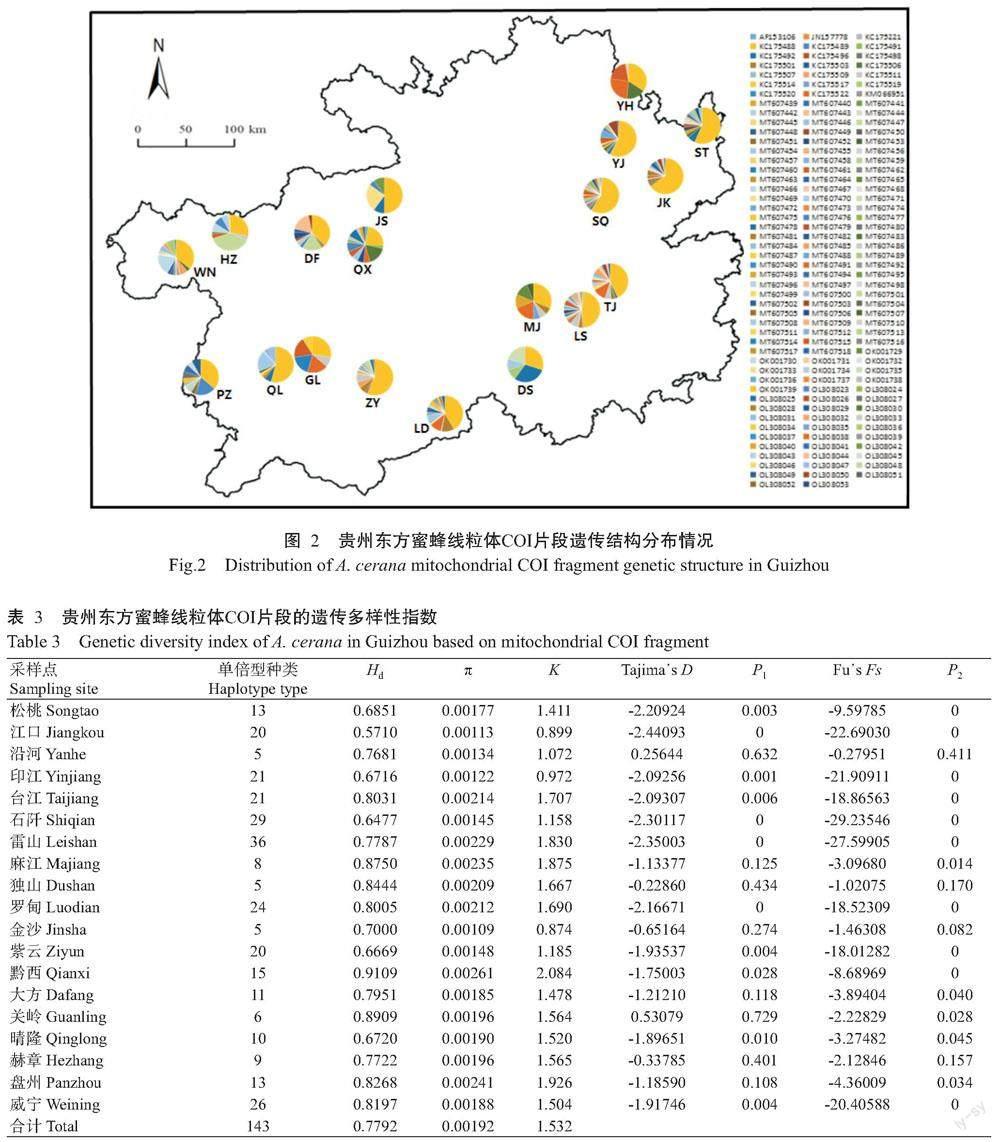
在贵州东方蜜蜂线粒体COI片段上共发现143 种单倍型(图2),其中122种为新发现单倍型,对应的GenBank登录号分别为MT607439~MT607518、OK001729~OK001739及OL308023~OL308053。各采样点的单倍型种类介于5~36种,Hd介于0.5710~0.9109,π介于0.00109~0.00261,K介于0.874~2.084,其中松桃、江口、印江、台江、石阡、雷山、罗甸、紫云、黔西、晴隆和威宁等11个采样点发生过群体扩张,中性检验(Tajima᾿s D,Fu᾿s Fs)呈显著性负值(表3)。
2. 2 贵州东方蜜蜂遗传分化情况
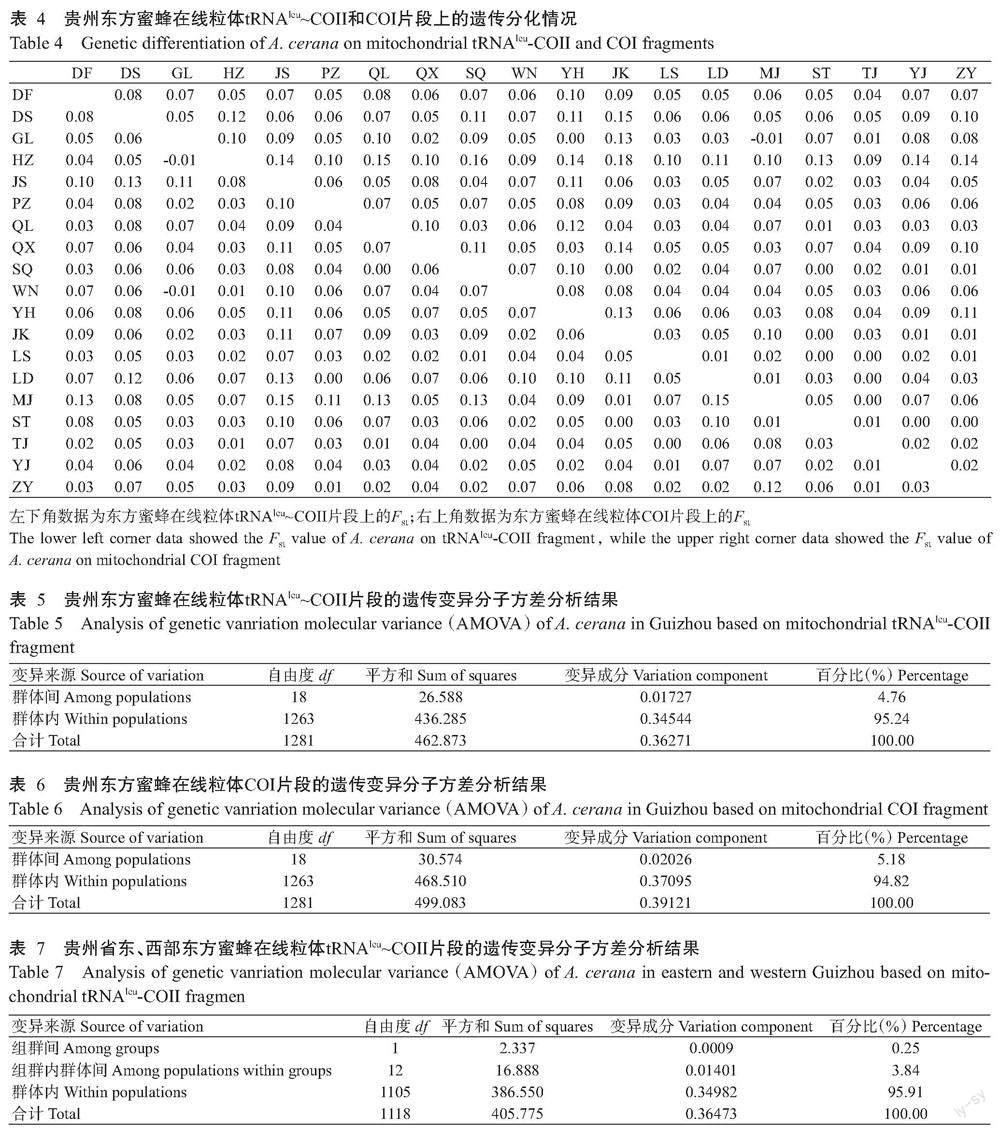
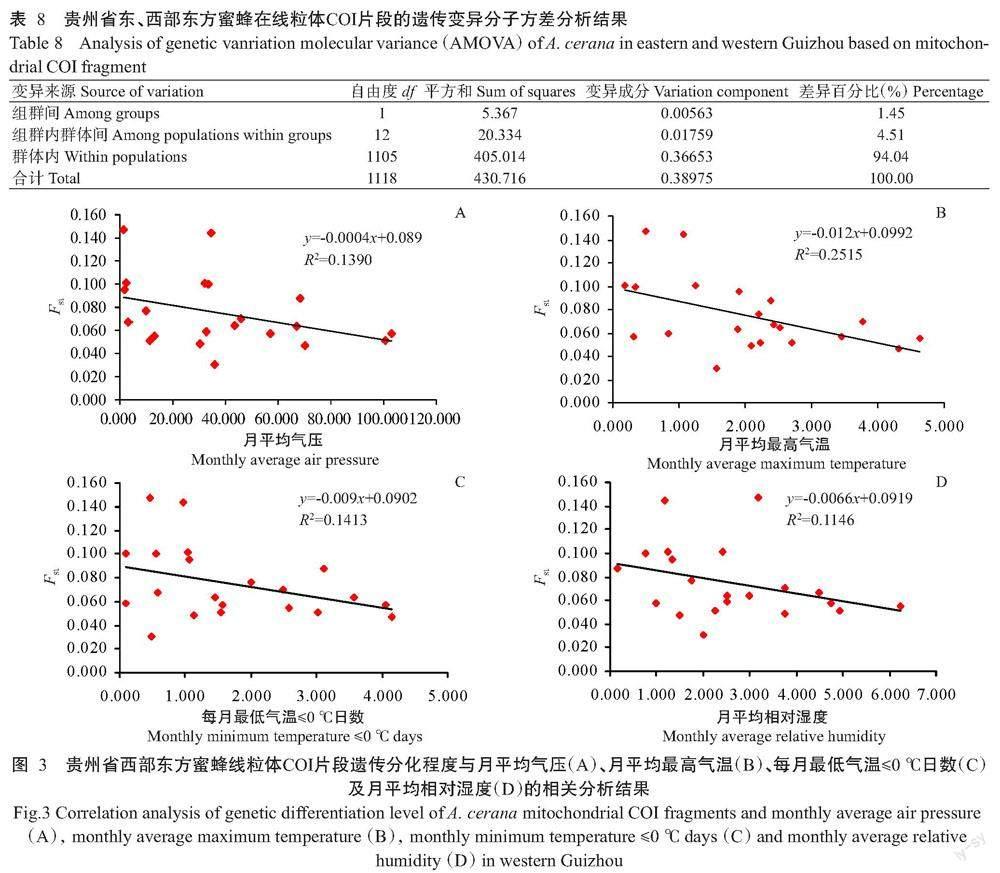
贵州东方蜜蜂整体上呈现出中度遗传分化(表4)。在线粒体tRNAleu~COII片段上的Fst介于 -0.01~0.15,平均为0.05±0.03;在线粒体COI片段上的Fst介于-0.01~0.18,平均为0.06±0.04。贵州东部(松桃、江口、沿河、印江、台江、石阡、雷山等7个采样点)东方蜜蜂群体与贵州西部(紫云、黔西、大方、晴隆、赫章、盘州、威宁等7个采样点)东方蜜蜂群体间存在中度遗传分化,在线粒体tRNAleu~COII片段上的Fst为0~0.09,平均为0.04±0.02;在线粒体COI片段上的Fst为0~0.18,平均为0.07±0.04。此外,贵州东部的松桃、江口、沿河、印江、台江、石阡、雷山等7个采样点东方蜜蜂在线粒体tRNAleu~COII片段上的Fst为0~0.09,平均为0.03±0.02;在线粒体COI片段上的Fst为0~0.13,平均为0.03±0.04。贵州西部的紫云、黔西、大方、晴隆、赫章、盘州、威宁等7 个采样点东方蜜蜂在线粒体tRNAleu~COII片段上的Fst为0.01~0.07,平均为0.04±0.02;在线粒体COI片段上的Fst为0.03~0.15,平均为0.07±0.03。其他采样点东方蜜蜂在线粒体tRNAleu~COII片段上的Fst介于0.05~0.15,平均为0.10±0.04;在线粒体COI片段上的Fst介于-0.01~0.09,平均为0.05±0.03。
分子方差分析时将贵州东方蜜蜂视为同一组群,基于线粒体tRNAleu~COII片段的分析结果显示,群体间遗传变异占总变异的4.76%,群体内遗传变异占总变异的95.24%(表5);基于线粒体COI片段的分析结果显示,群体间遗传变异占总变异的5.18%,群体内遗传变异占总变异的94.82%(表6)。可见,贵州东方蜜蜂不同群体间存在遗传分化。
按照地理区域,将贵州东方蜜蜂设为贵州东部(松桃、江口、沿河、印江、台江、石阡、雷山等7个采样点)和贵州西部(紫云、黔西、大方、晴隆、赫章、盘州、威宁等7个采样点)2个组群进行分析,基于线粒体tRNAleu~COII片段的分析结果显示,组群间遗传变异占总变异的0.25%,组群内群体间遗传变异占总变异的3.84%,群体内遗传变异占总变异的95.91%(表7);基于线粒体COI片段的分析结果显示,组群间遗传变异占总变异的1.45%,组群内群体间遗传变异占总变异的4.51%,群体内遗传变异占总变异的94.04%(表8)。可见,贵州东方蜜蜂遗传分化还存在于贵州东西部之间。
2. 3 贵州东方蜜蜂遗传分化与环境因子的相关性
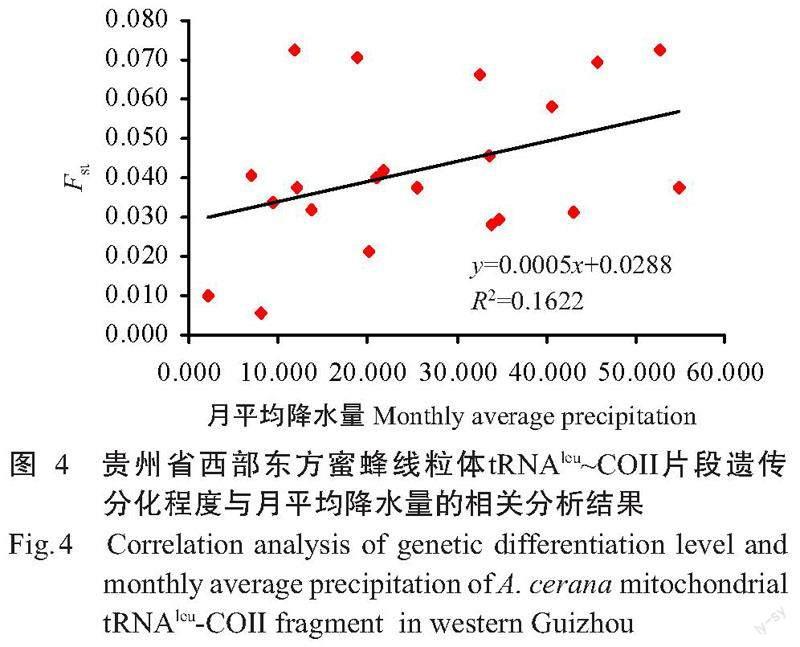
对存在中度遗传分化的贵州西部7个采样点东方蜜蜂进行Mantel检验分析,结果显示:线粒体COI片段的遗传分化程度与月平均气压(R²=0.1390,P=0.04)、月平均最高气温(R²=0.2515,P=0.01)、每月最低气温≤0 ℃日数(R²=0.1413,P=0.03)及月平均相对湿度(R²=0.1146,P=0.04)呈显著正相关(图3)。线粒体tRNAleu~COII片段的遗传分化程度与月平均降水量(R²=0.1622,P=0.03)呈显著正相关(图4)。线粒体tRNAleu~COII和COI片段的遗传分化程度与海拔均呈弱相关性(tRNAleu~COII-R²=0.0191,P=0.10;COI-R²=0.0819,P=0.03)。
2. 4 贵州东方蜜蜂线粒体tRNAleu~COII和COI单倍型的系统发育进化分析
基于线粒体tRNAleu~COII和COI片段各单倍型构建的系统发育进化树(图5和图6)均显示,贵州东方蜜蜂各单倍型聚类紧密,单倍型种类间的亲缘关系较近,从单倍型种类角度上并未体现出明显的地理发生关系。
3 讨论
我国东方蜜蜂遗传多样性分析结果显示,东方蜜蜂线粒体tRNAleu~COII的Hd介于0.171~0.911(周姝婧等,2012,2021),线粒体COI片段的Hd介于0.067~0.871(Zhao et al.,2014;劉意秋等,2018)。对比发现,贵州东方蜜蜂在线粒体tRNAleu~COII和COI片段上表现出较高的遗传多样性水平,究其原因可能是:(1)贵州省森林资源丰富,东方蜜蜂蜂群数量庞大。贵州省现存的东方蜜蜂蜂群数量约占全国的10%(韦小平等,2020),庞大的蜂群数量为其遗传多样性的形成奠定了基础。2020年贵州省森林覆盖率为61.51%,野生蜜源植物有243 种(韦小平等,2020),为蜂群的生存繁衍提供了物质基础。本研究的中性检验(Tajima᾿s D,Fu᾿s Fs)结果也显示贵州东方蜜蜂蜂群体发生过扩张,说明自然环境适宜蜜蜂群体数量增长。(2)贵州东方蜜蜂养殖仍保留有土法饲养,蜂群遗传结构受人为干扰的影响较小,尤其在自然保护区(江口和石阡)、西部山区(威宁)、南部石漠化地区(罗甸)等区域,土法饲养蜂群比例更高。土法饲养方式下蜂群操作不便,蜂农全年开箱操作保持在1~2次,虽然养蜂生产效率低,但减少了对蜂群的干扰,有效避免了蜜蜂种群遗传结构受人为干扰,在自然保护区更是严格限制外来蜂群的进入,使得东方蜜蜂遗传多样性极少受到人为因素的影响。
贵州东方蜜蜂整体上呈现中度遗传分化,且西部东方蜜蜂组群内部的遗传分化程度较东部东方蜜蜂组群更高。相关分析发现,贵州西部东方蜜蜂组群的遗传分化程度与海拔呈弱相关,但与温度、湿度等环境因子呈显著正相关,推测贵州西部东方蜜蜂的遗传分化是其为适应所处环境而进化产生,而非海拔因素造成。温度、湿度等环境因子直接影响蜜蜂出巢采集及婚飞等巢外活动,同时影响蜜源植物的分布。前人研究发现,湿度明显影响蜂王的正常交配,随着降雨量的增加,与蜂王交配的雄蜂数量呈下降趋势(Neves et al.,2011;Polatto et al.,2014);温度与西方蜜蜂不同亚种的分布范围密切相关,西方蜜蜂中卡尼鄂拉亚种和马其顿亚种的分布范围以年均温9 ℃为分界线(Coroian et al.,2014)。本研究中,致使贵州西部东方蜜蜂呈中度遗传分化的主要环境因子可能是温度和湿度。
本研究结果显示,贵州东西部东方蜜蜂组群的遗传分化以石阡—雷山、黔西—紫云为界限,在前人研究中贵州东方蜜蜂的遗传分化则以织金—册亨、赫章—盘县为界限(徐祖荫,1986;国家畜禽遗传资源委员会,2011)。究其原因可能是:(1)贵州呈自东向西逐渐升高的地势,无明显的地理隔离因素,蜜蜂遗传分化现象与所处栖息地的小环境相关,很难清晰界定遗传分化的界限。(2)东方蜜蜂种群分布处于动态变化。蜜蜂种群的大小及分布等与温度和湿度等自然环境、蜜粉源等食物来源、人为干扰等因素密切相关,因此种群的分布界限也处于动态变化过程中。
4 结论
贵州省东方蜜蜂在线粒体tRNAleu~COII和COI片段上的遗传多样性处于较高水平,主要归功于蜂群数量大和饲养方式较原始;贵州东方蜜蜂整体上呈现中度遗传分化,且西部东方蜜蜂组群内部的遗传分化程度较東部东方蜜蜂组群更高,主要与温度和湿度等环境因子密切相关,是其为适应所处环境而进化产生,而非海拔因素造成。
参考文献:
曹联飞,苏晓玲,陈道印,赵东绪,华启云. 2021. 浙江省金华市中华蜜蜂线粒体DNA遗传多样性研究[J]. 环境昆虫学报,43(4):986-991. [Cao L F,Su X L,Chen D Y,Zhao D X,Hua Q Y. 2021. Genetic diversity of Apis cerana cerana based on mitochondrial DNA in Jinhua,Zhejiang,China[J]. Journal of Environmental Entomology,43(4):986-991.] doi:10.3969/j.issn.1674-0858.2021. 04.18.
国家畜禽遗传资源委员会. 2011. 中国畜禽遗传资源志 蜜蜂志[M]. 北京:中国农业出版社. [China National Commission of Animal Genetic Resources. 2011. Animal genetic resources in China:Bees[M]. Beijing:China Agriculture Press.]
姬聪慧,戴荣国,罗文华,任勤,刘佳霖,王瑞生,曹联飞. 2017. 重庆大巴山地区中蜂遗传多样性分析[J]. 黑龙江畜牧兽医,(9):232-233. [Ji C H,Dai R G,Luo W H,Ren Q,Liu J L,Wang R S,Cao L F. 2017. Genetic diversity of Apis cerana cerana fabricius in the Daba mountain of Chongqing[J]. Heilongjiang Animal Science and Veterinary Medicine,(9):232-233.] doi:10.13881/j.cnki.hljxmsy.2017.0820.
刘意秋,周丹银,龚雪阳,冯毅楠,和绍禹,赵文正. 2018. 线粒体DNA分析青藏高原东方蜜蜂(Apis cerana)种群遗传结构[J]. 山西农业大学学报(自然科学版),38(11):60-66. [Liu Y Q,Zhou D Y,Gong X Y,Feng Y N,He S Y,Zhao W Z. 2018. MtDNA variation of Apis cerana population in the Qinghai-Tibet Plateau[J]. Journal of Shanxi Agricultural University (Natural Science Edition),38(11):60-66.] doi:10.13842/j.cnki.issn1671-8151.201807015.
骆群,周姝婧,徐新建,朱翔杰,经翩翩,周冰峰. 2015. 贵州东方蜜蜂形态遗传分析[J]. 福建农林大学学报(自然科学版),44(3):298-302. [Luo Q,Zhou S J,Xu X J,Zhu X J,Jing P P,Zhou B F. 2015. Morphometric genetic diffe-rentiation of Apis cerana from Guizhou Province[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition),44(3):298-302.] doi:10.13323/j.cnki.j.fafu(nat.sci.).2015.03.014.
韦小平,贺兴江,向华,任建峰,郑钢,龙立炎,吴建勇. 2020. 贵州蜂产业发展现状与趋势[J]. 贵州农业科学,48(10):87-92. [Wei X P,He X J,Xiang H,Ren J F,Zheng G,Long L Y,Wu J Y. 2020. Development status and trend of apiculture in Guizhou Province[J]. Guizhou Agricultural Sciences,48(10):87-92.] doi:10.3969/j.issn. 1001-3601.2020.10.019.
徐祖荫. 1986. 贵州省中蜂资源调查及其开发利用研究——贵州中蜂不同生态类型的划分、评价及开发利用意见[J]. 贵州畜牧兽医科技,(1):13-19. [Xu Z Y. 1986. Investigation and development and utilization of Apis cerana resources in Guizhou Province—Division,evaluation and development and utilization of different ecological types of Apis cerana in Guizhou Province[J]. Guizhou Journal of Animal Husbandry and Veterinary Medicine,(1):13-19.]
徐祖蔭. 2009. 蜂海求索:徐祖荫养蜂论文集[M]. 贵阳:贵州科技出版社. [Xu Z Y. 2009. Apiculture research—Xu Zuyin essays collection[M]. Guiyang:Guizhou Science and Technology Publishing House.]
杨冠煌. 2001. 中华蜜蜂[M]. 北京:中国农业科技出版社. [Yang G H. 2001. Chinese honeybee[M]. Beijing:China Agricultural Science and Technology Press.]
杨冠煌. 2009. 中华蜜蜂在我国森林生态系统中的作用[J]. 中国蜂业,60(4):5-7. [Yang G H. 2009. The effect of Apis cerana cerana on forest ecosystems[J]. Apiculture of China,60(4):5-7.] doi:10.3969/j.issn.0412-4367.2009.04.001.
于瀛龙,周姝婧,徐新建,朱翔杰,杨凯杰,陈道印,周冰峰. 2017. 贵州省东方蜜蜂微卫星DNA遗传分化与遗传多样性分析[J]. 福建农林大学学报(自然科学版),46(3):323-328. [Yu Y L,Zhou S J,Xu X J,Zhu X J,Yang K J,Chen D Y,Zhou B F. 2017. Genetic diversity and genetic differentiation of Apis cerana in Guizhou Province of southwest China[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition),46(3):323-328.] doi:10.13323/j.cnki.j.fafu(nat.sci.).2017.03.015.
张桂宁,方弟安,薛向平,毛成诚,彭云鑫. 2022. 基于线粒体COII基因序列的长江下游翘嘴群体遗传多样性分析[J]. 南方农业学报,53(7):2025-2032. [Zhang G N,Fang D A,Xue X P,Mao C C,Peng Y X. 2022. Genetic diversity analysis of Culter alburnus populations in the lower reach of Yangtze River based on COII gene sequences[J]. Journal of Southern Agriculture,53(7):2025-2032.] doi:10.3969/j.issn.2095-1191.2022.07.026.
赵金玉,龙见坤,David Tembong Cham,陈祥盛,常志敏. 2022. 贵州省东方蜜蜂Apis cerana线粒体DNA遗传多样性研究[J]. 环境昆虫学报,44(3):595-605. [Zhao J Y,Long J K,David T C,Chen X S,Chang Z M. 2022. Mitochondrial DNA diversity of Apis cerana in Guizhou Province[J]. Journal of Environmental Entomology,44(3):595-605.] doi:10.3969/j.issn.1674-0858.2022.03.10.
周姝婧,徐新建,朱翔杰,高景林,周冰峰. 2012. 海南中华蜜蜂线粒体DNA的遗传多样性[J]. 福建农林大学学报(自然科学版),41(2):170-175. [Zhou S J,Xu X J,Zhu X J,Gao J L,Zhou B F. 2012. Genetic diversity of Apis cerana cerana in Hainan based on mitochondrial DNA[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition),41(2):170-175.] doi:10.3969/j.issn.1671-5470.2012.02.013.
周姝婧,朱翔杰,徐新建,胡军军,于瀛龙,朱诗谣,熊长安,周冰峰. 2021. 广西东方蜜蜂遗传多样性分析[J]. 应用昆虫学报,58(3):672-684. [Zhou S J,Zhu X J,Xu X J,Hu J J,Yu Y L,Zhu S Y,Xiong C A,Zhou B F. 2021. Genetic diversity of Apis cerana in Guangxi,China[J]. Chinese Journal of Applied Entomology,58(3):672-684.] doi:10.7679/j.issn.2095-1353.2021.068.
Coroian C O,Muñoz I,Schlüns E A,Paniti-Teleky O R,Erler S,Furdui E M,Mărghitaş L A,Dezmirean D S,Schlüns H,de la Rúa P D L,Moritz R F A. 2014. Climate rather than geography separates two European honeybee subspecies[J]. Molecular Ecology,23(9):2353-2361. doi:10.1111/mec.12731.
Excoffier L,Lischer H E. 2010. Arlequin suite ver 3.5:A new series of programs to perform population genetics analyses under Linux and Windows[J]. Molecular Ecology Resources,10(3):564-567. doi:10.1111/j.1755-0998.2010. 02847.x.
Fu Y X. 1997. Statistical tests of neutrality of mutations against population growth,hitchhiking and background selection[J]. Genetics,147(2):915-925. doi:10.1093/genetics/147.2.915.
Garnery L,Cornuet J M,Solignac M. 1992. Evolutionary history of the honey bee Apis mellifera inferred from mitochondrial DNA analysis[J]. Molecular Ecology,1(3):145-154. doi:10.1111/j.1365-294X.1992.tb00170.x.
Kumar S,Stecher G,Tamura K. 2016. MEGA7:Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution,33(7):1870-1874. doi:10.1093/molbev/msw054.
Larkin M A,Blackshields G,Brown N P,Chenna R,McGettigan P A,McWilliam H,Valentin F,Wallace I M,Wilm A,Lopez R,Thompson J D,Gibson T J,Higgins D G. 2007. ClustalW and ClustalX version 2.0[J]. Bioinformatics,23(21):2947-2948. doi:10.1093/bioinformatics/btm404.
Librado P,Rozas J. 2009. DnaSP v5:A software for comprehensive analysis of DNA polymorphism data[J]. Bioinformatics,25(11):1451-1452. doi:10.1093/bioinforma-tics/btp187.
Neves E F,Faita M R,Gaia L D O,Alves V V,Antonialli W F. 2011. Influence of climate factors on flight activity of drones of Apis mellifera (Hymenoptera:Apidae)[J]. Sociobiology,57(1):107-114.
Peakall R,Smouse P E. 2012. GenAlEx 6.5:Genetic analysis in excel. Population genetic software for teaching and research—An update[J]. Bioinformatics,28(19):2537-2539. doi:10.1093/bioinformatics/bts460.
Polatto L P,Chaud-Netto J,Alves-Junior V V. 2014. Influence of abiotic factors and floral resource availability on daily foraging activity of bees[J]. Journal of Insect Behavior,27(5):593-612. doi:10.1007/s10905-014-9452-6.
Tajima F. 1989. Statistical method for testing the neutral mutation hypothesis by DNA polymorphism[J]. Genetics,123(3):585-595. doi:10.1093/genetics/123.3.585.
Zhao W Z,Tan K,Zhou D Y,Wang M,Cheng C F,Yu Z Y,Miao Y W,He S Y. 2014. Phylogeographic analysis of Apis cerana populations on Hainan Island and southern mainland China,based on mitochondrial DNA sequences[J]. Apidologie,45(1):21-33. doi:10.1007/s13592-013-0223-8.
(責任编辑 兰宗宝)
收稿日期:2022-07-12
基金项目:贵州省科技计划项目(黔科合基础〔2019〕1453号);国家现代农业产业技术体系建设专项(CARS-44-SYZ-22);贵州省农业科学院科技项目(黔农科院青年科技基金〔2020〕08号,黔农科院种质资源〔2022〕16号)
通讯作者:于瀛龙(1989-),http://orcid.org/0000-0002-2187-1687,博士,主要从事蜜蜂生物学研究工作,E-mail:yuyinglong2012@163.com;韦小平(1977-),http://orcid.org/0000-0002-4999-0952,博士,研究员,主要从事蜜蜂生物学与生态学研究工作,E-mail:xiaopinggzaas@126.com
第一作者:周文才(1992-),http://orcid.org/0000-0002-5424-3142,主要从事蜜蜂生物学研究工作,E-mail:2629779134@qq.com

