一氧化氮调控线粒体功能在疾病中的作用
李昊琦,呼庆勋(上海大学医学院,上海 200444)
一氧化氮(NO)作为生物体内具有生物活性的信号分子,介导多种生物学作用,在生物系统中发挥着重要的生理功能。随着对NO的深入探索,多项研究表明NO作为一种能在细胞间传递信号的分子,普遍存在于多种细胞、组织和器官中,参与心血管稳态[1]、免疫反应[2]、神经传递[3]以及与细胞凋亡和增殖[4]相关的多种生理病理途径。
线粒体是参与调节各种重要细胞过程的细胞器,除了作为细胞的能量工厂以产生大量三磷酸腺苷(ATP)外,也在细胞信号传导、细胞分化、细胞凋亡等过程中发挥着重要作用。线粒体通过调控细胞代谢和表观遗传修饰等机制对机体稳态产生影响,其功能异常将参与多种疾病的发生发展。近年来的研究表明NO及其衍生物对线粒体功能的调控起到重要影响作用,进而影响细胞生理状态和疾病的发生发展[5-6]。本文就NO对线粒体功能的调控机制及其通过调控线粒体功能参与疾病发病的机制进行综述。
1 NO的生物学作用
NO作为一种新型的气体信号分子,在氮原子上有不成对的电子对,对多种生物分子都具有很高的反应性。作为具有脂溶性的介质,NO可以快速透过生物膜扩散发挥生理作用,但在体内具有不稳定性,能迅速被血红蛋白、氧自由基等灭活。
内源性NO的产生主要是指在一氧化氮合酶(NOS)催化下,以L-精氨酸和分子氧为底物,在辅助因子四氢生物蝶呤(BH4)、还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)、黄素腺嘌呤二核苷酸(FAD)、黄素单核苷酸(FMN)参与下产生。NOS主要包括三种亚型:神经元型一氧化氮合酶(nNOS)、诱导型一氧化氮合酶(iNOS)和内皮型一氧化氮合酶(eNOS)。在三种亚型中,eNOS主要表达于内皮细胞、血管平滑肌细胞、心肌细胞中,对于维持心血管系统的稳态是最重要的[7]。nNOS在大脑的特定神经元中组成性表达,主要调节神经信号转导,在骨骼肌和心肌组织中也有表达。eNOS和nNOS的活性都受Ca2+和钙调素(CaM)以及自身翻译后修饰的调节。iNOS最早被发现存在于巨噬细胞中,iNOS非钙离子依赖的特性使其具有较高的催化活性,其催化产生的NO在炎症条件下的多种生化途径和能量代谢调节中起着核心作用[8]。此外,据报道,线粒体基质和内膜中具有线粒体一氧化氮合酶(mtNOS),以调节线粒体的耗氧量和生物发生。mtNOS被认为是nNOS的α亚型,但有关其性质尚未有确切定论[9]。除了NOS的催化作用,NO的合成也可以被其氧化代谢物亚硝酸盐还原,亚硝酸盐可以通过与质子反应或酶促反应转化为NO。
NO通过激活环磷酸鸟苷(cGMP)信号通路和参与细胞功能的各种蛋白质(包括参与线粒体生物学的蛋白质)的S-亚硝基化来介导大部分功能[10]。NO 可激活可溶性鸟苷酸环化酶(sGC),使细胞内cGMP增加,启动一系列蛋白磷酸化反应,从而发挥重要的生理功能。NO-cGMP信号通路广泛存在于人类和动物的多种组织细胞中,它代表一种新的细胞间信息传递和细胞功能调节的信号传导系统。NO也会通过cGMP非依赖性途径介导生物学效应,其作用于半胱氨酸残基,通过S-亚硝基化酶在靶蛋白上产生S-亚硝基硫醇(SNO),称为S-亚硝基化的翻译后修饰。
2 NO对线粒体功能的调控机制
2.1 NO介导靶蛋白的S-亚硝基化修饰
S-亚硝基化是指部分亚硝基与蛋白质的巯基残基(S)共价连接形成S-亚硝基,其动态过程主要由细胞内S-亚硝基谷胱甘肽(GSNO)的水平调节。S-亚硝基化是一种基于氧化还原的蛋白质翻译后修饰,可调节多种生理和病理过程,若发生异常可能导致蛋白质错误折叠,发生细胞凋亡和代谢紊乱[11]。研究表明NO通过介导靶蛋白的S-亚硝基化修饰可以调控线粒体功能(见图1)。
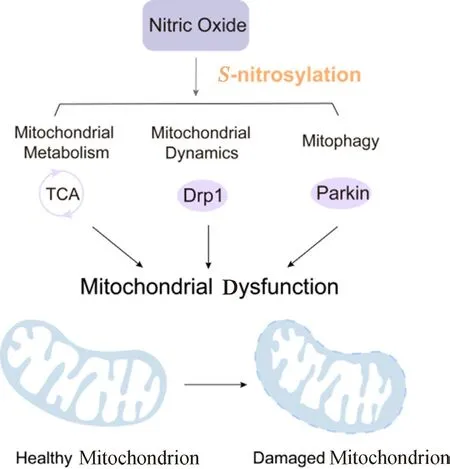
图1 NO介导靶蛋白的S-亚硝基化修饰调控线粒体功能Fig 1 Nitric oxide mediates the S-nitrosylation modification of target proteins to regulate the mitochondrion function
NO水平的升高会导致三羧酸循环(TCA循环)中的酶以及电子传递链(ETC)中蛋白质的异常S-亚硝基化,从而损害它们的酶活性。ETC中复合物Ⅰ、Ⅱ、Ⅳ和Ⅴ中关键亚基的直接S-亚硝基化或硝化抑制了它们的呼吸活性,从而抑制了它们产生ATP的能力。
GSNO是NO在体内的主要生物活性形式,可被亚硝基化谷胱甘肽还原酶(GSNOR)不可逆分解。因此,GSNOR在NO信号途径中可作为主要调节因子以调控反应发生。缺乏GSNOR会促进线粒体亚硝化应激,导致动力相关蛋白1(Drp1)和Parkin过度S-亚硝基化,对线粒体动力学和线粒体自噬产生损伤作用[12]。已有研究表明S-亚硝基化可以调节Drp1的磷酸化状态,从而影响Drp1的定位和功能。Drp1的S-亚硝基化促进Ser-616磷酸化,导致线粒体裂变增加[13]。在GSNOR敲除小鼠的肝脏和大脑中发现S-亚硝基化的Parkin累积,表明GSNOR缺乏会诱导Parkin异常S-亚硝基化从而抑制Parkin活性,导致线粒体自噬失调[14]。
2.2 NO调节线粒体呼吸链活性
NO及其衍生物通过不同的机制抑制线粒体呼吸,低浓度的NO特异性和可逆地抑制细胞色素C氧化酶,较高浓度的NO可导致呼吸链不可逆抑制、解偶联、通透性转变或细胞死亡[15]。NO可以与细胞色素C氧化酶的血红素α3-CuB活性中心结合并抑制其活性。NO与铜离子(CuB)结合,形成一种新的血红素-CuB-NO配合物,从而阻碍了ETC的正常运作,降低了细胞色素C氧化酶的活性。NO还通过形成不可逆地抑制线粒体呼吸的高反应性分子来发挥病理生理作用。NO与线粒体氧化磷酸化过程中产生的超氧化物阴离子反应形成过氧亚硝酸盐(ONOO-),破坏基质、内膜、外膜以及膜间空间中的关键线粒体组分。在线粒体中,ONOO-抑制复合物Ⅰ、Ⅱ、Ⅳ在呼吸链中的作用和ATP合酶的活性,还影响其他蛋白质的活性,如锰超氧化物歧化酶(Mn-SOD)和细胞色素C等,导致线粒体功能障碍[16](见图2)。

图2 NO介导线粒体呼吸链活性调控线粒体功能Fig 2 NO mediated mitochondrion respiratory chain activity regulates the mitochondrion function
3 NO调控线粒体功能在疾病中的作用
3.1 心血管疾病
心血管疾病是全球死亡的主要原因,在心血管疾病的发生和预防中,NO起着重要的作用。NO在心血管系统中发挥保护作用的机制主要包括调节血压和血管张力,抑制血小板聚集和白细胞黏附,防止平滑肌细胞增殖等[17]。NO生物利用度的紊乱会导致心血管系统保护功能的丧失,在某些情况下甚至会加速疾病进程。
线粒体是心肌细胞的能量代谢中心,在维持正常心肌收缩力和心脏活动中发挥必不可少的作用,因此线粒体已成为心血管系统保护策略的关键靶标。NO通过使线粒体呼吸链复合体、代谢酶以及线粒体相关蛋白质发生S-亚硝基化以影响其活性与功能,参与不同心血管疾病的发病机制。早期已有研究发现NO使线粒体复合物Ⅰ发生S-亚硝基化,抑制再灌注期间复合物Ⅰ活性的恢复,减少活性氧(ROS)的产生,减轻心脏再灌注损伤[18]。同样,Castillo等[19]在离体大鼠心脏缺血再灌注损伤模型中抑制GSNOR,发现可促进线粒体复合物Ⅲ和Ⅴ发生S-亚硝基化。用GSNOR抑制剂治疗的心脏显示心肌损伤标志物肌酸激酶的释放较低,心肌梗死区域减少,并且改善了缺血后的心室功能,表明S-亚硝基化水平提高在缺血性心脏病中能发挥一定的心肌保护作用。Siragusa等[20]研究发现eNOS与内皮细胞中的丙酮酸激酶2型(PKM2)相互作用并使其S-亚硝基化,降低其酶活性,PKM2抑制将葡萄糖分解代谢转向磷酸戊糖途径,通过磷酸戊糖途径增加底物通量,以产生还原当量(NADPH和GSH)并防止氧化应激,维持内皮的氧化还原状态。Tang等[21]研究阐明GSNOR在心肌细胞线粒体定位,通过调控线粒体蛋白腺嘌呤核苷酸转位酶1(ADP/ATP translocase 1,ANT1)的S-亚硝基化修饰影响线粒体功能,使得线粒体氧化应激增加并抑制了线粒体自噬,最终导致心肌重构和心力衰竭。因此,推测线粒体GSNOR将会成为心力衰竭的一个新治疗靶点,也有研究已证实GSNOR可以通过调节线粒体动力学和线粒体自噬相关蛋白的S-亚硝基化水平以维持线粒体稳态并延迟细胞衰老[12],这表明GSNOR具有间接影响细胞氧化还原状态的效力,可以对心血管稳态发挥一定的保护作用。
综上研究结果表明,NO除了作为内源性血管舒张因子参与对心血管的保护作用外,也可以通过对心肌线粒体的调控作用来维持心血管稳态。靶向S-亚硝基化修饰正成为保护心血管系统的潜在目标,可以为开发新的治疗策略提供新的途径,然而一些抑制剂是否会对心血管功能造成不良影响仍需进一步研究。
3.2 神经系统变性疾病
在大多数神经系统变性疾病中,线粒体功能紊乱,ROS和活性氮(RNS)的产生增加,从而导致突触丢失和神经元损伤[22]。RNS过量产生会导致NO介导的蛋白质翻译后修饰,如半胱氨酸残基的S-亚硝基化和酪氨酸残基的硝化。在阿尔茨海默病(AD)中,S-亚硝基化水平升高是其发病机制之一,且β-淀粉样蛋白(Aβ)能在NO调节下使得Drp1亚硝基化而导致线粒体分裂增加。Nakamura等[23]发现AD中iNOS的表达上调使NO合成增加,NO进而S-亚硝基化Drp1。其研究表明去泛素化酶Uch-L1促进S-亚硝基化级联反应,其将NO基团转移到Cdk5,然后再转移到Drp1,刺激Drp1活性增强。由此导致线粒体过度分裂碎片化和生物能量受损,引起神经元突触缺失及细胞死亡。Wang等[24]研究发现GSNOR通过减轻Drp1的S-亚硝基化修饰,维持线粒体稳态以及减少神经元凋亡蛋白的释放,从而发挥神经保护作用。另有研究表明,当NO在帕金森病(PD)中表达过高时,PINK1的S-亚硝基化会抑制其激酶活性,损害PINK1/Parkin介导的线粒体自噬,从而导致多巴胺能神经元细胞死亡[25]。以上研究揭示了NO介导线粒体动力学和线粒体自噬以致神经系统变性疾病的发生,而靶向部分酶的亚硝基化活性可能是神经系统变性疾病的治疗靶点。
此外,对于部分神经系统变性疾病,高浓度的NO可通过抑制线粒体呼吸和激活细胞死亡途径而导致神经毒性。NO是介导PD中多巴胺能神经元退变的主要影响因素之一,研究表明NO与多巴胺代谢物3,4-二羟基苯乙酸(DOPAC)的协同相互作用,可抑制细胞色素C氧化酶,引起线粒体损伤并通过消耗谷胱甘肽和氮氧应激的机制导致多巴胺能细胞死亡[26]。iNOS介导的NO产生也有助于α-突触核蛋白的聚集,导致线粒体呼吸能力下降及多巴胺能神经元的选择性丧失[27]。
3.3 肿瘤
NO在肿瘤中有着双重作用,低浓度NO可以促进肿瘤生长,高浓度NO则可抑制肿瘤细胞增殖并诱导肿瘤细胞死亡[6]。当NO存在时,与铁硫簇(Fe-S)形成铁-亚硝酰复合物,引发线粒体去极化,导致线粒体氧化应激,介导细胞凋亡。NO也可抑制电子呼吸链复合物Ⅳ,减少ATP的产生并降低细胞存活率。这种抑制作用还可以增加ROS/RNS的产生,诱导氧化/亚硝化应激或氧化还原信号传导,引起细胞凋亡,进而可抑制肿瘤进展,降低肿瘤细胞的转移潜力。目前,高浓度NO在肿瘤治疗方面具有广阔的应用前景,在肿瘤微环境中可与ROS反应生成具有更强氧化性的活性氮类衍生物,共同影响线粒体功能、调控细胞因子,在分子和细胞水平上有效地抑制肿瘤的生长和转移[28]。
代谢重编程是恶性肿瘤的特征,即使在有氧条件下,肿瘤细胞仍然以糖酵解途径为主要能量来源,即Warburg效应。NO通过与酶的相互作用或通过激活致癌途径来影响肿瘤细胞代谢。Gao等[29]研究表明,nNOS可促进磷酸果糖激酶1(PFK-1)亚型PFKM Cys351位点的S-亚硝基化修饰,导致卵巢癌细胞糖酵解增加。Li等[30]发现iNOS衍生的NO通过诱导PKM2发生核转位来促进卵巢癌细胞的糖酵解。另一方面,在肿瘤中发现编码TCA循环酶的基因发生突变,如富马酸水合酶(FH)、琥珀酸脱氢酶(SDH)和异柠檬酸脱氢酶(IDH),导致代谢产物琥珀酸、富马酸和2-羟基戊二酸的丰度增加[31]。这些代谢产物可作为驱动不同癌症的致病因子,并且代谢物积累会促进恶性肿瘤的发展。以上研究表明NO诱导代谢变化,导致致癌信号传导、增殖和突变发生率增加,因此靶向肿瘤细胞代谢可以作为潜在的肿瘤治疗手段,但仍需进一步研究阐明该类药物与肿瘤相关的免疫细胞产生不良影响的可能性。
3.4 炎症
巨噬细胞存在于大部分组织中,与组织稳态、炎症和宿主防御有关,在一些细胞因子和内毒素的诱导下可以产生大量的NO。NO可以通过改变线粒体生物性质来介导巨噬细胞效应活性,并且在控制巨噬细胞代谢重编程方面具有重要影响。在细胞代谢方面,NO可以通过抑制TCA循环中关键酶和相关代谢产物的活性调控巨噬细胞代谢[32]。研究表明NO可以通过抑制乌头酸酶2(ACO2)以调节衣康酸盐水平来调节炎症信号传导,并且通过改变呼吸链复合物Ⅰ中关键N-模块亚基的丰度来调节巨噬细胞呼吸功能[33]。NO还抑制丙酮酸脱氢酶(PDH),通过PDH-E3亚单位(DLD)的半胱氨酸亚硝基化,从而阻断丙酮酸进入TCA循环[34]。NO通过靶向ACO2和PDH限制了代谢产物进入TCA循环,进而影响了免疫细胞代谢重编程。在细胞凋亡方面,NO可以通过线粒体膜电位直接介导或通过产生过氧化亚硝酸盐间接诱导细胞色素C的释放,进而活化半胱氨酸蛋白酶(Caspase)依赖的细胞凋亡途径。Simpson等[35]发现过量的NO促进细胞凋亡和炎症。巨噬细胞内Caspase-8减少增加了iNOS的表达,从而促进了促凋亡蛋白BAX/BAK的信号传导,以驱动线粒体凋亡。NO影响免疫细胞代谢和细胞凋亡新机制的进一步阐明,可以为患有炎症性疾病的患者带来新的治疗方法。
4 总结与展望
综上所述,一氧化氮合酶亚型、S-亚硝基化修饰的靶蛋白、呼吸链组分、细胞因子等是机体内NO调控线粒体功能的重要因素。NO调控线粒体功能在各疾病的发生发展中发挥重要作用,靶向该途径可以为治疗各类疾病提供新的治疗策略,也为相应疾病的药物研发提供新的思路。但也应注意NO对于疾病的调控有双重性,NO及其衍生物与不同靶标的相互作用,具体取决于浓度、时间和空间限制。因此在临床治疗中有必要提出新的策略来提高NO的生物利用度,以增强其防治潜力。同时在NO介导线粒体代谢方面也需要进一步的研究来揭示复杂代谢途径之间的关系,并发现调节细胞生命活动的新代谢途径,将有助于我们进一步明确靶向目标,为疾病的防治提供新的策略。

