香辛料对传统发酵泡菜中细菌群落结构及理化特性的影响研究
吴建梅,汪 铃,刘 金,王 亮*
(江苏大学 食品与生物工程学院,江苏 镇江 212013)
泡菜是我国广受消费者喜爱的传统发酵蔬菜食品[1]。我国的泡菜历史悠久,传承至今,据记载,腌泡菜最早可以追溯到3 000多年前的商周时期[2]。目前泡菜生产大多基于家庭自制的自发发酵过程,是将大白菜、甘蓝、萝卜、菜豆、莴笋等蔬菜作为原料,用一定浓度盐水或卤水浸泡,然后放入泡菜坛中在室温条件下进行密封发酵6~10 d[3]。其中我国有名的泡菜包括四川泡菜、东北酸菜和涪陵榨菜等[4]。
泡菜的制作通常将蔬菜洗净后直接浸泡于卤水中进行厌氧发酵,这种开放式的生产方式使得泡菜制作成为一个复杂的混菌发酵过程,原料和环境中的微生物区系利用发酵体系中的营养物质产生代谢物,如有机酸、维生素、氨基酸、细菌素等[5-6],成熟泡菜中还含有丰富的乳酸菌等有益菌。自然发酵的泡菜产品风味独特,极具地域特色[7]。然而原料上的微生物并不总是受控制地生长繁殖,发酵过程中易受食源性致病菌污染[8-9],导致其发酵结果品质不稳定,安全性差。香辛料可以改善食品品质[10-11],且能抑制某些病原菌的生长[12-13],因此通常被添加到泡菜卤水中。然而,针对香辛料对泡菜发酵中微生物多样性的研究还比较少。
随着脱氧核糖核酸(deoxyribonucleic acid,DNA)测序技术和生物信息学分析方法的进步和优化,高通量测序技术在食品发酵领域得到广泛的应用[14-17]。本研究利用高通量测序技术研究两组泡菜样品(对照组和添加香辛料组)发酵结束时的微生物群落结构,比较两组样品间微生物群落差异,同时监测两组泡菜在发酵过程中的pH、总酸及亚硝酸盐含量变化,分析理化指标与差异物种的相关性。以期确定香辛料在泡菜发酵中的潜在效益,为泡菜发酵的传统工艺提供理论指导。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
大白菜、食用盐、白砂糖、大蒜、生姜、小红尖椒:镇江市市售;泡菜坛(800 mL):湖南宝升塑业科技开发有限公司。
1.1.2 化学试剂
亚铁氰化钾、乙酸锌、冰乙酸、硼酸钠、盐酸、盐酸萘乙二胺、对氨基苯磺酸(均为分析纯):青岛高科技工业园海博生物技术有限公司;亚硝酸钠、氢氧化钠(均为分析纯):南京翼飞雪生物科技有限公司。细菌基因组DNA提取试剂盒:天根生化科技有限公司。
1.2 仪器与设备
FE28pH计:梅特勒-托利多仪器有限公司;ZCZY-CS8V型摇床:上海知楚仪器有限公司;SW-CJ-2FD型超净工作台:苏州空泰空气技术有限公司;HY160冷冻离心机:湖南赫西仪器装备有限公司;DGL-100GL高压蒸汽灭菌锅:浙江力辰仪器科技有限公司;UV-200紫外分光光度计:上海元析仪器有限公司;HH-4S型恒温水浴锅:上海捷呈实验仪器有限公司。
1.3 方法
1.3.1 泡菜的制作工艺流程及操作要点

操作要点:
原料预处理:挑选新鲜的大白菜,清洗干净,沥干表面水分,切分为2 cm×2 cm×2 cm的小块。
未添加香辛料组(P)(对照组)卤水配制:将盐300 g,白砂糖100 g加至10 L开水中,充分浸泡,制成含3%盐和含1%糖的卤水,冷却至室温备用。
添加香辛料组(PS)卤水配制:将盐300 g,白砂糖100 g,大蒜400 g,生姜200 g,小红尖椒200 g加至10 L开水中,充分浸泡,制成含3%盐、1%糖、4%大蒜、2%生姜和2%小红尖椒的卤水,冷却至室温备用。
装坛:按照每坛200 g大白菜,500 mL卤水装坛,共制作20坛未添加香辛料泡菜(编号P1~P20)和20坛添加香辛料泡菜(编号PS1~PS20)。
密封发酵:将泡菜坛密封盖严,置于20 ℃摇床恒温发酵6 d,即得泡菜成品。
1.3.2 样品采集
发酵时间设为0、1 d、2 d、3 d、4 d、5 d、6 d。每天取样,在每坛泡菜中任选四个位置,各吸取5 mL,每次每坛共取20 mL泡菜汁混匀,从混匀后的泡菜汁中吸取5 mL放入无菌离心管,4 ℃、10 000 r/min离心10 min,收集沉淀,-80 ℃冰箱保存,直至测序。剩余15 mL泡菜汁用于pH、总酸、亚硝酸盐的测定。
1.3.3 理化指标的测定
采用pH计直接测定样品的pH;参照GB/T12456—2021《食品中总酸的测定》[18]测定样品的总酸含量;参照GB 5009.33—2016《食品中亚硝酸盐与硝酸盐的测定》[19]中分光光度法测定样品的亚硝酸盐含量。
1.3.4 DNA提取及测序
从未添加香辛料组(P)和添加香辛料组(PS)中各选取5个产酸高的样品和5个产酸低的样品进行测序。采用基因组DNA提取试剂盒提取泡菜样本的DNA,细菌通用引物515F(5'-GTGCCAGCMGCCGCGGTAA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对16S rRNA基因的V4区进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。用特异引物515F-806R扩增16S rRNA V4区基因。PCR扩增体系:MasterMix15μL、正反向引物0.2μmol/L、模板DNA 10 ng。PCR扩增条件:98 ℃初变性1 min,然后98 ℃变性10 s,50 ℃退火30 s,72 ℃延伸30 s,最后72 ℃,5 min,共30个循环。本研究中的泡菜样本PCR扩增产物委托天津诺禾致源生物信息科技有限公司完成Miseq文库构建,采用Illumina Miseq平台进行测序。
1.3.5 数据分析
经Illumina Miseq测序后所得的原始数据经拼接、去杂、优化后得到有效序列。使用Uparse对所有序列按97%相似水平进行操作分类单元(operational taxonomic unit,OTU)的划分,再将OTU的代表序列与SILVA(132.8版本)数据库比对进行物种注释分析。使用R中vegan包计算Chao1和Shannon指数,并计算组间贝叶斯距离(Bray-Curtis)进行β多样性分析,基于在线网站(http://huttenhower.sph.harvard.edu/galaxy/)进行组间线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)。本研究中统计分析及绘图主要在R软件(R 4.2.0)中完成。
2 结果与分析
2.1 不同处理组泡菜理化指标分析
P组和PS组泡菜在第6天的理化指标见表1。由表1可知,P2、P11、P12、P13、P19为P组发酵结束(第6天)的高酸样品,P1、P14、P5、P7、P17为P组低酸样品;PS1、PS2、PS4、PS5、PS9为PS组发酵结束(第6天)的高酸样品,PS10、PS12、PS13、PS14、PS20为PS组低酸样品。总酸是泡菜发酵过程中标志成熟的重要参数,研究表明,发酵成熟的泡菜中卤水pH值<4.0,可滴定酸含量>0.3 g/100 g[4]。P组中样本P5、P7、P14、P17在发酵第6天均未达到成熟时总酸含量0.3 g/100 g。而PS组中所有样本在发酵第6天总酸含量均达到规定标准0.3 g/100 g。与对照组(P组)相比,添加香辛料后同一批样品中的pH和总酸含量波动较小,且都达到泡菜成熟标准。亚硝酸盐积累是发酵蔬菜中常见的安全问题,摄入过量的亚硝酸盐会危害人体健康,诱发多种癌症[20]。P组中P5、P7、P14、P15亚硝酸盐含量已超过安全限值20 mg/kg[19],PS组中样本的亚硝酸盐含量为0.571~1.796 mg/kg,差异较小,单因素方差分析表明两组样品间亚硝酸盐含量存在显著差异(P<0.05)。
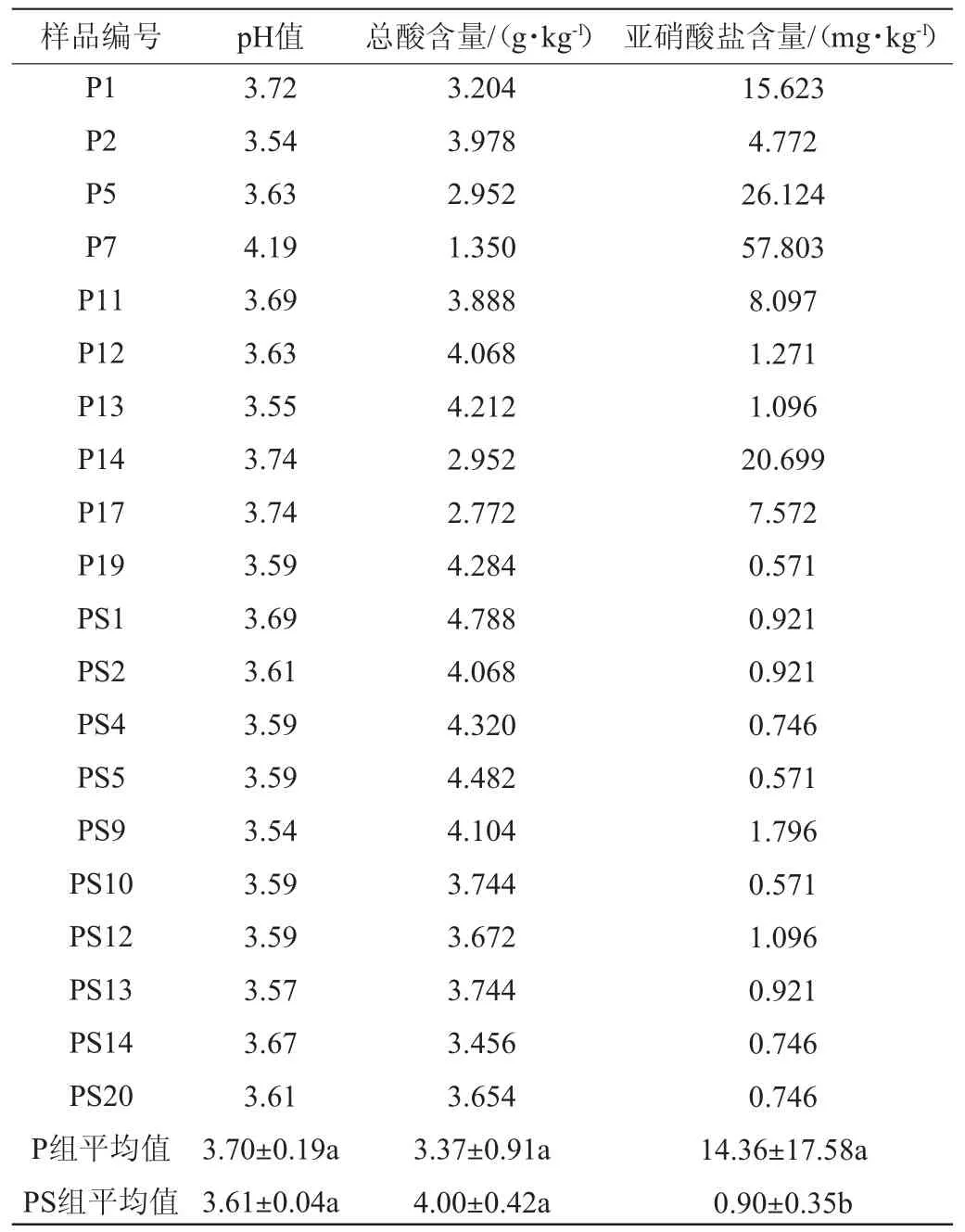
表1 不同处理组泡菜在发酵第6天的理化指标Table 1 Physicochemical indexes of pickles in different treatment groups on the 6th day of fermentation
综合上述结果,添加香辛料批次的泡菜与对照组相比呈现出更快的产酸速率,且PS组的各个样品间理化指标差异小于对照组,在发酵第6天的亚硝酸盐含量远低于标准限值,表明香辛料添加不仅能缩小样品间的差异,也表现出良好的食用安全性。
2.2 测序数据及OTU数目统计结果
两组泡菜样本经测序得到的原始下机序列、有效序列及OTU数目见表2。去除原始序列的接头信息以及低质量碱基等干扰信息后,所有样本的有效序列条数在67 319~87 021之间,每个样本的平均有效序列数为78 093。由表2可知,将两组中的有效序列进行物种注释,所有样本共获得931个OTU,P组各样本中OTU数为47~239个,由此可见P组10个样本间的OTU数存在较大差异,而PS组各样本中OTU数为45~64个,差异较小。由表2亦可知,覆盖率(Good's coverage)均大于0.99,覆盖率越高,说明所有样本中序列未被测出的概率很低。结合稀疏性曲线(图1)可得,随着测序深度加深,物种数先快速上升后趋于平缓,表明本次样品测序的质量和深度足够反映绝大多数的微生物物种信息。

图1 泡菜样本稀疏性曲线Fig.1 Rarefaction curves of pickles samples
2.3 微生物群落结构
两组泡菜样品在门水平及属水平上相对丰度前十的微生物群落组成见图2。由图2a可知,厚壁菌门(Firmicutes)和变形杆菌门(Proteobacteria)是两组泡菜样品中共同的优势门(相对丰度>1%),此结果与其他发酵蔬菜的优势细菌门相同[3,21],证明各发酵蔬菜微生物间存在共性。厚壁菌门在PS组中相对丰度更高,达到76.41%,在P组中为34.52%。变形杆菌门在P组和PS组中分别占62.74%和20.96%。

图2 不同处理组泡菜样本中门(a)和属(b)水平上微生物群落结构比较Fig.2 Comparison of microbial community structure of pickles samples with different treatment groups at phylum (a) and genus (b) level
由图2b可知,在属水平上,两组泡菜样品中的优势属种类大体相同,但同一细菌属在两组泡菜样品中的相对丰度存在差异。P组中的优势属(相对丰度>1%)为肠杆菌科(Enterobacteriaceae)下的未鉴定属(46.34%)、明串珠菌(Leuconostoc,18.25%)、乳球菌(Lactococcus,9.76%)、假单胞菌(Pseudomonas,4.22%)、弧菌属(Vibrio,1.95%)、乳酸杆菌属(Lactobacillus,1.92%)、泛菌属(Pantoea,1.12%)、气单胞菌(Aeromonas,1.09%)。PS组中的明串珠菌属(Leuconostoc,70.26%)丰度最高,其次是肠杆菌科(Enterobacteriaceae)下的未鉴定属(8.30%)、乳球菌(Lactococcus,2.22%)、弧菌属(Vibrio,2.19%)、假单胞菌(Pseudomonas,1.66%)、希瓦氏菌(Shewanella,1.31%)、乳酸杆菌属(Lactobacillus,1.30%)和泛菌属(Pantoea,1.17%)。
各细菌属中,肠杆菌是P组中占比最大的优势属,此外还检测出了低丰度的假单胞菌、弧菌属、泛菌属、气单胞菌属,有研究表明,这些细菌属在新鲜蔬菜及腌渍蔬菜中被检测出[22-23],推测其来源于发酵原料或者制作过程中的环境因子如发酵容器、刀具等,但随着发酵过程的进行,这些潜在病原微生物的生长受到抑制甚至在发酵后期完全消失[24]。假单胞菌和肠杆菌科是发酵蔬菜中常见的病原菌,有研究表明假单胞菌和肠杆菌科细菌代谢利用氨基酸,产生刺激性气味,加速食品腐败[25],肠杆菌的存在会与乳酸菌竞争发酵体系中营养物质并促进亚硝酸盐的产生[26]。以上结论证实了家庭自制泡菜中容易受到食源性致病菌的污染[27]。
香辛料的加入使得肠杆菌相对丰度从之前的46.34%下降至8.30%,假单胞菌也降低至1.66%,这降低了泡菜发酵中的致病性。另外明串珠菌从丰度18.25%上升至70.26%,成为PS组的绝对优势菌属,刘丽宅等[28]研究也表明,明串珠菌是泡菜发酵中优势菌。此外,乳酸杆菌、片球菌属、魏斯氏菌、肠球菌、乳球菌等乳酸菌也是泡菜中常见优势属[29]。大量研究表明乳酸菌主要通过碳水化合物发酵产生乳酸,该化合物有助于防止病原微生物和腐败微生物的生长,因而在传统泡菜中广泛存在[30]。
综上,香辛料可以显著提高泡菜发酵体系中乳酸菌的相对丰度,减少有害微生物污染,从而降低许多健康风险。
2.4 微生物群落多样性分析
2.4.1 微生物群落α多样性分析
微生物的α多样性指数反映了群落内物种数量及其相对丰度,Chao1指数常用来估计物种总数,Chao1指数越大,OTU数目越多,样本物种数比较多。Shannon指数综合考虑了物种的丰富度和分布的均匀度,其中Shannon值越大,说明群落多样性越高。
两组泡菜样品中细菌多样性指数分析见图3。由图3可知,经Wilcoxon检验,两组样品间Chao1指数无明显差异,PS组中Chao1指数较高,平均为111.46±52.38,表明PS组泡菜中的物种丰富度大。Shannon指数在PS组中更高,平均为2.48±0.76,显著高于P组(P<0.05),表明添加香辛料后增大了泡菜中的微生物多样性。
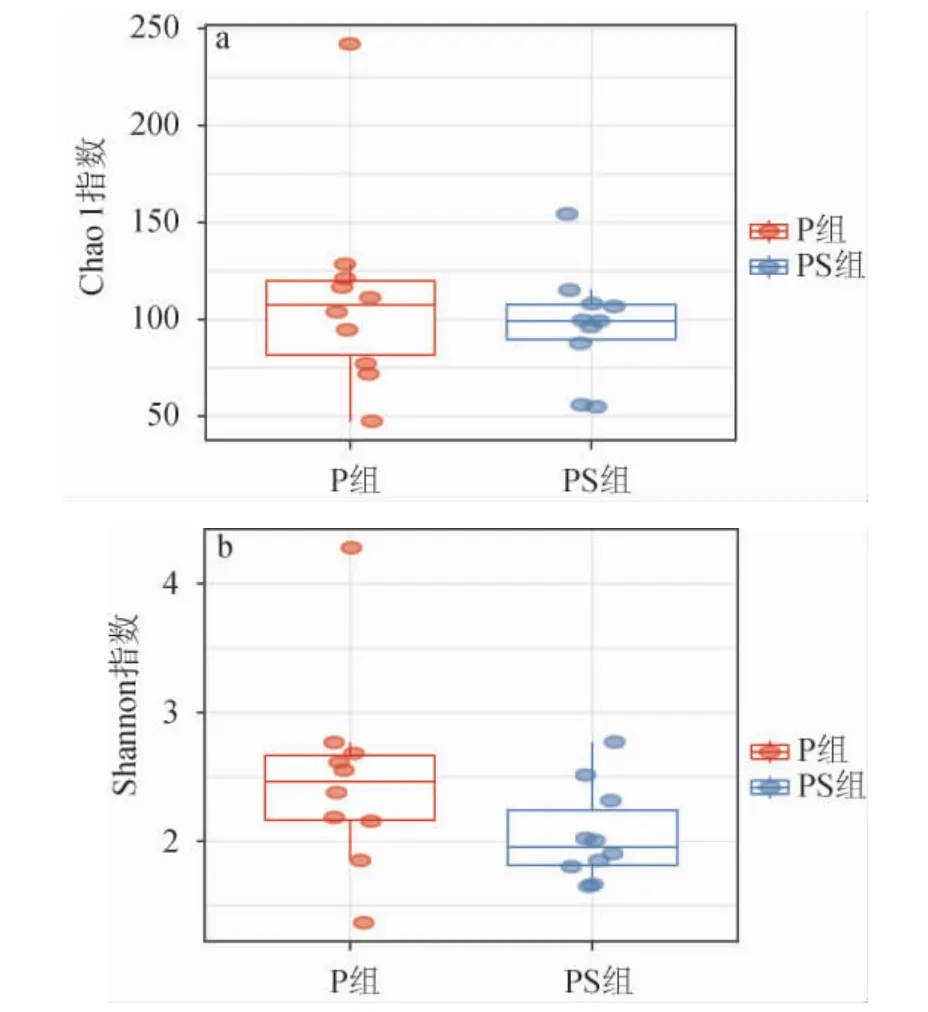
图3 不同处理组泡菜样本中Chao 1(a)和Shannon(b)指数Fig.3 Chao1 (a) and Shannon (b) indexes of pickles samples with different treatment groups
2.4.2 微生物群落β多样性分析
基于Bray-Curtis距离进行主坐标分析(principal co-ordinates analysis,PCoA)以表征两组泡菜中细菌群落结构的相似性,结果见图4。由图4可知,PCoA1和PCoA2分别解释了微生物群落结构总变异的50.43%和13.59%。除PS1样本外,PS组各样本聚集性较高,说明PS组中微生物群落构成差异较小。而P组中样品间距离较远,表明P组各样本空间距离较大。这可能与PS组中明串珠菌占据绝对优势,而非优势菌不能大量生长有关,因此PS组中细菌种类分散度较小,且PERMANOVA 检验组间差异极显著(P<0.01),表明香辛料对泡菜中微生物菌群结构有一定影响,未添加香辛料的同一批泡菜样本微生物群落结构差别较大,而添加香辛料可以缩小同批次中样本间的差异,后者工艺更利于泡菜发酵体系的稳定。
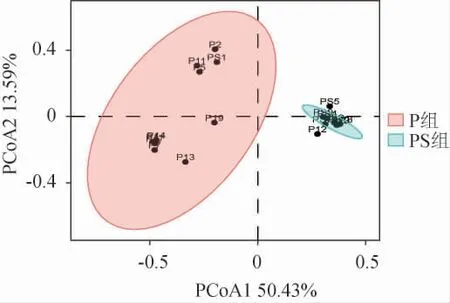
图4 不同处理组泡菜样本的主坐标分析结果Fig.4 Principal coordinate analysis results of pickles samples with different treatment groups
2.5 微生物群落差异性分析
2.5.1 LefSe分析及生物标志物
利用LefSe分析找到两组泡菜样品在丰度上有显著差异的物种,图5展示了LDA分值大于4.0的物种,分别作为P组和PS组的生物标志物,图中柱形图长度代表LDA分值的大小,长度越长,LDA分值越高,即该物种丰度对两组间差异效果影响大。由图5可得,LefSe分析共检验出前15个在两组泡菜样品间具有统计学差异的微生物类群,P组及PS组分别鉴定出10个和5个生物标志物,P组生物标志物分类到属水平的有乳球菌属、明串珠菌属、假单胞菌属、弧菌、乳杆菌属和Castellaniella,只有一个标志物分类到科水平(Enterobacteriaceae),其中LDA分值最高的生物标志物是来自肠杆菌科(6.13)。PS组中有4个标志物来自明串珠菌属,剩余1个标志物分类到科水平(Enterobacteriaceae)。LDA分值最高的生物标志物来自明串珠菌属(6.33)。
2.5.2 生物标志物与理化指标的相关性分析
为探究生物标志物与理化指标之间的联系,绘制了生物标志物与理化参数之间的Spearman相关性热图见图6。由图6可知,P组中LactobacillusKR107058.1.1463、VibrioKF799889.1.1509、PseudomonasEU539857.1.1397、PseudomonasAF534216.1.1462和Enterobacteriaceae KC555526.1.1442均与亚硝酸盐含量呈极显著正相关(P<0.01),而PS组中LeuconostocKC539103.1.1326、LeuconostocKX232108.1.1480和LeuconostocKX583579.1.1213与亚硝酸盐含量呈极显著负相关(P<0.01),这解释了表1中P组样品中有亚硝酸盐含量超标而PS组远低于安全限量值的原因。P组的10个生物标志物都与总酸呈现负相关,其中LactobacillusKR107058.1.1463与总酸呈现极显著负相关(P<0.01),PS组的LeuconostocKX232108.1.1480与总酸呈显著正相关(P<0.05);P组中6个生物标志物与pH呈显著正相关(P<0.05),PS组中1个生物标志物与pH呈显著负相关(P<0.05)。
3 结论
本研究采用高通量测序技术研究了香辛料对泡菜发酵中微生物多样性的影响,并结合理化参数分析。其中P组优势菌属为为肠杆菌、明串珠菌、乳球菌、假单胞菌、弧菌属、乳酸杆菌属、泛菌属、气单胞菌,而明串珠菌是PS组的绝对优势菌;PCoA分析结果表明PS组中各样品菌群差异较小,即添加香辛料能有效提高同批次泡菜中微生物群落的稳定性;P组中8个生物标志物与亚硝酸盐的生成呈极显著或显著正相关(P<0.01、P<0.05),而PS组中来自明串珠菌属的三个生物标志物与亚硝酸盐呈极显著负相关(P<0.01)。本试验结果表明,在传统泡菜生产中添加香辛料能有效提高乳酸菌的相对丰度,使有益菌占据主导优势,显著降低亚硝酸盐含量,更能保证食用安全性。

