杏鲍菇原生质体制备、再生及其遗传转化体系的建立
邹优花,连玲丹,钟武杰,杜敏如,黄颖茵,王杰
(华南农业大学食品学院,广东 广州 510642)
杏鲍菇(Pleurotus eryngii),学名为刺芹侧耳菌。杏鲍菇因其独特的口感和丰富的营养价值备受人们喜爱,它富含萜类、甾醇、多糖和多酚等生物活性成分[1],具备药用和功能性食品的特性,因此深受欢迎[2]。目前该产业的可持续发展受到优质种质供应不足的制约,成为其发展的核心难题。随着市场需求的快速增长,对杏鲍菇优良种源的需求愈发紧迫。
随着分子生物学技术的发展,利用遗传转化对食用菌进行定向遗传改良也成为新品创制的主流方式[3]。目前在茶树菇[4]、香菇[5]、金针菇[6]等食用菌中已成功利用原生质体遗传转化体系选育出优良品种。原生质体遗传转化是以原生质体为基础[7],以优质高产原生质体的制备与再生为前提,以稳定有效的遗传转化方法为关键步骤。目前食用菌原生质体多集中于其制备与再生条件[8],但刘莉等[9]发现将制备体系优化后所得的原生质体用于遗传转化,却得到较低转化效率。因此,用于遗传转化的原生质体不仅要有高的产量和再生率,也要具备高转化效率。
本研究以杏鲍菇菌株GIM5.344 为材料,通过对裂解酶、酶解温度、酶解时间、再生培养基稳渗剂种类4 个因素进行研究,优化杏鲍菇原生质体的制备与再生条件。同时,通过对潮霉素浓度筛选和转化方式的优化,建立稳定有效的杏鲍菇原生质体的遗传转化体系,以期为杏鲍菇的菌种改良和优良品种选育提供参考。
1 材料与方法
1.1 材料与试剂
杏鲍菇菌株GIM5.344、质粒4:华南农业大学食品学院王杰教授课题组构建;溶壁酶1(≥200 U/mg):广东省微生物研究所;溶壁酶2(≥200 U/mg):北京索莱宝科技有限公司;纤维素酶(≥200 U/mg)、甘露醇、聚乙二醇4000、氯化钙、顺丁烯二酸、顺丁烯二酸二钠、三羟甲基氨基甲烷盐酸盐、山梨醇、蔗糖、葡萄糖、硫酸镁、氯化钠:上海麦克林生化科技股份有限公司。所用化学试剂均为分析纯。
1.2 仪器与设备
HH-4 恒温水浴锅:常州澳华仪器有限公司;5804R高速冷冻离心机:美国Sigma 公司;SPX-158L 生化培养箱:宁波莱福科技有限公司;SPH-2102C 恒温摇床:上海世平摇床厂;JY600C 电泳仪:北京君意东方设备有限公司;QuantityStudio3 荧光定量PCR 仪、Quantity-Studio3 荧光显微镜:美国Applied Biosystems 公司;SWCJ-1F 超净工作台:江苏苏州净化公司。
1.3 方法
1.3.1 试剂配制
0.2 mol/L 马来酸溶液:0.2 mol/L 顺丁烯二酸和0.2 mol/L顺丁烯二酸二钠以1 ∶2 的体积比混合,调节pH 值至5.5,121 ℃,灭菌20 min。
甘露醇-马来酸(mannitol-maleic acid,MM)缓冲液:0.6 mol/L 甘露醇溶液25 mL,0.2 mol/L 马来酸溶液12.5 mL,去离子水12.5 mL,过滤除菌。
甘露醇-马来酸-氯化钙(mannitol-maleic acid-CaCl2buffer,MMC)缓冲液:0.6 mol/L 甘露醇溶液25 mL,0.2 mol/L 马来酸溶液12.5 mL,1 mol/L CaCl2溶液1.25 mL,去离子水11.25 mL,过滤除菌。
STC 溶液:10.93 g 甘露醇,1 mol/L 三羟甲基氨基甲烷盐酸盐溶液(pH7.5)1 mL,1 mol/L CaCl2溶液2.5 mL,定容至100 mL,121 ℃,灭菌20 min。
1.3.2 原生质体的制备
活化培养:用接种钩将保藏的杏鲍菇菌种转接至马铃薯琼脂葡萄糖培养基(potato dextrose agar,PDA)平板,在28 ℃培养箱避光培养6 d。
液体培养:取PDA 平板上长的新菌丝,将菌丝接种至马铃薯葡萄糖琼脂培养基(potato dextrose broth,PDB)液体培养基中,于28 ℃、150 r/min 摇床培养5 d。
恢复培养:待液体培养长出菌丝球后,用均质机将菌丝球打成细小碎片状,取5~7 mL 匀浆碎片液体转至100 mL 完全酵母培养基(complete yeast medium,CYM)中,在28 ℃培养箱静置恢复4 d(每天手动摇匀2 次),等待破碎后的菌丝长出较嫩的絮状菌丝即可作为原生质体制备的材料。
原生质体制备:菌丝过滤,称取0.05 g 菌丝加入1 mL 裂解酶,将菌丝弹匀,于32 ℃水浴锅水浴2.5 h,期间每隔10 min 颠倒混匀1 次,水浴结束后用塞有棉花的注射器过滤取得原生质体液,2 500 r/min、4 ℃离心20 min 后加500 μL MM 缓冲液和MMC 缓冲液各清洗1 次,最终加100 μL STC 重悬原生质体,用血球计数板在显微镜下计数。原生质体产量的计算公式如下。
P=C×4×106×N
式中:P 为原生质体产量,CFU/mL;C 为血球计数板上每个小方格的原生质体数,CFU/mL;N 为稀释倍数。
1.3.3 不同裂解酶对原生质体制备的影响
固定酶解温度为32 ℃、酶解时间为2.5 h,探究不同裂解酶(溶璧酶1、溶璧酶2、纤维素酶)对原生质体产量和再生率的影响。
1.3.4 不同酶解温度对原生质体制备的影响
按照1.3.2 方法制备原生质体,筛选裂解酶,设置酶解温度为28、30、32、34、36 ℃,过滤收集原生质体,用血球计数板计数,稀释到最佳浓度后进行再生试验,确定最佳酶解温度。
1.3.5 不同酶解时间对原生质体的影响
固定最佳裂解酶为溶壁酶1,酶解温度为32 ℃,设置酶解时间为0.5、1.0、1.5、2.0、2.5 h,按照1.3.2 的方法制备原生质体,分别收集原生质体并计数后稀释至最佳浓度进行再生试验。
1.3.6 原生质体再生
将原生质体稀释成108CFU/mL,取100 μL 加入0.9 mL 的CYM 再生液体培养基,放置在28 ℃恒温培养箱中预培养16 h 后2 500 r/min、4 ℃离心20 min,去除上清液留取少量液体重悬原生质体后涂板于PDA再生培养基,培养7~10 d。再生率计算公式如下。
R=(C1/C2)×100
式中:R 为再生率,%;C1为原生质体再生单个菌落,CFU/mL;C2为原生质体个数,CFU/mL。
1.3.7 再生培养基稳渗剂的筛选
固定原生质体制备裂解酶为溶壁酶1、酶解时间为2.5 h、酶解温度为32 ℃、原生质体浓度为108CFU/mL、稳渗剂浓度为0.6 mol/L,探究甘露醇、山梨醇、蔗糖、葡萄糖、硫酸镁、氯化钠对原生质体的影响,确定最佳再生培养基稳渗剂。
1.3.8 原生质体转化
原生质体转化采用CaCl2-PEG 转化法:杏鲍菇菌丝体32 ℃酶解2.5 h 后过滤,用1 mL MM 缓冲液在4 ℃、2 500 r/min、20 min 的条件下离心洗涤1 次,再用1 mL MMC 缓冲液同条件离心洗涤1 次,倒掉上清液,加100 μL STC 镜检,预估原生质体的数量,将原生质体稀释至107CFU/mL,每管100 μL 原生质体加入10 μL质粒4[图1,带有潮霉素抗性基因(HygR)和绿色荧光蛋白基因(GFP)]和100 μL PEG 溶液,同时将不添加质粒的设为空白对照组,冰浴50 min。然后每管加入500 μL PEG 溶液,混合均匀后,于30 ℃水浴锅水浴30 min,再加500 μL STC 缓冲液混匀后倒入再生培养基中进行培养。
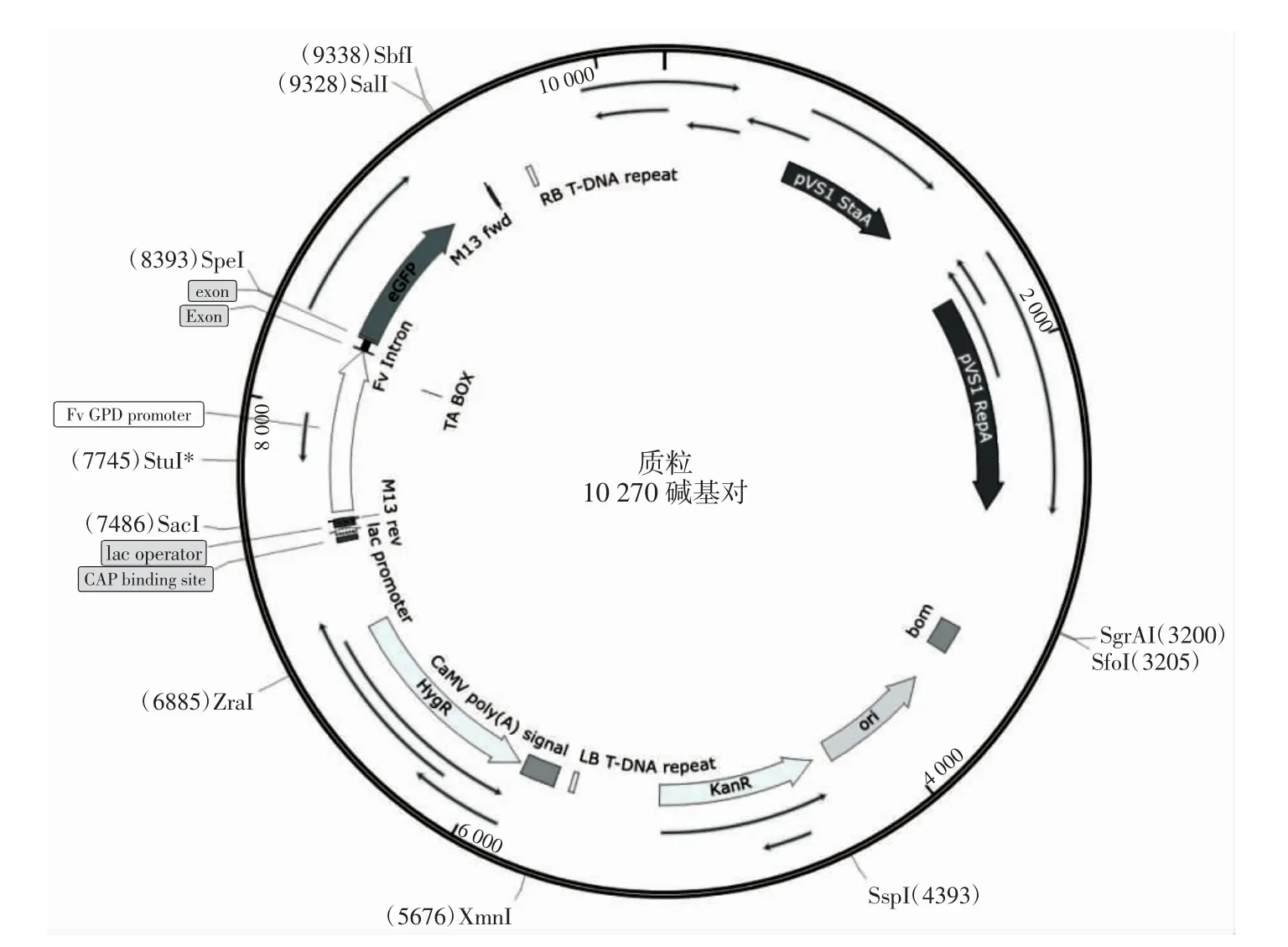
图1 质粒4 图谱Fig.1 Plasmid 4 diagram
1.3.9 潮霉素浓度的筛选
按照1.3.2 的方法制备出原生质体后,将原生质体稀释至106CFU/mL 后吸取100 μL 分别涂布于0、2、4、6、8、10 μg/mL 的再生培养基中,28 ℃培养10 d 后计数。
1.3.10 PEG 介导转化杏鲍菇原生质体方法的筛选
PEG 介导转化后的原生质体,按以下4 种方式进行培养和筛选拟转化子。
方法1(直接涂布法):将介导转化后的原生质体悬液4 ℃、2 500 r/min 离心20 min,除去部分上清液,留取100 μL 原生质体悬液,直接涂布于30 μg/mL 潮霉素的抗性筛选平板上,静置培养12 d。
方法2(液体预培养+涂布法):在介导转化后的原生质体中加入2 mL 液体再生培养基,预培养24 h 后离心去除部分上清液,留100 μL 原生质体悬液涂布于30 μg/mL 潮霉素的抗性筛选平板上,静置培养11 d。
方法3(固体预培养+双层培养基法):将介导后的原生质体悬液倒入15 mL 无抗性再生培养基迅速混匀后倒板,28 ℃培养48 h 后再覆盖一层30 μg/mL 潮霉素的抗性筛选培养基,静置培养10 d。
方法4(液体预培养+双层培养基法):在介导转化后的原生质体中加入2 mL 再生液体培养基,预培养48 h 后与含有30 μg/mL 潮霉素的抗性培养基混匀后倒板,静置培养10 d。
为验证转化效率,从方法3 所得的拟转化子中选取22 个提取其基因组,以潮霉素(hygromycin,Hyg)的700 bp 序列作为报告基因进行聚合酶链式反应(polymerase chain reaction,PCR)。同时,从潮霉素抗性筛选平板上刮取少许菌丝涂布于盖玻片中,以未导入表达载体的菌丝作为对照,在荧光显微镜下观测绿色荧光蛋白基因的表达情况。
1.4 数据处理
采用Excel、Graphpad 8.0.2、IBM SPSS Statistic 20等软件进行数据处理和相关性方差分析。
2 结果与讨论
2.1 不同裂解酶对原生质体产量及再生情况的影响
细胞壁裂解酶是制备原生质体的关键因素,不同种类的真菌细胞壁的组成结构差异较大,因此,选用合适的裂解酶对杏鲍菇原生质体的产量和再生率很关键。不同裂解酶对原生质体产量及再生率的影响见表1。

表1 不同裂解酶对原生质体产量及再生情况的影响Table 1 Effect of different lytic enzymes on the protoplast yield and regeneration
由表1 可知,采用溶壁酶1 处理的原生质体产量最高,为7.00×108CFU/mL,为其他裂解酶产量的70~350 倍,且其再生率也显著高于其他裂解酶的处理,为0.50%,纤维素酶的处理效果最差,原生质体产量低,且再生率为0%,与孙勇等[10]的研究结果相似。综上,溶壁酶1 的处理效果最佳,这与陶庭磊[11]研究的茶树花原生质体的制备条件优化结果一致。
2.2 不同酶解温度对原生质体产量及再生情况的影响
原生质体制备的酶解温度既要利于原生质体的高产,又要防止原生质体被破坏。在一定温度范围内,酶解效率随着温度的升高而增加。但温度过高不仅降低酶的裂解效率,而且会导致原生质体变性破裂,影响原生质体的产量和再生率[12]。不同温度对原生质体制备产量及再生率的影响见图2。

图2 不同酶解温度对原生质体产量和再生率影响情况Fig.2 Effect of different enzymatic hydrolysis temperature on protoplast yield and regeneration rate
由图2 可知,随着温度的升高,原生质体产量呈先上升后下降的趋势,当温度为30 ℃时,原生质体的产量达到最高,为1.51×108CFU /mL。再生率随着温度的升高总体呈先上升后下降的趋势,在30 ℃时再生率最高,为0.40%。说明温度过低或过高对原生质体的产量和再生率均有抑制作用,温度可能通过影响裂解酶的活性来影响细胞壁裂解的效果和再生能力[13]。
2.3 不同酶解时间对原生质体产量及再生情况的影响
原生质体制备的酶解时间对原生质体的产量和再生率具有较大的影响。酶解时间过短,原生质体形成不完全产量过低,酶解时间过长,细胞壁被完全清除且原生质体膜受到损伤裂解,导致产量和再生率降低[14]。不同酶解时间对原生质体产量及再生率的影响见图3。

图3 不同酶解时间对原生质体产量和再生率的影响Fig.3 Effect of different enzymatic hydrolysis time on protoplast yield and regeneration rate
如图3 所示,随着酶解时间的延长,原生质体产量和再生率均呈先上升后下降的趋势。在2.0 h 时,原生质体产量及再生率显著高于其他酶解时间(P<0.05),分别为1.25×108CFU /mL 和0.24%。酶解时间为2.5~3.5 h 时,原生质体的产量和再生率无显著性差异,表明2.5 h 时可能为酶解时间的极限。郭成金等[15]研究表明破壁后细胞壁的部分残余组分有助于原生质体的再生,若酶解时间过长将细胞壁残余组分完全清除则导致原生质体自我修复能力下降,从而影响再生率[16-17]。因此后续试验均选用酶解2.0 h 作为最佳酶解时间。
2.4 不同再生培养基稳渗剂对原生质体再生率的影响
稳渗剂的选择对原生质体再生形成菌丝体至关重要。稳渗剂可维持原生质体内外环境的稳定,保证渗透压的平衡,防止细胞膜的破裂或皱缩[12]。不同稳渗剂对原生质体再生的影响见图4。
由图4 可知,甘露醇作为再生培养基稳渗剂时,原生质体的再生率(0.20%)显著高于其他稳渗剂(P<0.05)。这与陈敏等[18]的研究结果相似。以蔗糖和氯化钠为稳渗剂的培养基再生率为0%,说明这两种稳渗剂不利于原生质体的修复,郭成金等[15]在冬虫夏草原生质体制备研究中也观察到类似的结果。综上,选择甘露醇作为再生培养基的最优稳渗剂。
2.5 不同潮霉素浓度对原生质体再生的影响
潮霉素B 是一种氨基糖苷类抗生素,可阻止原核生物和真核生物的蛋白质合成。食用菌对潮霉素具有一定的抗性,通常采用高于致死浓度的潮霉素进行转化子的筛选,因此,潮霉素在食用菌研究应用中常被作为一种抗性标记[19-20]。不同潮霉素浓度对原生质体再生的影响见图5。

图5 不同潮霉素浓度对原生质体再生的影响Fig.5 Effect of different hygromycin concentrations on protoplast regeneration
由图5 可知,在未添加潮霉素的再生培养基(对照组A)上杏鲍菇原生质体的菌落数最多,约为200 CFU/mL,随着潮霉素浓度的升高菌落数逐渐减少,在潮霉素浓度达到8 μg/mL 时,再无菌落生长,说明刚制备好的原生质体对潮霉素的敏感度较高。但在转化的试验中发现,PEG 介导降低了杏鲍菇原生质体对潮霉素的敏感性,将潮霉素浓度提高到30 μg/mL 时才能完全抑制再生平板上菌落的生长。因此,筛选转化子的潮霉素浓度定为30 μg/mL。
2.6 PEG 介导转化杏鲍菇原生质体
PEG 介导的转化方法通过增强细胞膜的通透性以及促进外源DNA 与细胞内结构的互作,因此PEG对细胞具有一定的毒性作用,为了提高原生质体介导后细胞膜的修复从而提高原生质体的再生率,对介导后的4 种方式进行筛选,4 种方法处理后所得的拟转化子数和菌落平板分别见图6 和图7。

图6 PEG 介导转化杏鲍菇原生质体4 种方法所得的拟转化子数Fig.6 Number of putative transformants by four regeneration methods of Pleurotus eryngii protoplasts mediated by PEG

图7 PEG 介导转化杏鲍菇原生质体所得的拟转化子Fig.7 Putative transformants obtained by PEG-mediated regeneration of Pleurotus eryngii protoplasts
如图6 所示,4 种不同的PEG 介导转化方法的拟转化子数均有显著性差异(P<0.05),方法1~4 的拟转化子数分别为83、132、338、192 CFU/mL,其中转化方法3 的拟转化子数最高,可能是因为方法3 对PEG 介导转化后的原生质体伤害最小。原生质体在进行PEG介导转化后其细胞膜受到不同程度的损伤[21],介导转化后进行离心,可能会提高原生质体膜的破损率,影响拟转化子原生质体的再生,进而影响转化率。刚介导转化后的原生质体活性较低,若直接涂布于潮霉素抗性板上,将提高原生质体的致死率[9],这样也会降低转化的效率。本研究中方法1 介导转化后进行离心并直接涂布于潮霉素抗性筛选平板上,其原生质体的破损率高、活性低,因此所得到的拟转化子数量最少。方法2中介导转化后的原生质体在液体培养基中恢复24 h,然后再进行离心并涂布于抗性筛选板上,拟转化子数比方法1 增加了59%,表明转化介导过后的原生质体恢复培养24 h 有利于提高原生质体的活性。方法4 是将介导转化后的原生质体恢复48 h 后,与含有潮霉素的培养基混合培养,其拟转化子数比方法2 提高了45%,表明介导转化后的原生质体恢复培养有利于提高转化率[22]。方法3 将转化介导后的原生质体倒入无抗的固体培养基中恢复2 d,比方法2 和方法4 中加入液体培养基恢复培养所得到的转化子都高,因此,方法3 的转化筛选方法最佳。
为了验证方法3 的转化效率,则随机挑取23 个拟转化子进行PCR 验证和荧光显微镜验证,拟转化子验证后的电泳胶图见图8,荧光蛋白检测结果见图9。
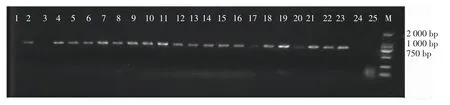
图8 拟转化子的PCR 验证Fig.PCR validation diagram of putative transformants

图9 绿色荧光蛋白检测结果Fig.9 Green fluorescent protein test results
如图8 所示,1~23 号转化子中除了1 号和3 号,其他拟转化子在1 000 bp 的位置均出现条带,且以水和野生型为模板未出现条带,说明选取的23 个拟转化子中有21 个转化子,由此说明转化效率极高,可达到91%以上。
为了进一步验证其转化子的表达效率,挑选条带最亮的19 号转化子和对照组野生型菌丝进行荧光显微镜验证,如图9 所示,在蓝色激发光下,可以看出对照组的菌丝在明场菌丝清晰可见,但在蓝色激发光下完全看不到绿色荧光,而图9 B2转化子发出明亮清晰的绿色荧光,表明质粒4 表达载体已成功导入原生质体中并能够稳定表达[23],证明所筛选的转化方法3 能显著提高转化效率并能稳定表达所导入的外源基因。
3 结论
本研究通过对杏鲍菇原生质体的制备与再生条件进行优化,得到最佳的裂解酶为溶壁酶1,当酶解温度为30 ℃、酶解时间为2 h、再生培养基的稳渗剂为甘露醇时,原生质体的产量可达到7×108CFU/mL,再生率达到0.40%。得到转化子最多的转化方法为方法3固体预培养+双层培养基法,所得转化子中的绿色荧光蛋白基因能够稳定有效表达。

