基于转录组测序挖掘马铃薯块茎采后发芽关键基因
吴林,杨苏渝,杨阳,廖喜梅,朱学栋,朱菲菲,梁峰铭,李勇,吕典秋
1.西南大学 西部(重庆)科学城种质创制大科学中心,重庆 400715;2.西南大学 农学与生物科技学院,重庆 400715;3.重庆市渝东南农业科学院,重庆 涪陵 408099;4.巫溪县署光农业科技发展有限公司,重庆 巫溪 405899;5.安顺学院 农学院,贵州 安顺 561000;6.薯类生物学与遗传育种重庆市重点实验室,重庆 400715
马铃薯是种植面积仅次于小麦、水稻和玉米的第4大粮食作物[1].中国是全球马铃薯第一大生产国.据国家统计局数据,2021年我国马铃薯种植面积约460.6万hm2,产量达1 830.9万t.马铃薯块茎采后发芽不仅显著降低商品价值,而且还严重威胁种薯的质量安全,造成巨大的经济损失[2].
为抑制马铃薯块茎采后发芽,国内外已开发出多种方法[3].如使用化学抑芽剂,包括氯苯胺灵(Chlorpropham,CIPC)[4]、过氧化氢(Hydrogen Peroxide Plus,HPP)[5]、精油[6]等.其中,CIPC应用最为广泛[4].但是,CIPC的抑芽作用不可逆,会严重影响种薯芽的活性;加之CIPC具有致癌性和毒性,2020年起欧盟已撤销其产品登记[7].此外,紫外(Ultraviolet,UV)辐射处理也可以有效降低马铃薯采后发芽率[8].
以往的研究发现,马铃薯块茎从休眠到发芽过程受植物激素严格调控.脱落酸(Abscisic acid,ABA)是促进马铃薯块茎休眠的主要物质,通过抑制细胞分裂及降低块茎中能量代谢抑制发芽[9].与ABA作用相反,赤霉素(Gibberellins,GAs)促进马铃薯块茎发芽[10].此外,细胞分裂素、生长素、茉莉酸等植物激素也具有调控马铃薯块茎采后休眠的作用[11].
近年来,随着测序技术和高通量筛选技术的发展,部分马铃薯休眠调节相关基因已被挖掘.Faivre-Rampant等[12]利用休眠和休眠解除的马铃薯块茎构建抑制性消减杂交文库(Suppression Subtractive Hybridization,SSH),筛选到385个差异表达基因;功能富集分析表明参与转录的相关基因表达发生显著变化.Liu等[13]利用休眠与发芽块茎构建SSH文库,鉴定到300个差异基因;与转录调控、信号转导、胁迫响应相关基因在马铃薯解除休眠时显著上调表达.Li等[14]利用转录组测序分析了樟脑抑制马铃薯采后休眠的差异基因和蛋白,鉴定到约4 000个差异表达转录本;Kyoto Encyclopedia of Genes and Genomes (KEGG)分析表明,樟脑可能通过调控马铃薯块茎中内源植物激素合成与信号转导抑制发芽.
马铃薯块茎休眠和发芽的分子调控机制已有少量报道.Farre等[15]利用马铃薯块茎特异表达基因Patatin的启动子,在块茎中特异表达大肠杆菌无机焦磷酸酶基因PPase,发现转基因马铃薯块茎较野生型提前6~7周发芽.Carrera等[16]发现超表达马铃薯赤霉素合成酶关键基因GA20-oxidasse,转基因马铃薯块茎出现提前发芽表型.Pasare等[17]证明,抑制马铃薯独脚金内脂(Strigolactone,SLs)生物合成关键酶基因CCD8会显著缩短转基因马铃薯休眠期.Li等[18]发现异源过表达马铃薯StHSP26.5基因,转基因烟草种子发芽被显著提前.相反,在马铃薯中沉默alpha-amylase基因StAmy23则会显著抑制块茎发芽[19].最近的研究证明,转录因子基因StTCP15通过介导ABA与GA的动态平衡调控马铃薯块茎发芽[20].
本研究通过马铃薯块茎采后发芽过程中的表型观察、细胞学特性分析、生理生化指标检测及发芽marker基因(dUTPase)表达变化等,明确了块茎休眠期、休眠解除期及芽生长期3个关键时间点.通过Illumina测序平台对3个时期的块茎进行转录组测序分析,挖掘马铃薯采后发芽关键基因,并从植物激素合成、信号转导角度系统分析了植物激素在调控马铃薯块茎发芽中的功能,为马铃薯块茎发芽关键基因功能解析和作用机制研究奠定了分子学基础.
1 材料与方法
1.1 试验材料
2022年秋季将马铃薯短休眠期栽培品种‘费乌瑞它’种植于重庆市渝东南农业科学院实验基地,常规田间管理,成熟时挑选300个大小均匀(约40 g/个)、健康、无损伤的块茎,洗净、自然干燥后,置于暗黑环境(室温22 ℃±2 ℃、相对湿度75%)中愈合1周,开始进行发芽统计.期间,每隔15 d进行拍照记录,并参考Li等[14]的取样方法进行取样,每个时间点设置3个生物学重复.样品经液氮速冻后,置于-80 ℃保存,用于后续试验.
1.2 块茎发芽过程的细胞学观察
块茎发芽过程的细胞学观察主要参考Liu等[13]的取样和切片制作方法.以块茎顶芽为中心,用直径5 mm的打孔器取样,样品置于福尔马林-醋酸-酒精固定液(FAA)(70%酒精∶冰醋酸∶甲醛=90∶5∶5)中,真空处理10 min,于4 ℃保存.切片采用莱卡RM2016切片机,成像采用尼康Eclipse E100光学显微镜+尼康DS-U3成像系统.
1.3 块茎发芽过程的ABA和GA3检测
ABA和GA3检测分别采用江苏酶免实业有限公司(http://www.mmbio.cn/)的植物脱落酸(ABA)ELISA试剂盒(MM1185-01)与植物赤霉素(GA3)ELISA试剂盒(MM-3587201),参照说明书进行检测.
1.4 块茎发芽过程中的淀粉、可溶性糖、蛋白检测
淀粉、可溶性糖、蛋白含量检测分别采用苏州格锐思生物科技有限公司(http://www.geruisi-bio.com/)的淀粉含量测定试剂盒(蒽酮比色法,G0507W)、可溶性糖含量(SS)测定试剂盒(蒽酮比色法,G0501W)、蛋白含量(SP)测定试剂盒(双缩脲法,G0432W),参照说明书进行检测.
1.5 Total RNA提取与转录组测序
马铃薯块茎Total RNA提取采用RNeasy Plant Mini Kit(QIAGEN,德国).Total RNA纯度检测采用NanoDrop 2000((Invitrogen,美国);完整性检测采用Agient2100(Agilent Technologies,美国).核糖体RNA去除采用Epicenter Ribo-ZeroTMrRNA Removal Kit (Epicenter,Madison,美国).cDNA文库构建采用NEB Next Ultra Directional RNA Library Prep Kit(NEB,美国).转录组测序在百迈客生物科技有限公司Illumina Novaseq6000测序平台进行.为提高分析质量,带接头和低质量序列被去除.利用HISAT2软件将Clean Reads与马铃薯DM参考基因组(http://spuddb.uga.edu/dm_v6_1_download.shtml)进行精确比对,再利用String Tie软件对比对上的Reads进行组装,用于后续分析[21-22].转录组原始数据已上传至美国国家生物技术信息中心(NCBI)数据库(Accession number:PRJNA1003271).
1.6 差异表达基因筛选与KEGG富集分析
利用DESeq2软件对测序数据进行差异表达基因分析,筛选标准设置为|Fold Chang|≥2且p-value<0.01.将KOBAS 2.0(https://www.biostars.org/p/200126/)用于KEGG富集分析,显著富集筛选标准为p-value<0.05.
1.7 实时荧光定量PCR(qRT-PCR)分析
根据转录组测序结果,随机挑选8条差异表达基因,利用NCBI网站(https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi?LINK_LOC=BlastHome)设计特异引物(表1).采用FastPure© Plant Total RNA Isolation Kit (Polysaccharides &Polyphenolics-rich)(Vazyme,中国)提取马铃薯发芽样品总RNA.利用HiScritpt© III 1st Strand cDNA Synthesis Kit (+gDNA wiper) (Vazyme,中国)反转录获得cDNA.Quantitative real time polymerase chain reaction (qPCR-PCR) 采用Bio-Rad CFX Connect Real-Time System with iTaq Universal SYBR©Green Supermix(Bio-Rad,美国)进行处理.程序设置为95 ℃变性3 min,(95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸45 s)× 40循环,并进行溶解曲线分析.相对表达计算采用2-ΔΔCt[1].马铃薯Ef1α为内参基因[19-20].

表1 定量引物序列
2 结果
2.1 马铃薯块茎贮藏过程中顶芽形态和细胞特性分析
为明确马铃薯块茎发芽过程中顶芽形态和细胞特性变化,本研究对马铃薯贮藏过程中的顶芽形态和细胞变化进行了持续观察.如图1所示,贮藏初期(0~15 d),马铃薯顶芽顶端分生组织(Apical meristem,AM)细胞处于停止分裂状态,未见白色的芽生长.贮藏30 d时,随着休眠解除,顶芽AM细胞与叶原基(leaf primordia,LP)细胞开始活化并快速分裂,可见白色芽点.贮藏45 d时,顶芽继续生长,白色的顶芽长至2 mm.贮藏60 d时,白色顶芽长至5 mm,LP持续分裂形成可见的叶,同时原形成层(Procambial,PC)和早期维管组织出现.
2.2 马铃薯块茎贮藏过程中顶芽的生理生化与内源植物激素变化
为分析马铃薯块茎贮藏过程中顶芽的生理生化与内源植物激素变化,作者分别检测了贮藏0~45 d内的顶芽中可溶性糖、淀粉、蛋白质、ABA、GA3含量及dUTPase基因表达变化.结果如图2所示,在贮藏过程中,顶芽组织中的淀粉含量和蛋白质含量显著降低,可溶性糖含量呈现出先升高后下降的趋势.ABA含量呈显著下降趋势;与之相反,GA3含量呈显著上升趋势,但第30 d与第45 d并无显著变化.qRT-PCR结果表明,马铃薯发芽相关marker基因dUTPase的表达趋势与发芽表型一致,在贮藏后30 d(休眠解除)开始显著上调表达,在芽生长过程中(30~60 d)呈先显著升高再下调的趋势.因此,本研究结合发芽表型与细胞学分析结果,最终明确了马铃薯贮藏发芽的3个关键时期,即30 d为芽休眠解除期,45 d为芽生长期.

A为马铃薯块茎贮藏过程中(0~60 d)顶芽形态变化,标尺为1 cm;B为马铃薯贮藏过程中(0~60 d)顶芽细胞切片观察,D0,D15与D30标尺为50 μm,D45标尺为100 μm,D60标尺为200 μm;P表示周皮、E表示表皮、AM表示顶端分生组织、LP表示叶原基、PC表示原形成层.图1 马铃薯贮藏过程中顶芽形态与细胞特性
2.3 马铃薯块茎发芽转录组测序分析
为挖掘调控马铃薯块茎发芽的关键基因,本研究利用RNA-seq技术对马铃薯块茎发芽3个关键时期(D0:休眠期;D30:休眠解除期;D45:芽生长期)样本进行了分析.如表2所示,9个测序样品Q30(碱基测序正确率为99.99%)均在92.76%以上.各样品比对参考基因组的效率在79.67%~84.33%之间,说明所得到的有效数据质量和准确度较高,可以满足后期数据分析.
2.4 马铃薯块茎发芽过程中的差异表达基因筛选及KEGG富集分析
差异表达基因筛选结果如图3所示,从休眠期(D0)到休眠解除期(D30)总共有1 008个基因表达量发生显著变化,其中上调表达的基因为252个,下调表达的基因为756个.从休眠解除期(D30)到芽生长期(D45)共有4 576个基因表达量发生显著变化,其中上调表达的基因为2 800个,下调表达的基因基因为1 696个.在这些基因中,总共有355个基因持续地发生显著变化.
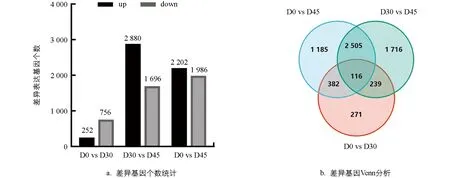
图3 马铃薯贮藏过程中表达差异基因筛选
KEGG富集分析发现(图4),这些差异表达基因主要富集在苯丙烷生物合成通路(Phenylpropanoid biosynthesis,ko00940)、苯丙氨酸代谢通路(Phenylalanine metabolism,ko00360)、类胡萝卜素生物合成通路(Carotenoid biosynthesis,ko00100)、DNA复制(DNA replication,ko03030)和糖代谢通路(Amino sugar and nucleotide sugar metabolism,ko00520)等.

q-value<0.05.图4 马铃薯贮藏过程中差异表达基因KEGG富集分析
2.5 马铃薯块茎发芽关键基因挖掘
植物激素ABA与GA是调控马铃薯采后发芽的关键因素[9-10].本研究结果发现,在马铃薯块茎发芽过程中ABA含量显著下调,而GA3含量显著上升(图2D,图2E).如图5所示,在马铃薯块茎发芽过程中,ABA生物合成酶基因NCED4,ZEP,ABA受体基因PYL8-like及ABA信号通路正调控基因ABI5,ABI5-like均显著下调表达;ABA代谢相关基因CYP707A2与ABA信号通路负调控基因PP2C却显著上调表达.与之相反,GA生物合成酶基因KS,KO2显著上调表达;GA信号通路抑制基因SCL1/3/8显著下调表达.有趣的是,本研究发现GA合成酶基因GA20ox1显著上调表达,而GA受体基因GID1B-like显著下调表达.
此外,本研究还系统挖掘了马铃薯采后发芽过程中显著差异表达的转录因子基因.结果如表3所示,在马铃薯休眠期(D0)到休眠解除期(D30),共有46个转录因子基因表达发生显著变化,其中AP2转录因子家族与MYB转录因子家族成员最多,分别有11个.在休眠解除期(D30)到芽生长期(D45),共有156个转录因子基因表达发生显著变化,其中MYB,bHLH和AP2转录因子家族成员最多,分别为38,26和22个.
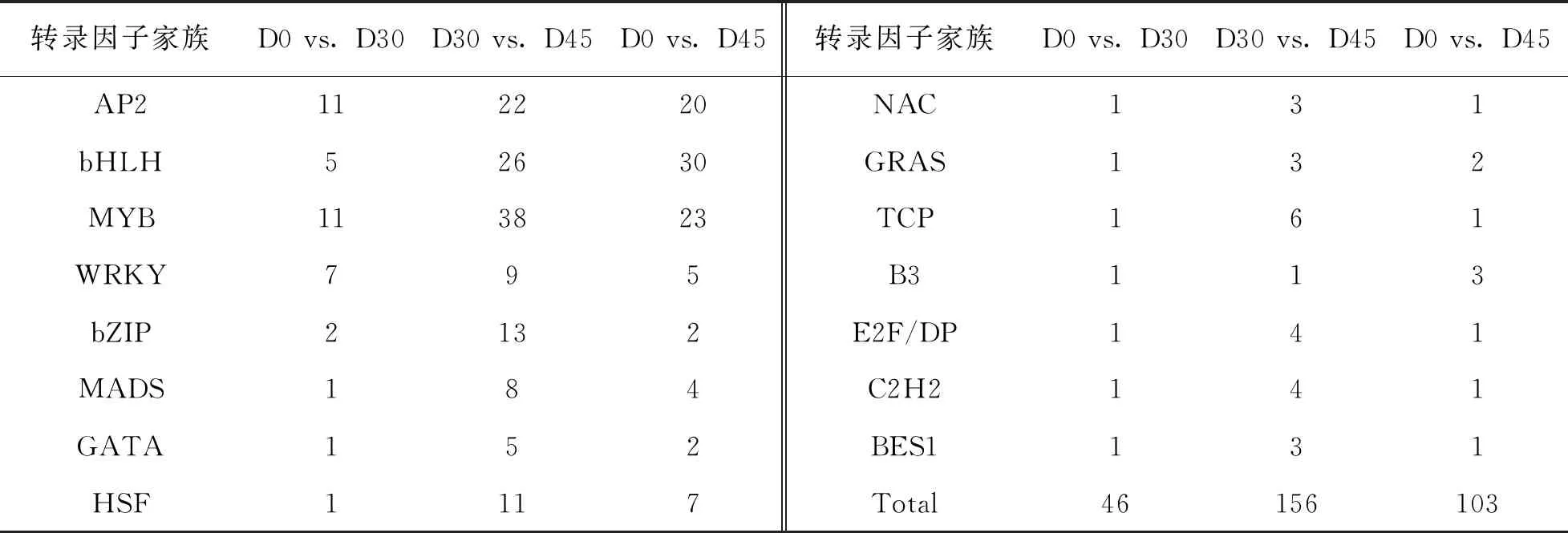
表3 马铃薯发芽过程中显著差异表达的转录因子基因
2.6 qRT-PCR验证转录组数据
为验证转录组数据的准确性,本研究随机挑选了8个显著差异表达基因,并利用qRT-PCR技术对其在马铃薯发芽样本中的表达量进行了检测.如图6所示,qRT-PCR结果与转录组数据的趋势完全一致,表明获得的转录组数据可靠性较高.

FPKM为转录组数据;相对表达量为qRT-PCR数据.图6 qRT-PCR验证转录组数据
3 讨论
为明确‘费乌瑞它’马铃薯采后发芽过程的关键变化时期,本研究对采后贮藏过程中的块茎顶芽表型及细胞学特性进行了分析.结果表明,‘费乌瑞它’马铃薯采后发芽可分为3个关键时期,分别为休眠期(0 d),休眠解除期(30 d)和芽生长期(45 d),该结果与Li等[14]的报道相一致.Li等发现,采后贮藏30~70 d,‘费乌瑞它’马铃薯的芽可长至2~10 mm.然而,Liu等[13]报道,‘费乌瑞它’马铃薯采后第8周为休眠解除期,第9周芽长才长至2 mm.引起这种差异的主要原因可能是Liu等[13]发芽试验采用的是试管薯(0.5 g/个),而本研究与Li等[14]均采用大田收获的马铃薯(约40 g/个).Ebrahim等[23]证明,马铃薯休眠期与块茎大小成反比,通常更小的薯采后发芽更慢.
在马铃薯采后发芽过程中,可溶性糖含量显著增加、蛋白与淀粉含量显著减少.本研究结果与张路[24]的结果一致.在贮藏过程中,马铃薯块茎内淀粉和还原性糖相互转化,为马铃薯块茎发芽提供能量.而巩慧玲等[25]研究发现,马铃薯块茎中蛋白含量在贮藏期间比较稳定,变化不大.同时,本研究发现在马铃薯块茎发芽过程中,内源植物激素ABA含量显著减少,GA3含量显著增加.结果与前人的报道一致[9-10].
RNA-Seq分析发现,‘费乌瑞它’马铃薯块茎从休眠期(D0)到休眠解除期(D30)共有1 008个基因表达发生显著变化.休眠解除期(D30)到芽生长期(D45)共有4 576个基因表达发生显著变化.其中,355个基因表达在贮藏过程中持续地发生显著变化.差异变化基因数量较之前Li等[14]的报道更多,Li等[14]发现,‘费乌瑞它’马铃薯块茎休眠期到芽生长期共有3925个基因表达发生显著变化.因此,本研究的数据进一步补充了马铃薯块茎发芽相关基因.
马铃薯块茎发芽过程显著变化基因被富集到苯丙烷生物合成通路(ko00940)、苯丙氨酸代谢通路(ko00360)、类胡萝卜素生物合成通路(ko00100)、DNA复制(ko03030)和糖代谢通路(ko00520)等.研究结果表明,苯丙烷生物合成通路、苯丙氨酸代谢、类胡萝卜素生物合成相关基因可能参与马铃薯块茎发芽调控,这与前人的报道一致.例如,Conrad等[26]发现杏树的芽休眠解除可能与苯丙氨酸代谢高度相关.Deng等[27]报道,马铃薯的Snakin-2(SN2)基因通过负调控木质素生物合成,显著抑制块茎采后发芽.
本研究还发现从马铃薯休眠期(D0)到休眠解除期(D30),共有46个转录因子基因表达发生显著变化;从休眠解除期(D30)到芽生长期(D45)共有156个转录因子基因表达发生显著变化.这些转录因子基因主要属于AP2转录因子家族、MYB转录因子家族及bHLH转录因子家族.同时,ABA与GA生物合成、代谢及信号转导相关基因表达也发现了显著变化,说明AP2,MYB,bHLH转录因子家族基因,ABA与GA合成、代谢、信号转导基因可能在调控马铃薯采后发芽过程中发挥了重要作用,与前人报道一致.例如,Wang等[28]发现,大豆的一个AP2转录因子基因GmSGR通过减少ABA的敏感性显著促进种子发芽.Himi等[29]发现,大麦的一个MYB转录因子基因Ant28通过调节花青苷合成显著抑制种子萌发.Liu等[30]报道,拟南芥中过表达ABA代谢酶基因CYP707A导致ABA含量显著减少,种子发芽显著提前.
4 结论
马铃薯‘费乌瑞它’块茎贮藏30 d时芽休眠解除;贮藏45 d时芽开始生长.在贮藏过程中,可溶性糖含量显著增加、淀粉和蛋白含量显著减少.从芽休眠到休眠解除,休眠解除到芽生长分别有1 008个、4 576个基因表达发生显著变化,其中355个基因持续地发生显著变化.在这些差异表达基因中,包括156个转录因子基因,大多属于AP2,MYB,bHLH转录因子家族.这些差异表达基因被富集到苯丙烷生物合成通路、苯丙氨酸代谢通路、类胡萝卜素生物合成通路、DNA复制和糖代谢通路.

