双氢青蒿素对AngⅡ诱导的心肌成纤维细胞及NLRP3炎性小体活性的影响
单铁强,栗志英,张素华,蔡安盛,姚晓华,杜相珠,行红燕,郭永泽,马景红
心脏在多种有害因素的长期或持续作用下,心肌细胞受损,而位于心肌细胞之间的成纤维细胞被过度活化,细胞增殖分裂能力及分泌活性均增强,加上在其他生物学因子的共同作用下,胶原等基质成分的分泌量大于降解量,造成其大量沉积且质地变硬,导致心肌发生纤维化病变[1-2]。此种病变使心肌细胞血氧缺乏,收缩能力下降,心肌传导系统功能异常,病人容易出现心律失常、心功能衰竭甚至猝死等严重病情而危及生命[3-4]。因此,探寻有效抑制成纤维细胞过度活化的措施为治疗心肌纤维化的重点。双氢青蒿素(DHA)源自于青蒿素,除作为优选的抗疟药物外,还具有抗病原微生物、降低炎症反应、抑制肿瘤及抗纤维化等药效[5-6]。血管紧张素Ⅱ(AngⅡ)作用于机体多种组织内的间质细胞,诱导其异常增殖、分裂及分泌过多的胶原等基质成分,促进组织发生纤维化病变[7-8]。本研究以新生鼠心室肌的成纤维细胞为研究对象,在体外采用AngⅡ诱导并制备纤维化细胞模型,经DHA干预后分析细胞增殖、转分化及激活NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎性小体的作用,为拮抗心肌纤维化的新药研发提供新策略。
1 材料与方法
1.1 材料
1.1.1 实验动物
新出生2 d的SD大鼠,由河北医科大学组胚教研室赠送。
1.1.2 药物与试剂
DHA购自陕西信康生物公司;AngⅡ、酶联免疫分析胶原蛋白含量的试剂盒由合肥莱尔生物有限公司提供;α-平滑肌肌动蛋白(α-SMA)、NLRP3、半胱氨酸蛋白酶-1(Caspase-1)和白细胞介素-1β(IL-1β)第一抗体均由Abcam提供。
1.2 方法
1.2.1 消化组织、分离细胞
取5只新出生2 d的SD大鼠,充分麻醉,将其整只喷乙醇进行消毒后,置于超净实验台上,剖开胸部露出心脏,剪下适当体积的心室肌组织块,洗净组织表面的血液和黏液,浸入盛有D-Hank′s的培养皿中,剪为细小颗粒后加入胰酶进行温浴消化40 min,滤网除去残渣,采用4 ℃、直径12 cm的离心机,以600 r/min速率离心10 min,离心后的细胞加入适量孵育液置于细胞培养箱中,根据成纤维细胞与其他细胞贴壁时间差异,将其纯化。少许细胞用作类型鉴定,其余用于后续实验。
1.2.2 细胞增殖实验
细胞孵育3 d时,消化、悬浮并移置96孔培养板中,分为正常组、DHA对照组、AngⅡ组、DHA处理组,每组6孔。正常组:细胞孵育液中孵育;DHA对照组:含有DHA的细胞孵育液中孵育;AngⅡ组:含有AngⅡ的细胞孵育液中孵育;DHA处理组:含有DHA和AngⅡ的细胞孵育中孵育。孵育液中DHA、AngⅡ的浓度分别为100 ng/mL、10-7mol/L。在细胞培养箱中孵育48 h后,向每孔里加入适量的噻唑蓝溶液,反应4 h后弃掉每孔的液体,向每孔中加入等量的二甲基亚砜溶液,于暗室中孵育15 min,上机记录每孔的吸光度值,计算出每组平均吸光度值。
1.2.3 检测孵育液中胶原含量
4组成纤维细胞经48 h的孵育,通过酶联免疫试剂盒检测出4组孵育液中的Ⅰ型、Ⅲ型胶原蛋白含量。
1.2.4 蛋白免疫印迹(Western Blot)实验
将各组细胞置于冰块上进行裂解,裂解液采用4 ℃、直径20 cm的离心机,设置速度14 000 r/min,时间30 min,检测上清液中的蛋白含量。40 μg蛋白中加入10 μL上样缓冲液,沸水浴中变性,冷却后加入凝胶孔中,依次通过电泳、膜转移、封闭,清洗后浸入α-SMA(1∶800)、NLRP3(1∶1 000)、Caspase-1(1∶1 000)、IL-1β(1∶1 200)以及β-actin(1∶1 500)一抗液中4 ℃过夜,清洗后浸入第二抗体液(1∶1 500)中2 h,通过成像仪获取目标蛋白的灰色条带,分析并比较其灰度均值。
1.3 统计学处理

2 结 果
2.1 成纤维细胞的培养和鉴定
新消化下来的细胞呈球状,孵育2 d后,细胞贴壁铺展,体积增大,单个细胞为有突起的不规则状,详见图1A;爬片的细胞依次经苏木精和伊红染色后,蓝色的圆核位于细胞中央,可见核仁,核周围为浅色的胞质,详见图1B;细胞与波形蛋白免疫染色后为阳性,详见图1C。

图1 成纤维细胞生长状态和类型鉴定(×400)
2.2 心肌成纤维细胞增殖情况
4组心肌成纤维细胞经过48 h的孵育,通过比较每组细胞的吸光度值来衡量其增殖情况。正常组和DHA对照组吸光度值比较差异无统计学意义(P>0.05),AngⅡ组吸光度值高于正常组(P<0.05),DHA处理组吸光度值低于AngⅡ组(P<0.05)。详见表1。
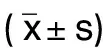
表1 4组吸光度值、Ⅰ型胶原含量、Ⅲ型胶原含量比较
2.3 细胞分泌胶原蛋白含量比较
正常组和DHA对照组Ⅰ型、Ⅲ型胶原蛋白含量比较差异均无统计学意义(P>0.05),AngⅡ组Ⅰ型、Ⅲ型胶原蛋白含量均高于正常组(P<0.05),DHA处理组Ⅰ型、Ⅲ型胶原蛋白含量均低于AngⅡ组(P<0.05)。详见表1。
2.4 细胞表型分子α-SMA表达比较
正常组和DHA对照组细胞表型分子α-SMA表达比较差异无统计学意义(P>0.05);与正常组比较,AngⅡ组细胞表型分子α-SMA表达升高(P<0.01);与AngⅡ组比较,DHA处理组细胞表型分子α-SMA表达降低(P<0.01)。详见图2、表2。
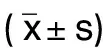
表2 4组细胞α-SMA、NLRP3、Caspase-1及IL-1β相对表达比较
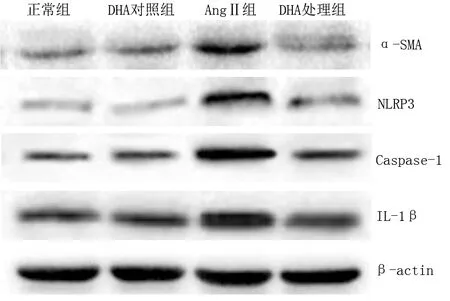
图2 4组细胞α-SMA、NLRP3、Caspase-1及IL-1β表达条带图
2.5 细胞内NLRP3、Caspase-1和IL-1β表达比较
正常组和DHA对照组细胞内NLRP3、Caspase-1和IL-1β表达比较差异均无统计学意义(P>0.05);与正常组比较,AngⅡ组细胞内NLRP3、Caspase-1和IL-1β升高(P<0.01);与AngⅡ组比较,DHA处理组细胞内NLRP3、Caspase-1和IL-1β降低(P<0.01)。详见图2、表2。
3 讨 论
心肌纤维化为在多种有害因素(如血氧不足、炎症、代谢紊乱等)的刺激下,心肌间质中的主要细胞成纤维细胞的活性异常增强,出现细胞增殖以及合成和释放Ⅰ、Ⅲ型胶原等基质成分过度沉积所致。通常表现为心壁增厚和僵硬程度增加,为冠心病、心律失常、心肌重构以及心功能不全等多种心脏疾病进展的共同病理基础[9-10]。心肌组织发生纤维化的过程与多种细胞因子[如促纤维化因子转化生长因子-β(TGF-β)、AngⅡ]以及炎性因子[肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)]等的参与和调节关系密切[11-12]。AngⅡ作为心肌组织局部的一种调节因子对心肌组织发生纤维化具有助推作用,其自身或与其他细胞因子结合刺激成纤维细胞分裂增殖、转分化、合成并释放胶原等基质成分,进而促进组织纤维化病变的进程[13-15]。因此,采用AngⅡ制备纤维化细胞模型已被普遍应用。本实验利用AngⅡ体外刺激后,细胞数目增加,表型分子α-SMA表达升高,释放到孵育液中Ⅰ、Ⅲ型胶原蛋白的含量增多,这充分表明AngⅡ已经成功地诱导成纤维细胞为纤维化细胞。
NLRP3炎症小体是一种能够对多种因素刺激(包括AngⅡ)作出反应的关键炎性介质,组织中此小体表达增高能够加速所在器官发生纤维化病变[16-17]。相关研究结果表明,博来霉素能诱导肺泡上皮细胞向间充质细胞转分化,细胞内NLRP3小体各成分表达升高并激活其下游的炎性因子IL-1β和白细胞介素-18(IL-18),加速了肺脏的纤维化;当NLRP3小体被抑制或敲除后,减弱二氧化硅诱导的上皮间充质转分化和炎性因子的表达[18]。四氯化碳诱导大鼠肝脏发生纤维化后,检测纤维化组织中NLRP3小体各成分表达升高并激活其下游的炎性因子IL-1β;采用香叶木素干预后,NLRP3小体各成分以及IL-1β表达降低,肝纤维化程度也得到了明显改善[19]。赵雅欣等[20]研究表明,AngⅡ能诱导乳鼠心肌组织中的成纤维细胞增殖,上调细胞内的NLRP3、Ⅰ型胶原、Ⅲ型胶原的蛋白和mRNA表达;用RNA干扰(RNAi)沉默NLRP3后,细胞内的NLRP3、Ⅰ型胶原、Ⅲ型胶原的蛋白和mRNA表达下调。单铁英等[21]已证实AngⅡ能提高子宫内膜间质细胞增殖能力,促进其分泌Ⅰ型胶原和纤黏连蛋白的含量,激活细胞内NLRP3炎症小体。本研究结果显示,AngⅡ能刺激成纤维细胞内NLRP3、Caspase-1及IL-1β的含量升高,这说明AngⅡ能激活该细胞内NLRP3炎性小体的活性。
DHA是用青蒿素首次合成的还原衍生物,其医治疟疾的药效优于青蒿素。除此之外,DHA还具有降低炎症反应、多途径抑制肿瘤及减轻组织纤维化程度等作用[22-23]。实验研究显示,结扎大鼠胆管制备肝纤维化的过程中,腹腔注射DHA能有效降低肝组织中α-SMA及Ⅰ型前胶原蛋白的含量,抑制肝纤维化并提高其功能指标[24]。通过博来霉素诱导大鼠肺组织发生纤维化病变时,干预后发现早期大鼠血清中的炎性因子IL-1β、白细胞介素-6(IL-6)及TNF-α水平降低,后期肺组织中羟脯氨酸含量降低,胶原沉积面积缩小,提示DHA能减轻早期肺泡炎症和后期肺纤维化[25]。研究证实DHA通过抑制肾组织成纤维细胞数量及其转分化、Ⅰ型胶原、Ⅲ型胶原和纤连蛋白的含量来缓解输尿管梗阻导致的肾组织纤维化[26]。体内、体外实验均表明,青蒿素不仅能拮抗AngⅡ刺激人肾皮质近曲小管上皮细(HK-2)内NLRP3炎性小体活性,而且也能通过降低大鼠行次全切肾组织中NLRP3炎性小体各成分的含量来阻止其组织内的炎症和纤维化改变[27-28]。
综上所述,AngⅡ能刺激成纤维细胞的增殖、表型转化,分泌Ⅰ型胶原、Ⅲ型胶原蛋白以及增加细胞内的NLRP3、Caspase-1和IL-1β的表达;DHA能够明显拮抗AngⅡ刺激成纤维细胞的上述活性。说明DHA能有效通过降低细胞内NLRP3炎性小体的活性拮抗AngⅡ诱导成纤维细胞的纤维化改变。

