不同干燥方式对秋茄功能成分与生物活性的影响初探
夏其乐, 郝蓓琼,2, 韩超, 曹艳, 杨祖泉, 刘晨星, 陈秋夏
(1.浙江省农业科学院 食品科学研究所 农业农村部果品产后处理重点实验室 浙江省果蔬保鲜与加工技术研究重点实验室, 浙江 杭州 310021;2.浙江农林大学 食品与健康学院, 浙江 杭州 311300; 3.浙江树人学院 生物与环境工程学院, 浙江 杭州 310015;4.浙江省农业科学院 亚热带作物研究所, 浙江 温州 325005)
新鲜的农产品和药材含水量比较高, 难以长期存放。干燥处理可以有效减少农产品和药材的水分含量、降低水分活度、控制原料质量, 避免受潮引发的虫蛀和发霉等劣变[1]。自古以来, 干燥是食药材的重要加工环节, 唐代孙思邈著 《千金翼方》中就有记载: “夫药采取, 不以阴干曝干, 虽有药名, 终无药实。[2]” 但这个过程同时会破坏原材料的功能成分结构和生物活性, 所以针对不同的原材料探究出合适的干燥方式, 在延长储藏期的同时最大限度地保持其活性成为关键的问题。
红树林系统在防风固堤、促淤造陆、抵御自然灾害、净化海域环境、为海洋动物提供栖息地、维持生物多样性等方面发挥着重要作用[3]。秋茄(Kandeliacandel) 为红树科 (Rhizophoraceae) 秋茄属 (kandelia), 是一种生长于滨海滩涂的海洋植物, 主要分布在福建、浙江和台湾等我国南方地区以及东南亚国家[4]。《现代本草纲目》 中记载秋茄的各部位均可用作药材, 它的药效功能来源于其中所含有的黄酮、萜类、酚类、多糖等内源成分,使得秋茄在抗氧化、抗肿瘤、降血糖和抑菌等方面均表现出显著的药理活性[4-6]。
秋茄作为一种富含活性物质的天然海洋植物资源, 具有巨大的发展潜力。目前, 关于秋茄加工处理的相关研究不多, 不同干燥方式对秋茄功能成分和生物活性的影响未见相关报道。现阶段对秋茄干燥工艺的相关研究具有实际意义, 为进一步提取、分离新的天然活性成分提供了可能。本研究比较了经不同干燥方式后的秋茄的功能成分及生物活性变化, 筛选出最适合工业化生产的秋茄干燥工艺, 为生产加工过程中的秋茄质量控制提供了理论依据和技术参考。
1 材料与方法
1.1 主要的仪器与试剂
ME204E 电子分析天平 (瑞士Mettler Toledo 仪器 公 司); Five Easy plus pH 计 (瑞 士 Mettler Toledo 仪器公司); UV-1800 紫外可见分光光度计(日本岛津公司); SCIENTZ-10N 冷冻干燥机 (宁波新芝公司); XH-C 旋涡混合器 (金坛市白塔新宝仪器厂); Tecan Spark 多功能酶标仪 (瑞士Tecan 公司); SPX-250B-Z 生化培养箱 (上海博讯公司)。
葡萄糖标准品 (1 mg·mL-1)、齐墩果酸 (分析级)、没食子酸 (国药集团化学试剂有限公司);2, 2-联苯基-1-苦基肼基 (DPPH, 96%)、二甲基亚砜 (DMSO, 99.7%)、2-2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸-二胺盐 (ABTS, 98%, 上海麦克林有限公司);α-葡萄糖苷酶、阿卡波糖 (≥95%,上海士锋生物科技有限公司); 芦丁标准品(≥97%)、对 硝 基 苯 基-β-D-吡 喃 半 乳 糖 苷(PNPG, 生物技术级, 99%, 上海源叶生物科技有限 公 司); 尼 罗 蓝 (Dye content ≥75%, 美 国Sigma-Aldrich 公司)。
1.2 方法
1.2.1 秋茄来源、处理以及提取液制备
秋茄样品采集于浙江省龙港市鳌江口, 采集日期为2021 年5 月31 日。秋茄样品经厦门大学王文卿教授鉴定为红树科秋茄胎苗。将收集到的秋茄样品充分洗净、均匀切断后分成3 组, 每组500 g,然后进行以下干燥处理:
阳光自然晒干 (简称 “晒干” ): 将秋茄样品单层均匀平铺于不锈钢托盘上, 放置于通风良好、干燥、阳光直射的室外进行自然晒干至水分含量约10%。
热风恒温烘干 (简称 “烘干” ): 将秋茄样品单层均匀平铺于不锈钢托盘上, 在60 ℃的烘箱恒温烘干至水分含量约10%。
真空冷冻干燥 (简称 “冻干” ): 将秋茄样品先置于-80 ℃冰箱预冷冻2 h, 均匀平铺在冻干托盘上在-50 ℃, 真空度为50 Pa 同样冻干至水分含量约10%。
参考翁梦婷[5]的方法对干燥后的样品进行提取, 将不同干燥处理后的秋茄打粉过0.35 mm (50目) 筛, 放入离心瓶中按1 ∶10 的质量体积比用蒸馏水稀释, 加水后在旋涡混合器上混合。接着在40 ℃水浴超声提取30 min, 放入离心机5 000 r·min-1离心15 min, 过滤取滤液, 并将滤渣重复提取两次, 合并滤液后得到秋茄提取液。
1.2.2 总黄酮含量测定
秋茄中总黄酮含量测定参考包强等[7]的方法。经测定得到标曲方程:Y=0.013 2X-0.009 (图1中a), 标 准 曲 线 的 线 性 梯 度 为0、12、24、36、48、60、72 mg·L-1。

图1 不同化学物质的吸光值标准曲线
将秋茄提取液稀释5 倍, 取2.5 mL 于25 mL刻度试管中, 分别加1.0 mL 5% NaNO2溶液, 摇匀放置6 min, 加1 mL 10% Al (NO3)3溶液, 摇匀放置6 min, 加2.5 mL 4% NaOH 溶液, 用蒸馏水将其定容至25 mL, 振荡摇匀后, 室温静置15 min, 以空试管调零, 在512 nm 下测吸光值D。对照已建立的标准曲线得到总黄酮含量。
1.2.3 总多糖含量的测定
秋茄中总多糖含量测定参考马丽等[8]的方法。经测定得到标准曲线方程:Y=0.059 4X-0.001 5(图1 中b), 标准曲线的线性梯度为0、2.5、5.0、7.5、10.0、12.5 mg·L-1。将秋茄提取液稀释40倍, 取2.0 mL 于25 mL 具塞试管中, 再加入1.0 mL 5%苯酚和5.0 mL 浓硫酸, 摇匀后置于沸水中水浴20 min, 取出后水浴冷却10 min, 在490 nm处测定吸光值D。对照已建立的标准曲线得到总多糖含量。
1.2.4 总三萜含量的测定
秋茄中三萜含量测定参考张家敏等[9]的方法。经测定得到标准曲线方程:Y=0.045 9X-0.020 6(图1 中c), 标准曲线的线性梯度为0、4、8、13、17、21 mg·L-1。将秋茄提取液稀释2 倍, 取2.5 mL 于25 mL 比色管中, 氮吹溶剂至吹干, 加入0.5 mL 50 g·L-1的香草醛-冰乙酸和1.0 mL 高氯酸, 混合后60 ℃水浴20 min 冰水冷却15 min 后加入3.0 mL 冰乙酸, 室温静置反应10 min, 最后于547 nm 处测吸光值。对照已建立的标准曲线得到总三萜含量。
1.2.5 总酚含量的测定
秋茄中三萜含量测定参考李培源等[10]的方法并做适当修改。经测定得到标准曲线方程:Y=0.096 5X-0.005 9 (图1 中d), 标准曲线的线性梯度为0、0.8、2.4、4.0、5.6、7.2 mg·L-1。将秋茄水提物提取液稀释5 倍, 取2.5 mL 于25 mL 容量瓶中, 加入2.5 mL Folin.Ciocalten 显色剂, 摇匀, 再加入5 mL 5% Na2CO3溶液, 加水定容, 在25 ℃下避光放置反应1 h, 在750 nm 处测定其吸光值。总酚得率为总酚含量乘以提取液体积乘以稀释倍数除以1 000 再乘以100。
1.2.6 ABTS 自由基清除率测定
参考张培月等[11]的方法测定ABTS 自由基清除能力。加入秋茄提取液0.1 mL 和4.0 mL ABTS自由基反应液, 避光静置6 min, 在734 nm 处测定吸光值为A; 另设无水乙醇作为空白对照, 在734 nm 处吸光值为A0。清除率计算公式:
1.2.7 DPPH 自由基清除率测定
参考Yap 等[12]的方法测定DPPH 自由基清除能力。按表1 中数据加样, 混匀, 暗处静置30 min。以60%乙醇溶液调零, 在517 nm 处测定吸光值。清除率计算公式:

表1 DPPH 自由基清除率测定的各试管配制
1.2.8α-葡萄糖苷酶抑制率测定
参照李井雷等[13]的方法检测了秋茄提取物对α-葡萄糖苷酶的抑制活性。选取阿卡波糖为阳性对照。在405 nm 处测量吸光值,α-葡萄糖苷酶的抑制率计算公式:
式中:A对照1是PNPG 溶液和样品的混合物的吸光度;A对照2是PNPG 和酶的混合物的吸光度。
1.3 数据处理
各处理组的各指标检测重复至少3 次, 剔除明显异常的数据。采用IBM SPSS Statistics 26 软件对测试数据进行均值的差异显著性分析和皮尔逊线性相关分析 (Pearson correlation coefficient), 同组数据以平均值±标准偏差表示。在表示比较各组间均值的统计学差异时,P<0.05 被认为在统计学上有显著性。皮尔逊线性相关的显著性结果以*表示P<0.05,**表示P<0.01。
2 结果与分析
2.1 不同干燥方式对秋茄功能成分含量的影响
不同处理组的总黄酮、总多糖、总三萜和以及总酚含量测定的结果如表2 所示。在3 个不同的处理组中, 冻干处理秋茄的总黄酮、总酚和总三萜含量最高, 其总多糖含量介于另外两组之间; 晒干处理秋茄的总多糖含量显著高于其他两组 (P<0.05), 其总三萜含量与冻干处理结果接近且无显著性差异 (P>0.05); 烘干处理的秋茄4 种物质含量均显著 (P<0.05) 低于另外两个处理组。吴励萍等[14]
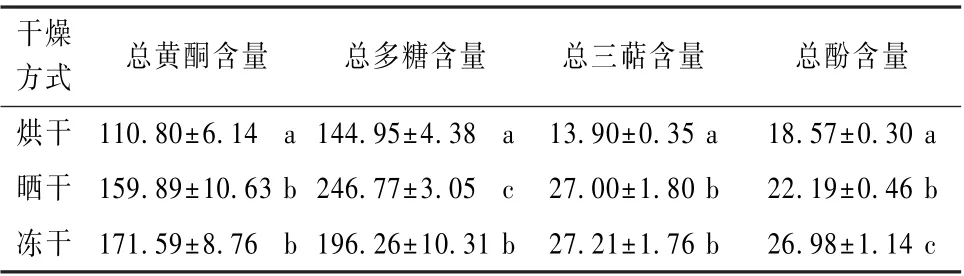
表2 干燥后秋茄总黄酮、总多糖、总三萜以及总酚的含量 (n=3) 单位: mg·g-1
指出, 冻干处理之所以在保留原料功能性成分方面优势不明显, 其原因可能是由于分解活性成分的氧化酶活性在低温状态下受到一定程度的抑制, 但这个过程是可逆的, 待冻干结束后一旦回温, 酶活性得以恢复, 会继续分解原料中的活性成分, 从而造成了含量的损失。吴励萍等[14]采用真空冷冻干燥处理后的枸杞子的总多糖含量远低于经微波干燥、红外干燥、烘干处理过的总多糖含量,大约有20%的损失。同样地, 王红等[15]评价了6种不同干燥方法 (阴干、晒干、烘干、真空冷冻干燥、红外干燥、微波干燥) 对芡实品质的影响,结果发现, 真空冷冻干燥后, 芡实中总多糖、总酚和总黄酮类物质含量分别下降了1.43、2.29、1.23 mg·g-1。廖素溪[16]通过4 种不同的方式 (热风105 ℃干燥、蒸30 min 后80 ℃干燥、远红外105 ℃干燥和微波干燥) 对不同产地的铁皮石斛进行干燥, 通过对比发现, 低温干燥能更完整保留药材的功能活性, 这为调整秋茄的干燥温度提供了一定的参考。
2.2 不同干燥方式对秋茄的抗氧化活性以及降血糖能力的影响
不同干燥处理组的秋茄体外抗氧化和降血糖活性如表3 所示。晒干处理的秋茄ABTS 自由基清除率以及DPPH 自由基清除率最高且显著高于另外两组(P<0.05),α-葡萄糖苷酶抑制率显著低于另外两组(P<0.05); 冻干处理的秋茄α-葡萄糖苷酶抑制率最高, 而DPPH 自由基清除率最低; 烘干处理的秋茄ABTS 自由基清除率显著低于其他两组 (P<0.05)。在本研究中, ABTS 与DPPH 自由基清除率结果以及体外α-葡萄糖苷酶抑制率的结果不完全一致。陈青等[17]研究了树莓在干燥后体外的抗氧化活性, 发现ABTS 和DPPH 自由基清除能力的结果具有一致性。同时也有文章与本研究结果相似, 郑善元等[18]

表3 不同干燥方式处理后秋茄的生物活性(n=3)单位:%
报道了不同单丛茶水提物的ABTS 与DPPH检测结果不一致。迟晓君等[19]研究了老山芹在干燥后的抗氧化性变化, 发现微波干燥老山芹的自由基清除能力最强, 热风干燥组的最差, 真空冷冻干燥效果一般。程毛等[20]提取了不同干燥处理后柚子皮中的多糖进行分析, 发现真空冷冻干燥最大程度保留了秋茄的体外降血糖活性, 这与本研究结论一致。农产品和中药材体系, 仅仅通过化学评价或生物评价均无法全面评价整体质量与临床功效[21]。为实现药材在加工过程中更好的整体质量控制, 通常采用“质量标志物-生物活性” 关联分析[22]。
2.3 皮尔逊线性相关分析
将不同干燥处理的秋茄的功能成分含量与生物活性结果结合起来进行皮尔逊线性相关分析, 从而挖掘秋茄中各种功能成分与生物活性潜在的联系,同时为后续秋茄高值化利用的研究提供基础, 分析结果如表4 所示。相关性分析结果发现, 秋茄的ABTS 自由基清除率与其总黄酮、总多糖、总三萜含量呈极显著相关 (P<0.01) 且相关系数均大于0.86, 说明秋茄中的多糖类、三萜类以及黄酮类物质贡献了较强的抗氧化活性。DPPH 自由基清除率、α-葡萄糖苷酶抑制率与以上几种功能物质的含量无显著性相关 (P>0.05)。DPPH 清除率与α-葡萄糖苷酶抑制结果呈极显著性相关 (P<0.01), 与ABTS 结果无显著性相关 (P>0.05)。

表4 各检测指标之间的皮尔逊线性相关性分析
秋茄中提取的酚酸被认为具有很强的抗氧化活性, 其抗氧化活性与总酚含量呈显著性相关 (P<0.05)[22-24]。此外, 秋茄中的黄酮、三萜、多糖等功能成分也具有一定的抗氧化以及降血糖的活性[4,22-26]。唐岚等[25]通过HPD722 树脂纯化分离秋茄后得到了总黄酮占比77.48%的提取物, 50 μg·mL-1黄酮溶液的DPPH 自由基清除率就可以达到78.57%。秋茄中复杂的成分可能是其粗提物的皮尔逊相关性分析结果无显著性的主要原因。此外,属于同一种大类的不同细分物质的生物活性也各不相同。翁梦婷[5]研究同样发现, 秋茄的抗氧化活性与总酚含量高度显著相关 (P<0.01), 但是同属于酚酸的游离酚酸、可溶脂酚酸以及可溶糖苷化酚酸等之间的抗氧化活性存在显著性差异 (P<0.05)。这可能是导致本研究中抗氧化的结果与总酚含量未呈显著性相关 (P>0.05) 的主要原因。
3 结论与讨论
阳光自然晒干能最大限度地保留秋茄中的功能成分与生物活性, 可作为秋茄加工的最佳处理方式。吴秀彩等[27]归纳总结了秋茄中功能已被明确的化学成分, 包括12 种黄酮化合物、24 种萜类化合物、12 个酚酸化合物以及7 个糖苷化合物等。除抗氧化和降血糖功能外, 秋茄已被发现还有其他的药用价值。符健[28]研究发现, 秋茄粗提物对大鼠的胃溃疡症状具有显著的改善作用。秋茄的粗取物同时被发现具有广谱抑菌作用, 分离出3 个抑菌作用强于粗提物的单体化合物HS-2 (京尼平甙酸)、HS-4 (京尼平甙酸的衍生物, 名称为10-(4′-羟 基-3′, 5′-二 甲 氧 基 苯 甲 酰 基) -京 尼 平 甙酸) 和HS-5 (未知单体化合物)。王小蒙[29]研究发现, 秋茄提取物对胰岛素抵抗大鼠和2 型糖尿病大鼠的各相关指标有明显的改善作用, 可以提高胰岛素敏感性, 保护胰岛细胞, 减缓肝细胞内脂肪的堆积。由此可见, 秋茄中含有的功能物质种类多、功能广、活性强, 是一种极具发展潜力的植物原料, 干燥方式对其他功能成分及生物活性的影响还有待研究。
采收方式、切制方式、干燥方式、贮藏方式等诸多加工因素都会对其质量造成不同程度的影响,而且这些因素对药材中细分功能成分的影响是不规律的[30-33]。本研究探索了干燥对秋茄功能成分及生物活性的影响, 为其加工过程中的质量控制提供了参考。

