神经重症监护单元内生发基质-脑室内出血早产儿预后的影响因素分析
熊伟,朱悦欣,蔡姣,朱恒香,左茜茜,杨阳,赵珣,陈晓霞,陈茂琼
早产儿颅内出血是导致早产儿神经系统后遗症的主要原因[1]。胎龄(gestational age, GA)越小、出生体质量越低,颅内出血发生率越高[2]。生发基质(germinal matrix, GM)位于脑室周围室管膜下区,是神经前体细胞的发源地,于胚胎15周时迅速发育,于25周达最大容积,之后逐渐退化,至36周完成[3-4],因此早产儿颅内出血特指生发基质-脑室内出血(germinal matrix-intraventricular haemorrhage, GMH-IVH),其发生及严重程度与GA及出生质量呈负相关。据统计GA<30周的早产儿GMH-IVH的发生率为25%,其中重度(Ⅲ~Ⅳ级)脑室内出血(intraventricular hemorrhage, IVH)的发生率为10%[5]。早产儿颅内出血后经过直接和间接作用损伤大脑皮质、髓质及脑脊液循环系统,临床可导致脑瘫、认知功能障碍、癫痫、行为异常及出血后脑积水等,给社会及家庭带来严重负担。
新生儿神经重症监护单元(neonatal neurological intensive care unit, NNICU)以脑为中心,整合管理或护理过程,目的是尽可能减少患儿的原发性或继发性脑损伤,促进患儿最大化脑修复的过程。同时集监护、治疗、护理,以及产前、产时及出院后管理为一体系统管理早产儿,为早产儿颅内出血发生及预后的影响因素提供数据。本研究以出生后24 h内纳入NNICU管理的早产儿作为研究对象,探索影响早产儿颅内出血预后的相关因素,便于临床防治,降低早产儿神经系统后遗症的发生或减轻其严重程度。
1 对象与方法
1.1 研究对象
选取2020年1月至2021年12月贵州医科大学附属医院新生儿科收治并诊断为颅内出血的早产儿为研究对象。取得患儿家属知情同意并通过贵州医科大学附属医院伦理委员会批准(2021伦审第〔709〕)。纳入标准:(1)日龄<24 h,入住新生儿重症监护室(neonatal intensive care unite, NICU)后纳入NNICU管理;(2)出院后随访至纠正年龄1岁,资料完整。排除标准:(1)GA ≥37周新生儿;(2)外院出生后转入本院NICU,未纳入NNICU管理的新生儿;(3)住院期间放弃治疗、死亡的新生儿;(4)出院后未参与随访或随访时间不足纠正年龄1岁,或资料不全的新生儿;(5)诊断为先天畸形或遗传代谢疾病的新生儿。根据随访至纠正年龄1岁时的0~1岁神经运动20项检查及影像学结果判断预后。
1.2 方法
1.2.1 头颅超声检查方法、诊断及分度
头颅超声为床旁操作,无需搬动患儿,初次检查时间为患儿出生后3 d内,之后每周1次,直至出院,由经新生儿头颅超声专科培训的超声科主治及以上职称的医师完成;使用PHILIPS M2540A超声仪,探头频率为5 MHz~7 MHz;患儿取平卧位,于安静状态下经前囟取冠状和矢状切面进行超声扫描,经过颞囟监测脑血流频谱。住院期间任一次颅脑超声检查提示颅内出血则诊断为颅内出血,严重程度则以最严重表现为准。Volpe等[6]根据头颅超声检查结果对早产儿颅内出血进行分级:Ⅰ级为单纯室管膜下出血;Ⅱ级为GM出血并侧脑室内出血,不伴侧脑室扩大;Ⅲ级为IVH,伴脑室扩大,出血量占脑室容积的50 %以上;Ⅳ级为IVH伴脑室周围髓静脉梗死。Ⅰ、Ⅱ级为轻度颅内出血,Ⅲ、Ⅳ级为严重颅内出血。
1.2.2 振幅整合脑电图(amplitude integrated electroencephalogram, aEEG)监测及判断标准
患儿出生后3 d内完成第1次aEEG监测,之后每周1次,直至纠正至GA 40周,每次持续4~6 h,若有低电压、暴发抑制及惊厥发作出现,则增加监测频率。采用尼高利aEEG仪,由经过aEEG专科培训的新生儿医生和护士完成,监测由护士操作,医生判读检查结果;患儿取平卧位,避免使用镇静剂及止惊剂。按照国际标准安置6个电极,电极位置分别为左额极(Fp1)、右额极(Fp2)、左颞中(T3)、右颞中(T4)、左枕(O1)及右枕(O2),电阻范围<10 kΩ;检查内容为脑电背景活动、睡眠—觉醒周期、是否有惊厥发作。判断标准[7]:正常为(1)脑电活动背景连续、正常电压;(2)存在成熟睡眠—觉醒周期,且睡眠—觉醒时间为20~30 min;(3)未见惊厥波;若(1)、(2)、(3)项正常,则脑功能正常,(1)、(3)项正常,纠正GA 37周以前未见睡眠—觉醒周期或睡眠—觉醒周期时间不足20~30 min。异常为(1)或(3)任一项异常,或纠正至GA 40周后仍未见睡眠—觉醒周期。
1.2.3 影像学检查
住院期间诊断为颅内出血的早产儿,病情稳定,可搬动时完善其头颅CT或头颅MRI检查;患儿处于安静状态,由影像科具有相关资质医生操作,并出具影像学诊断报告,初次检查结果异常者,纠正年龄12个月,再次行头颅MRI检查。
1.2.4 自动听性脑干反应(automatic auditory breuinstem response, AABR)
患儿出生1周内由本院听力中心相关资质医生在床旁进行检查,使用Type1077(AccuScreen TE/DP)仪器,患儿取平卧位,于安静状态下进行检查,AABR ≤35 dBnHL为通过,AABR >35 dBnHL为不通过,初次检查双侧或一侧AABR不通过的患儿,出院后1周于听力中心再次复查,双侧或单侧仍未通过者,纠正年龄3个月复查,未通过者为异常。
1.2.5 新生儿随访
随访频率:纠正年龄6个月前1次/月,纠正年龄6~12个月1次/2个月。随访内容:纠正GA 40~44周行新生儿行为神经测定(neonatal behavioral neurological assessment, NBNA)评分;患儿生命体征平稳,检查在两次喂奶之间进行,于安静、光线柔和的环境及睡眠状态下检查患儿光习惯及声音习惯形成,觉醒状态下评估一般状况、主动肌张力、被动肌张力、视、听及原始反射等,总分40分,额外增加2个加分项,满分为42分;评分 37~42分为正常,初次评分≤36分的患儿1周后复查,评分仍≤36分为异常。纠正年龄1~12个月行神经运动20项检查,包括视、听、行为、运动、姿势及认知状态等,每次检查异常的患儿在康复科训练,定期评估,直至纠正年龄为12个月。
1.2.6 颅内出血早产儿预后判断
本研究根据患儿临床表现及头颅影像学资料评估预后。临床表现主要通过“0~1岁神经运动20项检查”评估,该方法系吴卫红等[8]将法国Amil-Tison的52项神经运动检查经多年临床应用改编而成,又称“婴儿神经运动20项检查”。包括6个部分:行为能力3项(对红球追踪、对说话人脸追踪、对声音反应),姿势和自然运动2项(非对称性紧张性颈反射、持续手握拳),被动肌张力4项(围颈征、内收肌角、腘窝角、足背屈角),主动肌张力和主动运动6项(拉坐姿势和头竖立、俯卧位、瞬间独坐姿势、手主动抓握、翻身、主动爬),深腱反射和姿势反应3项(膝反射、侧面肢撑、降落伞反应),姿势反应2项(立位和俯卧位悬垂)。该检查操作简单、不需昂贵仪器、依从性高,结合临床序贯检查共9次,能全面、早期发现早产儿神经发育异常。影像学检查指头颅CT或MRI检查,首选头颅MRI,因其组织分辨率高,能精确定位病灶部位及评价大脑白质和灰质发育程度。若患儿镇静效果不佳,或不能耐受MRI检查,则初次影像学检查可选择头颅CT,异常者纠正年龄12个月时复查,其结果可与临床表现综合判断。(1)预后良好:纠正年龄12个月时,0~1岁神经运动20项检查正常,同时头颅MRI或CT排除出血后脑积水(post-hemorrhagic hydrocephalus,PHH)、脑内囊性结构及脑软化灶;(2)预后不良:纠正年龄12个月时,0~1岁神经运动20项检查存在≥1项异常,头颅CT或MRI显示PHH、脑内囊性结构或脑软化灶。
1.2.7 资料收集
(1)一般资料:GA、出生体质量、性别及分娩方式等;(2)产前资料:妊娠期高血压综合征(pregnancy-induced hypertension syndrome, PIH)、产前硫酸镁治疗、产前激素治疗、宫内窘迫、宫内感染、脐带异常及胎盘早剥等;(3)新生儿期疾病及治疗:贫血、新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome, NRDS)、代谢性酸中毒、凝血功能异常、低血糖症、产时窒息、早发型败血症(early onset sepsis, EOS)、头颅血肿、呼吸机使用时间及多巴胺治疗等;(4)辅助检查资料:头颅超声、aEEG、初次检查头颅CT或MRI及AABR结果;(5)随访资料:NBNA评分及0~1岁神经运动20项检查结果。
1.2.8 患儿母亲和患儿的疾病诊断及治疗判断标准
(1)母亲疾病诊断遵循产科医生诊断;(2)新生儿疾病诊断:贫血、NRDS、代谢性酸中毒、凝血功能异常、低血糖症、产时窒息、EOS及头颅血肿等。
母亲治疗判断标准为(1)产前硫酸镁治疗为25%硫酸镁静脉滴注,疗程≥1 d;(2)产前激素治疗为地塞米松6 mg肌肉注射,2次/d, 2 d为1个疗程,疗程≥1。
患儿治疗判断标准为(1)多巴胺治疗:出生后72 h内使用过多巴胺,无论剂量及次数;(2)无创机械通气:持续气道正压通气,无创正压通气,高流量氧疗,使用过1种或序贯化使用3种,无论时间长短,均视为无创机械通气;(3)有创机械通气:经气管插管使用常频或高频机械通气,或治疗过程中使用有创通气,无论模式及时间长短,均视为有创机械通气。
1.2.9 统计学方法
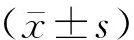
2 结果
2.1 一般资料
本研究符合纳入排出标准的患儿共80例,其中男性40例(50.00%)、女性40例(50.00%),GA 26+3~33+5周、平均(30.38±2.22)周,出生体质量 850~3 280 g,平均出生体质量(1133.43±388.25) g;剖宫产分娩38例(47.50%),经阴道分娩42例(52.50%)。80例颅内出血早产儿分级:Ⅰ级30例(37.50%),Ⅱ级35例(43.75%),Ⅲ级12例(15.00%),Ⅳ级3例(3.75%);轻度颅内出血65例(81.25%),严重颅内出血15例(18.75%)。预后良好组61例(76.25%),预后不良组19例(23.75%)。
2.2 颅内出血早产儿预后相关因素分析
80例颅内出血早产儿出院后系统随访至纠正年龄1岁,经序贯化的评估及干预,综合判断临床结局,预后良好61例(76.25%),预后不良19例(23.75%)。19例预后不良早产儿中神经运动20项异常12例,其中主动肌张力及主动运动异常12例,被动肌张力异常10例,行为异常6例,姿势反应异常2例;影像学检查异常7例,其中PHH 并脑内囊性结构3例,单纯脑内囊性结构2例,脑软化灶2例。
2.2.1 产前因素对颅内出血早产儿预后的影响
预后良好组在PIH、宫内窘迫、宫内感染、脐带异常、胎盘早剥、产前激素使用及产前硫酸镁治疗方面与预后不良组比较,差异无统计学意义(P>0.05)。结果详见表1。
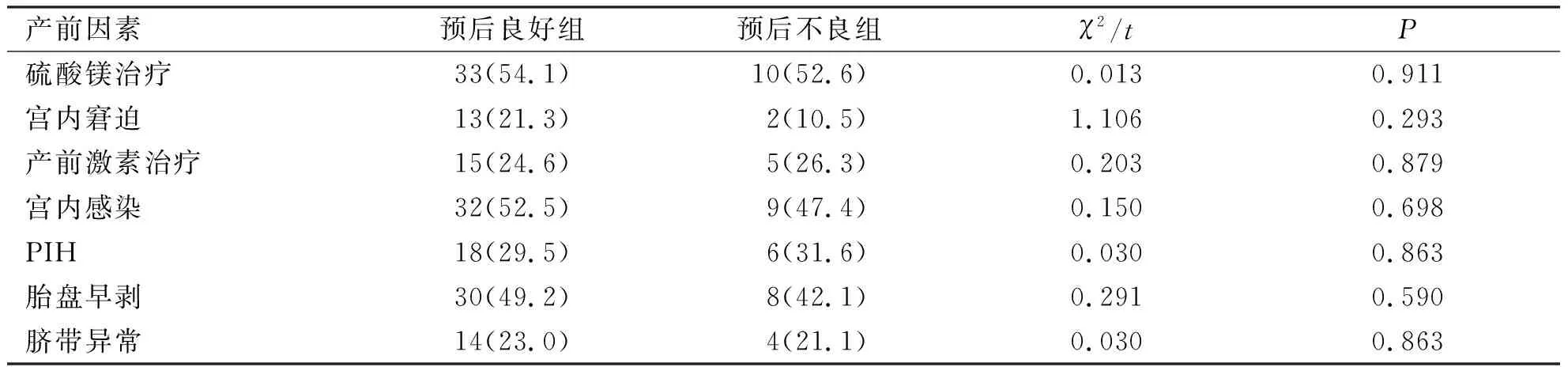
表1 影响良好组与预后不良组颅内出血早产儿预后的产前因素分析n(%)
2.2.2 新生儿期因素对颅内出血早产儿预后的影响
新生儿期因素包括GA、出生体质量、新生儿疾病和辅助检查及治疗等,预后不良组与预后良好组颅内出血早产儿新生儿期因素比较,预后不良组GA、出生体质量较预后良好组小,严重颅内出血、代谢性酸中毒比例较预后良好组大,预后不良组辅助检查(aEEG、AABR、NBNA及初次头颅影像学)异常比例高于预后良好组,差异均有统计学意义(P<0.05);而两组在产时窒息、头颅血肿、贫血、凝血功能异常、有创及无创机械通气、EOS、多巴胺治疗、低血糖症及NRDS比例方面比较,差异无统计学意义(P>0.05)。结果详见表2。
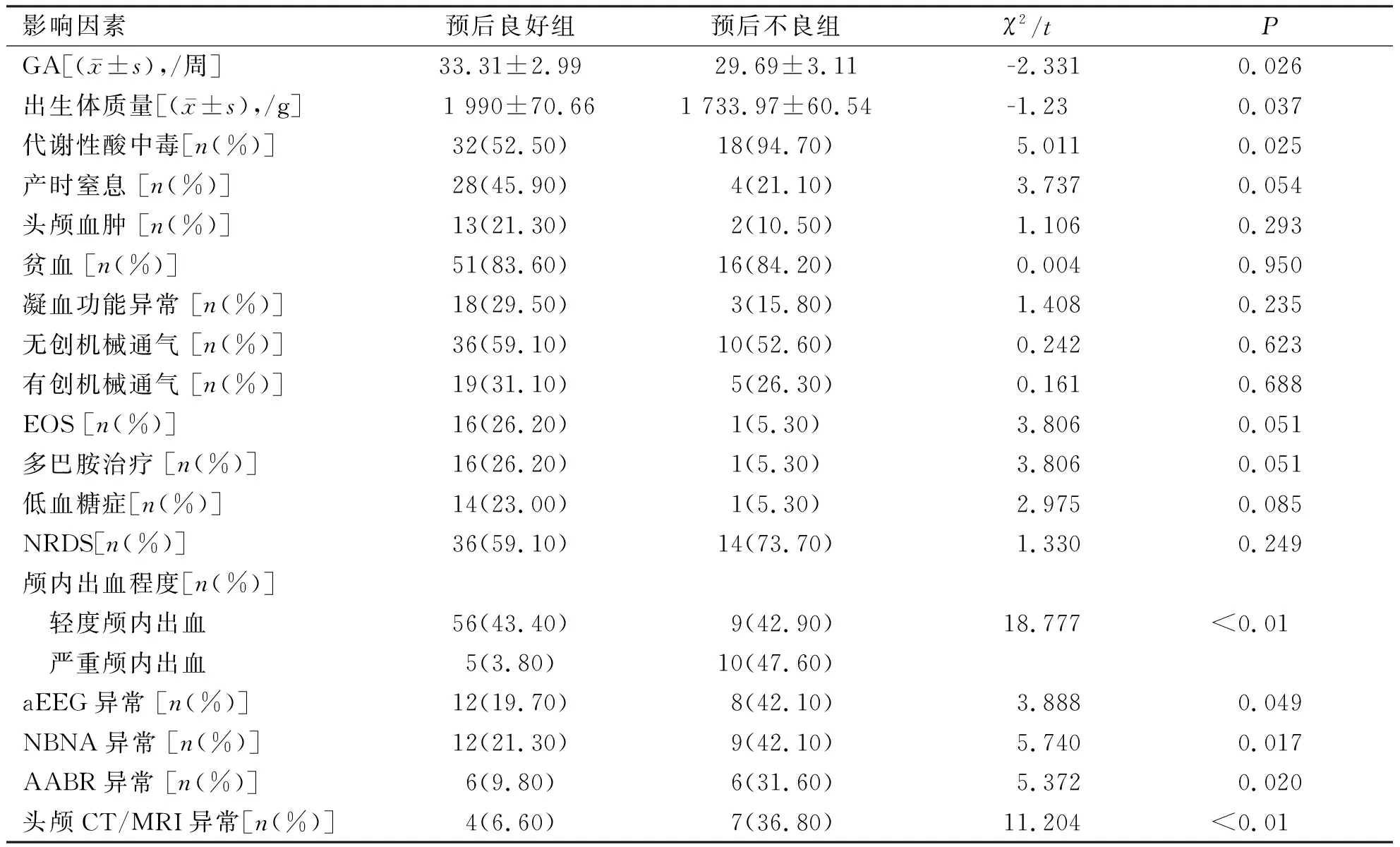
表2 影响预后良好组与预后不良组颅内出血早产儿的新生儿期因素分析
2.2.3 影响颅内出血早产儿预后的多因素分析
预后不良为因变量,产前、新生儿期影响因素为自变量进行单因素分析,P<0.05的相关因素进行logistic分析,GA≥32周、出生体质量≥1 500 g为颅内出血早产儿预后良好的保护因素(OR=0.298、1.992),代谢性酸中毒及严重颅内出血为早产儿颅内出血预后不良的危险因素(OR=2.458、2.364),aEEG异常、AABR异常、NBNA异常及头颅影像学异常预示颅内出血早产儿预后不良(OR=2.336、3.931、3.805、3.746),差异有统计学意义(P<0.05)。结果详见表3。
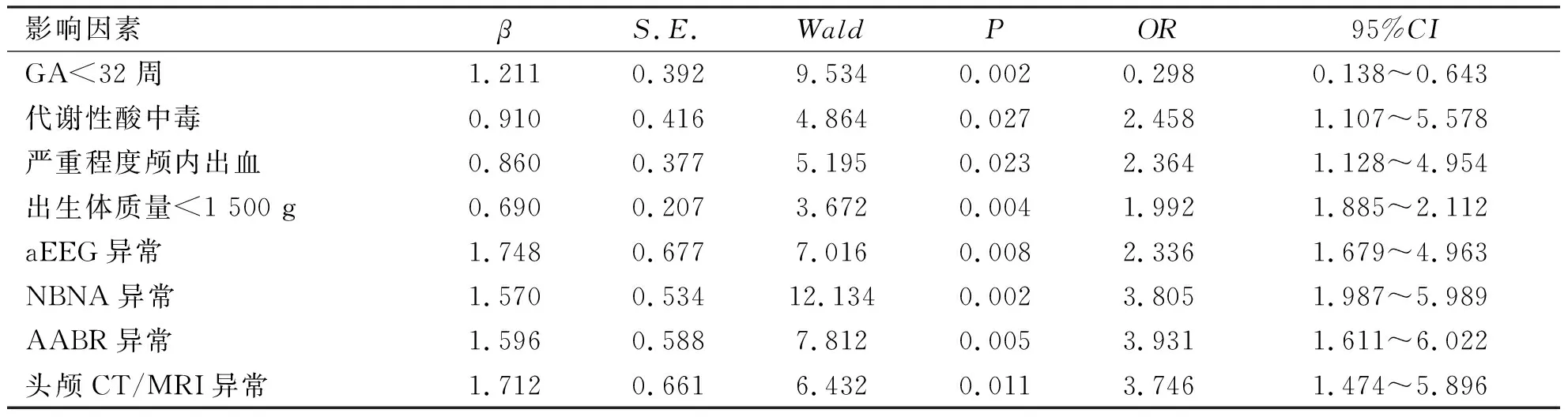
表3 影响颅内出血早产儿预后的logistic分析
3 讨论
随着新生儿重症监护及治疗技术的提高,危重新生儿救治存活率增高,存活者中约有5%~15%发生脑性瘫痪,25%~50%发生认知或学习障碍[9]。因此NICU建立NNICU显得尤为重要。通过整合新生儿科、神经科、神经影像学、神经电生理、遗传学、康复和神经专科护理的多学科团队,共同管理脑损伤高危患儿[10],目的是降低新生儿的病死率,预防脑损伤,建立脑保护策略,提高新生儿的生存质量[11]。NNICU专属配置包括视频脑电图(video electro-encephalogram, V-EEG)、aEEG、头颅B超、近红外光谱分析仪、经颅多普勒超声脑血流测定仪(transcranial doppler, TCD)、诱发电位仪(脑干听觉诱发电位、视觉诱发电位、躯体感觉诱发电位)、连续血糖监测及颅内压监测等[12-15]。有研究报道,通过NNICU的早期监护和干预可减少早产儿颅内出血的危害及神经系统相关并发症的发生,还可通过NNICU监护判断颅内出血患儿的预后[16-17]。本研究探讨经NNICU管理的颅内出血早产儿预后的影响因素。
本研究80例颅内出血早产儿中预后不良组19例(23.75%),预后良好组61例(76.25%)。产前因素分析两组比较差异无统计学意义(P>0.05);新生儿期因素分析显示,GA、出生质量、严重颅内出血、代谢性酸中毒及辅助检查(aEEG、AABRNBNA及初次头颅影像学)异常为患儿预后不良的危险因素。GA越小,出生体质量越低,提示早产儿成熟度越差,颅内出血程度越重,出生后伴发问题越多,除促进IVH的发生,同时干扰早期干预。如Ⅲ级IVH已出现脑室增大,将导致患儿脑组织原发性及继发性损伤,需要连续腰椎穿刺或植入ommaya囊抽取脑脊液,减轻出血对脑组织的压迫,以及稀释脑脊液中有毒物质,如Fe2+、补体、血黄素及凝血酶等,阻止继发性脑损伤,但患儿呼吸不稳定,血流动力学波动大,限制干预,从而影响预后。出生后72 h患儿出现代谢性酸中毒多与缺氧缺血相关,同时缺氧可影响糖代谢[18],故除颅内出血影响预后外,缺氧缺血也发挥关键作用。有研究表明,缺血性脑损伤与GA相关,且体重越低,出血性脑损伤及缺血性脑损伤发生率越高[19-20]。代谢性酸中毒与缺氧缺血互为因果关系,相互促进,导致脑血流障碍,能量代谢耗竭,兴奋性氨基酸毒作用,从而导致少突胶质前体细胞增殖、分化,阻止髓鞘化形成,严重影响患儿的运动功能发育,从而导致患儿出现脑瘫及运动发育落后。严重颅内出血后大量Fe2+留存于脑组织和脑脊液中,造成神经元细胞凋亡和坏死,临床易导致患儿癫痫发作,学习及记忆能力减退。严重出血后血凝块阻塞脑脊液循环通路,以侧脑室侧孔和中脑导水管常见;出血后刺激炎症因子释放,尤其是转化生长因子-β,从而导致蛛网膜粒纤维化,引起出血后脑积水,严重影响患儿预后[21]。严重颅内出血导致预后不良者占大多数,故减少严重颅内出血的发生率可降低颅内出血早产儿不良预后的发生。临床上为改善颅内出血早产儿预后,应降低早产儿出生率,尤其是超早产儿及超低出生体质量患儿,防治代谢性酸中毒,预防严重颅内出血的发生。有文献报道,颅内出血Ⅳ级早产儿的病死率可达50%,致残率可达65%~100%[22]。
本研究显示,颅内出血早产儿中脑功能异常、AABR异常、NBNA异常及早期头颅MRI或CT异常比例增高,提示脑损伤严重,预示预后不良。早产儿较足月儿更容易发生出血性脑损伤,且早产儿脑实质出血多为小脑出血。Bolisetty 等[23]的研究报道孤立的轻度GMH-IVH 与较高的神经障碍风险独立相关,且幕上 GMH-IVH 会直接或通过蛛网膜下腔间接影响小脑,导致患儿小脑体积减小,遗留神经功能障碍[24-25]。郁春等[1]的研究对69例颅内出血早产儿进行随访发现,发生重度颅内出血者11例(15.94%),其中死亡2例(18.10%),发生严重后遗症7例(63.63%)。重度颅内出血早产儿发生严重后遗症者比例高。因此,NNICU在早产儿监护中尤显关键,通过神经系统序贯化管理,可预示早产儿神经系统预后,故临床上应尽早、尽最大程度进行干预,改善患儿预后。
本研究的局限性在于神经系统评估随访时间较短,不能完全体现患儿神经系统的发育情况。更多的神经发育异常如社会-情绪异常及学习能力不足等发生在3~6岁[26]。今后的研究中可进一步随访至3岁或更大年龄,从而探究早产儿的远期临床结局。
综上所述,GA<32周、出生体质量<1 500 g、严重颅内出血及代谢性酸中毒为颅内出血早产儿预后不良的危险因素,早期发现患儿脑功能异常、AABR异常、NBNA低评分、头颅MRI或CT异常预示早产儿颅内出血预后不良,应尽早、尽最大程度干预,以改善颅内出血早产儿的神经系统预后。

