基于活性成分和α-葡萄糖苷酶抑制作用的组织培养牡荆遗传稳定性评价*
周 梅,孟 雪,薛建平,段永波,赵丰兰△
(1.安徽省食品药品检验研究院,安徽 合肥 230001; 2.淮北师范大学生命科学学院·安徽省特色资源植物利用工程实验室,安徽 淮北 235000)
糖尿病为全球三大慢性病之一,近年来发病率呈增长趋势[1],严重影响患者的生活质量及健康。糖尿病分为1型和2型,其中2型糖尿病患者占比超过95%[2],患者需长期依赖降糖药。α-葡萄糖苷酶是糖尿病药物筛选时的重要靶标[3],是水解葡萄糖苷键释放的葡萄糖关键酶。阿卡波糖作为α-葡萄糖苷酶抑制剂的常用药物,作用温和而持久,但存在不良反应[4],故从植物源中挖掘新型糖尿病治疗药物成为研究热点[5]。牡荆Vitex negundovar.cannabifolia为马鞭草科牡荆属药用植物,以叶入药,具有抑菌、抗炎、镇痛、抗肿瘤、抗氧化等活性[6]。牡荆叶中典型的活性成分为牡荆素,具有较强的抗糖尿病活性[7]。牡荆主要为野生资源,未开展广泛的人工标准化种植,牡荆素多从其他来源植物中提取而得[8],故开展牡荆组织培养并进行全面评价对于牡荆的规模化和标准化种植意义重大。李旭群等[9]对牡荆组织培养进行了相关研究;本课题组孟雪[10]也以未萌发腋芽为外植体建立了牡荆高效再生体系,但基于活性成分的遗传稳定性评价尚未开展。本研究中比较了不同溶剂对组织培养牡荆叶活性成分提取的影响,并分析了提取物对α-葡萄糖苷酶的抑制作用,以评价组织培养牡荆的遗传稳定性,为开发抗糖尿病药物提供参考,同时为组织培养牡荆的规模化种植提供科学支撑。现报道如下。
1 仪器与试药
1.1 仪器
Dionex U3000 型液相色谱仪(美国Thermo Fisher Scientific公司);KQ-500型超声波清洗器(昆山市超声仪器有限公司,功率为500 W,频率为40 kHz);JA2003型电子天平(上海菁海仪器有限公司,精度为0.1 mg);紫外- 可见分光光度计(上海联通仪器有限公司);CW-2000型超声-微波协同萃取仪(上海新拓微波溶样测试技术有限公司,功率为900 W,频率为50 kHz);SHZ-D(Ⅲ)型循环水式真空泵(巩义市予华仪器有限责任公司)。
1.2 试药
对硝基苯基-α - D- 吡喃葡萄糖苷(pNPG,梯希爱< 上海> 化成工业发展有限公司,批号为wkq20071504,纯度为98%);α -葡萄糖苷酶(批号为G5003,纯度为98%),芦丁(批号为100080-201811,纯度为92.6%),均购自索莱宝生物科技有限公司;牡荆素对照品(上海源叶生物科技有限公司,批号为111687-201704,纯度为98%);磷酸盐缓冲液(PBS)、无水乙醇、丙酮、乙酸乙酯为分析纯或色谱纯。
2 方法与结果
2.1 总黄酮提取与含量测定
以野生牡荆和本课题组前期获得的组织培养苗移栽5 个月的牡荆植株叶片为试验样品(批号为2021011)。取野生和组织培养牡荆叶适量研磨成粉,取1 g,分别用乙酸乙酯、酸性乙醇(pH 1.33)、70%乙醇溶液、丙酮于超声微波萃取仪萃取,真空干燥离心机抽滤,即得牡荆叶提取物。以芦丁为对照制作标准曲线,测定总黄酮含量[11]。取芦丁制成质量浓度分别为200,400,600,800,1 000 μg/mL的系列标准溶液,于510 nm波长处测定吸光度值(A510)。以A510(X)为横坐标、芦丁质量浓度(Y)为纵坐标进行线性回归,得回归方程Y=164.21X- 12.82(R2= 0.991 6,n= 5)。取牡荆叶提取物,用甲醇溶解,测定A510,按标准曲线换算成黄酮含量[mg/g(以鲜重计)]。结果见图1 A。
2.2 高效液相色谱(HPLC)法测定牡荆素含量
2.2.1 色谱条件与系统适用性试验
色谱柱:518905-902 Agilent HC-C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈(B)- 0.1%甲酸水溶液(A),梯 度 洗 脱(0~30 min 时60%B,30~35 min 时60%B →100%B,35~37 min 时100%B →10%B,37~42 min时10%B);流速:1.0 mL/min;检测波长:254 nm;柱温:30 ℃;进样量:10 μL。每次进样前用初始流动相平衡10 min。在此色谱条件下,牡荆素色谱峰与样品中其他成分的色谱峰分离度均大于1.5,理论板数按牡荆素峰计不低于5 000。色谱图见图2。
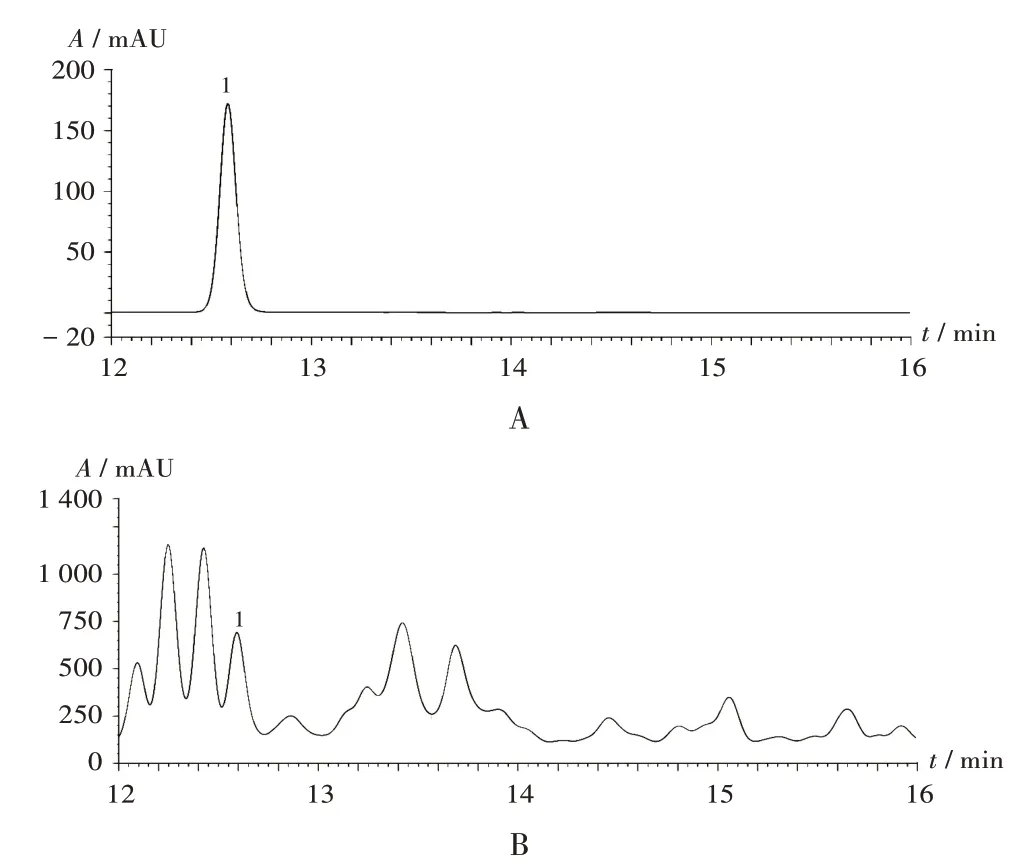
1.牡荆素A.对照品溶液 B.供试品溶液图2 高效液相色谱图1.VitexinA.Reference solution B.Test solutionFig.2 HPLC chromatograms

2.2.2 溶液制备
取牡荆素对照品2.50 mg,精密称定,用甲醇溶解并定容于25 mL容量瓶中,配成质量浓度为100 μg/mL的牡荆素贮备液,用甲醇梯度稀释得质量浓度分别为20,40,60,80,100 μg/ mL 的系列对照品溶液。取牡荆叶提取物,用甲醇溶解,溶液经0.22 μm滤膜滤过,即得供试品溶液。
2.2.3 方法学考察
线性关系考察:精密量取2.2.2项下系列对照品溶液,按2.2.1项下色谱条件进样测定,记录峰面积。以牡荆素质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,得回归方程Y=0.215 3X+0.024 18(R2= 0.998 4,n= 5)。结果表明,牡荆素质量浓度在20~100 μg/mL范围内与峰面积线性关系良好。
精密度试验:精密吸取2.2.2 项下质量浓度为20,60,100 μg/mL 的对照品溶液各适量,按2.2.1 项下色谱条件连续进样测定5次,记录峰面积。结果的RSD分别为0.97%,1.14%,1.05%(n=5),表明仪器精密度良好。
重复性试验:取同一批(批号为2021011)样品6份,按2.2.2项下方法制备供试品溶液,按2.2.1项下色谱条件进样测定,记录峰面积,并计算牡荆素含量。结果牡荆素含量的RSD为0.45%(n=6),表明方法重复性良好。
稳定性试验:取同一批(批号为2021001)样品适量,依法制备供试品溶液,分别于室温放置0,2,4,6,12,24 h 时按2.2.1 项下色谱条件进样测定,记录峰面积。结果的RSD为0.17%(n=6),表明供试品溶液在24 h内稳定性良好。
加样回收试验:取样品(批号为2021011)适量,精密称定,依法制备供试品溶液,分别加入相当于供试品溶液中牡荆素含量50%,100%,150%的牡荆素对照品,按2.2.1项下色谱条件进样测定,记录峰面积,并计算回收率。结果平均回收率为99.72%,RSD为1.21%(n=9),表明方法准确性良好。
2.2.4 组织培养和野生牡荆叶的牡荆素含量测定
取2.1 项下不同溶剂牡荆叶提取物适量,用甲醇溶解,制成质量浓度为0.1 mg/ mL 的供试品溶液,经13 000g离心10 min后取上清液,按2.2.1项下色谱条件进样测定,记录峰面积,并计算牡荆素含量。结果不同溶剂对牡荆活性成分提取效果的影响依次为酸性乙醇(pH 1.33)>70%乙醇溶液>丙酮>乙酸乙酯。详见图1 B。
2.3 α-葡萄糖苷酶活性抑制试验
参照林海生等[12]的试验方法,在450 μL 0.1 mol/L PBS(pH=6.8)中加50 μLα-葡萄糖苷酶(0.1 U/mL)和各溶剂牡荆叶提取物(1.82 mg/mL),37 ℃保温10 min,加入50 μL 质量浓度为3 mg/ mL 的pNPG 溶液,混匀,37 ℃反应20 min,加入800 μL(0.1 mol/L)Na2CO3溶液终止反应,测定405 nm 波长处吸光度(A405)。按公式抑制率(%)=1-(A样品-A样品空白)/(A对照-A空白)计算抑制率。式中,A样品为样品组吸光度值(样品+ 酶+pNPG);A样品空白为样品空白组吸光度值(样品+ PBS +pNPG);A对照为对照组吸光度值(PBS + 酶+ pNPG);A空白为空白组吸光度值(PBS+PBS+pNPG)。
当野生和组织培养牡荆叶提取物质量浓度为1.82 mg/mL 时,酸性乙醇提取物对α-葡萄糖苷酶的抑制率显著高于其他3种溶剂提取物,且抑制率与各溶剂所提取总黄酮含量变化趋势一致,表明黄酮是牡荆抑制α-葡萄糖苷酶的主要活性物质。详见图3。
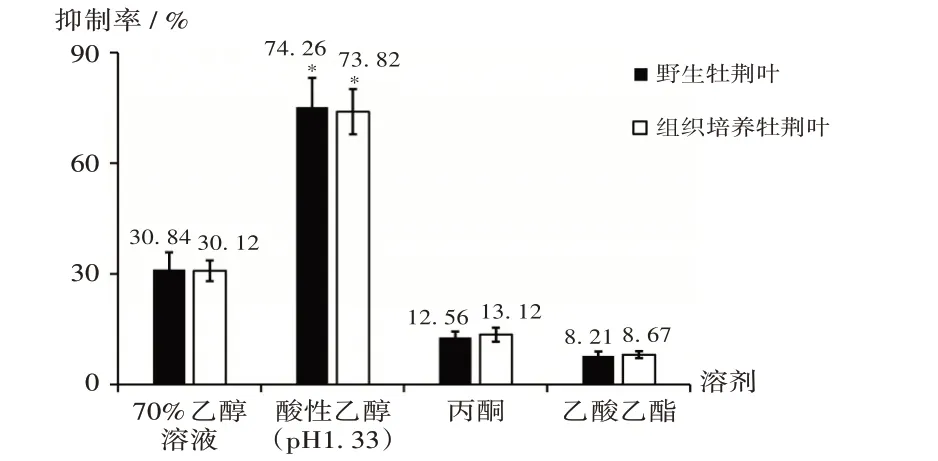
图3 不同溶剂提取物对α-葡萄糖苷酶抑制率的影响Fig.3 Effect of extracts extracted with different solvents on inhibitory rate against α - glucosidase
将抑制效果最好的组织培养和野生牡荆叶酸性乙醇(pH 1.33)提取物稀释成质量浓度分别为1.32,1.36,1.40,1.44 mg/ mL,按上述方法反应,并测定A450,绘制抑制率曲线,计算半数抑制浓度(IC50)。根据测试提取物浓度,反应后测定吸光度,计算抑制率。得抑制率对野生牡荆叶总黄酮质量浓度的拟合曲线为Y野=0.073 0X野+0.399 5(R2=0.982 4),以抑制率为50%计算得IC50为1.37 mg/mL;组织培养牡荆叶拟合曲线为Y组=0.099 1X组+0.361 1(R2=0.984 7),以抑制率为50%计算得IC50为1.41 mg/mL。结果表明,组织培养与野生牡荆叶对α-葡萄糖苷酶的活性抑制作用相当。
2.4 牡荆叶提取物对α-葡萄糖苷酶的抑制动力学研究
制备质量浓度为1.44 mg/mL的酸性乙醇(pH 1.33)提取物,与20,40,60,80,100 mg/Lα -葡萄糖苷酶反应,按2.3 项下方法测定吸光度,以不添加(0 mg/mL)提取物为对照组,计算反应速率。以α-葡萄糖苷酶质量浓度为横坐标(X,mg/ mL)、抑制速率[Y,以每分钟405 nm 波长处的光密度变化值(ΔOD405)]为纵坐标,确定牡荆叶提取物对α-葡萄糖苷酶的抑制动力学曲线和抑制类型。结果见图4。可见,野生和组织培养牡荆叶提取物抑制速率均通过原点,表明其对α-葡萄糖苷酶的抑制类型均为可逆性抑制。

A.野生 B.组织培养图4 牡荆叶提取物对α-葡萄糖苷酶抑制动力学曲线A.Wild Viticis Negundo Folium B.Tissue-cultured Viticis Negundo FoliumFig.4 Kinetic curves of extracts from Viticis Negundo Folium inhibiting α - glucosidase
3 讨论
组织培养是植物脱毒复壮的重要途径,也是实现药用植物标准化种植的必要技术[13]。不同组织培养条件下再生苗可能出现一定变异,故组织培养苗需进行遗传稳定性分析。关于组织培养苗的稳定性评价多集中在DNA 水平[14-15],从代谢水平深入评价其稳定性对于组织培养苗的大规模种植十分重要[16-17]。本研究在前期建立的牡荆组织培养体系基础上,基于活性成分和对α-葡萄糖苷酶的抑制作用对组织培养牡荆进行了遗传稳定性评价。
溶剂是决定不同植物活性成分的提取率的重要因素之一。本研究中比较了4种溶剂对牡荆叶总黄酮成分的提取效果,结果显示,酸性乙醇(pH 1.33)为牡荆叶总黄酮提取的最佳试剂,所提取的野生和组织培养牡荆中,总黄酮和牡荆素含量均远超其他3种溶剂,与文献[18]的研究结果一致。表明酸性乙醇(pH 1.33)作为溶剂能实现牡荆活性成分的高效提取与分离,可为后期研究牡荆活性成分的规模化提取方法提供参考。
作为牡荆主要的黄酮成分之一,牡荆素在预防和治疗多种疾病方面都有重要作用[19-20],其可作为α -葡萄糖苷酶抑制剂用于糖尿病治疗[21]。体外酶活抑制试验不涉及大鼠等模型动物的使用,仅在合适温度条件下即可完成活性测定,为酶活力分析提供了一种简易方法。因此,本研究中采用体外酶活抑制试验考察提取物对α-葡萄糖苷酶的抑制率,比较组织培养与野生牡荆的差异,评价组织培养牡荆的遗传稳定性。结果显示,以酸性乙醇(pH 1.33)为溶剂的牡荆叶提取物对α -葡萄糖苷酶表现出良好的抑制效果,组织培养与野生牡荆叶的IC50分别为1.41 mg/ mL 和1.37 mg/ mL,表明组织培养与野生牡荆叶对α-葡萄糖苷酶的抑制作用相当。牡荆叶提取物对体外α -葡萄糖苷酶抑制作用的IC50低于药用植物红景天[21],故进一步分析了牡荆叶提取物对α -葡萄糖苷酶的抑制特征。结果显示,其抑制类型为可逆性抑制,表明牡荆叶提取物是通过非共价键与α-葡萄糖苷酶分子结合而抑制其活性的,临床治疗中可用简单方法去除抑制剂而恢复α-葡萄糖苷酶活性[22]。可见,牡荆具有深入开发为α-葡萄糖苷酶抑制剂的潜力,为糖尿病的治疗提供新方法。
综上所述,组织培养牡荆遗传稳定性较高,在组织培养过程中未发生实质性的遗传变异;体外α-葡萄糖苷酶活性抑制试验可作为牡荆遗传稳定性评价的简易方法,为牡荆组织培养苗的标准化种植提供理论和技术基础。

