淋巴管生成的调节及其在心肌梗死中的作用研究进展
杜 清岳彤彤王 贺
(河南中医药大学第一附属医院,心脏中心/国家区域(中医)心血管诊疗中心,郑州 450000)
淋巴系统是液体运输和细胞迁移的通道,淋巴网络在调节心肌细胞外体积和免疫细胞稳态中起关键作用。 淋巴内皮细胞稳态是心脏生理功能正常发挥的前提,而淋巴管生成不足或功能障碍显著影响心肌梗死(myocardial infarction, MI)后病理性心脏重塑。 VEGFC/VEGFR3 信号传导长期以来一直被认为是淋巴管生成的主要分子驱动因素。 淋巴信号传导的神经网络是复杂的,目前已经发现淋巴管在肿瘤转移和心脏修复的免疫调节中起着至关重要的作用[1]。 而心脏淋巴管生成也被提出作为预防心肌梗死后心力衰竭的治疗靶点。 虽然调节功能性淋巴管的分子机制尚不完全清楚,但淋巴管生成与免疫调节之间的相互作用已被探索。 心肌梗死后,心脏淋巴管系统协调免疫反应和心脏重塑过程,尤其是巨噬细胞,通过受损心脏的淋巴管运输调节MI 后的免疫应答和心脏修复。 针对淋巴管生成的实验性治疗策略也显示出减少心肌炎症、水肿、纤维化以及改善心脏功能的前景。
淋巴管与免疫系统之间密不可分,了解二者的关系能更好地理解淋巴管与心肌梗死后炎症期之间的重要关系;了解心肌梗死后心脏及淋巴管基本的病理变化对疾病能有针对的治疗方向;了解淋巴管生成的调控,以及巨噬细胞对淋巴管生成和心脏修复的影响对疾病能找到更好的治疗靶点。 对以上内容进行总结,希望对淋巴管系统在心肌梗死后影响疾病的发展方向有更好的理解,为免疫细胞和淋巴管在损伤后心脏修复中的相互联系提供了新见解,从而为临床刺激淋巴管生成治疗心脏疾病提供有效的依据。
1 淋巴管与免疫系统
淋巴系统由薄壁的初始淋巴管网络、预收集管、集合管以及与血液循环系统平行的节点组成。初始淋巴管是由单层淋巴内皮细胞(lymphoendothelial cells,LECs)形成的,通过锚定丝与间质相连,没有周细胞和平滑肌细胞的包裹,缺乏连续的基底膜,这一结构特征使毛细淋巴管壁具有高渗透性,能够通过被动引流吸收多余的间质液和大分子[2]。 被初始淋巴管吸收的液体和大分子统称为淋巴,它流入预收集淋巴管和集合淋巴管。预收集淋巴管和集合淋巴管由LECs 组成,与初始淋巴管不同,LECs 以拉链状连接紧密连接,并覆盖有平滑肌细胞和基底膜,以防止淋巴渗漏[3]。 集合淋巴管也包含管腔内阀,调节淋巴的单向流动[4]。
成人心脏的淋巴网络密集于心室,稀疏于心房[5]。 心脏淋巴重塑(淋巴管生成)发生在许多以水肿和炎症为特征的心血管疾病中[6],包括缺血性心脏病或晚期心力衰竭患者。 水肿或渗透压升高刺激淋巴重塑,部分是通过巨噬细胞驱动的VEGFC产生。 除了维持间质液稳态,淋巴管系统还通过调节免疫细胞、细胞因子和抗原组织清除来调节免疫反应。 此外,淋巴管确保乳糜微粒摄取膳食脂质,并使胆固醇从组织逆向运输到肝[7]。
淋巴管与免疫系统之间的相互作用关系复杂。许多促炎介质降低了淋巴管功能[8],但免疫细胞的组织清除仍依赖于淋巴趋化因子的活跃表达来选择性地招募和排出不同的免疫细胞群。 同时,不同的免疫细胞群对淋巴内皮细胞的生长和生存产生刺激或抑制作用,影响淋巴重塑[9]。
2 心肌梗死后心室重构
心肌梗死后,如不加干预会进展为心室重构进而发展为心衰。 冠状动脉阻塞导致血流中断,心肌细胞立即死亡。 死亡的心肌细胞释放细胞内蛋白质进入循环,并触发炎症反应,招募炎症细胞浸润组织,清除死亡的心肌细胞。 炎症反应消失后,心肌成纤维细胞分泌的细胞外基质蛋白形成纤维化瘢痕。 心肌细胞为应对壁应力的增加引起梗死边界区心肌细胞肥大、壁变薄和心室扩张。
在这一系列过程中,免疫细胞的浸润是一把双刃剑。 缺血损伤后的心脏免疫反应以免疫细胞浸润为特征,不仅包括中性粒细胞、单核/巨噬细胞、树突状细胞(dendritic cells,DCs),还包括B 和T 淋巴细胞。 这些细胞共同协调死亡心肌细胞的移除,参与疤痕稳定和成熟所需的肉芽组织形成,并通过分泌促血管生成介质、抗凋亡介质和抗炎介质来调节随后的心脏修复和炎症消退阶段[10]。 但是,由于低效炎症反应引起的心脏慢性炎症,通过诱导冠状动脉内皮功能障碍和有害的心脏重塑(心肌细胞肥大和间质纤维化),加重心功能障碍,导致慢性心力衰竭的发展[11]。 因此,改善心脏炎症是许多心血管疾病的治疗目标,治疗性淋巴管生成可以加速心肌梗死后心脏炎症的消退。
3 心肌梗死后淋巴管的变化及作用
成人中,淋巴管是静止的,但在病理条件下淋巴管生成被重新激活[12]。 MI 后淋巴管生成的增加与免疫细胞浸润的增加有关,这是由受损细胞、细胞碎片和邻近细胞的细胞因子释放的促凋亡信号所吸引的[13]。 心肌梗死后,心肌内毛细淋巴管生成增多,心外膜预收集淋巴管和集合淋巴管的减少,导致心脏淋巴管的转运能力降低,对梗死区和邻近非梗死区的液体和炎症排出产生负面影响,加重心功能障碍[14]。 临床上,心肌梗死后可检测到心肌水肿延伸到梗死区以外,这提示淋巴功能不足。 对大鼠进行实验性的心肌梗死[14],在心脏的梗死区以及边界区观察到了淋巴管生成,增加的淋巴管生成可以通过促进免疫细胞清除和液体运输来减缓或逆转病理进展。 这一内源性淋巴管生成反应,主要由心肌缺血后VEGF-C 和VEGF-D 表达增加所驱动。虽然在梗死瘢痕处部分的毛细淋巴管扩张,但是并不能满足心脏修复的需要。
有研究使用缺乏VEGF-C、VEGF-D 或VEGFR3的小鼠来阻断淋巴管生成,结果显示不会损害心肌梗死后2 周小鼠的心功能[15]。 虽然心脏淋巴管的减少不影响初始损伤后的心功能恢复,但增强淋巴管生成除了在急性恢复期外,还在慢性恢复期抑制心脏组织损伤[9]。 在小鼠中,通过激活VEGFR3 信号增强的淋巴管生成可以改善心功能并促进心肌梗死后的恢复,这表明增强淋巴管生成对心脏修复的治疗潜力[16],通过淋巴管生成来维持正常的淋巴功能在长期内是必要的。
4 淋巴管生成的调控因素
在成人体内淋巴管生成主要发生在已存在的血管中。 在胚胎时期,淋巴管是在心血管系统建立并具有功能后出现的。 小鼠的遗传实验已经证实哺乳动物的淋巴管起源于胚胎静脉[17]。 淋巴管向成熟淋巴网络的发展依赖于VEGF-C、VEGFR-3、淋巴管内皮透明质酸受体(LYVE-1)、同源盒基因转录因子1(Prox1) 与Podoplanin(PDPN) 等的相互作用[18]。
4.1 Prox1
Prox1 启动了LECs 的早期发育[19],是淋巴内皮发育过程中的特异性转录因子,影响着VEGFR-3 的表达[20]。 Prox1 已被证明可以通过Prox1-VEGFR-3反馈循环维持LECs 的表型[21]。 Prox-1 不仅编程LECs,且在细胞分化中起着重要作用[18]。 缺乏Prox1 的内皮细胞不能表达淋巴内皮标记物,而是保留其血管内皮表型。 Prox1 阳性内皮细胞从静脉中萌发并以极化方式迁移形成淋巴囊。 Prox1 敲除胚胎缺乏淋巴囊和淋巴管,表明Prox1 不仅是LECs规范所必需的,也是淋巴管生成所必需的[18]。
4.2 VEGF 家族
VEGF 属于血小板衍生的生长因子表基因家族,调节血管以及淋巴管生成。 VEGFR-2 在血管内皮细胞中高度表达,对血管生成至关重要。 VEGFR-3 是淋巴管发育所必需的。 在发育的早期阶段,VEGFR-3 广泛表达于内皮细胞中,随着淋巴管系统的开始发育, VEGFR-3 的表达几乎只局限于LECs[18]。 VEGF-C 的完全缺失会导致LEC 无法迁移出主静脉,淋巴形成出现严重缺陷,从而导致水肿和产前死亡[22]。 VEGF-C 在大多数组织中通过多种细胞类型(包括心肌细胞)低水平表达。 VEGFC 水平在炎症期间升高[5]。
在成年淋巴管系统的维持中并不需要VEGFC/VEGFR-3 信号通路[23],但过表达VEGF-C 或VEGF-D 可以诱导内皮细胞增殖、迁移和存活,刺激淋巴管生成。 心肌缺血后用VEGF-C 治疗,促进了心脏淋巴管生成,可以通过增加多余蛋白质(如促炎介质)、免疫细胞和液体的淋巴引流能力,最终改善心功能[9]。 VEGF-C 及其受体VEGFR-3 通过激活淋巴管生成中的AKT/ERK1/2 和钙调磷酸酶/NFATC1/FOXC2 通路,是缺血损伤后维持组织液平衡和心肌功能的关键[24]。
4.3 PDPN
Podoplanin 是一种小跨膜蛋白。 研究表明,PDPN 敲除小鼠具有淋巴/血管分离缺陷[25],并表现出淋巴管扩张和功能障碍以及淋巴水肿。 心肌梗死后PDPN 阳性细胞与免疫细胞之间的相互作用调节有助于免疫细胞的募集。 因此,PDPN 也被认为是MI 后增强心脏修复和恢复心功能的新的治疗靶点[26]。
4.4 FOXC2
FOXC2 在成人发育中的淋巴管和淋巴管瓣膜中高度表达。 FOXC2 缺失会使集合淋巴管缺少瓣膜,淋巴异常回流,毛细淋巴管被基底膜成分和平滑肌细胞异位覆盖[27],这表明FOXC2 控制着负责淋巴管规范和集合淋巴管表型的遗传程序。 FOXC2还在LEC 静止过程中调节连接蛋白37(Connexin 37,Cx37) 和钙调磷酸酶/活化T 细胞核因子(nuclear factor of activating T,NFAT)信号[28],所以FOXC2 对于淋巴管的成熟和维持是必要的。FOXC2 还被证明可以通过限制Hippo 通路转录共激活因子具有PDZ 结合基序的转录共激活因子(TAZ)介导的增殖来调节LEC 连通性的完整性,并维持LEC 细胞在受干扰流动区域的静止,而TAZ 对维持淋巴瓣膜功能至关重要[28]。 FOXC2 也被证明与VEGFR-3 一起调节LECs 中的RAS/ERK 信号通路,这也表明它可以调节淋巴管生成[29]。
4.5 LYVE-1
LYVE-1 是最特异性的LEC 标志物,被广泛用于评估心肌梗死后的心脏淋巴管生成,其在淋巴细胞、造血细胞和血管内皮细胞中不表达[30]。 在成人中,LYVE-1 在毛细淋巴管中保持高表达,在集合淋巴管中的表达减少[23]。
4.6 血管内皮钙黏蛋白(VE-cadherin)
VE-cadherin 是一种位于细胞连接之间的内皮粘附分子,在调节细胞增殖、凋亡、机械信号转导和内皮生长因子受体功能中发挥重要作用。 VEcadherin 既是血管发育不可缺少的,也是淋巴组织中发展和维持心脏淋巴网络所必需的[31]。 在LECs中,VE-cadherin 通过形成可渗透的纽扣状连接或很大程度上不渗透的拉链状连接,来调节内皮细胞的通透性,并选择性地定位于整个淋巴血管系统,以调节淋巴管内液体的进入和运输。 VE-cadherin 稳定质膜上的VEGFR3,为VEGF-C 的典型激活奠定了基础,从而建立了心脏淋巴维持所需的功能性淋巴信号节点。 VE-cadherin 还通过作为内皮机械感觉复合体的中心成分,控制β-连环蛋白(β-catenin)和LECs 转录因子的表达, 并诱导 VEGFR2/VEGFR3-AKT 信号通路,对LECs 施加各种间接影响[32]。 研究证明VE-cadherin 的淋巴表达是胚胎期和出生后心脏淋巴系统的发育及其在成年期的维持的要求。 尽管VE-cadherin 的LEC 特异性损失小鼠会导致受伤心脏的淋巴管退化,但是在心肌梗死前后并没有明显损害心功能。 然而,VE-cadherin 缺乏小鼠心肌梗死后心肌梗死面积和纤维化增加,提示淋巴血管受损可能会影响心肌梗死后的长期心功能并加重心力衰竭[31]。
4.7 血管生成素(Ang)
Ang 生长因子与受体酪氨酸激酶2(Tie2)结合,并调节内皮细胞和壁细胞之间的相互作用。 Ang2敲除小鼠表现出淋巴管成熟缺陷,包括平滑肌细胞向集合管的招募受损和毛细淋巴管发育不良,表明淋巴管稳定需要Ang2[23]。
4.8 细胞外基质(ECM)
毛细淋巴管的LECs 不是附着在像血管一样的基底膜上,而是通过由纤维蛋白和人弹性蛋白微纤维界面蛋白1(emilin-1)组成的弹性锚定丝附着在周围的ECM 如I 型胶原蛋白和纤维连接蛋白上。水肿期间,扭曲的ECM 成分对锚定丝的拉力增加,使毛细淋巴管保持开放,增加组织液吸收[12]。 对犬的研究表明,心脏淋巴转运的大幅增加是心脏对心肌缺血或心脏停搏引起的急性心肌水肿的反应的代偿机制[33]。 然而在炎症期间,浸润的中性粒细胞释放中性粒细胞弹性蛋白酶,降解emilin-1 锚定丝,导致细胞间连接减弱和淋巴管崩溃,结果淋巴运输不良水肿形成。 组织水肿可能通过ECM 释放介质进一步诱导淋巴管生成,糖胺聚糖透明质酸被透明质酸酶降解为具有生物活性的促淋巴管生成片段,作用于LYVE-1,与VEGF-C 协同刺激LEC 增殖和迁移[34]。 此外,ECM-整合素信号也在调节淋巴重构中的发挥重要作用。 间质液压力(IFP)增大时,ECM 中纤维连接蛋白通过β1 整合素直接与VEGFR3 结合向LECs 发出信号,放大VEGF-C 信号[35]。 然而功能性淋巴管生成是一复杂的过程,受局部微环境的影响,由于水肿通常伴有炎症,会对LEC 连接和屏障功能产生不利影响[36]。
5 免疫细胞对淋巴管生成和心脏修复的影响
5.1 巨噬细胞对淋巴管生成和心脏修复的影响
巨噬细胞可以分为两个亚类:M1 为经典激活的巨噬细胞[37],由脂多糖(LPS)和干扰素(IFN)-C诱导,产生高水平的促炎细胞因子介导组织损伤并损害伤口愈合。 M2 为交替激活的巨噬细胞,可进一步极化为M2a、M2b 和M2c 巨噬细胞[38]。 M2a和M2c 巨噬细胞分泌大量促纤维化转化生长因子(TGF)-β,诱导组织纤维化。 M2b 巨噬细胞也称为调控巨噬细胞,维持促炎和抗炎功能之间的平衡,研究表明M2b 巨噬细胞可以减轻心肌缺血再灌注损伤(myocardial Ischemia reperfusion injury,MI/RI)的影响[39]。
心肌梗死后,尤其是巨噬细胞的聚集及其对死亡细胞的吞噬清除,即胞葬作用,是心脏修复的必要的初始步骤。 以往研究表明,胞葬作用缺陷会加速心力衰竭[40]。 心肌梗死诱导促淋巴管生成因子VEGFC 的表达,触发心脏淋巴管生成,缓解炎症,从而改善心脏功能[16]。 巨噬细胞炎症期间分泌VEGFC 并促进淋巴管生成[41]。
Tammela 等[23]报道实验性心肌梗死后巨噬细胞胞葬作用缺陷导致心脏淋巴管生成和VEGFC 表达减少。 以及在培养的原代巨噬细胞中添加凋亡细胞后,发现胞葬作用诱导VEGFC 的细胞内证据。心肌梗死小鼠模型中观察到,心脏巨噬细胞升高了VEGFC 表达水平,髓系VEGFC 缺乏的小鼠表现出急性梗死面积的增加、心室收缩能力受损、不良组织重塑和淋巴管生成减少[23]。 同时细胞实验分析显示髓系VEGFC 缺乏也以炎症反应缺陷为特征,巨噬细胞产生的VEGFC 有直接抑制促炎巨噬细胞激活的作用。 因此,这些结果表明,心脏巨噬细胞通过胞葬作用产生VEGFC 除了促进心脏淋巴管生成和进行抗原清除,还能直接抑制巨噬细胞过度分泌促炎细胞因子改善心脏修复,促进心脏愈合。
Wang 等[42]在大鼠体内的研究表明,M2b 巨噬细胞促进淋巴管生成,减少心肌纤维化,改善心脏功能,减少心脏重构。 M2b 巨噬细胞移植后VEGFC和VEGFR3 表达上调。 体外实验表明,M2b 巨噬细胞可刺激LECs 的增殖、迁移和管状形成。 此外,与未分化(M0) 巨噬细胞相比,M2b 巨噬细胞中VEGFC 的表达上调。 且M2b 巨噬细胞上清培养的LECs 中VEGFR3 的表达也上调。 因此,M2b 巨噬细胞可以被运用到心肌保护疗法中。
5.2 T 淋巴细胞对淋巴管生成和心脏修复的影响
Houssari 等[9]对心肌梗死后心脏招募T 细胞在淋巴重塑中的作用进行研究,发现使用VEGF-C/VEGF-D trap(可溶性VEGFR3)治疗限制T 细胞招募到梗死区,导致左心室壁变薄减少延迟瘢痕重塑,并减少心肌梗死后的心功能障碍。 进一步研究证实心脏浸润T 细胞(包括CD4+和CD8+亚群)在心肌梗死后对心脏淋巴系统产生有害影响,并在一定程度上通过IFN-γ 导致心肌梗死后急性期淋巴毛细血管和预收集器的稀疏。
6 治疗性淋巴管生成
有研究通过抑制VEGF-C 和VEGFR3 对心肌缺血模型小鼠进行研究[43],结果发现,抑制内源性淋巴管生成增加了梗死瘢痕大小,增加了心室肥厚,增加了左心室扩张,并降低了左心室功能。 相反,有选择性地刺激心脏淋巴管生成,改善预收集淋巴管和集合淋巴管的重构,使心脏淋巴管运输能力加快,足以减轻大鼠心肌梗死后的心肌水肿、炎症和纤维化,从而减少病理性重构,改善心功能,部分预防心衰发展。 另外LEC 分泌的细胞因子可以促进心肌细胞增殖存活,减少心肌细胞凋亡,为心肌梗死后心脏提供保护[44]。
Hartikainen 等[45]在对小鼠心梗模型的研究中发现,通过腺相关病毒载体实现持续的VEGFCC156 S 治疗,才能有效增加心脏淋巴管生成,并减少心肌梗死后3 周心脏炎症和功能障碍。 在一项随访1 年研究中,促进淋巴管生成和血管生成的基因治疗增加了难治性心绞痛患者的心肌灌注储备[46]。因此淋巴管生成疗法可能是治疗心血管疾病的一种有前途的方法。
7 小结
心血管疾病的心肌改变包括心肌细胞和非心肌细胞的细胞群以及ECM 的改变。 对于心肌梗死以及其他心脏疾病的治疗要考虑多种细胞及ECM中的靶点。 淋巴管生成不足或功能障碍在MI 和非缺血性心脏病的心肌重塑和心功能障碍中起着病理生理作用。 心脏淋巴功能受损导致心肌水肿和免疫炎症延迟消退,而慢性水肿和炎症都可以诱导心肌间质纤维化。 为了改善心肌梗死后的心功能,减少心肌水肿、炎症和纤维化,治疗性淋巴管生成已经成为一种有前途的新方法。 其中与淋巴管密切相关的免疫巨噬细胞在急慢性炎症、组织稳态和重塑等多种生理和病理过程中发挥重要作用。VEGFC-VEGFR3 是主要的淋巴管生成通路,巨噬细胞通过胞葬作用产生的VEGFC 可以促进心脏淋巴管生成,不仅能清除抗原,同时抑制促炎细胞因子的过度分泌,改善心脏修复(见图1)。 但考虑到,VEGF-C 可以与内皮细胞上的VEGFR2 受体结合刺激血管生成,同时也刺激血管渗漏[12],VEGFR3 也在心肌细胞和肌成纤维细胞上表达,VEGF-C 治疗可能直接影响心肌细胞和重塑期成纤维细胞的信号转导。 因此未来的研究仍需充分了解不同类型细胞中的VEGF-C 和VEGFR3 信号如何影响MI 后淋巴管生成及心肌生理病理变化。
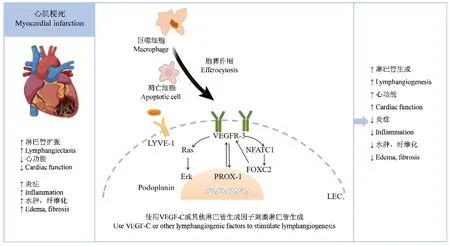
注:LEC:淋巴内皮细胞;VEGF-C:血管内皮生长因子C;VEGF-D:血管内皮生长因子D;VEGFR-3:血管内皮生长因子受体3;HA:透明质酸;LYVE-1:淋巴管内皮透明质酸受体;Podoplanin:膜黏蛋白;NFATC1:活化T-细胞核因子1;FOXC2:叉头框C2;PROX-1:同源盒基因转录因子1;Erk:细胞外调节蛋白激酶。图1 淋巴管生成的调节及其在心肌梗死中的作用Note.LEC, Lymphoendothelial cell.VEGF-C, Vascular endothelial growth factor C.VEGF-D, Vascular endothelial growth factor D.VEGFR-3, Vascular endothelial growth factor receptor 3.HA, Hyaluronic acid.LYVE-1, Lymphatic endothelial hyaluronic acid receptor.Podoplanin,Membrane mucin.NFATC1, Activated T-nuclear factor 1.FOXC2, Forkhead frame C2.PROX-1, Homeobox gene transcription factor 1.Erk,Extracellular regulated protein kinase.Figure 1 Regulation of lymphangiogenesis and its role in myocardial infarction

