蓝莓果渣多酚-纳米硒的制备、表征及抑菌活性
徐雅琴,钟敬伟,李国强,王欣茹,常松涛,杨 昱,王丽波
(东北农业大学文理学院,黑龙江 哈尔滨 150030)
蓝莓(Vacciniumspp.),杜鹃花科、越橘属蓝果类型植物的俗称。蓝莓果实中含有丰富的多酚类生物活性成分,如花青素、黄酮和酚酸等[1-3]。蓝莓多酚成分具有较强的抗氧化、抗炎、保护心脏和调节免疫力等功效[4]。据报道,蓝莓鲜果加工后所产生的蓝莓果渣仍中含有大量多酚类物质[5],但目前通常将其丢弃,只有少量用作食品添加剂、薄膜改良剂等[6],如能合理运用果渣中多酚类物质,将进一步提高蓝莓的利用率。
硒是人体必需的微量元素,可提高人体免疫力、预防心血管疾病、延缓人的衰老[7-9]。因此,硒的补充对人体至关重要。近年来,研究发现纳米硒相比于常规形式硒的吸收利用率高、生物活性高、毒性低,原因可能是纳米材料独特的高比表面积、小尺寸效应[10]。同时纳米硒还具有抑菌和抗癌活性。王娜等利用没食子酸修饰制备的纳米硒颗粒,发现对金黄色葡萄球菌与大肠杆菌均具有较强的抑菌活性[11]。Wang Yijun等[12]报道,硒颗粒越小,在体内和体外系统中癌细胞生长抑制效果越好,因纳米硒的小尺寸效应更容易作用于细胞表面生物膜和细胞内部。
纳米硒的制备常采用化学方法,其中利用植物多酚制备纳米硒具有明显优势。植物多酚是具有多元酚结构的次生代谢物,具有较强的还原能力,能够有效的将硒盐转化为单质硒[13];由于多酚中的官能团与纳米颗粒之间的作用方式,使纳米颗粒分子间存在强烈的静电斥力,避免纳米颗粒产生聚集,可形成稳定、分散的球形结构[14]。植物多酚自身有一定的抑菌活性,如Yang Guiyun等[15]发现蓝莓多酚对金黄色葡萄球菌、单核细胞性李斯特菌、鼠伤寒沙门氏菌和大肠杆菌都具有较好的抑菌效果,这对纳米硒颗粒的抑菌性起到促进作用。
本研究以蓝莓果渣为原料提取多酚,利用多酚为模板制备蓝莓果渣多酚-纳米硒。对蓝莓果渣多酚-纳米硒进行结构表征并测定其抑菌活性、抑菌机理,以期为进一步利用蓝莓果渣以及制备具有高抑菌活性的纳米硒颗粒提供理论基础和实践指导。
1 材料与方法
1.1 材料与试剂
蓝莓果渣购置于尚志市绿野浆果有限公司,分装后于-20 ℃贮存。蓝莓果渣解冻后,置于60 ℃的恒温干燥箱中烘干,研磨,过40 目筛,得到蓝莓果渣干粉,真空密封保存。
X-5大孔树脂 南开大学化工厂;二甲基亚砜上海阿拉丁生化科技股份有限公司;金黄色葡萄球菌、大肠杆菌、沙门氏菌由东北农业大学保藏;枯草芽孢杆菌、副溶血弧菌 北纳生物科技有限公司;李斯特菌由吉林大学保藏;营养肉汤培养基 北京奥博星生物技术有限公司;碱性磷酸酶测试试剂盒、蛋白定量测试试剂盒 南京建成科技有限公司。
1.2 仪器与设备
JY92-2D超声波细胞粉碎机 新芝生物科技股份有限公司;FDU-1100冷冻干燥机 东京理化机械株式会社;Nano ZS90粒度及电位分析仪 英国马尔文仪器有限公司;FTS135型傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪美国Bio-Rad公司;H-7650透射电子显微镜(transmission electron microscopy,TEM)日本日立公司;EDX-7000能量色散型X射线荧光光谱仪(energy dispersive X-ray spectroscopy,EDX)、UV-2700双光束紫外-可见分光光度计 日本岛津公司;X Pert3 Powder X射线衍射仪(X-ray powder diffraction,XRD)荷兰帕纳科公司;XSP-19C倒置显微镜 上海巴拓仪器有限公司;Spark 10M多功能酶标仪 瑞士Tecan公司。
1.3 方法
1.3.1 蓝莓果渣多酚的提取与纯化
采用超声辅助硫酸铵/乙醇双水相法提取蓝莓果渣多酚[16]。具体操作如下:准确称取14.0 g硫酸铵溶于30.0 mL去离子水,再加入20.0 mL无水乙醇,搅拌均匀,静置直至形成澄清透明的两相。按照料液比1∶80(g/mL)称取蓝莓果渣干粉于体系中,在超声功率340 W条件下提取39 min。将粗提液抽滤、离心(3 500 r/min,20 min)除掉残渣后,经分液漏斗静置分层萃取,得到上相多酚提取液。
多酚提取液经旋转蒸发仪浓缩(50 ℃)后,采用X-5型号大孔树脂(2.5 cm×55 cm)纯化。上样质量浓度1.4 mg/mL、上样量100 mL、流速0.5 mL/min条件下,进行多酚的动态吸附。待吸附饱和后用去离子水洗脱,再用乙醇溶液(乙醇∶水=7∶3,V/V,pH 6.0)洗脱。收集多酚洗脱液、减压浓缩、冻干,获得纯化蓝莓果渣多酚(total phenol,TP)。采用福林-酚法测定TP纯度[17]。
1.3.2 纳米硒和蓝莓果渣多酚-纳米硒的制备
纳米硒的合成:向Na2SeO3溶液(10 mmol/L)加入等体积的VC溶液(2.0 mg/mL),将其置于磁力搅拌器上,充分混匀,添加1.0 mol/L NaOH溶液调节pH值为8.5,在超声功率为500 W下,冰浴反应10 min。静置24 h后,去离子水透析72 h,50 ℃浓缩,冻干,获得纳米硒(selenium nanoparticles,SeNPs)样品。
蓝莓果渣多酚纳米硒的制备:准确移取0.2 mL TP溶液(2.0 mg/mL)于烧杯中,将其置于磁力搅拌器上搅拌,缓慢滴加2.0 mL 25 mmol/L的Na2SeO3溶液,搅拌3 min,使其混合均匀,继续加入2.0 mL 50 mmol/L的VC溶液,用去离子水补至20.0 mL,混合液置于超声波细胞破碎仪中,在冰浴、超声功率500 W下制备10 min。制备液于室温放置24 h后,使用去离子水透析36 h,浓缩,冻干,得到多酚-纳米硒(TP-SeNPs)样品。
1.3.3 TP-SeNPs的结构表征
1.3.3.1 FTIR分析
分别将样品(TP、SeNPs与BP-SeNPs)与KBr颗粒于研钵中研磨,然后转移到模具中20 MPa压力下压片约0.5 min。在4 000~400 cm-1范围内进行FTIR扫描。
1.3.3.2 粒径和Zeta电位
将SeNPs和TP-SeNPs配制成0.25 mg/mL的溶液,过0.45 μm水系膜后,采用Nano ZS90粒度及电位分析仪测定粒子直径和Zeta电位、多分散性指数(polydispersity index,PDI)。
1.3.3.3 TEM形貌观察
将SeNPs和TP-SeNPs加去离子水适当稀释并超声,取少量滴在涂有碳膜的铜栅上,铺展在室温下干燥,在100 kV的加速电压下通过透射电子显微镜比较其形貌,大小和均匀性。
1.3.3.4 EDX分析
取适量的TP-SeNPs样品粘在样品台上,利用溅射的方法在真空下镀一层100 nm左右的金膜,通过EDX能谱确定TP-SeNPs体系的表面元素组成和分布。
1.3.3.5 XRD分析
参考Ye Xiguang等[18]的方法,使用XRD仪对TP、SeNPs、TP-SeNPs进行物相分析,以确定纳米硒体系的确切晶型。仪器参数条件为电压40 kV,电流40 mA,入射束角度扫描范围5°~90°。
1.3.4 TP-SeNPs抑菌活性测定1.3.4.1 菌悬液制备
在无菌操作台中,将-80 ℃储存的金黄色葡萄球菌、大肠杆菌、沙门氏菌、李斯特菌、枯草芽孢杆菌与副溶血弧菌菌种保藏液解冻后,分别接种于营养肉汤培养基中,在培养箱中37 ℃(副溶血弧菌30 ℃培养)培养至对数期,进行传代,将第2代菌浓度稀释至106CFU/mL,得到菌悬液。
1.3.4.2 最小抑菌浓度(minimum inhibitory concentration,MIC)的测定
采用二倍稀释法在96 孔微板上测定细菌的MIC[19]。将100 μL 25 mg/mL的TP-SeNPs样品溶液与100 μL各供试菌悬液混合,通过倍比稀释获得质量浓度为12.50、6.25、3.13、1.56、0.78、0.39、0.20、0.10 mg/mL的混合液。同时设置不含TP-SeNPs样品溶液的阴性对照组与菌悬液阳性对照组。混合液于37 ℃(副溶血弧菌30 ℃培养)振荡培养箱中孵育24 h(李斯特菌培养48 h)后,顺次依序观察到第1个混合液体呈澄清透明的样品质量浓度即为MIC。同时,通过酶标仪测定培养0 h与24 h(或48 h)时混合液OD600nm的变化辅助判别MIC值。
1.3.4.3 TP-SeNPs对李斯特菌生长速率的影响
根据Zhao Meimei等[20]报道的方法测定。在无菌环境下,取5.0 mL浓度为106CFU/mL的李斯特菌悬液于无菌试管中,随后加入2.0 mg/mL TP-SeNPs样品混合均匀,使样品的终质量浓度依次为1/4 MIC、1/2 MIC、1 MIC、2 MIC、4 MIC,并以5%二甲亚砜溶液代替样品作为空白对照组。混合液置于37 ℃恒温培养箱中培养,随机在0~48 h不同时间段取样,测定实验组与对照组的OD600nm,绘制时间-抑菌曲线。
1.3.4.4 TP-SeNPs对李斯特菌生物被膜的影响
按照1.3.4.2节中方法,将得到的不同倍数MIC李斯特菌混合液在37 ℃温箱中分别培养6、12、24、48 h。用灭菌磷酸盐缓冲溶液漂洗3 次后吸干,甲醇固定,1%结晶紫染色,再用灭菌磷酸盐缓冲溶液漂洗4 次,待干燥后,通过显微镜观察细菌生物被膜的生长情况。
1.3.4.5 生物被膜抑制率测定
将不同倍数MIC李斯特菌混合液置于37 ℃温箱孵育48 h。弃去孔板内培养液,用无菌磷酸盐缓冲溶液(phosphate buffered saline,PBS)冲洗1~3 次,随后向孔中加入100 μL 0.1%结晶紫溶液,并孵育30 min。丢弃结晶紫溶液,再次用无菌PBS洗涤平板。残留底物用200 μL 33%的乙酸溶液溶解,室温静置20 min,用酶标仪测定OD570nm。生物被膜抑制率按照下式进行计算:
式中:OD0为空白对照组的光密度;OD1为试样组的光密度。
1.3.4.6 生物被膜活性细胞检测
将不同倍数MIC李斯特菌混合液混合液置于37 ℃温箱孵育48 h。弃去孔内培养液,用无菌PBS冲洗1~3 次,然后在孔中加入100 μL四唑蓝溶液,孵育4 h后,吸出上清液,用二甲基亚砜(100 μL)终止反应。用酶标仪测定OD570nm。生物被膜细胞活力按照下式计算:
式中:OD0为空白对照组的光密度;OD1为试样组的光密度。
1.3.4.7 TP-SeNPs对李斯特菌细胞膜通透性的影响
将不同倍数MIC李斯特菌混合液在37 ℃温箱中分别培养0、10、14、18、22 h,混合样品8 000 r/min离心10 min收集上清液,按照总蛋白含量测定试剂盒说明书中测定步骤测定上清液中蛋白质含量,并通过260 nm波长处OD值测定核酸含量。
1.3.4.8 TP-SeNPs对李斯特菌细胞壁通透性的影响
通过测定碱性磷酸酶(alkaline phosphatase,AKP)的泄漏情况确定TP-SeNPs对李斯特菌细胞壁的影响。按照1.3.4.6节所述制备上清液,采用AKP试剂盒测定上清液中AKP活性。
1.4 数据处理
2 结果与分析
2.1 TP与TP-SeNPs的制备
超声辅助硫酸铵/乙醇双水相法制得T P 纯度为(21.10±0.75)%,经X-5大孔树脂纯化后,TP纯度达到(77.52±0.38)%,无多糖、蛋白质等杂质。TP冻干样品为红褐色固体,如图1A所示。TP用去离子水溶解后,添加到硒盐中并加入VC,混合液的颜色从深紫色变为橙红色。溶液颜色变化表明了硒盐被还原后形成TP-SeNPs颗粒[21],冻干样品为黑色固体,如图1B所示。SeNPs为红棕色固体,如图1C所示。
“金鱼和人一样,都是生命,不能剥夺它们看到真相世界的权利。”一杭恨不得陈前台立刻走人,便说:“万物皆有灵,众生且平等。人不喜欢一个环境,还可以离开,金鱼就只能被动地接受人类强加给它们的环境。我看这样吧,你去买一只方形鱼缸回来,咱们直接把它换了。”

图1 TP(A)、TP-SeNPs(B)和SeNPs(C)产品外观Fig.1 Visual appearance of TP (A),TP-SeNPs (B) and SeNPs (C)
2.2 TP-SeNPs结构表征
2.2.1 红外光谱
如图2A所示,SeNPs在官能团区几乎没有吸收峰。而TP与TP-SeNPs表现出相似的特征吸收,不同的是,TP样品在1 338.60 cm-1处有对应酚羟基的变形振动峰[22]。与TP相比,TP-SeNPs中酚羟基的变形振动峰减弱。此外,TP在3 377.36 cm-1处有一个O—H伸缩振动峰[23],该吸收峰与硒盐相互作用时发生红移至3 211.48 cm-1,峰强度明显降低且变的更宽,说明TP的O—H基团和纳米硒的硒原子之间有着类似氢键的相互作用(O—H…Se),因此可以推测TP参与了还原过程[24]。

图2 TP-SeNPs的红外光谱(A)、粒径分布(B)和电位(C)Fig.2 FTIR spectrum (A),particle size distribution (B) and potential (C) of TP-SeNPs
由图2B可知,SeNPs经TP分散后,平均粒径从(486.95±18.55)nm降低至(101.15±3.01)nm,PDI从0.444降低至0.334,PDI越低,颗粒聚集性越小。经TP分散后,纳米硒粒径变小,TP-SeNPs体系已属于纳米级别(≈100 nm),均一性增强且分散度降低。
Zeta电位的大小被用来预测胶体溶液中纳米颗粒的稳定性。由图2C可知,TP-SeNPs带负电,表明硒纳米粒子相互排斥,具有非聚集倾向。TP-SeNPs电位为(-29.8±1.16)mV,比SeNPs高3.19 倍,表明经多酚分散的纳米硒稳定性更好,绿色合成的纳米粒子在胶体溶液中一定程度上稳定。相比Lai Haoqiang等[25]以茶多酚作为分散剂获得的纳米硒粒子粒径为200 nm、电位为-10 mV,蓝莓果渣TP-SeNPs粒径更小,稳定性更高。
2.2.2 TEM光谱
由图3A、B可知,未加蓝莓果渣多酚制备的纳米硒为球状,但团聚在一起,呈簇状分布,导致其稳定性较差,易聚集沉底,丧失生物活性。TP-SeNPs颗粒聚集现象显著改善,纳米硒颗粒以近似球状的形态独立分布在视野中,且大小均匀,分散性良好。这与粒径测定结果一致,即TP-SeNPs体系中纳米硒的粒径(101.15±3.01)nm远小于SeNPs(486.95±18.55)nm。由此可证明,TP-SeNPs是一个相对稳定的体系。据报道,采用茶多酚[25]与鞣酸[26]作分散剂也得到了类似的纳米硒颗粒。
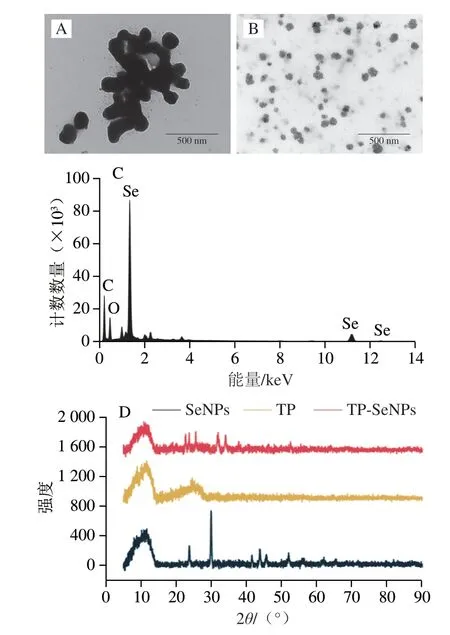
图3 TP-SeNPs结构表征Fig.3 Structural characterization of TP-SeNPs
2.2.3 EDX光谱
由图3 C 可知,给定样品中原子百分比分别为12.50% Se、67.45% C和20.05% O组成,无其他元素的干扰信号,说明体系纯度较高。元素Se在1.39、11.23、12.47 keV处有明显的信号吸收峰,其中主吸收峰位于1.39 keV,证实了硒盐经还原变为单质形态,这与Sharma等[27]报道一致。
由图3D可知,TP在11°与25°的2θ处存在两个宽峰,没有尖锐和狭窄的衍射峰,说明TP为无定形结构。SeNPs在约24°与30°的2θ处出现明显的衍射峰,与文献中报道的一致,分别对应于晶体硒100和101的晶格面[26]。对比SeNPs的XRD衍射峰,TP-SeNPs在24°的衍射峰明显减弱、30°的衍射峰消失。同时对应110、102、111、201晶面的41°、43°、45°、52°,2θ衍射峰均不明显,表明TP-SeNP颗粒是非晶型结构[28]。
2.3 TP-SeNPs的抑菌活性
2.3.1 MIC
由表1可知,TP-SeNPs、TP和SeNPs均有一定抑菌作用。其中SeNPs主要对3 种革兰氏阳性菌有较好的抑制效果,TP对革兰氏阴性菌和阳性菌都有抑制作用。TP-SeNPs对革兰氏阳性菌的抑制效果优于革兰氏阴性菌,可能的原因是革兰氏阳性细菌细胞壁含有较多肽聚糖,不含有脂多糖,其表面净负电荷比革兰氏阴性菌少,因此对细胞的保护作用较差,样品容易在细菌细胞内转染,抑制核酸合成,干扰能量系统[29]。同时,TP-SeNPs中的酚羟基也会与细胞蛋白中的氨基或羧基相互作用,抑制细菌的生长[30]。在3 种革兰氏阳性菌中,TP-SeNPs对李斯特菌的抑制能力最强,MIC为0.06 mg/mL,因此选择李斯特菌进行后续抑菌活性的测定。

表1 TP-SeNPs对不同细菌的MIC值Table 1 MIC of TP-SeNPs against different bacteria mg/mL
2.3.2 TP-SeNPs对李斯特菌的抑制作用
图4A为TP-SeNPs体系对李斯特菌的时间-杀灭曲线。空白对照组的李斯特菌在0~48 h内生长状况良好,符合典型的生长规律。添加TP-SeNPs后,李斯特菌的生长和繁殖都受到了不同程度的抑制。随着TP-SeNPs质量浓度的增加,细菌增长变缓慢。当TP-SeNPs添加量小于MIC时,李斯特菌的生长仍旧呈现典型生长趋势,但生长对数期的开始时间延后,且时间缩短。当添加量达到2 MIC以上时,细菌几乎没有增殖迹象。这些结果说明低质量浓度的TP-SeNPs可延缓李斯特菌的生长,高质量浓度TPSeNPs可完全抑制李斯特菌的生长,且与对李斯特菌的抑制作用呈正相关。
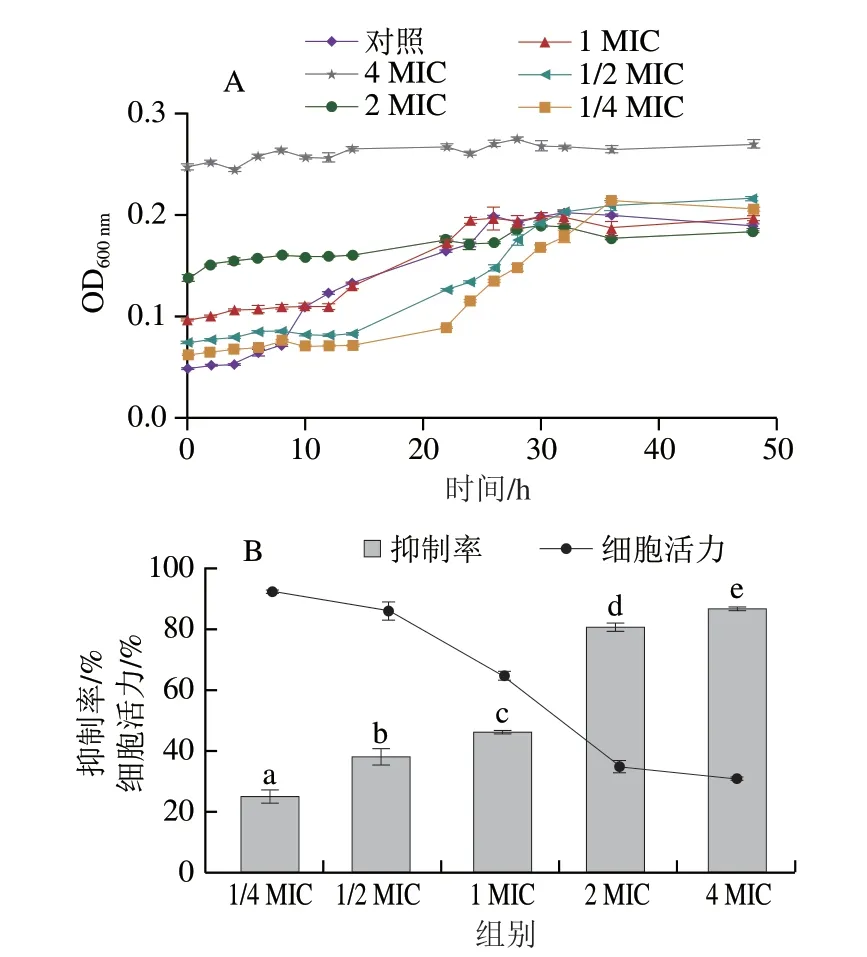
图4 TP-SeNPs对李斯特菌的时间杀灭曲线(A)和生物被膜(B)的影响Fig.4 Effect of TP-SeNPs on the time killing curve (A) and biofilm formation (B) of L.monocytogene
2.3.3 细菌生物被膜抑制率和活性细胞检测
如图4B所示,在所有测试浓度(1/4~4 MIC)范围内,TP-SeNPs呈现质量浓度依赖的方式抑制李斯特菌生物被膜的形成(P<0.05)。当加入TP-SeNPs质量浓度为1/4 MIC时,对生物被膜形成的抑制率为(25.10±2.01)%,而当其质量浓度增加至4 MIC时,抑制率达到(86.76±0.40)%,提高了约2.5 倍。
在活细胞中,线粒体琥铂酸脱氢酶可以将MTT还原为深紫色结晶状物质,而死细胞不可以,因此可以通过MTT比色法反映活细胞的数量与代谢活力。由图4B可知,随着TP-SeNPs质量浓度的增加,李斯特菌生物膜细胞活力显著下降(P<0.05)。加入TP-SeNPs质量浓度为4 MIC(0.24 mg/mL)时,生物膜细胞活力仅(30.78±0.87)%,抑制率为69.22%。已有报道,由蓝莓提取物(6.25 mg/mL)处理单核细胞性李斯特菌的生物被膜72 h后,生物被膜的细胞活力抑制率为64.4%[31]。比较可知,TP-SeNPs的抑菌效果优于蓝莓提取物。
2.3.4 TP-SeNPs对李斯特菌生物被膜的影响
细菌群落和自身分泌的胞外聚合物质组成的生物膜[32-33],容易使食品变质,给食品安全造成潜在的隐患。生物膜对消毒剂、低温等不利条件耐受性强。例如李斯特菌可通过嵌入胞外聚合物基质而增强对抗菌和消毒剂处理的耐药性。因此,抑制生物被膜的形成可以有效降低李斯特菌的危害。
如图5所示,李斯特菌在6 h时,生物被膜形成较少,随着时间的延长,微菌落逐渐扩大,连接成网状,接着生物被膜成熟,网状间隙变密,形成多层状结构,到48 h时,生物被膜进一步变得密致,形成复杂的团状结构,这与曹启航等[33]结果一致。但随着TP-SeNPs质量浓度依次增加,生物被膜的形成呈现剂量依赖性下降。当TP-SeNPs质量浓度为1/2 MIC时,仍有生物被膜的形成,但与空白对照相比,生物被膜的紧密程度明显降低,多层状结构不明显;当TP-SeNPs质量浓度为4 MIC时,培养6 h后有少量细菌黏附于载玻片,12 h后黏附细菌数量增多,出现较大的微菌落,24 h后微菌落向四周扩散,48 h菌落连成细微的网状结构,但并未形成致密的生物被膜。以上结果表明,TP-SeNPs对李斯特菌生物被膜的形成具有抑制作用。

图5 TP-SeNPs对李斯特菌生物被膜形成的影响Fig.5 Effect of TP-SeNPs on the biofilm formation of L.monocytogene
2.3.5 TP-SeNPs对李斯特菌细胞膜通透性的影响
细胞膜完整性是细菌抵挡外界抑菌物质的关键因素,细胞中包含核酸、蛋白质、酶、Na+、K+等物质。其中,核酸和蛋白质对于维持菌体正常的生理代谢具有重要的意义,因此可以通过蛋白质与核酸的泄漏情况判断细菌细胞膜是否破损。由图6A、B可知,TP-SeNPs与李斯特菌作用后,随着孵育时间的延长,与对照组相比菌液核酸释放量急剧增加,且蛋白质泄漏量也平缓上升。TP-SeNPs质量浓度越大,泄漏情况越严重。由此表明TP-SeNPs破坏了李斯特菌细胞膜的通透性与完整性,使其内容物流出,进而诱导细菌死亡。

图6 TP-SeNPs对李斯特菌核酸(A)、蛋白质(B)、AKP(C)泄漏的影响Fig.6 Leakage of DNA (A),protein (B) and AKP (C) from L.monocytogene treated with TP-SeNPs
2.3.6 TP-SeNPs对李斯特菌细胞壁通透性的影响
细胞壁作为细胞外部的刚性结构,具有支持细胞形状,承受压力并保护细胞免受异物入侵的能力。而AKP属于细胞膜和细胞壁之间的一组同工酶,当细菌细胞壁结构受到损伤时,则AKP会发生泄漏,故通过测定菌液上清液中AKP活力变化可以判断细胞壁的通透性指标。如图6C所示,对照组中AKP活力始终在同一水平波动,实验组上清液中AKP活力在一定范围内以时间和剂量依赖性方式显著增加(P<0.05)。李斯特菌与4 MIC的TPSeNPs孵育22 h后,上清液中AKP活力达到了对照组的1.6 倍,综上可知,TP-SeNPs提高了李斯特菌的细胞壁通透性是产生抑菌作用的原因之一。
3 结论
以蓝莓果渣为原料,制得纯度为(77.52±0.38)%的蓝莓果渣多酚,以多酚为分散剂制备了TP-SeNPs。该方法具有环保、低成本、方法简单等特点。TP-SeNPs相比纳米硒更稳定、粒径更小、为近球形无定形固体。此外TP-SeNPs对李斯特菌有较强的抑菌活性,优于TP和SeNPs的抑菌效果。TP-SeNPs抑菌机理初步测定表明:TP-SeNPs有效抑制李斯特菌生物被膜,破坏了李斯特菌细胞壁与细胞膜的通透性与完整性,造成细胞内容物泄漏,生理活动受阻,进而诱导李斯特菌死亡。本研究为蓝莓果渣在食品和医药行业的可能应用提供了理论基础。

