含油废水中产脂肪酶微生物的筛选和酶学性质研究
苏少林, 张文娟
(杨凌职业技术学院, 陕西 杨陵 712100)
随着餐饮业发展的多样化,餐饮废水油脂物含量越来越高,其化学成分相当复杂,给废水处理增加了困难。脂肪酶又被称为甘油三酰酯水解酶,是能将天然油脂的酯键水解的一种酶[1],根据国内外许多研究[2-4]表明,它能快速地水解甘油三酯的酯键并释放脂肪酸和甘油。Rosa等[5]研究表明,水解反应阶段是餐饮废水处理中限制反应速度最重要的一步,脂肪酶在水解过程中起关键性作用[6]。
脂肪酶广泛存在于动物体胰腺内、植被的油料种子和各种细菌真菌[7]微生物中,在微生物中发现的脂肪酶种类最多,常见于细菌、酵母菌和真菌中,非常容易获得,可以大批量的生产,而且具有比动、植物体内脂肪酶更高的pH存在范围值和耐高低温性,因此成为了工业生产脂肪酶的重要来源。当前的脂肪酶相对于普通的化学催化剂,生产的成本仍然偏高,因此筛选出新型的酶微生物和优化反应酶的条件具有重要意义。本研究从某高校食堂下水道采集含油废水,从废水样中分离筛选出产脂肪酶的菌株,进行多次复筛,纯化后测定酶活力,最终得到能产脂肪酶的高效菌株,并观测其特性。
1 材料与方法
1.1 样品来源
本次实验选自某高校食堂下水道中的废水为研究对象,裁剪相同规格大小的无菌纱布,分几次蘸取下水道排污口的含油物质用来筛选产酶菌株。
1.2 主要试剂和仪器
蛋白胨(AR)、牛肉膏(AR)、琼脂粉(BR)、氯化钠(AR);PHS-25pH计、SW-CJ-2FD超净工作台、SPX-150-Z恒温振荡培养箱、AR1140型电子分析天平、JB-2磁力搅拌器、ZSD-1270全自动化生化培养箱、立式压力蒸汽灭菌器、3K15冷冻离心机。
1.3 培养基
(1)普通筛选培养基:蛋白胨10 g/L,牛肉膏粉3 g/L,氯化钠5 g/L,琼脂15 g/L,再添加0.05%的罗丹明B(筛选培养基于121 ℃灭菌30 min)和1%的三丁酸甘油酯的普通肉汤琼脂培养基,最终pH 7.3~7.5。
(2)液体种子培养基:营养肉汤培养基,121℃高压灭菌16 min。
(3)发酵摇瓶培养基:酵母膏5 g/L,(NH4)2SO45 g/L,KH2PO42 g/L,NaCl 3 g/L,MgSO4·7H2O 0.5 g/L,橄榄油2 mL/L,pH7.0。
1.4 实验方法
1.4.1 产脂肪酶微生物的分离 从食堂下水道采集含油废水水样,无菌条件下,将一份5g的样品加入一个装有45ml无菌水并且瓶内放有一定数量的玻璃珠的锥形容器中,然后放置于摇床。利用磁力搅拌器的作用使其充分振荡,打散摇匀水样中的胶团使其游离菌跑出来,完全混合均匀后取出在室温条件下静置分层30~40 min,取上清菌液按梯度分别制成1∶10的稀释液。用一次性无菌塑料吸管吸取上清液,用同样的操作方式配制成稀释度为10-2、10-3、10-4、10-5、10-6的梯度悬菌液。分别从以上7个梯度依次吸取0.1 mL,接种于事先配制好的普通筛选培养基的平板上,于恒温培养箱中37 ℃倒置培养2 d左右。每天都要观察菌落的存在,以及附近有无黄色透明圈出现,将没有透明圈的菌落淘汰出去,有透明圈的挑选出并进行检测纯化,重复多次直至变为纯种后置于冰箱中,调节冰箱温度至4 ℃,将培养基倾斜保存。
1.4.2 产脂肪酶微生物的筛选
(1)产脂肪酶菌株的初筛。将分离保存的无菌菌株从冰箱中取出,用接种环分别涂布于单个的筛选培养基平板上,37 ℃条件下在恒温培养箱中培养2 d~3 d。然后将其取出来,采取肉眼观察法记录产生黄色透明圈的菌株。透明圈法[8]作为筛选酶最简捷的办法之一,需要每隔24 h观察透明圈的颜色及大小,并测量菌落透明水解圈的直径(D)以及菌落的直径(d),然后算出两者的比值大小,观察颜色的透明度等,大致推算出酶活力的大小。二者的比值相差越大,该菌株产酶能力越强。把比值相差大的菌落用金属接种环转移至固体的斜面培养基上,使用划线培养的办法进行多次划线培养,4℃保存供复筛备用。
(2)产脂肪酶菌株的复筛。挑取初筛得到的具有酶活性的成熟菌落于液体种子培养基中,在温度为37℃、转速为160 r/min的条件下,在摇床振荡中培养12 h,然后在摇瓶发酵培养基中培养,接种量以1%的比例接入培养基中振荡培养大约24 h。取适量的上清菌液于冷冻离心机中,以速率2 500 r/min离心6 min左右,消除酶溶液中的泡沫,取上清菌液进行酶活测定,进一步得到更高活性菌株。
(3)脂肪酶活力测定。本实验采用指示剂滴定法[9]来测定酶活力,以下为具体操作方法。
取两个容量为100 mL的干净无水渍的锥形瓶,分别在锥形瓶上标记为空白①和样品②,在瓶中分别加入橄榄油乳化液(3%的聚乙烯醇:橄榄油=3∶1的比例混合) 4 mL,pH为7.5,现配制的磷酸缓冲盐溶液5 mL,再于①中加入95%的无水乙醇15.00 mL,在40 ℃的水浴锅中保温反应5 min,然后各加1 mL的粗制酶液(需配制),晃匀后立即使用电子手表计时,准确反应15 min后,于②中即刻一次性补加15.00 mL 95%无水乙醇后停止反应,用湿抹布取出。
于①、②中各滴加早先配制的酚酞溶液两滴,用0.5 mol/L的NaOH标准溶液进行滴定,直至溶液从无色变为微红,并保持在30 s内颜色不褪,此刻视为滴定终点,结束操作。记下使用NaOH标准溶液的体积,根据损耗的碱量计算酶活力大小。
(4)脂肪酶菌株形态学测定。参照《微生物分类学》《常见细菌系统鉴定手册》等对筛选出的菌落进行初步形状的观察[10]。例如菌落的大小、形状、颜色、凸起情况、表面有无褶皱、是否透明等等。
1.4.3 脂肪酶酶学性质的分析
(1)温度对酶活性的影响。设置反应转速为150 r/min,将酶液分别放在25~65 ℃条件下,挨个测量脂肪酶活力的最适宜生存温度,然后再将酶菌液分别放于30~75 ℃的恒温水浴锅中,保温反应60 min,其中每间隔20 min需要检测残余菌株的酶活。重复做3次平行实验,得到最佳温度。
(2)初始pH对酶活性的影响。主要选用磷酸盐缓冲液作为本实验的缓冲体系,然后进行脂肪酶水解活性[11]的测定。取适量的粗制酶液,分别与pH为5~9的缓冲溶液等体积混合搅拌至均匀,在40 ℃前提下存放24 h以后,测量残余酶活,得到最佳初始pH值。重复做3次平行实验,获得脂肪酶活性存在的最适pH。
(3)金属离子对酶活性的影响。按次序在酶菌液中各加入10 mmol/L的Cu2+、Fe2+、Mg2+、K+、Ca2+等金属离子以等体积比例混合,室温情况下静置一段时间,然后测定其中的酶活,与没有加任何金属离子的空白酶液作为它的对照试验,测量残余的酶活。
2 结果与分析
2.1 产脂肪酶菌株的分离和筛选
含油餐饮废水水样经过分离、初筛、复筛等过程使菌株大量繁殖生长[12],划线分离数次,获得适应环境生长的产脂肪酶菌株。经过初筛可以获得透明圈与菌落直径比值较大的菌株,当比值≥3.0时,统计出35株产酶能力较好的菌落(大部分酶活在5~11 U/mL之间)透明圈水解图如图1所示。进一步复筛之后得到8株透明圈明显的菌株,但范围较小,将肉眼可见的菌落进行划线培养。产酶菌株随时间生长变化检测成果如表1所示。由表1可以看出,F-11的酶活力最高,其值为10.96 U/mL。本次实验以F-11菌株作为出发菌株,对其进行酶学性质[13]的探讨。
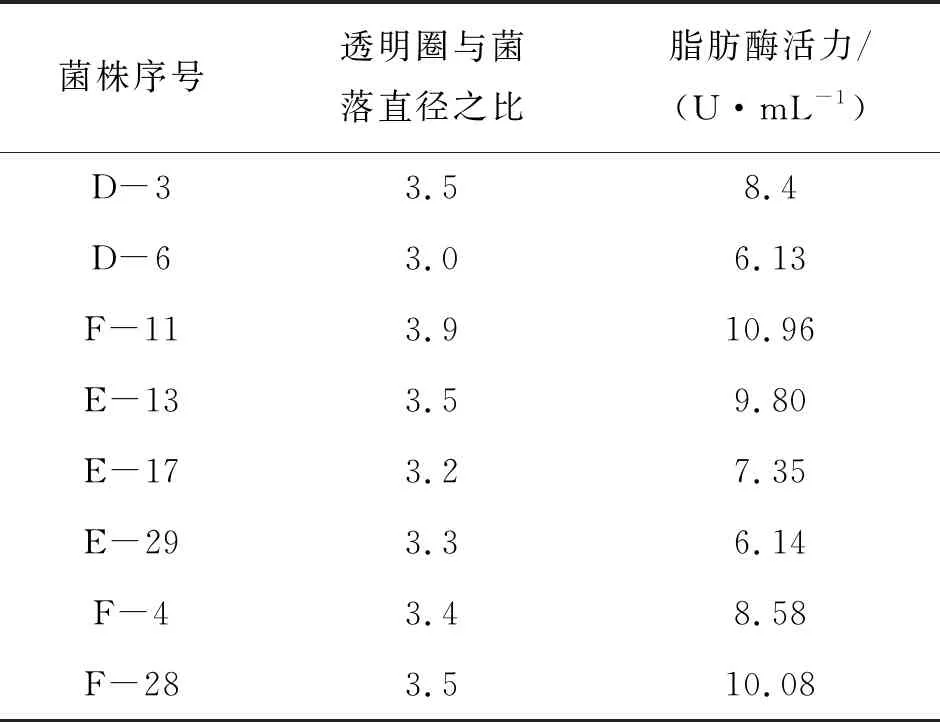
表1 产脂肪酶菌株酶活力大小的比较

图1 产脂肪酶菌株在三丁酸甘油酯平板上形成的水解圈
2.2 菌株形态学鉴定
菌株F-11在营养琼脂平板上38 ℃培养2~3 d进行形态观察[14],发现F-11 表面有鞭毛,直径2~5 cm,表面粗糙有隆起、褶皱,菌落颜色灰绿色,菌体颀长而且长度不一样,有些是球杆状,有些为线状,成双或者呈短链状排布。在视野比较暗的显微镜下可观测细菌运动活泼。初步判断为革兰氏阴性杆菌。
2.3 菌株所产脂肪酶的性质
2.3.1 温度对脂肪酶酶活力的影响与热稳定性 由图2看出,温度为25~30 ℃时,菌株F-11的产酶能力伴随着温度的升高,而呈上升趋势,30 ℃产酶能力最高,可高达为88.6%左右,30 ℃之后产酶能力伴随着温度的升高反应活性反而呈下降趋势,因此,认为菌株F-11的最适产酶温度为30 ℃。然而在40 ℃以后产酶能力快速呈直线下降趋势,脂肪酶在65 ℃时残留活力仅为初始反应的40%左右。
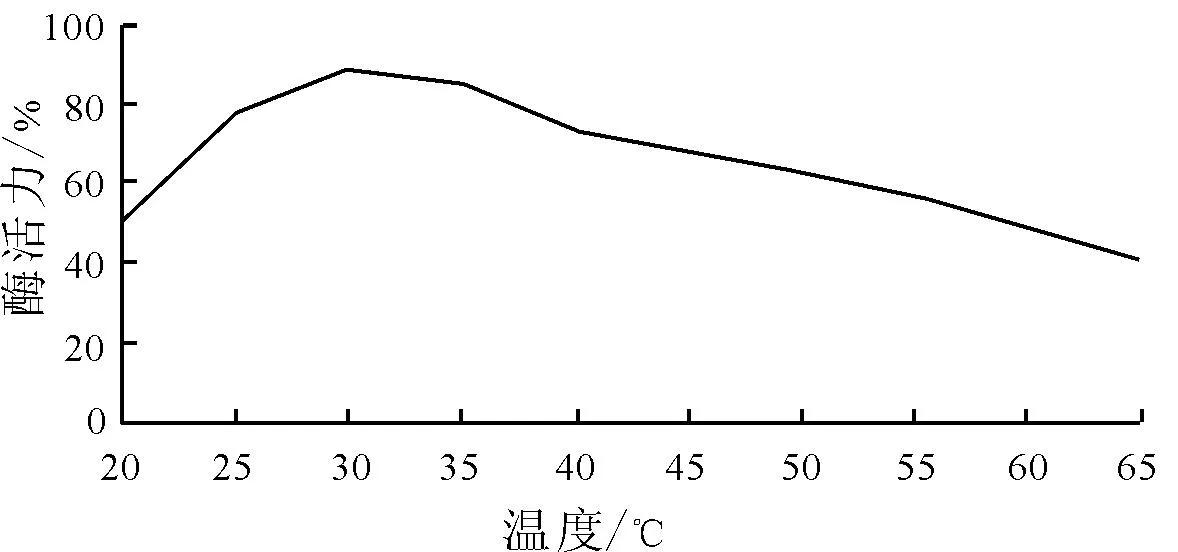
图2 温度对脂肪酶活性的影响
2.3.2 初始pH对脂肪酶酶活力的影响 图3表明:当初始pH小于7.5时,随着pH值的逐渐增大,酶活力也呈逐渐增长趋势。当pH等于7.5时,酶的活性最大,可达到88.9%左右。pH在5~7.5之间,酶活性处在较高水平。pH在7.5~9处,酶活性明显降低。pH在较高或较低水平时,都会对酶活力产生影响,因此,最佳此菌落初始pH为7.5。
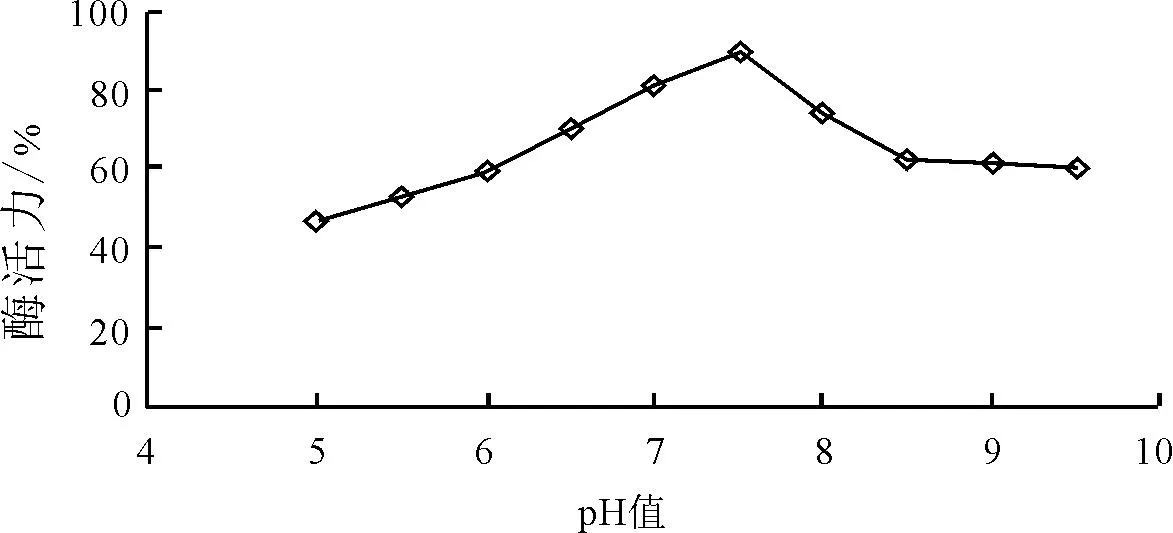
图3 初始pH对脂肪酶酶活力的影响
2.3.3 金属离子对酶活性的影响 金属离子可以与酶结合,对酶的构象排布起稳定作用,也可以作用与界面生成自由脂肪酸,减少抑制作用,从而改变酶活力的大小。表2显示,在本次实验中Ca2+对酶活性有一定的激活作用,酶活为19.06 U/mL。K+对本次实验产生的菌株酶活性大体上没有影响,Cu2+、Fe2+、Mg2+对酶活性存在明显的抑制作用,其中Cu2+的抑制作用最强,由表2可知最小为5.23 U/mL。

表2 金属离子对酶活性的影响
3 结 论
本实验从高校食堂下水道中分离筛选出一株高脂肪酶活力菌株F-11,经形态学初步鉴定为革兰氏阴性杆菌。通过对F-11菌株酶活性的探讨,反应转速设置为150 r/min时,最佳初始pH为7.5,最佳培养温度为30 ℃,菌株酶活性最高为10.96 U/mL。本次实验的研究,为含油废水中油脂的生物降解筛选出了高效产脂肪酶菌株。该菌株在温度25~30 ℃和pH为5~7.5协同发酵时,脂肪酶酶活力趋于稳定,酶活损失较小。而在添加金属离子抑制剂时,Ca2+对酶活有一定的促进作用,K+基本无影响,Cu2+、Fe2+、Mg2+存在极大的抑制作用,尤其是Cu2+抑制作用更甚。

