pH 和菲协同效应对中华绒螯蟹幼蟹的毒性效应
杨志刚,江青青,房余程,陈阿琴,成永旭,王爱民
1.上海海洋大学/农业农村部淡水水产种质资源重点实验室,上海 201306
2.上海海洋大学/农业农村部鱼类营养与环境生态研究中心,上海 201306
3.上海海洋大学/水产科学国家级实验教学示范中心,上海 201306
4.盐城工学院 海洋与生物工程学院,江苏 盐城 224000
水体pH 是水生动物生长存活的重要环境因子[1],其波动可以对水生动物的组织形态、代谢及基因表达产生直接影响[2]。相关研究指出鱼类长时间暴露于低pH 水体,会造成糖原分解变慢、糖异生途径降低及肝糖原得不到及时补充[3]。
多环芳烃化合物 (Polycyclic aromatic hydrocarbons,PAHs) 是水环境中广泛存在的持久性污染物[4]。其在水体环境、河口沉积物中,甚至水生生物中已被大量检出[5],如太湖 (877~5 730 ng·g-1) 和鸭绿江沉积物 (68~1 500 ng·g-1)。高度城市化和工业化地区的PAHs 污染水平较高,例如珠江 (1 434~10 811 ng·g-1) 和澳门内港 (294~12 714 ng·g-1)[6-8]。已有研究证实PAHs 对多种水生动物具有明确的毒性作用[9-10]。菲 (Phenanthrene,PHE) 等PAHs 污染物进入机体后,可直接作用于多环芳烃受体 (AHR),进而转移至细胞核,与芳香烃受体核转位因子 (ARNT) 结合,AhR/ARNT的复合物进而促进细胞色素p450 1A1 (cyp1a1) 基因的表达[11],产生一些高度致癌性中间产物,最终导致细胞凋亡等[12-13]。
对于甲壳动物而言,其脂肪常常存储在肝胰腺的R 细胞中[14]。中华绒螯蟹 (Eriocheirsinensis) 是一种主要在长江流域养殖的重要经济品种,“蟹黄”的质量是消费者重点关注的食用品质,其中含有大量的脂肪和胆固醇[15-16],而脂肪是重要的能量物质,因此能量代谢对于中华绒螯蟹而言十分重要。在现代养殖条件下,水生动物由于环境因素的变化更容易发生脂质代谢的变化[17]。随着天气和养殖密度等因素的变化,水体pH 也会随时发生改变,且中华绒螯蟹作为典型的底栖生物,其生活在水体地表沉积物表面,非常容易接触到PHE 和低pH 环境,在生产中若发生两者联合作用,会对养殖造成损失。为探究pH 和PHE 复合胁迫的毒性作用机制,本实验测定了不同pH 下PHE 进入中华绒螯蟹机体后,对其重要的呼吸器官鳃和代谢器官肝胰腺的损伤情况,以及对能量代谢主要场所肝胰腺中相关生化指标及基因表达的影响。
1 材料与方法
1.1 材料
中华绒螯蟹 [(15.0 ± 2.3) g] 采集自上海崇明,运送到上海海洋大学实验基地进行相关实验。实验开始前,所有的蟹均在含有碳过滤自来水 [溶解氧质量浓度8.0~8.5 mg·L-1、pH 7.8、温度 (20±2) ℃] 的脱氯水族箱 (100 cm×60 cm×50 cm) 中进行为期1 周的驯化适应,水箱中间均放置几个长形拱状瓦片作为隐蔽物。期间每2 d 投喂1 次商业饲料(浙江澳华公司),每天用虹吸法吸取多余饵料,每2 d进行1 次水体更新。
1.2 pH 和PHE 暴露实验建立
为研究低pH 和PHE 的联合效应,建立了阶乘设计:3 个pH 分别为5.5、6.5 和7.8 (5.5 为重度酸化,6.5 为中度酸化,7.8 为对照),2 个PHE 质量浓度 (0 和50 μg·L-1),分别为对照组pH 7.8×PHE 0,处理组pH 7.8×PHE 50、pH 6.5×PHE 0、pH 6.5×PHE 50、pH 5.5×PHE 0、pH 5.5×PHE 50。酸化条件根据有关的研究和整个酸化环境的预测[15,18]设定。将PHE 按照0.02% (质量分数) 溶解在二甲亚砜(DMSO) 中,配制成1 mg·L-1的母液,在DMSO 体积分数为 0.01%的情况下,向PHE 处理组中加入适量PHE 母液以达到目标PHE 质量浓度 (50 μg·L-1) 。实验中PHE 质量浓度 (50 μg·L-1) 的设置是参考虾蟹相关实验[18]和中国湖泊环境中的实际浓度[19],pH 的设定是基于本实验室的研究基础以及深度酸化的探讨[17]。健康蟹随机分组 (每组3 个重复,每个重复10 只蟹)。实验期间,使用便携式pH 计(HQ40D,美国Hach) 每4 h 检测1 次水体pH,用1 mol·L-1NaOH 和1 mol·L-1HCl 调节pH。每2 d 更换1 次胁迫水体,以保持实验性PHE 浓度。实验持续14 d,期间持续充氧,每周饲喂2 次商业饲料。
1.3 样品采集
实验14 d 后,对中华绒螯蟹进行4 ℃低温麻醉,而后每池取3 只蟹解剖采集鳃和肝胰腺,分别置于固定液中保存用于显微结构的观察,另外再采集3 只中华绒螯蟹肝胰腺置液氮速冻,-80 ℃保存待测。
1.4 实验方法
1.4.1 组织染色与观察
从不同的实验组中各采集3 只中华绒螯蟹,迅速取出肝胰腺和鳃组织,样品置于Bouin 氏液里固定24 h,经体积分数为70%、80%、95%、100% 梯度乙醇脱水,然后用二甲苯透明,石蜡包埋,使用手摇式切片机切片,厚度约为5 μm,最后用苏木精和伊红进行常规HE 染色,显微镜观察并拍照 (Leica TCS SP8,德国) 。
1.4.2 能量代谢指标的测定
肝胰腺样品以无水乙醇作为匀浆介质,经冰浴匀浆,离心提取上清后按试剂盒 (南京建成) 说明书测定甘油三酯(TG)、糖原 (Gly)、高密度脂蛋白胆固醇 (HDL-C) 和低密度脂蛋白胆固醇 (LDL-C)。
1.4.3 基因表达的测定
使用TRIozl 法对肝胰腺样本进行RNA 的提取,使用HiScript®II 1st Strand cDNA Synthesis Kit (+gDNA wiper) (南京诺唯赞) 对RNA 进行反转录生成cDNA,根据已报道的相关基因序列设计引物 (表1) 用于荧光定量PCR 检测。SYBR®PCR Kit (南京诺维赞) 用于荧光定量PCR 反应,反应条件为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,40 个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。基于2-∆∆Ct方法,分析基因的相对表达水平[20]。

表1 引物名称及序列Table 1 Primer names and sequnences
1.5 数据处理
数据采用Levene 检验法检测方差齐次性,pH 和PHE 2 个因素共同胁迫采用SPSS 22.0 软件进行双因素方差分析(Two-way ANOVA),同一因素胁迫采用SPSS 22.0 软件进行单因素方差分析 (One-way ANOVA),最后对实验结果采用Duncan's 法进行多重比较,采用t检验法检测同一pH 下PHE的毒性。实验结果以“平均值±标准差 ()”表示,P<0.05 为统计学差异显著。
2 结果
2.1 中华绒螯蟹肝胰腺和鳃组织结构
中华绒螯蟹肝胰腺由柱状上皮 (即肝小管) 构成,管腔(Lumen,Lu) 结构呈星型。PHE 胁迫下,pH 7.8 时肝胰腺星型结构稍有改变,且基膜脱落,细胞顶端微绒毛(Microvilli,MV) 部分脱落、微绒毛黏膜 (Enteric coat,EC)完整但R 细胞处出现空泡 (图1-a)。在pH 6.5 条件下,肝胰腺管腔扩张,但基膜没有明显脱落,微绒毛黏膜部分破损、B 细胞部分破损 (图1-b)。在pH 5.5 下,管腔结构明显扩张,部分柱状上皮细胞解体,细胞核固缩破碎,R 细胞出现萎缩、胞质空泡化,微绒毛黏膜破损 (图1-c)。
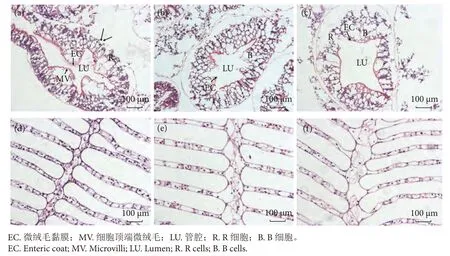
图1 中华绒螯蟹肝胰腺和鳃组织暴露在 PHE (50 μg·L-1) 和 pH (7.8、6.5 和 5.5) 中14 d 后的病理变化注:a.pH 7.8×PHE 50 组肝胰腺;b.pH 6.5×PHE 50 组肝胰腺;c.pH 5.5×PHE 50 组肝胰腺;d.pH 7.8×PHE 50 组鳃;e.pH 6.5×PHE 50 组鳃;f.pH 5.5×PHE 50 组鳃。Fig.1 Pathological changes of hepatopancreas and gill tissues of E.sinensis after exposure to PHE (50 μg·L-1) and pH (7.8,6.5 and 5.5) for 14 dNote: a.Hepatopancreas in pH 7.8×PHE 50 group; b.Hepatopancreas in pH 6.5×PHE 50 group; c.Hepatopancreas in pH 5.4×PHE 50 group;d.Gill in pH 7.8×PHE 50 group; e.Gill in pH 6.5×PHE 50 group; f.Gill in pH 5.5×PHE 50 group.
中华绒螯蟹幼蟹的鳃由数条形状规整的鳃丝以及一条鳃轴组成。鳃叶分为上皮层和血腔,而上皮层主要由角质层、上皮细胞层以及基膜组成。通过HE 染色法对中华绒螯蟹鳃组织的形态结构变化进行观察,所有处理组肝胰腺结构均有不同程度的改变 (图1)。PHE 胁迫下,pH 7.8 时鳃丝厚度变薄,局部基膜出现脱落,部分角质层表皮分离,近鳃腔部分有血细胞存在 (图1-d)。而在pH 6.5 条件下,鳃轴厚度变厚,但鳃丝的基膜完整,角质层表皮平整(图1-e) 。在pH 5.5 下,鳃丝形状扭曲,部分角质层表皮破损,基膜脱落,鳃轴出现空泡化 (图1-f)。
2.2 中华绒螯蟹肝胰腺能量代谢指标
如图2-a 所示,在PHE 0 μg·L-1组中,中华绒螯蟹TG 浓度随着pH 降低而显著降低 (P<0.05)。而在PHE 50 μg·L-1组中,pH 6.5 处理时,TG 浓度最高,且显著高于单独pH 6.5 处理 (P<0.05);pH 5.5 时,TG 浓度最低,且低于pH 7.8 条件下的TG 浓度。pH 和PHE 的交互作用对中华绒螯蟹TG 浓度有显著影响 (P<0.05,表2)。
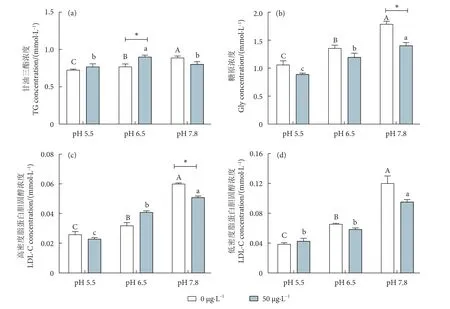
图2 不同 pH 条件下 PHE 浓度对中华绒螯蟹能量代谢指标的影响注:数值表示为“平均值±标准误”(n=3);方柱上方不同大写字母表示在PHE 0 μg·L-1 下差异显著 (P<0.05);不同小写字母表示在PHE 50 μg·L-1 下差异显著 (P<0.05);*表示相同pH 下组间差异显著 (P<0.05)。图3 同此。Fig.2 Effect of PHE concentration on energy metabolism indexes of E.sinensis under different acidification conditionsNote: Values are represented as Mean±SE (n=3); different uppercase letters above the columns represent significant differences at PHE 0 μg·L-1(P<0.05); different lowercase letters represent significant differences at PHE 50 μg·L-1 (P<0.05); * represents significant differences between the two groups at the same pH values (P<0.05).The same case in Fig.3.
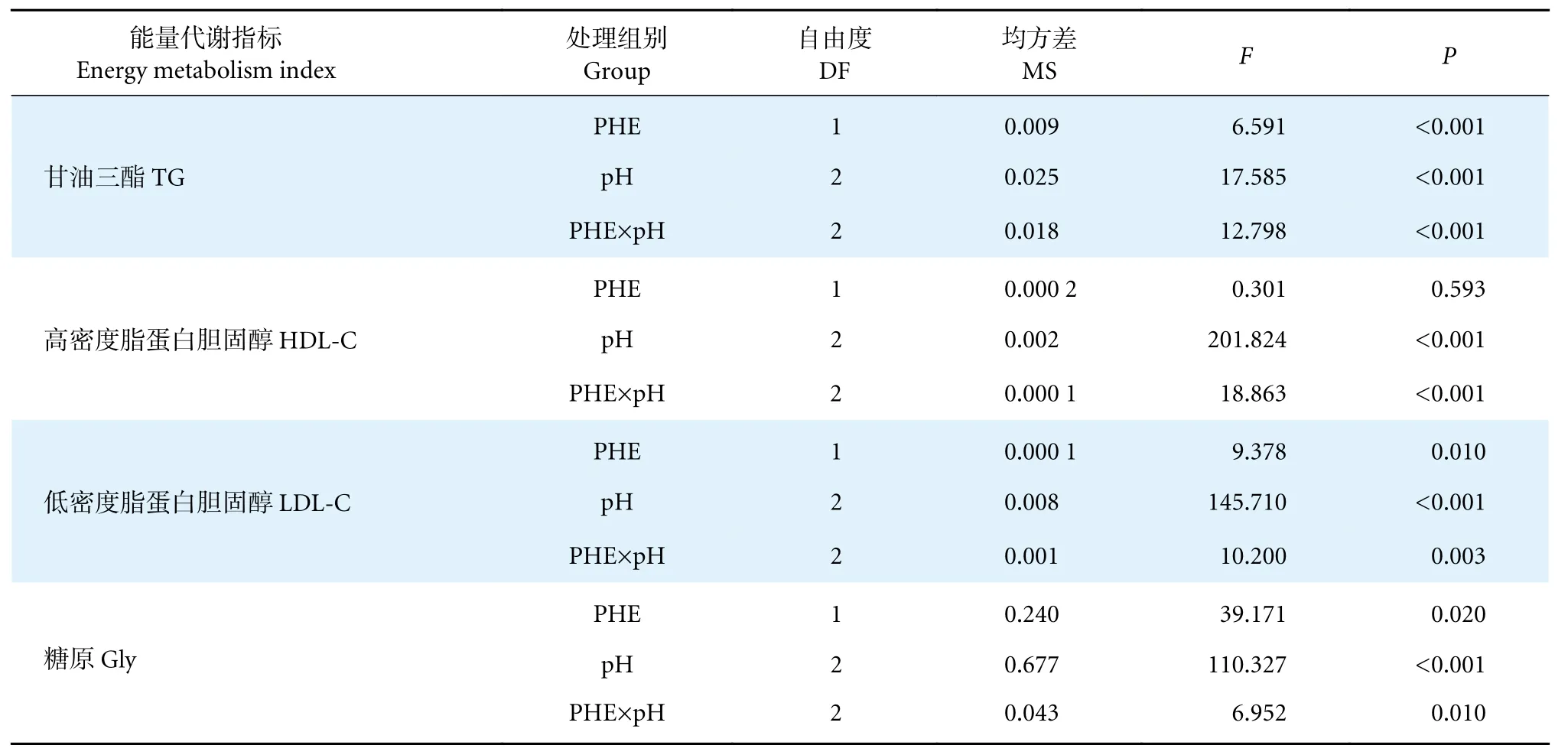
表2 pH 和 PHE 对中华绒螯蟹肝胰腺甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇和糖原含量影响的双因素方差分析Table 2 Two-way analysis of variance for influence of pH and PHE on contents of TG,HDL-C,LDL-C and Gly in E.sinensis hepatopancreas
与对照组 (pH 7.8×PHE 0) 相比,PHE 使得Gly 浓度显著降低 (P<0.05),在PHE 0 μg·L-1组中,Gly 浓度也随着pH 的降低而显著下降 (P<0.05,图2-b)。pH 和PHE 的交互作用对中华绒螯蟹Gly 浓度变化有显著影响 (P<0.05,表2)。在PHE 50 μg·L-1组中,Gly 浓度随着pH 降低而显著下降(P<0.05),在pH 5.5 时达到最低,为所有实验组中的最低值 (P<0.05,图2-b)。
HDL-C 也有相似的结果,无论是否存在PHE,pH 的降低均可导致中华绒螯蟹HDL-C 浓度显著降低 (P<0.05,图2-c),且pH 和PHE 的交互作用也对中华绒螯蟹HDLC 浓度有显著影响 (P<0.05,表2) 。
pH 和PHE 的交互作用对中华绒螯蟹的L D L-C浓度也有显著影响 (P<0.05,表2)。在PHE 0 μg·L-1组中,与pH 7.8 相比,pH 6.5 及pH 5.5 条件下LDL-C浓度均出现了显著降低 (P<0.05),且pH 5.5 组显著低于pH 6.5 组 (P<0.05)。在PHE 50 μg·L-1组中,pH 6.5 及pH 5.5 条件下LDL-C 浓度也出现显著下降 (P<0.05),但两组间无显著性差异 (P>0.05,图2-d)。
2.3 中华绒螯蟹肝胰腺中ahr、arnt、cyp1a1 基因表达水平
实时荧光定量PCR 检测了pH 和PHE 对中华绒螯蟹肝胰腺中的ahr、arnt、cyp1a1基因相对表达量的影响(图3)。在PHE 0 μg·L-1组中,与pH 7.8 组相比,pH 6.5 组ahr基因表达量显著降低 (P<0.05),而pH 5.5 组的ahr基因表达量则显著升高 (P<0.05)。在PHE 50 μg·L-1组中,随着pH 的降低,ahr基因表达量显著升高 (P<0.05),且在pH 6.5 及pH 5.5 条件下,均显著高于PHE 0 μg·L-1组(P<0.05,图3-a)。pH 5.5×PHE 50 组的ahr基因表达量为所有组中最高。pH 与PHE 的交互作用对ahr基因的表达量具有显著影响 (P<0.05,表3)。

图3 不同 pH 条件下 PHE 浓度对中华绒螯蟹肝胰腺基因表达量的影响Fig.3 Effect of different PHE concentrations on expression of hepatopancreas genes in E.sinensis under acidification conditions
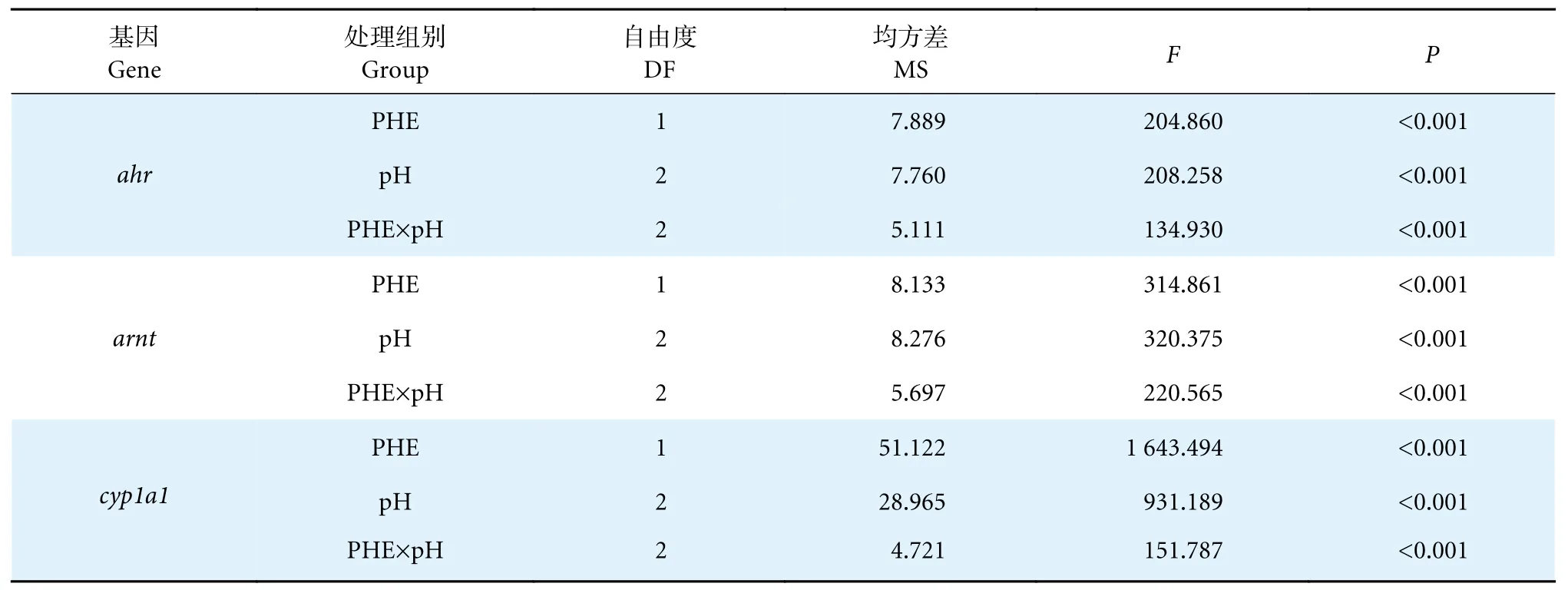
表3 pH 和 PHE 对中华绒螯蟹 ahr、arnt、cyp1a1 基因表达量影响的双因素方差分析Table 3 Two-way analysis of variance for effects of pH and PHE on ahr,arnt and cyp1a1 gene expression of E.sinensis
PHE 0 μg·L-1组中,与对照组相比,pH 5.5 和pH 6.5 处理均未使arnt基因表达量出现显著性变化 (P>0.05,图3-b) 。而在PHE 50 μg·L-1组中,随着pH 的降低,arnt基因的表达量随之显著升高 (P<0.05),且在pH 5.5 和pH 6.5 下,均显著高于PHE 0 μg·L-1组 (P<0.05,图3-b)。同样,pH 与PHE 的交互作用对arnt基因的表达量也有显著性影响 (P<0.05,表3)。pH 5.5×PHE 50 组的arnt基因表达量也为所有组中的最大值。
对于cyp1a1基因而言,在PHE 0 μg·L-1组中,与pH 7.8 组相比,pH 6.5 使cyp1a1基因的表达量显著降低(P<0.05) ,而pH 5.5 处理使cyp1a1基因的表达量显著升高(P<0.05,图3-c)。在PHE 50 μg·L-1组中,pH 的降低使得cyp1a1基因的表达量显著升高 (P<0.05,图3-c),在pH 5.5 条件下,cyp1a1的基因表达量最高。pH 和PHE 对cyp1a1基因的表达量有显著的交互作用 (P<0.05,表3)。
3 讨论
鳃是甲壳动物重要的呼吸器官,也是重要的渗透压和离子调节器官[21],肝胰腺是中华绒螯蟹的主要消化腺,因而环境污染物很可能对中华绒螯蟹的鳃和肝胰腺造成组织损伤。本研究中,PHE 对中华绒螯蟹的鳃和肝胰腺均造成了一定程度的损伤,这与一些污染物造成中华绒螯蟹组织损伤的研究相一致[15]。肝胰腺作为甲壳类动物的重要多功能器官,不仅参与食物消化吸收相关的消化酶的合成和分泌,且在能量代谢中具有重要作用[22]。中华绒螯蟹肝胰腺小管的R 细胞以及B 细胞顶端的微绒毛和微绒毛表面的黏膜对物质转运具有重要作用[14]。本研究中,不同pH 与PHE 联合作用均对其造成不同程度的损伤,说明PHE 对中华绒螯蟹呼吸和消化系统产生了影响,从而影响其能量代谢。同时R 细胞是重要的脂肪和糖原贮藏场所,且能量的消耗往往会导致细胞收缩和萎缩[23]。本研究中,在pH 7.8 及5.5 下,PHE 不仅使得肝小管细胞顶端的微绒毛和微绒毛表面的黏膜脱落破损,而且使得肝小管R 细胞萎缩、空泡化,说明在pH 7.8 及5.5 下,PHE 对中华绒螯蟹的糖代谢和脂代谢均产生了一定影响。因而相较于正常的pH,pH 6.5 在一定程度上缓解了PHE 对中华绒螯蟹的组织损伤,而pH 5.5 则加剧了PHE 对中华绒螯蟹肝胰腺的组织损伤,这也表明在极端环境下,生物体可能通过大量的能量消耗以抵御外界压力[24]。
此外,肝胰腺还被认为是多种环境应激的关键靶器官[17]。研究表明,当受到环境压力时,甲壳类动物需要额外的能量来维持体内平衡[25]。pH 作为水生动物生长发育重要的环境因子[26],其异常变化往往导致动物机体代谢失调,能量消耗增加[27]。TG、Gly、HDL-C、LDL-C 等物质的动态平衡对机体健康至关重要,它们在机体的免疫反应和抗氧化能力中发挥着重要作用[28-29]。本研究中,在pH 7.8 条件下,PHE 导致Gly 浓度显著降低,说明糖类是中华绒螯蟹遭受环境压力时优先利用的物质之一,这与对一些鱼类的研究相一致[30]。与中华绒螯蟹暴露于苯并芘 (Bap)中的研究结果也类似[31],说明PAHs 会引起中华绒螯蟹的能量消耗。而不同的pH 与PHE 的联合作用均使中华绒螯蟹肝胰腺Gly 显著降低,尤其在pH 5.5 条件下,PHE 对Gly 的影响最为显著,说明机体抵御环境压力时会产生能量损耗[24]。
对于TG 而言,单独的PHE 处理并未使中华绒螯蟹肝胰腺TG 发生显著改变,甚至在pH 6.5 下,PHE 诱导TG 浓度较单独PHE 处理组显著升高,这可能是中度的酸化诱导了中华绒螯蟹对外界环境的积极响应,某种程度上减轻了PHE 的毒性,降低了脂质的消耗[32]。但pH 5.5 与PHE 联合胁迫时,TG 浓度为所有组中最低,表明重度酸化加剧了PHE 对中华绒螯蟹糖代谢和脂代谢的影响。而HDL-C 和LDL-C 在胆固醇向组织运输的过程中起着重要作用[33-34],其在其他动物上的研究往往与“疾病”因素呈现负向关系[35]。本研究中,单独PHE 处理使得中华绒螯蟹肝胰腺HDL-C 浓度较对照组显著降低,表明低浓度的PHE 对中华绒螯蟹存在潜在风险。而不同程度pH 与PHE 的联合作用均对中华绒螯蟹HDL-C 产生了显著影响,尤其是pH 5.5×PHE 50 组,肝胰腺HDL-C 浓度为所有组中最低,表明酸化和PHE 协同处理对中华绒螯蟹能量代谢具有显著影响。与之相似,酸化和PHE 的联合作用也会使得LDL-C浓度显著降低。
pH 和PHE 的联合作用导致TG、Gly、HDL-C、LDL-C浓度的显著变化,尤其在pH 5.5 的重度酸化条件下,PHE 显著影响了中华绒螯蟹的能量代谢平衡。由此可见,不同环境应激源可能会产生协同效应,从而影响甲壳动物的能量代谢过程,这与铜 (Cu) 和土霉素 (Oxytetracycline)协同效应诱导了草鱼 (Ctenopharyngodonidella) 的脂质代谢的研究结果相一致[36]。
本研究中,PHE 显著促进了arnt和cyp1a1基因的表达,且酸化条件显著提高了ahr和arnt基因的表达,并最终导致cyp1a1基因表达量的显著升高。Holen 和Olsvik[37]同样发现PHE 对大西洋鳕 (Gadusmorhua)cyp1a1基因表达的诱导,同时还发现脂多糖 (Lipopolysaccharide) 和PHE 的交互作用对cyp1a1基因的显著诱导。Guo 等[38]报道了PAHs可以诱导菲律宾蛤仔 (Ruditapesphilippinarum) 中ahr基因的表达;Liu 等[39]发现苯并芘 (BaP) 可显著诱导栉孔扇贝(Chlamysfarreri) 中ahr基因的表达;低浓度BaP 可诱导栉孔扇贝中ahr和arnt基因的表达[40];Lima 等[41]在牡蛎(Crassostreagasar) 中也发现pH 和PHE 协同效应对cyp家族基因的诱导。这与本研究结果一致,本实验也发现pH与PHE 协同作用可诱导中华绒螯蟹cyp1a1基因的表达。
ahr基因与脂类代谢以及能量代谢有重要关联,有研究指出ahr对哺乳动物脂质代谢具有调控作用[42],多氯联苯或ahr配体暴露导致鱼类肝糖原浓度降低的研究也有相关报道[43]。本研究也阐明了PHE 对中华绒螯蟹脂质代谢产生影响的重要原因,而过度的酸化与PHE 产生交互效应,显著影响了中华绒螯蟹的能量代谢。相关研究指出,在无脊椎动物中,PAHs 的解毒代谢经由I 相的AHR-ARNT 信号通路以及II 相的谷胱甘肽-S-转移酶 (GST) 代谢进行,期间产生大量的活性中间体和活性氧 (Reactive oxygen species,ROS),干扰水生生物的正常生理功能[44]。因此,pH 和PHE 协同作用可能对中华绒螯蟹能量代谢及抗氧化系统产生影响。
本研究结果表明,从组织结构方面,pH 6.5 可以缓解PHE 的毒性作用;从能量代谢、基因表达方面,随着pH 的降低,PHE 毒性的影响也随之增强。
——鞭毛、纤毛和微绒毛(2)

