长江鲟幼鱼黏液、肠道内容物及其养殖水体的微生物菌群结构和潜在病原菌分析
田 甜,张建明,朱 欣,张德志,舒婷婷
中国长江三峡集团有限公司中华鲟研究所/三峡工程鱼类资源保护湖北省重点实验室,湖北 宜昌 443100
像哺乳动物一样,鱼类的微生物主要集中在体表和消化道,并形成了相应的菌群结构,对宿主的健康发育和生长具有重要作用。鱼类体表是保护机体的一道重要屏障,体表分泌的黏液构成了鱼体与水环境的隔离界面[1],成为防御入侵的第一道防线,同时也是鱼体天然免疫的重要组成部分[2]。肠道微生物菌群数量丰富、结构复杂,被称为宿主的额外器官,具有维持宿主营养吸收[3]、免疫调控[4]、生长发育[5]等重要作用。鱼类的肠道微生物系统是后天形成的,其菌群结构与宿主自身发育状态、养殖环境和饵料种类密切相关。鱼类生活在水中,水中含有复杂多样的微生物,其皮肤黏液和肠道更容易受到水环境的影响。Giatsis 等[6]认为水环境对孵化后罗非鱼 (Oreochromismossambicus) 肠道微生物的最初定殖起到了重要作用。因此,鱼类和体表黏液、肠道、水环境中的微生物互相依赖、互相制约、动态平衡才能保证宿主的健康生长。
研究发现不同生境导致草鱼 (Ctenopharyngdon idellus) 前肠微生物组成差异较大:自然生境的优势菌属是不动杆菌属 (Acinetobacter) 和贪铜菌属(Cupriavidus);高密度池塘养殖生境的优势菌属是鲸杆菌属 (Cetobacterium) 和希瓦氏菌属 (Shewanella);低密度池塘生境的优势菌属是链球菌属(Streptococcus) 和消化链球菌属 (Peptostreptococcus)[7]。樊英等[8]采用16S rRNA 高通量测序技术分析大泷六线鱼 (Hexagrammosotakii) 表皮黏液和肠道内容物的微生物多样性,结果显示表皮黏液和肠道内容物的微生物既有相似性又有差异性,二者共有操作分类单元 (Operational Taxonomic Unit,OTU) 数量为33 个,表皮黏液具有更高的微生物多样性,而肠道内容物具有更高的微生物丰富度。郝佳慧等[9]通过Illumina MiSeq 扩增子高通量测序技术分析了小头裸裂尻鱼 (Herzensteiniamicrocephalus) 的皮肤黏液、肠道黏膜和肠道内容物间微生物菌群的组成差异,发现皮肤黏液微生物多样性最高,肠道黏膜和肠道内容物之间微生物多样性差异较小,3 个部位的优势菌门均以放线菌门、变形菌门、厚壁菌门、绿弯菌门和蓝藻门为主。已有众多针对不同鱼类体表黏液、肠道和不同养殖环境开展的单一或两者之间的微生物菌群结构研究[10-12],但鲜见对鱼类体表黏液、肠道以及养殖水环境三者之间联合开展的菌群结构和动态分析研究。
长江鲟 (Acipenserdabryanus) 是中国特有鱼类,主要分布于长江上游干流以及部分重要支流[13]。近年来,由于环境污染、过度捕捞、生境破坏等因素的影响,其自然种群资源急剧下降,已被国际自然保护联盟 (International Union for Conservation of Nature,IUCN) 列为极危级 (CR) 物种。对长江鲟开展科学、有效的人工养殖工作仍是维持其种群数量的关键。本研究采用Illumina 高通量测序技术,探究了长江鲟幼鱼黏液、肠道内容物及其养殖水体的微生物菌群组成、多样性及动态变化,以期为长江鲟幼鱼的健康养殖和病害分析提供参考依据。
1 材料与方法
1.1 实验材料
实验所用长江鲟幼鱼由中华鲟研究所2022 年春季自主繁育。2022 年6—9 月单养在直径4 m、水深0.8 m 的圆形流水养殖池。水源为井水和塘水混合水,6、7 和9 月每日投喂2 次鲟鱼配合饲料,投喂量约为鱼体质量的1%;8 月水温升高,调整为每日投喂1 次鲟鱼配合饲料,投喂量约为鱼体质量的0.5%。养殖期间每日排污2 次,换水量约为20%,每周开展常规水质监测。
1.2 样品采集
春夏季节,水温适宜,各种病原体容易滋生繁殖,是鱼类疾病的高发期。2022 年6—9 月期间,每月对长江鲟幼鱼开展一次体表黏液、肠道内容物及其养殖水体样品的采集工作,每种样品设置6 个平行。黏液样品和肠道内容物样品的采集方法为:随机挑取6 尾鱼,在2 mL 无菌EP 管中加入1 mL无菌水,用无菌镊轻轻刮取鳍条、腹部、体侧及背部黏液与无菌水混合均匀,于—80 ℃保存备测。随后,用75% (φ) 乙醇棉球对鱼肛门、腹部及体侧进行消毒,用无菌解剖剪从腹部剪开,取出肠道,用无菌PBS 缓冲液冲洗3 次,无菌棉球擦拭干燥后将瓣肠、直肠肠道内容物置于2 mL 无菌EP 管中,于—80 ℃保存备测。同时,采集与黏液、肠道样品同时期的养殖水体样品,采集方法为:在养殖池3 个对角线点分别用无菌水样采集袋采集500 mL水样,3 个水样混合均匀,用0.22 μm 滤膜抽滤收集菌体,—80 ℃保存备测。
1.3 16S rRNA 高通量测序
采集的全部样品于干冰保存送至上海美吉生物医药科技有限公司进行16S rRNA 高通量测序。具体流程如下:利用Fast DNA®Spin Kit for Soil (MP Biomedical,美国) 试剂盒提取黏液、肠道内容物及其水环境微生物总DNA,用1% (w) 琼脂糖凝胶电泳检测DNA 的质量。使用V3—V4 变异区引物(338F-806R) 进行PCR 扩增,产物经回收、纯化后进行定量和均一化处理,构建文库并通过Illumina Miseq PE300 平台进行高通量测序。
1.4 数据处理及生物信息学分析
在美吉生物云平台完成数据处理及生物信息学分析工作。使用Fastp 0.19.6 软件对测序得到的原始数据进行质控,使用Flash 1.2.11 软件进行拼接。使用Uparse 11 软件根据97%的相似度对序列进行OTU 聚类并剔除嵌合体。采用PDR Classifier 2.13 软件对每条序列进行物种注释分类,设置比对阈值为70%,比对Silva 16S rRNA 数据库。按照最小样本序列数对数据抽平处理后,进行物种组成分析、Alpha 和Beta 多样性分析、潜在病原菌分析及功能预测分析,采用Kruskal-Wallis 秩和检验开展指数间差异检验。
2 结果
2.1 测序结果分析
共计采集到长江鲟幼鱼黏液、肠道内容物、养殖水体样品72 个,PCR 扩增显示69 个样品满足实验要求,测序结果显示69 个样品共计获得3 462 138条高质量序列,有效序列的平均长度为417 bp。对有效序列进行97% 的相似性聚类,可划分为4 349 个OTUs,鉴定出50 门、154 纲、381 目、632 科、1 306 属、2 360 种。各样品稀释曲线显示稀释曲线已到达平台期 (图1),表明本次测序几乎已覆盖所有的细菌,可真实反映出细菌的群落结构和多样性。
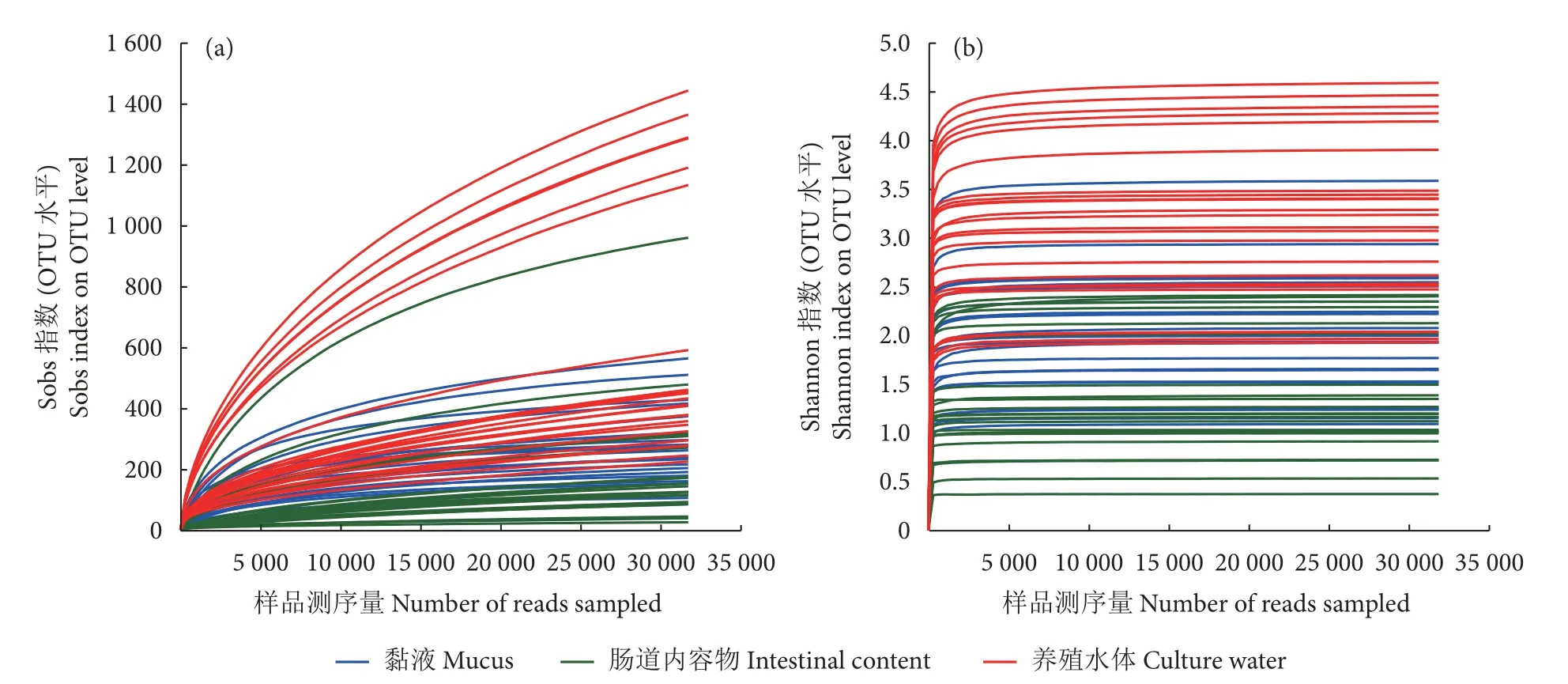
图1 样品稀释曲线Fig.1 Rarefaction curves and Shannon curves of different samples
2.2 多样性分析
Venn 图分析显示,长江鲟幼鱼黏液、肠道内容物和养殖水体共有OTUs 数量为485 个,养殖水体特有OTUs 数量最多 (1 229 个),黏液和肠道内容物特有OTUs 数量相似,分别为680 和691 个(图2)。三者之间微生物多样性存在差异。Chao 指数和Ace 指数显示,黏液和肠道内容物微生物物种丰富度无显著性差异,二者均极显著低于养殖水体(P<0.001,图3-a、3-b)。Shannon 指数和Simpson指数显示,养殖水体微生物的物种多样性最高、黏液次之、肠道内容物最低 (图3-c、3-d)。基于bray_curtis 的PCoA 分析显示,黏液和肠道内容物样本部分重叠 (图4-a),说明二者的菌群差异较小,而养殖水体与二者间有一定距离,说明它们之间的菌群具有差异。基于相同距离算法的样本层级聚类分析将样本明显分成2 个簇 (图4-b),其中黏液和肠道内容物聚为一簇,养殖水体单独为一簇,表明黏液和肠道内容物菌群更为相似,且可与养殖水体菌群区分开来。
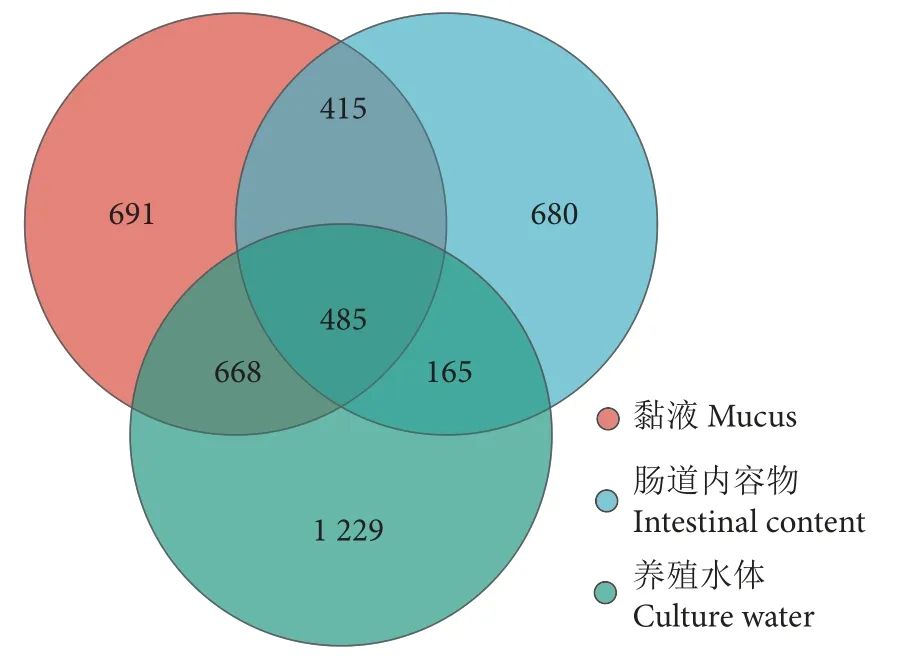
图2 黏液、肠道内容物及其养殖水体 OTUs 分布 Venn 图Fig.2 Venn diagram analysis of mucus,intestinal content and culture water
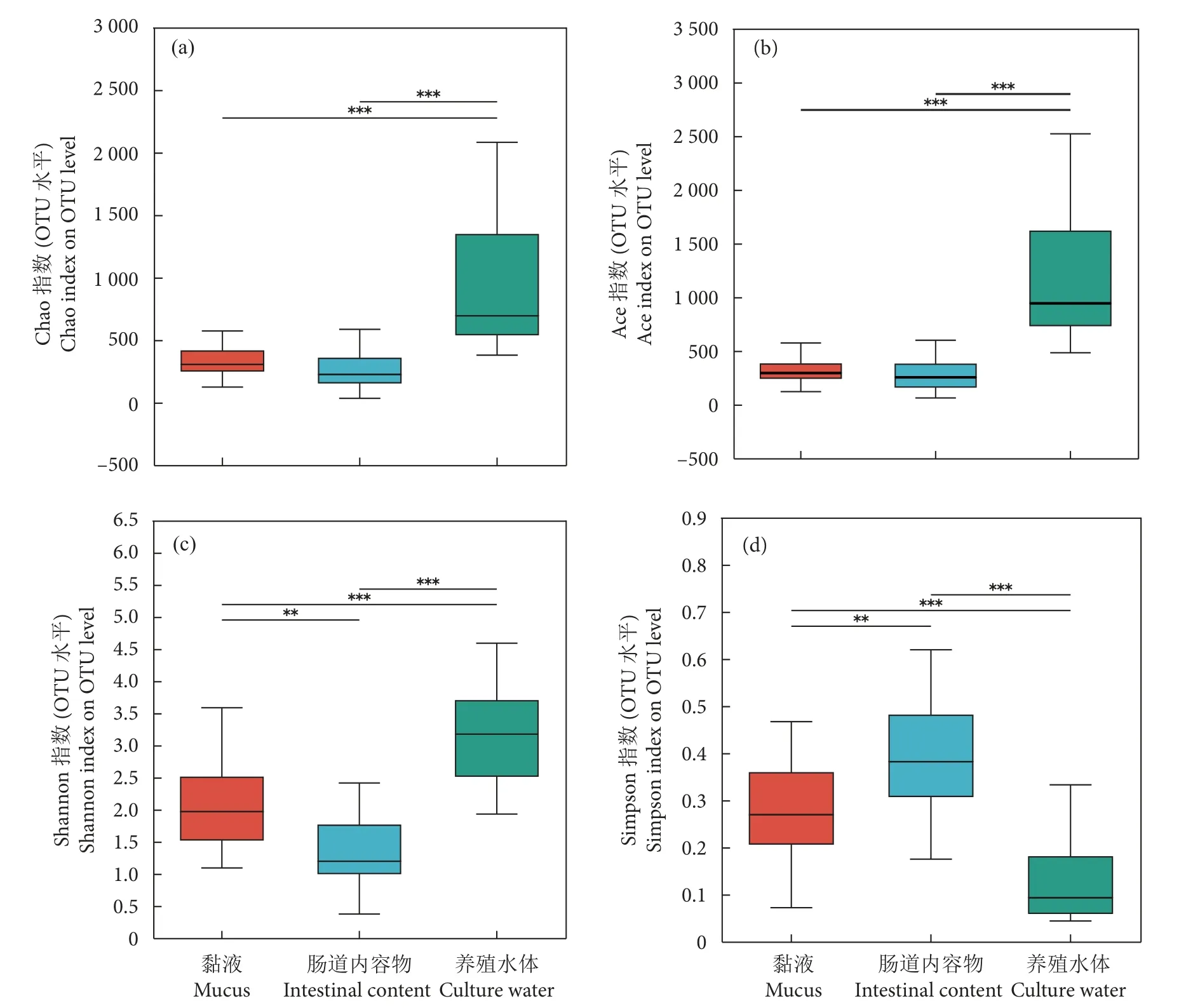
图3 黏液、肠道内容物及其养殖水体中微生物的 Alpha 多样性指数间差异检验注:*.P<0.05;**.P<0.01;***.P<0.001。Fig.3 Alpha diversity difference of microorganism in mucus,intestinal content and culture waterNote: *.P<0.05; **.P<0.01; ***.P<0.001.
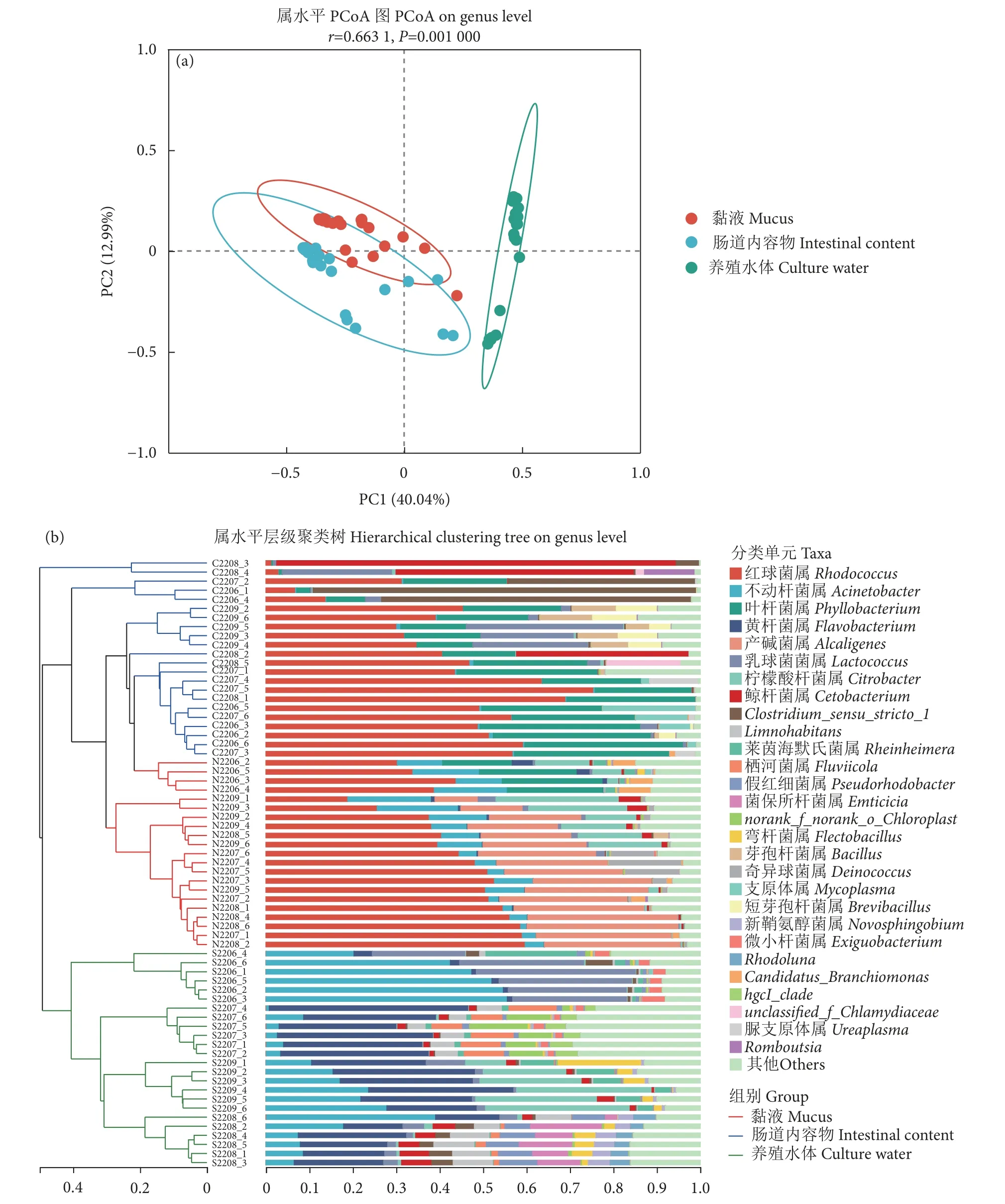
图4 黏液、肠道内容物及养殖水体中微生物的 Beta 多样性注:a.PCoA 图 (属水平);b.样本层级聚类树 (属水平)。Fig.4 Beta diversity of bacteria in mucus,intestinal content and culture waterNote: a.PCoA on genus level; b.Hierarchical clustering tree on genus level.
2.3 物种组成及变化分析
在门水平,长江鲟幼鱼黏液和肠道内容物微生物优势菌门较为相似,均以放线菌门、变形菌门和厚壁菌门为主,不同门类的排列顺序有所差异(图5-a、5-b)。6—9 月期间,黏液微生物优势菌门变幅不大,而肠道内容物微生物中梭杆菌门在8 月明显增加,在9 月明显减少并趋于正常,这可能与高温季节投喂频率和投喂量下降有关。养殖水体微生物优势菌门依次为变形菌门、拟杆菌门和厚壁菌门,与前两者优势菌门有所差异 (图5-c)。6 月,养殖水体中排名前三的优势菌门分别为变形菌门 (占比58.91%)、厚壁菌门 (35.60%) 和拟杆菌门 (3.46%)。7 月,养殖水体微生物优势菌门发生改变,拟杆菌门成为第一优势菌门 (占比46.80%),变形菌门下降至25.45%,厚壁菌门下降至3.16% (图5-c)。8—9 月,开始重新建立新的平衡。9 月,变形菌门恢复为第一优势菌门 (占比60.29%),拟杆菌门成为第二优势菌门 (占比34.08%),厚壁菌门占比3.07%。6—9 月,养殖水体优势菌门排序发生变化可能与高温、枯水期水源改变有关。
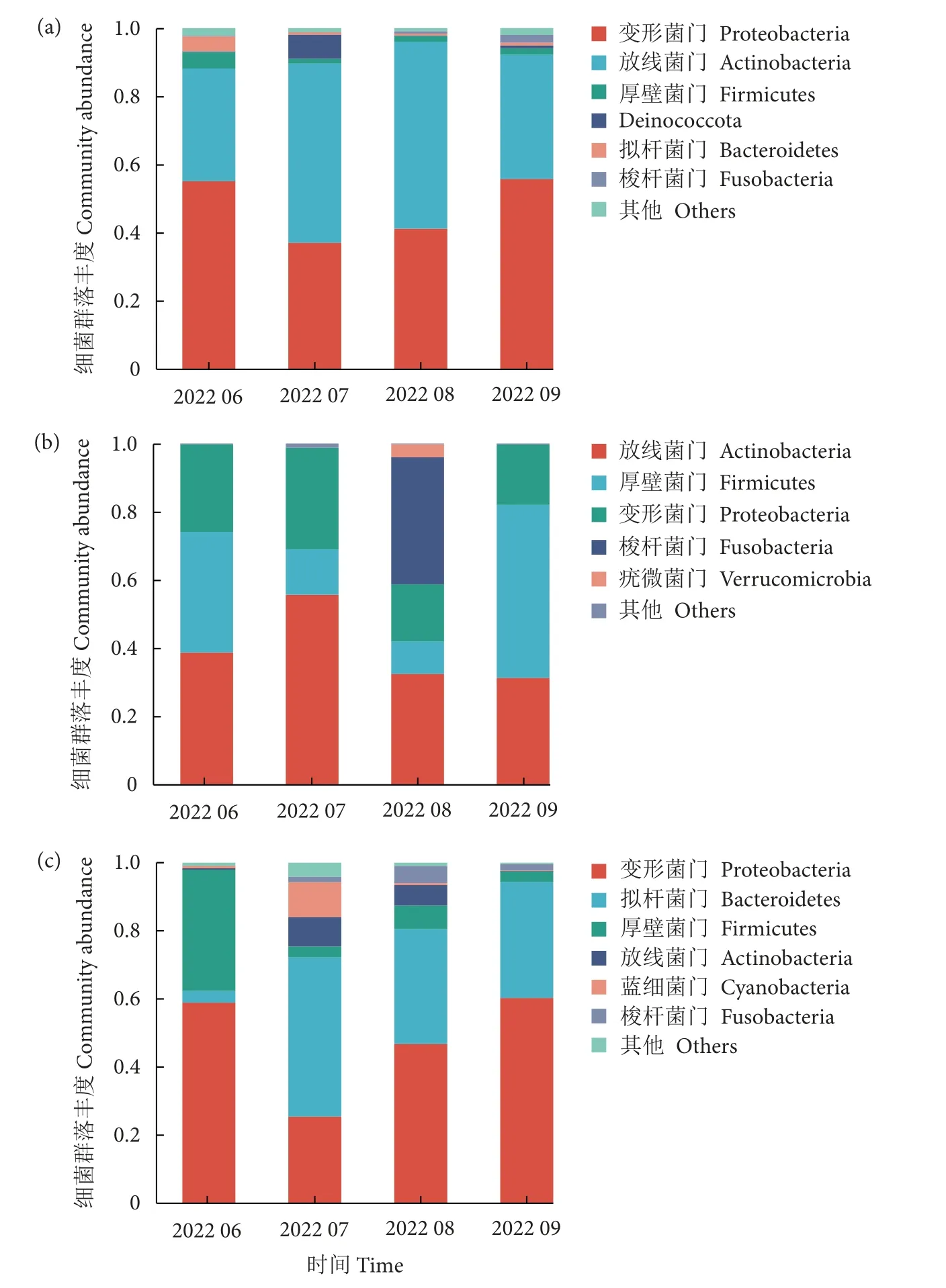
图5 黏液 (a)、肠道内容物 (b) 及养殖水体中 (c) 微生物在门水平的菌群结构组成Fig.5 Dominant species of bacteria in mucus (a),intestinal content (b) and culture water (c) on phylum level
在属水平,长江鲟幼鱼黏液优势菌群为红球菌属 (Rhodococcus)、产碱菌属 (Alcaligenes)、不动杆菌属、柠檬酸杆菌属 (Citrobacter) 和叶杆菌属(Phyllobacterium) (图6-a)。6 月以红球菌属 (占比31.25%)、叶杆菌属 (17.72%) 和不动杆菌属(14.53%) 为主;7 月叶杆菌属、不动杆菌属占比降低,优势菌属变为以红球菌属 (51.13%)和产碱菌属 (28.07%) 为主;8 月仍以红球菌属 (53.91%)、产碱菌属 (30.40%) 为主;9 月以红球菌属 (35.06%)、产碱菌属 (19.81%)、柠檬酸杆菌属 (16.16%) 和不动杆菌属(13.11%) 为主。肠道内容物优势菌属为红球菌属、叶杆菌属、鲸杆菌属、乳球菌属 (Lactococcus) 和Clostridium_sensu_stricto_1(图6-b)。6 月以红球菌属 (38.25%)、Clostridium_sensu_stricto_1(26.69%) 和叶杆菌属 (24.95%) 为主;7 月Clostridium_sensu_stricto_1占比大幅下降,以红球菌属(54.60%) 和叶杆菌属 (27.59%) 为主;8 月,随着投喂频率和投喂量的下降,鲸杆菌属成为第一大优势菌属 (37.43%),其次为红球菌属 (32.20%),叶杆菌属 (14.76%) 为第三大优势菌属;9 月,红球菌属恢复为第一优势菌属 (30.28%),乳球菌属激增成为第二大优势菌属 (29.32%),叶杆菌属为第三大优势菌属 (14.86%)。养殖水体中优势菌属为黄杆菌属(Flavobacterium)、不动杆菌属、乳球菌属和柠檬酸杆菌属 (图6-c)。6 月以不动杆菌属 (45.37%) 和乳球菌属 (28.57%) 为主;随着水温升高和枯水期水源改变,7—8 月菌群种类更加丰富,打破原有平衡,黄杆菌属成为第一优势菌属;9 月形成以黄杆菌属 (28.30%)、柠檬酸杆菌属 (24.12%) 和不动杆菌属 (19.40%) 为主的新平衡。
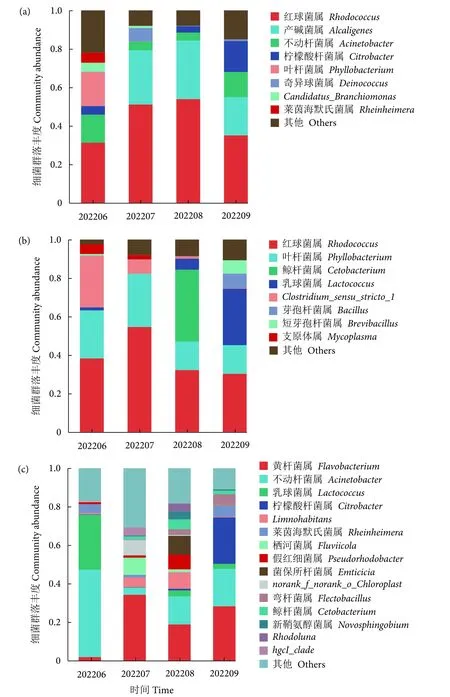
图6 黏液 (a)、肠道内容物 (b) 及养殖水体中 (c) 微生物在属水平的菌群结构组成Fig.6 Dominant species of bacteria in mucus (a),intestinal content (b) and culture water (c) on genus level
2.4 潜在病原菌的分析
对OTU 丰度进行统计,选择丰度前50 个OTUs 在属水平进行热图分析,以展示潜在病原菌在黏液、肠道内容物和养殖水体中的分布情况(图7)。发现柠檬酸杆菌属、不动杆菌属、黄杆菌属、爱德华氏菌属 (Edwardsiella)、假单胞菌属(Psedomonas)、邻单胞菌属 (Plesiomonas) 和气单胞菌属 (Aeromonas) 共计7 种潜在病原菌菌属。养殖水体中潜在病原菌分布最广,以柠檬酸杆菌属、不动杆菌属、黄杆菌属、邻单胞菌属和气单胞菌属为主;黏液次之,以柠檬酸杆菌属、不动杆菌属和邻单胞菌属为主;肠道内容物中各病原菌属分布较窄。
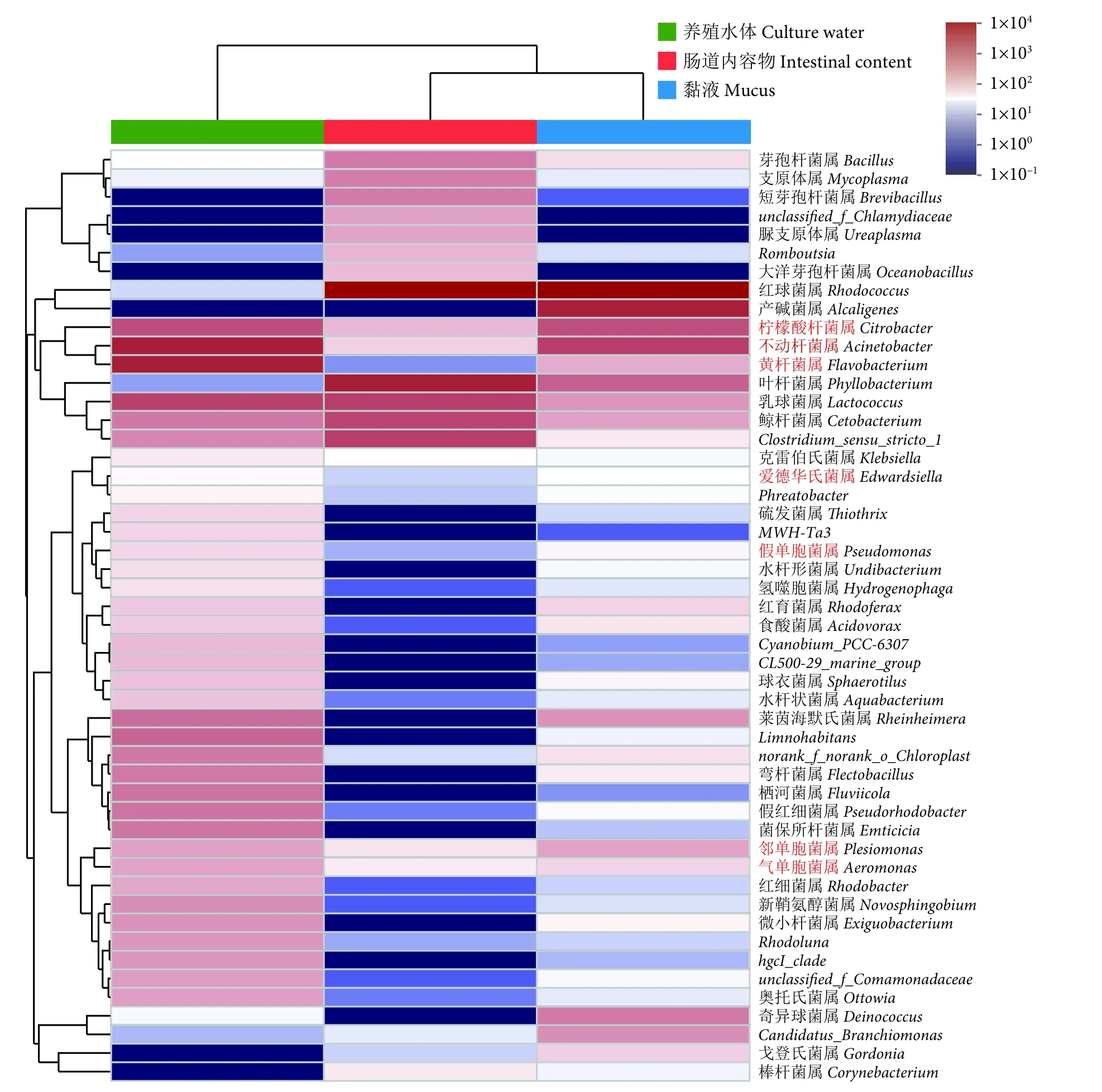
图7 属水平下黏液、肠道内容物及其养殖水体中微生物组成热图Fig.7 Heatmap of microbial communities in mucus,intestinal content and culture water on genus level
2.5 表型预测分析
为进一步了解长江鲟幼鱼黏液、肠道内容物及养殖水体微生物菌群的功能轮廓,利用BugBase 对细菌表型进行预测。BugBase 表型预测分析开展了革兰氏阳性、革兰氏阴性、厌氧、兼性厌氧、好氧和潜在致病性共计6 种表型特征。结果显示,肠道内容物以革兰氏阳性菌为主 (占比62.57%,图8-a),黏液和养殖水体以革兰氏阴性菌为主,分别占比59.70% 和71.18% (图8-b)。在厌氧菌组成方面,肠道内容物厌氧菌丰度最高,养殖水样次之,黏液厌氧菌丰度最低 (图8-c);在兼性厌氧菌组成方面,养殖水体兼性厌氧菌显著高于黏液和肠道内容物 (图8-d);在好氧菌组成方面,黏液好氧菌丰度为79.87%,肠道内容物为62.73%,养殖水体为37.31% (图8-e)。有潜在致病性的菌群主要富集在养殖水体和黏液中,远高于肠道内容物(图8-f)。
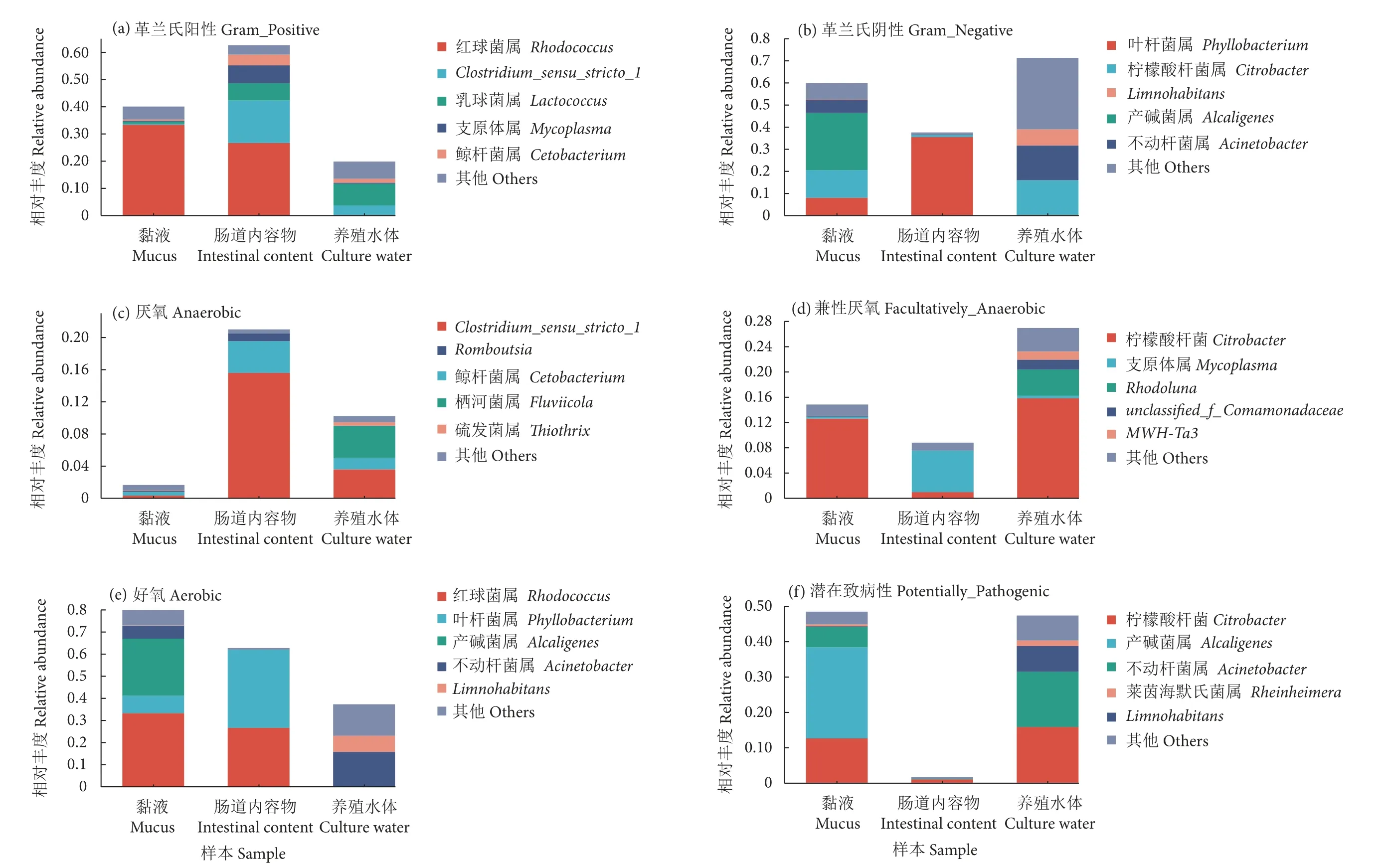
图8 利用BugBase 对黏液、肠道内容物及养殖水体中微生物菌群表型进行预测分析Fig.8 Phenotype analysis of bacteria in mucus,intestinal content and culture water by BugBase
3 讨论
微生物是生命世界中丰富多样的生物资源,不同来源的微生物表现出不同的菌群结构和特征。本研究对长江鲟幼鱼黏液、肠道内容物及养殖水体的微生物菌群结构进行分析,结果显示三者间的菌群结构兼具相似性和差异性。鱼类表皮细胞分泌大量黏液,其微生物群落结构会受到物种、饵料、发育进程以及健康状态的影响,但这些影响随着宿主发育而逐渐减弱[14]。鱼类体表黏液根据自身需要建立特定菌群,并在特定发育时期保持相对稳定[15]。研究认为鱼类黏液微生物菌群结构和功能与肠道具有相似性[16]。本研究中,Alpha 和Beta 多样性分析表明黏液和肠道内容物微生物菌群结构更为相似,且可与养殖水体微生物菌群区分开来。推测可能是鱼类体表黏液和肠道与机体互利共存、相互作用的结果。养殖水体中存在大量的微生物,它们参与各项物质循环,维持整个养殖系统的生态平衡[17]。研究表明,斑点叉尾鮰 (Ictalunespunctatus)[18]、大菱鲆 (Scophthalmusmaximus)[19]、花鲈 (Lateolabraxjaponicus) 和日本黄姑鱼 (Nibeajaponica)[20]肠道的微生物多样性低于养殖水体。本研究结果与上述结果一致,Alpha 多样性分析结果显示,长江鲟幼鱼肠道内容物中微生物的菌群丰富度和多样性低于同时期养殖水体,且差异显著 (P<0.001)。
在门水平,虹鳟 (Oncorhynchusmykiss) 体表黏液以变形菌门和拟杆菌门为主[21];小头裸裂尻鱼体表皮肤的优势菌门为放线菌门和变形菌门[9]。变形菌门、厚壁菌门、梭杆菌门是大口黑鲈 (Micropterussalmoides) 肠道菌群的优势菌门[22];变形菌门、放线菌门和拟杆菌门是玫瑰高原鳅 (Triplophysarosa) 肠道的主要菌群[23];变形菌门、拟杆菌门和厚壁菌门是石首鱼 (Aplodinotusgrunniens) 肠道的优势菌门[24]。本研究发现,长江鲟幼鱼黏液和肠道内容物的优势菌门较为相似,均为放线菌门、变形菌门和厚壁菌门,与上述学者的研究结果有所差异。可能是由于不同组织来源、不同种类的微生物菌群因其宿主特征、饵料种类、组织特性不同,其优势菌门会呈现不同组成变化。本研究显示6—9 月期间各门类比例呈现动态变化,其中黏液动态变幅不大,而肠道内容物在8 月出现梭杆菌门明显增加,9 月明显下降恢复正常的现象。这可能与8 月水温升高降低日投喂量和投喂频率,9 月恢复正常投喂有关。这提示我们改变投喂策略可以直接影响肠道优势菌门的组成。
在门水平对养殖水体优势菌群进行研究,结果表明辽宁长海刺参 (Apostichopusjaponicus) 养殖池水体[25]和凡纳滨对虾 (Litopenaeusvannamei) 异养、自养型生物絮团[26]以变形菌门和拟杆菌门为主;4 种鲟鳇网箱养殖水体优势菌门由变形菌门、放线菌门和拟杆菌门等组成[27]。本研究养殖水体中变形菌门、拟杆菌门和厚壁菌门占优势地位,与上述结果相一致。同时,本研究发现养殖水体随外界因素影响呈现动态变化。6 月,优势菌门排列由高到低依次为变形菌门、厚壁菌门和拟杆菌门。7 月,枯水期水源改变导致拟杆菌门成为第一优势菌门,变形菌门降至第二。9 月,水源逐步趋于稳定,形成以变形菌门、拟杆菌门、厚壁菌门为主的新平衡状态。变形菌门是细菌中最大的一个门,具有利用碳源,去除氮与磷,降解有机物等作用[28-29]。拟杆菌门作为第二优势菌门,在降解生物大分子、发酵碳水化合物、参与碳循环等方面具有重要作用[30-31]。
在属水平,长江鲟体表黏液优势菌属为红球菌属、产碱菌属、不动杆菌属、柠檬酸杆菌属和叶杆菌属;肠道内容物优势菌属为红球菌属、叶杆菌属、鲸杆菌属、乳球菌属和Clostridium_sensu_stricto_1;养殖水体中优势菌属为黄杆菌属、不动杆菌属、乳球菌属和柠檬酸杆菌属。其中黏液和肠道内容物共同优势菌属2 个,且第一优势菌属相同,黏液和养殖水体共同优势菌属2 个,肠道内容物和养殖水体共同优势菌属1 个。鱼体黏液与水环境密切接触,水环境中含有复杂多样的微生物群落,但物种组成分析结果和多样性结果均显示黏液与养殖水体的相似性低于其与肠道的相似性。推测产生此现象的原因有两种:1) 黏液作为机体的第一道防御屏障,含有大量的土著微生物,水环境中的微生物难以定殖成功,其在水环境中会选择自身需要的微生物并构建特定的群落;2) 黏液和肠道共同与宿主互相作用、互相影响,宿主利用各种防御机制将二者中的微生物群落维持在一定的范围,以保障机体健康生长。
水产养殖中,细菌性疾病是制约养殖成活率的一大瓶颈[32-33]。众所周知,条件病原菌广泛存在于养殖环境和鱼体内外,当鱼体体质下降或外界环境恶化极易导致病害的发生。已报道的鲟鱼病害研究显示,柱状黄杆菌 (Flavobacteriumcolumnare) 可导致中华鲟 (A.sinensis) 患烂鳃病[34];嗜水气单孢菌(Aeromonashydrophila)[35-36]、维氏气单胞菌 (A.veronii)[37]、迟缓爱德华氏菌 (Edwardsiellatarda)[38]、弗氏柠檬酸杆菌 (Citrobacterfreundii)[39]可导致西伯利亚鲟 (A.baerii)、达氏鲟、中华鲟患细菌性败血症;恶臭假单胞菌 (Pseudomonasputida) 可导致杂交鲟 (Husodauricus♀×Acipenserschrenckii♂) 患肠炎病[40];停乳链球菌 (Streptococcusdysgalactiae)[41]、海豚链球菌 (S.iniae)[42]可导致俄罗斯鲟 (A.gueldenstaedti)、波斯鲟 (A.persicus) 患链球菌病;偶发分枝杆菌 (Mycobacteriumfortuitum)[43]、龟分枝杆菌 (M.chelonae)[44]、海分枝杆菌 (M.marinum)[45]可导致小体鲟 (A.ruthenus)、俄罗斯鲟、中华鲟患分枝杆菌病。本研究通过对丰度前50 个OTUs 在属水平进行热图分析,发现潜在病原菌在长江鲟幼鱼黏液、肠道内容物及养殖水体中普遍存在,共计发现7 个潜在病原菌属:柠檬酸杆菌属、不动杆菌属、黄杆菌属、爱德华氏菌属、假单胞菌属、邻单胞菌属和气单胞菌属。提示在养殖过程中容易发生烂鳃病、肠炎病和细菌性败血症。潜在病原菌在三者之间的分布关系为养殖水体最广、黏液次之、肠道内容物最窄,表明在适宜的条件下,潜在病原菌可能会由外向内导致上述疾病的发生。
通过BugBase 对细菌表型进行预测分析发现,长江鲟幼鱼黏液、肠道内容物及养殖水体中存在革兰氏阴性菌和阳性菌。其中肠道内容物的优势菌群为革兰氏阳性菌,占比超过60%;黏液和养殖水体的优势菌群均为革兰氏阴性菌,占比分别为60%和70%。研究发现达氏鳇 (Husodauricus)[46]和大泷六线鱼幼鱼[47]肠道中革兰氏阳性菌分别占比80% 和56%,与本研究结果相似。这与梭菌属、乳球菌属等革兰氏阳性菌的功能有关,它们可以在肠道中发酵碳水化合物、利用蛋白质和糖分,帮助鱼类从饵料中获取营养和能量[48-49]。已有研究显示小头裸裂尻鱼皮肤黏膜微生物中革兰氏阴性菌占比约为50%[9],南极中山站上层海水微生物中革兰氏阴性菌占比约为60%[14],二者革兰氏阴性菌比例均小于本研究,这可能与物种、水源以及发育进程的影响相关。在氧气需求方面,黏液和肠道内容物以好氧菌为主;养殖水体以好氧菌和兼性厌氧菌为主。与黏液和养殖水体相比,肠道内容物中含有更多的厌氧菌,Clostridium_sensu_stricto_1在肠道厌氧菌中占比超过70%,成为优势菌属。Clostridium_sensu_stricto_1具有促进短链脂肪酸(SCFAs) 产生,改善肠道微生物结构的作用[50]。在人类医学研究中发现,Clostridium_sensu_stricto_1可以通过阻碍病原微生物的定殖进而增强婴儿肠道中细菌的耐药性[51]。潜在致病性菌群在养殖水体和黏液中占比均超过45%,远远高于肠道内容物(0.2%)。由此可见,养殖水体和黏液中存在着大量的条件致病菌,当鱼体处于应激状态或养殖环境恶化时,可能导致病害的发生。
4 结论
本研究利用高通量测序技术对长江鲟幼鱼黏液、肠道内容物及养殖水体的微生物多样性进行了研究。发现养殖水体的微生物多样性最高、黏液次之、肠道内容物最低。黏液和肠道微生物菌群结构更为相似,且可与养殖水体微生物菌群区分开来。养殖水体和黏液中存在大量的潜在致病菌,当鱼体处于应激状态或养殖环境恶化时,可能导致病害的发生。
致谢:衷心感谢三峡金沙江川云水电开发有限公司柯伟主任在本研究过程中给予的支持与帮助!

