肿瘤靶向的硼携带剂在硼中子俘获治疗中的应用与发展
陈 奎,吕林雯,邢更妹,*
1.中国科学院 高能物理研究所,北京 100049;2.散裂中子源科学中心,广东 东莞 523808
1 肿瘤靶向的硼中子俘获治疗
放射治疗是肿瘤治疗的三种经典方法之一,尤其是近年快速发展高线性能量转移(high linear energy transfer, high-LET)放射治疗方法(重离子和中子俘获治疗),其细胞周期状态依赖性小、辐射抗性产生比率相对较低等显著优势[1-3],为化疗和X射线放疗等耐受的恶性肿瘤的治疗提供了途径。世界卫生组织国际癌症研究机构(IARC)发布的2020年全球最新癌症负担数据显示,2020年中国新发癌症病例457万例,已经成为“癌症大国”。我国恶性肿瘤的5年相对生存率约为40.5%,与发达国家还有很大差距。重离子和中子俘获治疗等,具有提高恶性肿瘤治疗效果的明显优势。硼中子俘获治疗[4-5](也称硼中子捕获治疗,boron neutron capture therapy, BNCT)是一种基于10B和热中子相互作用的二元治疗体系。非放射性同位素10B原子中子俘获截面为3 835 b(1 b=10-28m2),高出机体其他元素3个数量级。10B吸收低能热中子(<0.5 eV),发生核反应(10B(n,α)7Li),产生α粒子(4He)和反冲的锂原子核(7Li)。其中α粒子的穿透距离很短,只有4~9 μm,与细胞的直径接近。因此,将10B选择性递送至肿瘤细胞俘获热中子,可以实现对肿瘤细胞的特异性杀伤,避免对邻近正常细胞的损伤[6]。BNCT对肿瘤细胞的DNA的损伤是直接的、不易修复的,而且不依赖于细胞周期状态,因此,极大降低了辐射抗性的产生。BNCT不仅在一些中枢神经系统的恶性肿瘤和额面部肿瘤治疗中已经取得显著疗效,同时对一些解剖结构特殊且难治的实体瘤也显示了非常好的疗效(如生殖器肿瘤)[7-9]。
理想的BNCT治疗,是实现单个肿瘤细胞的精确杀伤,而不损伤正常细胞,这与传统放疗和化疗的治疗逻辑有所不同[10-11]。最大化的实现BNCT的物理-生物-治疗效应,需要10B化合物选择性地积累在肿瘤细胞达到足够高的蓄积浓度(质量分数>20×10-6)。同时,在正常脏器和组织中的蓄积较少(肿瘤和正常组织的硼浓度比值(T/N)>3,肿瘤与血液的硼浓度比值(T/B)>3)。由此可见,硼药在肿瘤中的特异性靶向蓄积是实现肿瘤BNCT治疗目标的关键。
肿瘤靶向治疗(药物的靶向递送和肿瘤的靶点治疗),一直是肿瘤药物的研发热点。这些靶点本质上是调节肿瘤发生发展的特异性分子位点(如信号通路的活化、免疫环境的调整等)[12]。目前BNCT硼药的肿瘤靶向递送研究主要聚焦于肿瘤细胞表面特异性/差异性表达受体介导的选择性识别、靶向和富集。本文在此重点总结硼药研发过程中,肿瘤靶点和递送方法的选择和挑战,及其改进策略和方案。
2 小分子硼药的肿瘤靶向选择及改进方案
2.1 以L型氨基酸转运体(LAT)为靶点的类氨基酸硼药
L型氨基酸转运体(L-type amino transporters, LAT)是一种与Na+和pH值无关的异二聚体氨基酸转运蛋白[13]。它优先转运大支链和芳香族中性氨基酸进入增殖细胞。包括LAT1、LAT2、LAT3、LAT4四种亚型,其中LAT1在多种人类肿瘤细胞中过表达,与肿瘤细胞快速增殖需要大量吸收和重吸收氨基酸有关,也与肿瘤分期、肿瘤组织血管生成及肿瘤患者的预后等病理进程密切相关[13]。此外,作为跨越血脑屏障(blood-brain barrier, BBB)的氨基酸的主要转运蛋白,LAT1对氨基酸的转运,也是保证正常大脑完成其生理功能所必须的[14]。因此,许多需要进入中枢神经系统的药物设计与LAT1的内源性底物具有高度结构相似性,通过降解修饰由LAT1转运入脑[15]。
1) 以LAT1为靶点的首个临床硼药:BPA
2020年5月,日本厚生省批准了首个用于BNCT临床治疗的硼药——硼法伦(Borofalan [10B],“Steboronine®”)。它的主要成分为(L)-4-二羟基硼基苯丙氨酸(boronophenylalanine, BPA),是中性氨基酸苯丙氨酸的衍生物。BPA依赖LAT1选择性转运进入细胞[15],参与特定蛋白质的合成[16]。由于其结构与酪氨酸(Tyr)类似,可以作为酪氨酸酶的底物,通过黑色素代谢途径合成大分子,因此BPA-BNCT首先被用于治疗皮肤黑色素瘤[17]。此外,由于BPA可以通过LAT1穿过BBB[18],也被广泛用于头颈部恶性肿瘤的BNCT。
但是,LAT1具有双向转运能力,为维持细胞的生理需要和平衡,也会将细胞内BPA与细胞外氨基酸交换,导致BPA的外排[19]。然而,BNCT通常需要30~60 min的热中子照射,BPA在肿瘤细胞内浓度的持续降低,影响治疗效果[20]。因此硼法伦在BNCT临床治疗中,采用了持续静脉滴注给药以维持较高的瘤内硼浓度[21]。但这也增加了BNCT的潜在风险,同时影响治疗效果。
为此,日本学者Nomoto等[22]构建合成了聚乙烯醇(PVA)与BPA的硼酸酯复合物(PVA-BPA复合物)(图1)。当通过LAT1转运进入肿瘤细胞,该复合物可以在细胞内体/溶酶体中积累,降低胞质中BPA的含量,减缓LAT1介导的BPA外排,实现在皮下肿瘤中较长时间滞留,提升了BNCT的治疗效果。以此为基础,他们进一步构建了BPA和果糖修饰聚乙二醇-聚(L-赖氨酸)——PEG-P[Lys/Lys(fructose)]-BPA复合物[23],该复合物可以通过LAT1转运进入肿瘤细胞,同时抑制LAT1介导的BPA外排。此外,该复合结构的阳离子骨架结果促进其肾脏清除效率,增加了在模型鼠中分布的T/B和T/N比。 通过BNCT实验,进一步证实了聚合物-BPA策略的有效性。

(a)——BPA的分子结构(白色、灰色、红色、蓝色和粉色原子分别为H、C、O、N和B);(b)——BPA通过LAT1细胞内化,LAT1将细胞外BPA转运进细胞并外排包括谷氨酰胺在内的细胞内底物;(c)——细胞内BPA的外排,当细胞外BPA浓度降低时,细胞内BPA可以与包括酪氨酸在内的细胞外底物交换;(d)——PVA和PVA-BPA的化学结构,PVA-BPA的形成不涉及BPA中的苯丙氨酸结构,这对LAT1的识别至关重要;(e)——PVA-BPA的内化途径,PVA-BPA与LAT1相互作用,然后通过内吞作用内化图1 BPA细胞摄入和外排示意图[22]Fig.1 Scheme of cell uptake and exertion of BPA[22]
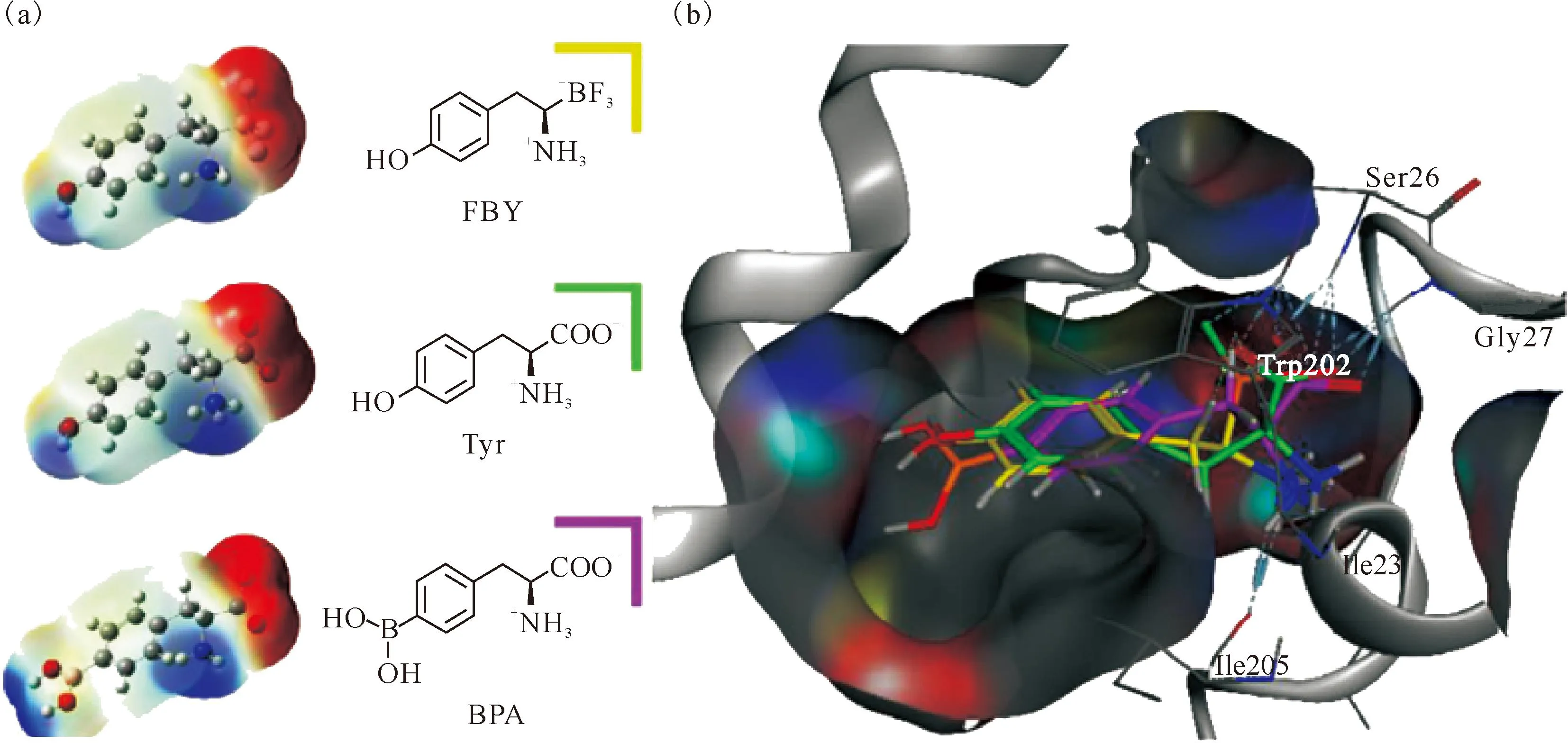
(a)——FBY、Tyr和BPA的化学结构和分子静电势图像(蓝色表示正电荷的分布,红色表示负电荷的分布);(b)——LAT1和FBY(黄色)/Tyr(绿色)/BPA(粉色)复合物的预测结构;LAT1(灰色)为实心带状表示,配体和LAT1之间的氢键(涉及残基Trp202、Ser26、Gly27、Ile205和Ile23)显示为天空蓝色虚线,已知其高度保守图2 计算研究表明FBY与酪氨酸(Tyr)和BPA之间存在高度相似性[25]Fig.2 Computational studies show a high degree of similarity between FBY and tyrosine(Tyr) and BPA[25]
2) 以LAT为靶点的其他含硼类氨基酸化合物
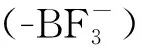
3) 以LAT为靶点的巯基十一氢十二烷基钠(BSH)
巯基十一氢十二烷基钠(sodium mercaptoundecahydro-closo-dodecaborate, Na2B12H11SH, BSH),是一种富含硼原子的多面体硼烷结构,具有良好的化学稳定性和生物相容性[26]。BSH能够穿过BBB,富集在脑肿瘤部位,也已经被用于临床脑肿瘤的BNCT治疗研究。然而,由于BSH无法进入肿瘤细胞,BSH的肿瘤靶向性一直备受质疑,也使利用BSH的肿瘤细胞精准BNCT难以实现[27]。
Futamura等[28]将1-氨基-3-氟环丁烷-1-羧酸(ACBC),一种非天然的α氨基酸连接到BSH上,实现了LAT介导的肿瘤细胞的特异性靶向性。进一步用18F标记ACBC(18F-ACBC),监测硼药代谢和生物分布。对F98大鼠脑胶质瘤模型治疗研究显示,ACBC-BSH处理后BNCT鼠的中位生存时间为(44.3±0.8) d,明显优于BSH((37.4±2.6) d)。
2.2 基于细胞穿膜肽的BSH靶向选择
细胞穿膜肽(cell-penetrating peptides, CPPs),又称蛋白质/多肽转导域,是一类以非受体依赖方式、非经典内吞直接穿过细胞膜、进入细胞的多肽分子,它们的长度一般不超过30个氨基酸且富含碱性氨基酸,常带有正电荷。2014年,Michiue等[29]将BSH连接到多种CPPs(包括HIV-TAT和多聚精氨酸等)上,分别和脑胶质瘤U87MG细胞共孵育,发现细胞中硼蓄积具有时间和浓度依赖性,随着处理时间的延长,BSH可以更多地进入细胞核,有利于增强对肿瘤细胞的杀伤效果,提高BNCT疗效。他们还筛选出了一种含8个BSH结构和聚11精氨酸结构的含硼化合物(8BSH-11R),硼含量达20.1 ppm(1 ppm=1×10-6)。给药24 h后, BSH高浓度的蓄积在细胞核中。以10 mmol/L 8BSH-11R处理U87MG细胞,细胞中10B含量达到了5 623.7 ng/106细胞。更重要的是,8BSH-11R的BNCT细胞杀伤率比BSH提高了100倍以上。该团队后续进一步优化BSH-CPPs结构,构建了单个BSH偶联3聚精氨酸的BSH-Tmr-3R结构,不仅增加了脑胶质瘤肿瘤细胞摄取,在脑胶质瘤荷瘤鼠模型上实现了肿瘤靶向和瘤内的均匀分布[30]。将1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)偶联到BSH-Tmr-3R上,标记放射性核素64Cu,进行PET成像,实现了对BNCT过程中的硼浓度变化的实时监测。注射后6 h和24 h,T/N比值分别达到15.5和8.2,T/B比值分别为2.8和1.9。
3 纳米硼携带剂的肿瘤靶向选择
在以小分子硼化合物为基础的BNCT硼药靶向递送研究不断推进的同时,含硼大分子及含硼纳米药物等的设计构建也取得了进展,其中含硼纳米颗粒能够通过被动靶向进入肿瘤组织,利用修饰靶向分子再主动靶向肿瘤细胞表面受体,完成细胞内亚定位,成为BNCT新型硼药的研究热点。
3.1 肿瘤EPR效应介导被动靶向
EPR效应是指,由于肿瘤部位血管结构的异常,淋巴回流缺乏,导致大分子药物和纳米颗粒在肿瘤部位具有高渗透性和滞留性现象。EPR效应自1986年提出以来,成为无靶向因子的大分子及纳米药物实现肿瘤部位选择性蓄积的重要机制。也成为构建纳米载药体系,实现药物肿瘤靶向递送的前提条件之一。
刘志博团队[31]合成了一种甲氧基-聚乙二醇-聚乙丙交酯的胶束载带硼化卟啉,形成了硼化卟啉复合物(BPN),BPN依赖EPR效应在肿瘤组织富集(图3(a))。本课题组[32]构建了一种基于锆(Zr)和四羧基苯基卟啉(TCPP)的金属有机框架结构、通过主客体反应负载10B的硼酸(图3(b))。利用EPR效应靶向递送到脑胶质瘤中,实现了体内脑胶质瘤的高硼蓄积(硼质量分数>60 ppm(1 ppm=1×10-6)),具有一定的BNCT应用前景。当然,这类含卟啉结构的纳米药物的靶向是否完全属于EPR仍然存在争议,也有人认为卟啉分子可以靶向低密度脂蛋白受体(LDL receptor)来介导纳米药物的肿瘤靶向递送[33]。
(a)——甲氧基-聚乙二醇-聚乙丙交酯胶束,载带硼化卟啉[31];(b)——TCPP和锆组装的金属有机框架通过主客体反应负载硼酸形成共结晶,用于脑胶质瘤的BNCT和PET成像[32]图3 含硼胶束[31]和含硼共晶示意图[32] Fig.3 Scheme of boron-containing micelles[31] and boron-containing co-crystal[32]
Sumitani等[34]合成了聚乙二醇嵌段聚乳酸(PEG-b-PLA)多聚物,核心交联碳硼烷形成的含硼胶束也可通过EPR效应,实现在肿瘤区域的选择性聚集。文献[35]用苯乙烯-顺丁烯结合葡萄糖胺形成的多聚物,与硼酸形成稳定且水溶性良好的配合物,这种纳米复合体也能够通过EPR效应,在肿瘤组织中达到十倍于正常组织的硼含量——注射24 h后肿瘤组织中10B质量分数约为24×10-6,同时这种纳米复合体在偏酸性的肿瘤微环境和肿瘤细胞内涵体中,可控释放硼酸阻碍肿瘤细胞糖酵解,协同BNCT抑制肿瘤生长,为BNCT硼药研发提供了新的思路。
3.2 识别肿瘤细胞表面受体的主动靶向
由于BNCT疗效对肿瘤组织中硼浓度的依赖性,纳米药物除了利用EPR效应被动靶向肿瘤组织,还因其较大的比表面积,可通过连接靶向分子识别肿瘤细胞表面的受体,更高效介导含10B的载药体系进入肿瘤细胞,提高全身给药后的T/N比,降低毒副作用,改善BNCT的疗效[36-37]。
1) 利用叶酸受体介导靶向肿瘤细胞
叶酸受体在多种肿瘤细胞表面高表达,已经成为一种重要的肿瘤治疗靶向分子。叶酸受体与配体叶酸的结合常数较高(Kd=10-10mol/L),且具有较好的可修饰性,可以连接多种治疗药物。构建叶酸修饰的纳米药物/纳米递送系统,可以实现叶酸受体介导的肿瘤靶向给药[38]。
Ciofani等[39]合成了氮化硼纳米管(BNNTs)硼携带剂(图4)。首先通过包覆聚-L-赖氨酸(PLL)使其表面暴露氨基基团,然后再与叶酸的羧酸基团相连接,修饰荧光量子点,最终得到功能化BNNTs。这种氮化硼纳米管载药系统被证明,能够被多形性胶质母细胞瘤细胞选择性摄取,自身带有的荧光也可在未来BNCT治疗实验中,进行体内示踪以配合中子照射。

叶酸作为配体修饰氮化硼纳米管,靶向肿瘤细胞表面叶酸受体,完成硼药的肿瘤靶向递送[39] 图4 叶酸修饰纳米颗粒作为靶向策略[39]Fig.4 Functionalization with folic acid for nanoparticles as targeting strategy[39]
除了BNNTs外,Mandal等[40]利用金纳米颗粒,将异硫氰酸荧光素(FITC)标记的10B-多聚烯丙胺盐酸盐(10B-FITC-PAH)和硼化聚苯乙烯磺酸钠(10B-PSS)交替包覆在金纳米颗粒表面,形成多层聚电解质外层。为了避免纳米颗粒的聚集,以一层PSS和一层PAH进行封装,最后利用静电相互作用将叶酸分子修饰在颗粒表面,得到功能化金纳米颗粒载硼系统,这种系统可以被多种肿瘤细胞摄取。
2) 利用转铁蛋白受体介导靶向肿瘤细胞
转铁蛋白(transferrin, Tf)是一种广泛存在的糖蛋白,能够将血液中的铁通过细胞表面转铁蛋白受体(TfR)转运进入细胞[41],而TfR在恶性细胞中表达上调,且显示出和细胞恶性增殖及肿瘤发生发展具有一定相关性,因此TfR成为一种有潜力的肿瘤靶向治疗的靶点[42]。
文献[43]设计合成了一种包封BSH的匀质后的脂质体,活化其表面的羧基后使其和转铁蛋白表面的氨基相连,得到直径小于200 nm的纳米硼携带剂,由于其表面的PEG基团,延长了该携带剂的血液循环时间,通过转铁蛋白介导的靶向能力,使10B在肿瘤组织富集,注射3 d后浓度仍超过30 ppm,与其他对照组相比,中子照射后荷瘤模型小鼠,明显抑制了肿瘤生长,小鼠生存率显著延长。Doi等[44]同样也合成了类似的含硼脂质体,脑胶质瘤小鼠模型静脉注射24 h后,肿瘤组织中的硼浓度达到了20 ppm,中子照射后也显著延长了小鼠的生存率。这些结果表明,靶向TfR的含10B脂质体可以提高肿瘤组织中的硼蓄积,有望进一步应用于BNCT提高疗效。
在BNNTs修饰叶酸配体的研究的基础上,Ciofani团队[45]也尝试依赖转铁蛋白靶向给药的策略。他们首先在硝酸的强氧化作用下,在BNNTs表面引入羟基,通过硅烷化使BNNTs表面携带氨基,和转铁蛋白相连,得到主动靶向的BNNTs硼递送系统,体外实验结果显示了肿瘤细胞对这种BNNTs的高摄取,说明转铁蛋白的修饰赋予了硼递送系统肿瘤特异性靶向能力。
3) 利用表皮生长因子受体介导靶向肿瘤细胞
表皮生长因子(EGF)受体EGFR是一种存在于细胞表面,在多种肿瘤细胞表面过表达或突变后发生超活化的蛋白,因此EGFR已经成为一种重要的肿瘤治疗及药物递送靶点[46]。
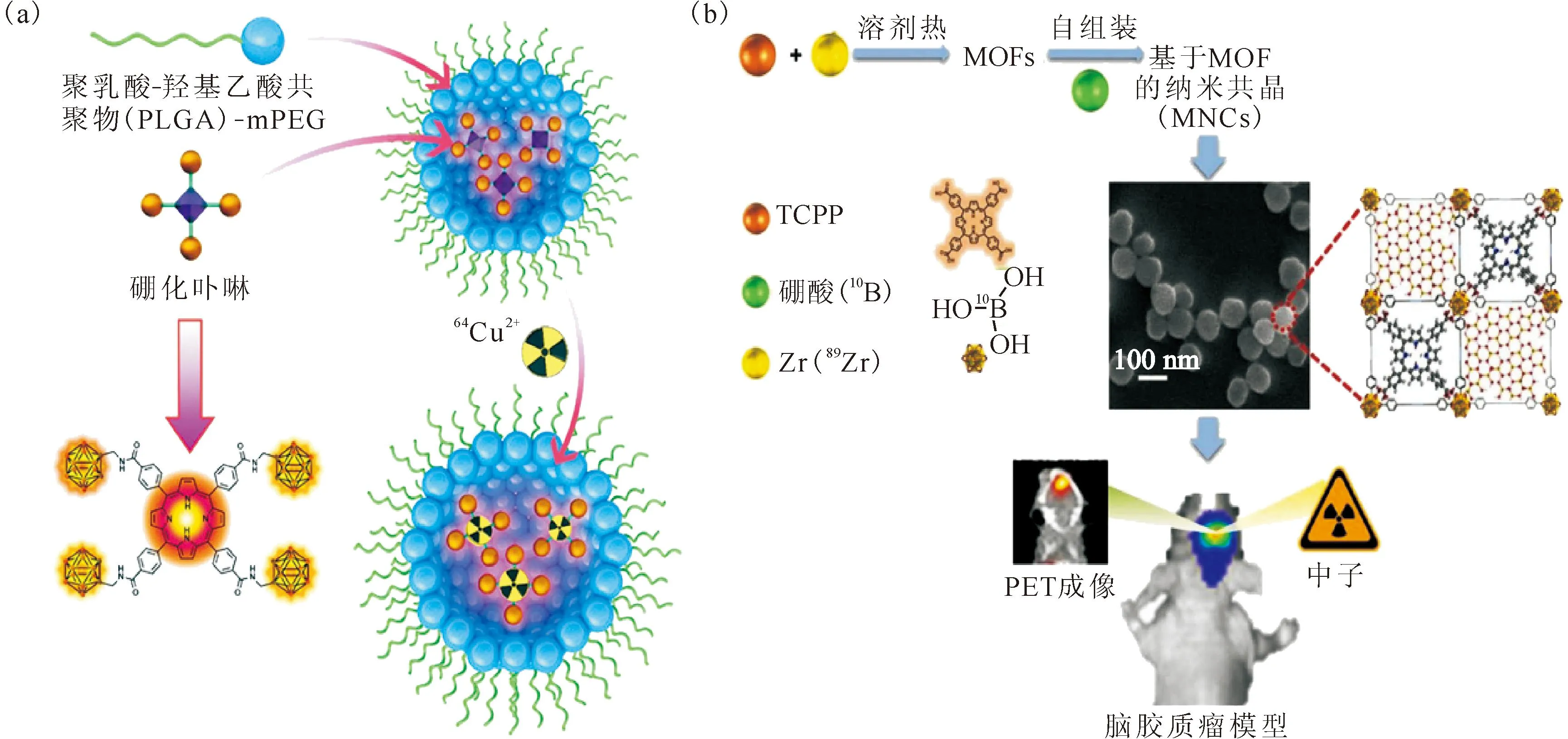
为了硼药的肿瘤靶向递送,Kullberg团队[47]尝试利用EGF作为靶向分子,他们首先利用EGF末端的氨基,在Traut’s试剂(2-iminothiolane)的存在下,连接一个硫醇基团,后者可以和马来酰亚胺-PEG-二硬脂酰磷脂酰乙醇胺(DSPE)相连,使得EGF桥连在一个脂质分子上,脂质分子通过干燥和水化过程形成胶束后,和载带了硼药的脂质体混合得到具有EGF靶向配体修饰的载硼脂质体,成为具有有效肿瘤靶向性的纳米硼药(图5)。
图5 通过将EGF修饰和胶束与载硼脂质体混合,得到具有靶向肿瘤细胞表面EGFR能力的含硼脂质体[47]Fig.5 Boron-loading liposomes, obtained via hybriding EGF-conjugated micelles with boron-containing liposomes, targeting EGFR on tumor cell surface[47]
4) 利用单克隆抗体介导靶向肿瘤细胞
单克隆抗体(单抗)是指与特异抗原或表位具有高特异性(单特异性)结合能力的免疫球蛋白[48]。经过数十年研究,单抗已在临床诊断、治疗包括癌症、感染类疾病、免疫调节等方面得到了广泛应用[49]。在肿瘤治疗中,单抗除了直接用于干扰肿瘤细胞生长、破坏细胞膜、阻断免疫抑制通路,还作为靶向分子,修饰载体完成放疗或化疗药物的肿瘤靶向递送。
(1) 癌胚抗原(CEA)
癌胚抗原(CEA)是一种组织特异性蛋白,在多种肿瘤细胞中过表达,并分布于细胞膜表面。针对CEA+的肿瘤研究表明,CEA体外致敏T细胞能够在体内产生CEA特异性免疫应答,从而杀死肿瘤细胞,是一种非常有前途的肿瘤免疫治疗靶点[50]。
以CEA为配体,构建BNCT硼药靶向给药系统。Yanagie团队[51]首先由卵磷脂、胆固醇和3-(2-吡啶二硫)丙酰基-二棕榈酰基磷脂酰乙醇胺(DTP-DPPE)混合制备了多腔室脂质体,在水化步骤中引入10B化合物(Cs210B12H11SH),得到表面有巯基的含硼脂质体,再在交联剂作用下与CEA单抗交联,得到能够靶向肿瘤组织的含硼脂质体。体外实验也显示了其具有肿瘤细胞靶向硼递送能力。
(2) 表皮生长因子受体(EGFR)
同前所述,EGFR蛋白在肿瘤细胞表面过表达,也可用作肿瘤特异性靶向递送的靶点。Pan等[52]利用特异性结合EGFR的西妥昔单抗,将其硫醇化后连接在由马来酰亚胺-PEG-胆固醇分子形成的胶束表面,再与载硼脂质体相混合,得到靶向富硼免疫脂质体。体外实验结果显示出其具有了更高的被肿瘤细胞摄取的能力,可能成为一种潜在的有效硼递送载体。
(3) 人表皮生长因子受体(HER2)
与EGFR类似,HER2也是一种生长因子受体跨膜蛋白,在恶性乳腺细胞中过表达,且可能导致预后不良。过表达的HER2也可以作为肿瘤治疗靶点之一,已经有研究显示人源化抗HER2单抗治疗和化疗结合能够有效提高生存率[53]。尝试将HER2单抗用于BNCT硼携带剂的构建,可能成为一种极具潜力的BNCT硼药靶向递送策略。
Wu等[54]设计了功能化金纳米颗粒,利用巯基和金纳米颗粒的相互作用,将巯基化的硼烷和巯基修饰的HER2的单抗(61 IgG)同时沉积在金纳米颗粒表面。在体外实验中,这些功能化金纳米颗粒与无修饰的金纳米颗粒相比,显著提高了被肿瘤细胞摄取的能力。为实现体内示踪,研究者利用加成点击反应,将123I标记在金纳米颗粒表面,在MicroSPECT/CT成像中显示了优异的体内肿瘤组织的靶向成像。
5) 利用去唾液酸糖蛋白受体介导靶向肿瘤细胞
去唾液酸糖蛋白受体(ASGP-R)表达于肝癌细胞表面,而在正常肝细胞表面极少存在。ASGP-R对半乳糖等碳水化合物表现了较高的亲和力,且能够通过网格蛋白介导内吞,进入肿瘤细胞。以ASGP-R为靶点的纳米载体已经成为一种肝肿瘤靶向给药策略[55]。Zhang等[55]设计构建了一种表面修饰壳聚糖-乳糖酸-硫辛酸的中空介孔二氧化硅的复合纳米材料,在酸性条件下,表面壳聚糖质子化,介孔硅负载碳硼烷,当环境溶液pH为中性时,壳聚糖去质子化,防止碳硼烷的泄露,表面修饰的乳糖酸使纳米颗粒通过ASGP-R主动靶向至肝癌细胞,在肿瘤细胞中较高的谷胱甘肽(GSH)和较低的pH双重作用下,刺激释放碳硼烷,后者吸收中子射线后破坏肿瘤细胞DNA,诱导肿瘤细胞凋亡,硫辛酸的释放还减轻了BNCT产生的炎症反应及ROS损伤,最终达到肿瘤治疗并降低副作用的效果。
6) 利用唾液酸(SA)介导靶向肿瘤细胞
肿瘤细胞在发生发展过程中,细胞表面糖基化关键改变之一是唾液酸显著上调,能够直接影响免疫细胞及其与肿瘤细胞的相互作用,也影响肿瘤细胞的迁移和转移能力[56]。文献[57]利用PBA与唾液酸的特异性结合能力,设计了一种苯硼酸-PEG-聚乳酸的嵌段共聚物分子,自组装形成100 nm的聚合物纳米颗粒(NanoPBA),相较于临床硼携带剂BPA,依赖于氨基酸浓度梯度的双向转运,NanoPBA基于SA主动运输,在体外实验中展现出了较高的肿瘤细胞摄取能力,尽管由于该纳米颗粒的稳定性欠佳,导致给药后肿瘤组织硼蓄积量只有约1 ppm,但在中子照射后仍表现出了显著的肿瘤抑制作用,这可能由于NanoPBA的细胞内定位更靠近细胞核,提高了肿瘤细胞的DNA断裂率。
3.3 肿瘤细胞核的主动靶向
由于BNCT对肿瘤细胞的杀伤是基于在细胞内的10B吸收中子后产生的α粒子和7Li核,因此细胞内的10B原子的分布离细胞核越近,越容易对核DNA造成损伤,从而更高效地杀死肿瘤细胞。
为了提高硼药分布的细胞核趋向性,Chen等[58]巧妙地将阿霉素(DOX)与碳硼烷(CB)结合,并将其插入表面修饰有iRGD的阳离子脂质体中,同时负载CRISPR-Cas9系统来阻断巨噬细胞介导的CD47-SIRPα免疫监视通路(图6)。实验结果显示,这种脂质体利用环状多肽iRGD完成了肿瘤细胞的靶向递送,进入细胞后,载药系统利用DOX的核易位性,将10B定位于细胞核,实现了更有效肿瘤细胞杀伤,同时内部包载的质粒激活了肿瘤免疫,进一步阻止了肿瘤复发,提高了小鼠的存活率,这种复合脂质体不仅实现了BNCT硼携带剂靶向递送,同时开拓了联合免疫治疗的新的肿瘤BNCT治疗策略。

图6 DOX-CB利用其疏水性插入脂质体膜上,内部包载CD47-SIRPα的CRISPR-Cas9系统,得到的复合型脂质体将BNCT和免疫治疗相结合,达到治疗肿瘤的目的[58] Fig.6 DOX-CB inserts into membranes of liposomes which contain CD47-SIRPα CRISPR-Cas9 system. The multifunctional liposomes combine BNCT with immunotherapy for cancer treatment[58]
4 总结与展望
BNCT是依赖于肿瘤细胞靶向硼药的精准二元治疗方式。设计构建新型硼药的靶向递送系统,是目前BNCT硼药研发中的焦点。为此,硼药递送肿瘤靶点的选择和靶向分子的设计成为了BNCT硼药研发的焦点。
利用组学等方法识别和筛选出更多的肿瘤候选靶点,通过机器学习等手段优化出识别这些靶点的靶向分子库是目前药物研发的一个重要手段。比如,来自苏黎世联邦理工学院的研究人员[59]通过机器学习方法去优化治疗性抗体,从Herceptin抗体的DNA序列出发,通过CRTSPR-Cas9介导的同源定向修复,定点突变产生了约40 000个相关抗体,利用支持这一优化阶段的机器学习方法,优化出最佳的55个序列,可以在实验室中产生抗体并表征其特性。在确定这些靶向分子后,建立模块化的靶向硼药构筑系统是提高当前硼药研发速度的一个重要突破口。这需要首先构建出模块化的硼核,然后将其与靶向分子偶联,从而构建新型靶向硼药筛选库,提高靶向硼药设计和筛选的效率,降低开发成本,促进BNCT硼药的快速发展。
分子靶向药物是继抗体靶向药物之后肿瘤精准治疗的重要发展方向之一。BPA等硼氨酸以及硼苷酸等核酸类似物均具有明显分子靶向特征,已成为小分子硼药研发的焦点。然而这些小分子硼药受限于硼含量、内化和外排等在肿瘤细胞内蓄积和代谢过程等因素的影响,需要在提高硼含量、改善在肿瘤细胞中的代谢、提高在肿瘤细胞内的靶向蓄积等进行进一步的开拓性研究。
多靶向基团的设计可能是硼药研发的新思路。本课题组前期通过水热法将葡萄糖和BPA缀合,合成出了一种含硼量子点(BCDs)。这一结构同时拥有葡萄糖和BPA的靶向特征,能够通过LAT1和葡萄糖转运子双重作用增加脑胶质瘤U87MG细胞的硼摄取[60]。这一结果提示了复合靶向硼药设计的可行性,对小分子硼药和纳米硼携带剂靶向性设计均有一定的借鉴作用。

