AAMDC激活mTOR通路促进肝细胞癌转移
周宣辰, 胡丽玲, 李钰莹, 石富金, 郑丹丹, 施心雨, 张志毅, 孟坤,3*, 田秋红*
(1. 南昌大学 第一附属医院 肿瘤科, 江西 南昌 330006; 2. 暨南大学 生命科学技术学院,肿瘤分子生物学教育部重点实验室, 广东 广州 510632; 3. 暨南大学 附属第一医院 科研科, 广东 广州 510630)
原发性肝癌(hepatocellular carcinoma,HCC)是人类最常见的恶性肿瘤之一,其死亡率高居癌症死亡第三[1]。Global Cancer Observatory数据显示,2020年全球肝癌新发病例数为905 677和410 038, 死亡病例数为830 180和391 152。在我国60岁以下男性中,肝癌是发病率最高的癌症类型,严重威胁国人的健康[2]。临床上80%以上原发性肝癌是肝细胞性肝癌。由于HCC的高复发率和转移率,患者的预后较差,五年生存率不足20%。且其早期症状隐匿导致多数患者确诊时已发展为远端转移,错过了最佳治疗时机,因此探索肝癌的发生、发展机制为肝癌诊断和治疗提供分子标记物和靶点具有重要的临床意义。
脂肪形成相关Mth938结构域蛋白(AAMDC),又名C11orf67、PTD015,该基因位于11号染色体,编码由122个氨基酸组成的蛋白质,目前还未有文献明确报道其生物学功能。针对AAMDC的早期研究结果显示,该蛋白可能参与脂肪形成过程,并且参与多个代谢调控环节。已有研究表明,AAMDC作为癌基因,促进了雌激素受体阳性乳腺癌的进展[3]。同时在另一项研究中显示,龙葵碱的抑癌作用与阻断AAMDC/MYC/ATF4/Sesn2介导的自噬途径相关,并且AAMDC的过表达能够逆转龙葵碱对自噬和胃癌的抑制作用[4]。
目前尚未有AAMDC在HCC中的相关研究。基于以上信息,本课题组前期查阅了相关数据库,发现在HCC样本中AAMDC与多个临床指标高度相关,本研究旨在以AAMDC为研究对象,采用蛋白质相互作用组学及转录组学的技术方法揭示其生物学功能的分子机制,以及其在HCC中的细胞器定位和表达水平,探讨AAMDC对HCC细胞迁移、侵袭能力的影响。
1 材料与方法
1.1 试剂与仪器
1.1.1 细胞株
人正常肝细胞L02,人肝细胞癌细胞系Huh7、HepG2、HCCLM3、PLC8024、SNU387由本实验室保存。
1.1.2 主要试剂
DMEM培养基(# C11995500BT)、RPMI培养基(#C11875500BT)、Opti-MEM培养基(#31985070)、磷酸盐缓冲液(#C10010500BT)、0.25 %胰蛋白酶(#2520056)、胎牛血清(#A3160802)均购自美国Gibco公司;细胞冻存管(#375418PK)和Lipofectamine3000转染试剂(#L3000008)均购自美国Thermo Scientific公司;Transwell小室(#353097)、Transwell 24孔板(#353034)和Matrigel胶(#356234)均购自美国Corning公司;AAMDC抗体(NBP2-34040)购自美国Novus Biologicals公司;PVDF膜(#SLHVR33RB)购自美国Millipore公司;山羊抗兔二抗、免疫荧光二抗、IP裂解液(#P0013J)、DAPI(#C1002)购自上海碧云天生物技术有限公司;mTOR抗体(#2983)、p-mTOR抗体(#5536)、β-actin抗体(#4970S)和Tubulin抗体(#2146S)均购自美国Cell Signaling Technology公司;荧光定量PCR试剂盒(#11201ES08)、逆转录试剂盒(#11123ES60)和无核酶水(#10601ES76)均购自上海翌圣生物科技股份有限公司;氯仿(#GD10)、异丙醇(#HC16)、无水甲醇(#SA01)和无水乙醇(#HB15)均购自广州化学试剂厂;EDTA修复液(#ZLI-9067)、免疫组化二抗(#PV-6000)、免疫组化笔(#ZLI-9305)、Triton-X 100(#ZLI-9308)均购自北京中杉金桥生物技术有限公司;Rapamycin(#AY-22989)购自美国Selleck生物科技有限公司。
1.1.3 仪器设备
移液器(德国Eppendorf公司);PCR仪(苏州东胜兴业科技有限公司);-80 ℃冰箱和冷冻离心机(美国Thermo Scientific公司);细胞培养箱(上海普和希健康医疗器械有限公司);普通倒置显微镜(浙江舜宇光学科技有限公司);生物安全柜(上海力康公司);Western blot电泳套装(美国Bio-Rad公司);恒温鼓风干燥箱(上海精宏实验设备有限公司);水平摇床(其林贝尔TS-200)。
1.2 研究方法
1.2.1 生物信息学分析
本研究采用的生物信息学分析的数据库主要包括:GTEx(https://gtexportal.org/home/);The human protein atlas数据库(HPA,https://www.proteinatlas.org/);Gene expression profiling interactive analysis数据库(GEPIA2,http://gepia2.cancer-pku.cn/#index);The cancer genome atlas数据库(TCGA,https://www.genome.gov/Funded-Programs-Projects/Cancer-Genome-Atlas)。
1.2.2 细胞培养
L02和SNU387使用RPMI1640+10%胎牛血清+1%青/链霉素培养,Huh7、HepG2、HCCLM3、PLC8024用高糖DMEM+10%胎牛血清 +1%青/链霉素培养。
1.2.3 免疫组织化学实验
石蜡切片65 ℃烘箱中烤片4 h;将切片放入含有环保透明剂的缸中进行脱蜡,依次放入无水乙醇以及95%、80%、50%的乙醇和蒸馏水中各1 min;将切片置于pH 8.0的EDTA修复液中,用微波炉中高火和中火加热各5 min。微波修复结束后,等待切片冷却至室温;用免疫组化笔在组织周围画圈,滴加H2O2孵育50 min,在4缸PBST中依次漂洗。甩干PBST后使用封闭液封闭1 h,并清洗。滴加AAMDC一抗工作液(体积比为1∶200),放入4 ℃冰箱孵育过夜,清洗4次,滴加二抗于37 ℃孵箱孵育20 min,使用PBST清洗二抗。滴加DAB显色,苏木素复染10 s,流水冲洗,盐酸乙醇分化3 s后蒸馏水水洗,将切片放入烘箱65 ℃,封片,镜检评分。
1.2.4 实时荧光定量PCR检测
提取细胞总RNA,用逆转录试剂盒将RNA逆转录为cDNA,通过荧光定量PCR检测AAMDC的相对表达。AAMDC的上游引物序列为:5’-TCAGGTGTTCATGTCAGGGC-3’, 下游引物序列为:5’-AGGTGACTCATTGCCAGCTC-3’。β-actin的上游引物序列为:5’-ACGTGGACAT-CCGCAAAG-3’, 下游引物序列为:5’-GACTCGTCATACTCC-TGCTTG-3’。
1.2.5 蛋白质免疫印迹实验
制备样品,使用SDS-PAGE凝胶分离蛋白质,转移到PVDF膜上。使用5%的牛奶室温封闭1.5 h,敷上一抗置于4 ℃水平摇床上过夜孵育。TBST清洗3次,每次10 min。清洗完后二抗室温下孵育1~2 h;TBST洗膜3次,每次10 min。将ECL发光液的A液与B液等体积混合置于避光EP管中。将PVDF膜放入显影仪中,加入适量显影液,进行曝光。
1.2.6 免疫荧光
将细胞铺板在共聚焦培养皿,培养过夜。PBS清洗两遍,加入4%的多聚甲醛固定细胞。 PBS 清洗3次,加入0.2% Triton-X的PBS常温静置透化细胞10 min,弃去透化液,用PBS清洗细胞3次,每次5 min。使用5% BSA于室温封闭1 h,加入200 μL一抗,4 ℃孵育过夜。用PBST清洗细胞3次,每孔加入200 μL二抗,室温避光孵育1 h。加入DAPI溶液 200 μL,室温避光孵育10 min;激光共聚焦观察并拍照。
1.2.7 Transwell实验
在24孔板下室加入600 μL含FBS的培养基,将小室放入Transwell孔板上,消化细胞,用PBS清洗2遍,无血清培养基重悬。细胞计数后,取15万细胞加入小室的上室(侵袭实验需要提前在每个小室上室中央垂直悬空加入基质胶100 μL)。到达观测时间后取出小室,使用甲醇固定30 min,结晶紫染色20 min后使用纯水清洗小室并用棉签擦拭小室的上室,晾干。使用显微镜拍照,ImageJ等软件进行计数。
1.2.8 免疫共沉淀
预冷的PBS清洗细胞2次,加入1 mL的IP裂解液。转移至1.5 mL离心管中裂解细胞;在4 ℃,12 000 g条件下离心,将上清转移至新的1.5 mL离心管中并置于冰上。取1 mg蛋白加入1.5 μg抗体,另一组加入1.5 μg IgG;4 ℃旋转仪上缓慢旋转孵育过夜;次日加入40 μL Protein A/G琼脂糖珠捕获抗原抗体复合物,4 ℃条件下缓慢旋转孵育4 h。在4 ℃,2 500 r/min条件下离心5 min,去除上清,用预冷的PBS清洗复合物3遍,每次加入500 μL;最后一次吸干净液体,加50 μL裂解液,到上述沉淀中并混匀;将样品煮沸后收集上清进行蛋白质电泳。
1.2.9 银染
将胶条放入盛有固定液的容器中,置于水平摇床孵育过夜;倒掉固定液,加入敏化液室温下放置30 min;倒掉敏化液,加入H2O放于水平摇床清洗3次,每次10 min。弃掉H2O后避光加入银染液,置于摇床上避光银染30 min;倒掉银染液,用H2O清洗胶条3次,每次30 s。清洗结束后加入显色液,观察胶条的显色情况;待胶条的条带清晰可见时,倒掉显色液,并加入终止液终止10 min;用H2O清洗胶条,去除过多的银离子,然后扫胶备用。
1.3 统计学分析
2 结果
2.1 AAMDC在泛癌中表达的生物信息学分析
为了探索泛癌中AAMDC在肿瘤组织和癌旁组织中的表达情况,分析了GEPIA2数据库中AAMDC的表达水平,结果显示AAMDC在弥漫性大B细胞淋巴瘤(DLBC)、多形成胶质细胞瘤(GBM)、脑低级别胶质瘤(LGG)、肝细胞癌(HCC)、胰腺癌(PAAD)及胸腺癌(THYM)等肿瘤组织显著高表达,而在急性髓细胞样白血病(LAML)和睾丸癌(TGCT)肿瘤组织中表达显著降低(图1A)。随后对AAMDC在泛癌中的表达量和肿瘤患者的预后进行分析,结果显示AAMDC的高表达水平与肾上腺皮质癌(ACC)、肾嫌色细胞癌(KICH)患者总生存期缩短相关,而与肾透明细胞癌(KIRC)以及LGG患者总生存期延长相关(图1B-F)。无疾病生存分析结果显示,AAMDC与肾上腺皮质癌(ACC)、HCC及肺鳞癌(LUSC)患者无疾病生存期缩短相关(图1G-J)。综上,AAMDC在多个癌症类型中表达失调,并与肿瘤患者的生存时间密切相关,提示其可能参与了肿瘤的发生发展,可作为潜在的预后因子指导肿瘤患者的诊断和治疗。本研究关注到AAMDC在HCC患者的肿瘤组织中表达异常升高,且和HCC患者的总生存预后以及无疾病生存期密切相关,提示AAMDC参与HCC的发生发展。

A: AAMDC在多种肿瘤和癌旁中组织的差异表达; T为肿瘤组织,N为癌旁中组织。1)P<0.05; B: AAMDC的表达和泛癌的预后相关性热图,高亮部分表示AAMDC表达可以作为预后预测癌种;C-F:AAMDC的表达和预后可预测癌种肿瘤患者的预后生存图;G: AAMDC的表达和泛癌的无疾病生存期相关性热图,高亮部分表示AAMDC表达可以作为无疾病生存期的预测癌种;H-J:AAMDC的表达和生存期可预测肿瘤患者的无病生存预后生存图。A: AAMDC is expressed differently in a variety of tumors and adjacent para-cancerous tissue; T: tumor, N:non-tumor. 1)P<0.05. B: Heat map of the prognostic correlation between AAMDC expression and pan-carcinoma, and the highlighted part indicates that AAMDC expression can be used as a prognostic predictor; C-F: Survival plot of the association between AAMDC expression and prognosis in tumor patients; G:Heat map of the correlation between the expression of AAMDC and disease-free survival for pan-carcinoma, and the expression of AAMDC in the highlighted part can be used as a prediction of disease-free survival prognosis. H-J: Prognostic survival plot of the correlation between AAMDC expression and disease-free survival in tumor patients.图1 AAMDC在泛癌中的表达Figure 1 Expression of AAMDC in pan-carcinoma
2.2 AAMDC在HCC中的高表达与HCC不良预后相关
基于以上研究结果,于是检测了多株人源HCC细胞及人类正常肝细胞L-02中AAMDC的表达,qRT-PCR(图2A)和Western blot(图2B)显示AAMDC在HCC细胞株中表达显著升高。采用免疫组化对多例HCC组织样本中的AAMDC表达水平进行检测,探究了其蛋白表达水平与预后相关性,结果显示AAMDC高表达水平与HCC患者较短的无疾病生存期相关(图2C),3例代表性染色结果如图2D所示。随后,用共聚焦荧光显微镜检测AAMDC在HCC细胞株中的定位,结果显示野生型以及外源过表达的AAMDC蛋白主要定位于HCC细胞的细胞质中(图2E)。
2.3 AAMDC对HCC的迁移和侵袭促进作用
HepG2细胞中过表达AAMDC,通过Western blot验证了其过表达效果(图3A),Transwell迁移和侵袭的结果显示,过表达AAMDC后能够促进HepG2细胞的迁移和侵袭(图3A)。此外,在PLC8024细胞株中也具有相同的效应,过表达AAMDC能够使PLC8024细胞的迁移和侵袭能力增强(图3B)。本研究选择AAMDC表达水平较高的HCC细胞SNU387和Huh7细胞敲低了AAMDC,qRT-PCR验证AAMDC的敲低效果,随后的Transwell结果表明,干扰AAMDC表达能够抑制SNU387(图3C)和Huh7(图3D)两株HCC细胞的迁移和侵袭能力。上皮-间质转换(EMT)是指由上皮细胞转化为间充质细胞,并获得迁移侵袭能力的过程,多个研究证明EMT在肿瘤细胞的转移和侵袭中起到关键作用。本研究基于网络数据库对上皮相关分子标志物和AAMDC表达的相关性进行了分析,结果如图3E所示,间质细胞的标志物β-促胰蛋白酶(β-catenin,CTNNB1)、球蛋白(Vimentin)及N-凝集素(N-cadherin)与AAMDC的表达显著正相关,提示AAMDC促进HCC细胞的转移可能与EMT过程相关。

1)P<0.05; 2)P<0.01。
2.4 AAMDC与FASN的相互作用
过表达AAMDC或敲低AAMDC分别促进或抑制HCC细胞的迁移和侵袭。为明确介导AAMDC促进肿瘤细胞迁移和侵袭功能的生物学途径,采用免疫共沉淀结合高效液相质谱的方法绘制AAMDC的相互作用蛋白质网络。首先在HepG2和PLC8024细胞里过表达AAMDC,并对其进行了免疫共沉淀、银染、质谱鉴定,探索AAMDC的相互作用蛋白质(图4A、B)。韦恩图显示,HepG2和PLC8024细胞中分别鉴定到353个和161个AAMDC的特异性互作蛋白质(图4C、D)。将HepG2细胞中AAMDC的互作蛋白质进行通路分析,发现这些互作蛋白主要富集在细胞代谢通路、复合物组装以及翻译相关的信号通路(图4E),而在PLC8024细胞中AAMDC的互作蛋白质主要集中在细胞代谢、RNA剪接和rRNA生物合成等信号通路中(图4F)。对在HepG2细胞和PLC8024细胞中获取的AAMDC互作蛋白质取交集,得到了11个在两株HCC细胞中都与AAMDC具有相互作用的蛋白质(图4G),分别为FASN、PRMT1、S100A8、STRAP、RPS24、RPL27、RPL38、 RPS16、ABCB1、ITGA11、TUBA1B。其中,FASN通过催化脂肪酸生物合成来促进细胞生长和存活,并且多个研究报道FASN的异常激活是HCC发展过程中的主要代谢事件。随后通过免疫共沉淀实验验证了AAMDC和FASN存在相互作用(图4H)。并且通过油红-O染色实验发现,细胞过表达AAMDC之后染色增加,表明AAMDC能够促进脂质合成(图4I)。文献报道FASN蛋白在脂肪酸生物合成中发挥重要作用[11],因此推测AAMDC可能通过与FASN互作影响HCC细胞的脂肪酸合成和代谢,进而参与介导HCC恶性进展。
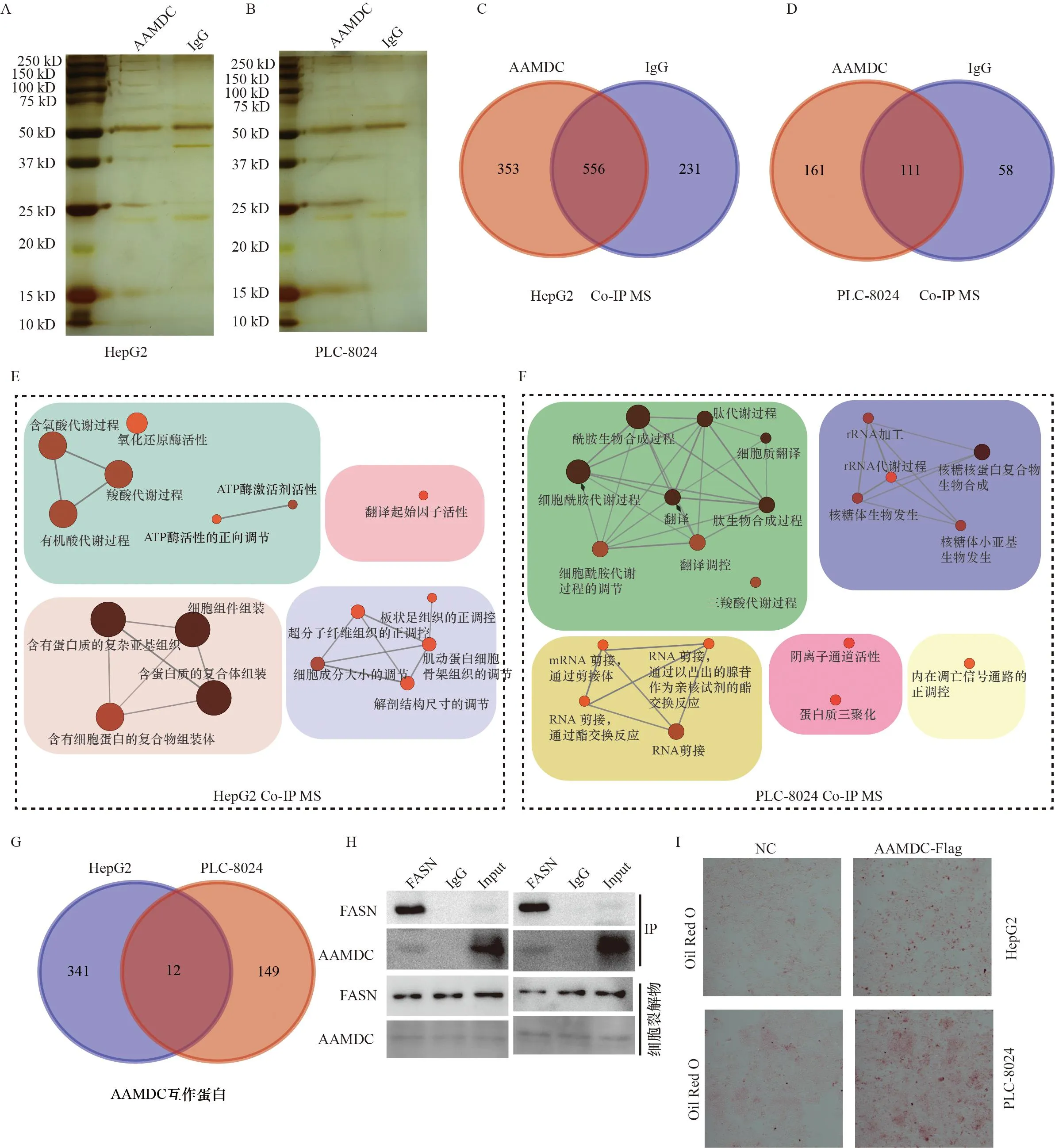
A-B:SDS-PAGE结合银染结果显示AAMDC在HepG2 (A)和PLC8024 (B)中的相互作用蛋白质;C-D:高效液相质谱鉴定AAMDC在HepG2 (C)和PLC8024 (D)中的相互作用蛋白质;E:AAMDC在HepG2细胞中的相互作用蛋白质功能富集;F:AAMDC在PLC8024细胞中的相互作用蛋白质功能富集;G:韦恩图显示AAMDC在HepG2和PLC8024的相互作用蛋白质交集;H:免疫共沉淀结合Western blot的结果显示FASN和AAMDC具有相互作用;I:油红-O实验结果显示过表达AAMDC促进HCC中的脂质积累。A-B: SDS-PAGE binding silver staining results showed AAMDC interaction proteins in HepG2 (A) and PLC8024 (B); C-D: High performance liquid phase mass spectrometry to identify AAMDC interaction proteins in HepG2 (C) and PLC8024 (D); E: Functional enrichment of interacting proteins of AAMDC in HepG2 cells; F: Functional enrichment of interacting proteins of AAMDC in PLC8024 cells; G: Wayne diagram showed that the intersection of AAMDC interacting proteins in HepG2 and PLC8024; H: The results of co-immunoprecipitation combined with Western blot showed that FASN and AAMDC interacted; I:Oil red-O experimental results showed that overexpression of AAMDC promoted lipid accumulation in HCC.图4 AAMDC相互作用蛋白Figure 4 AAMDC interaction protein
2.5 AAMDC参与mTOR通路
为了探究AAMDC如何激活下游通路促进HCC细胞的侵袭转移能力,对过表达AAMDC的HCC细胞HepG2和PLC8024进行了转录测序。火山图显示在HCC细胞过表达AAMDC后差异表达的基因(图5A、B)。对过表达AAMDC的HCC细胞和对照组细胞进行生物信息学分析(图5C),结果显示mTOR信号通路被显著激活。Western blot实验检测mTOR信号通路关键marker,结果表明过表达AAMDC促进mTOR信号通路的激活(图5D),在过表达AAMDC的肝癌细胞,加入mTOR通路的抑制剂Rapamycin,结果显示AAMDC激活p-mTOR的功能被显著地抑制(图5E)。另外,在过表达AAMDC的肝癌细胞中沉默FASN的表达,Western blot结果表明沉默FASN能够抑制AAMDC对p-mTOR的激活作用(图5F)。以上结果表明,AAMDC与mTOR通路异常激活相关,并且该途径是由FASN所介导的。
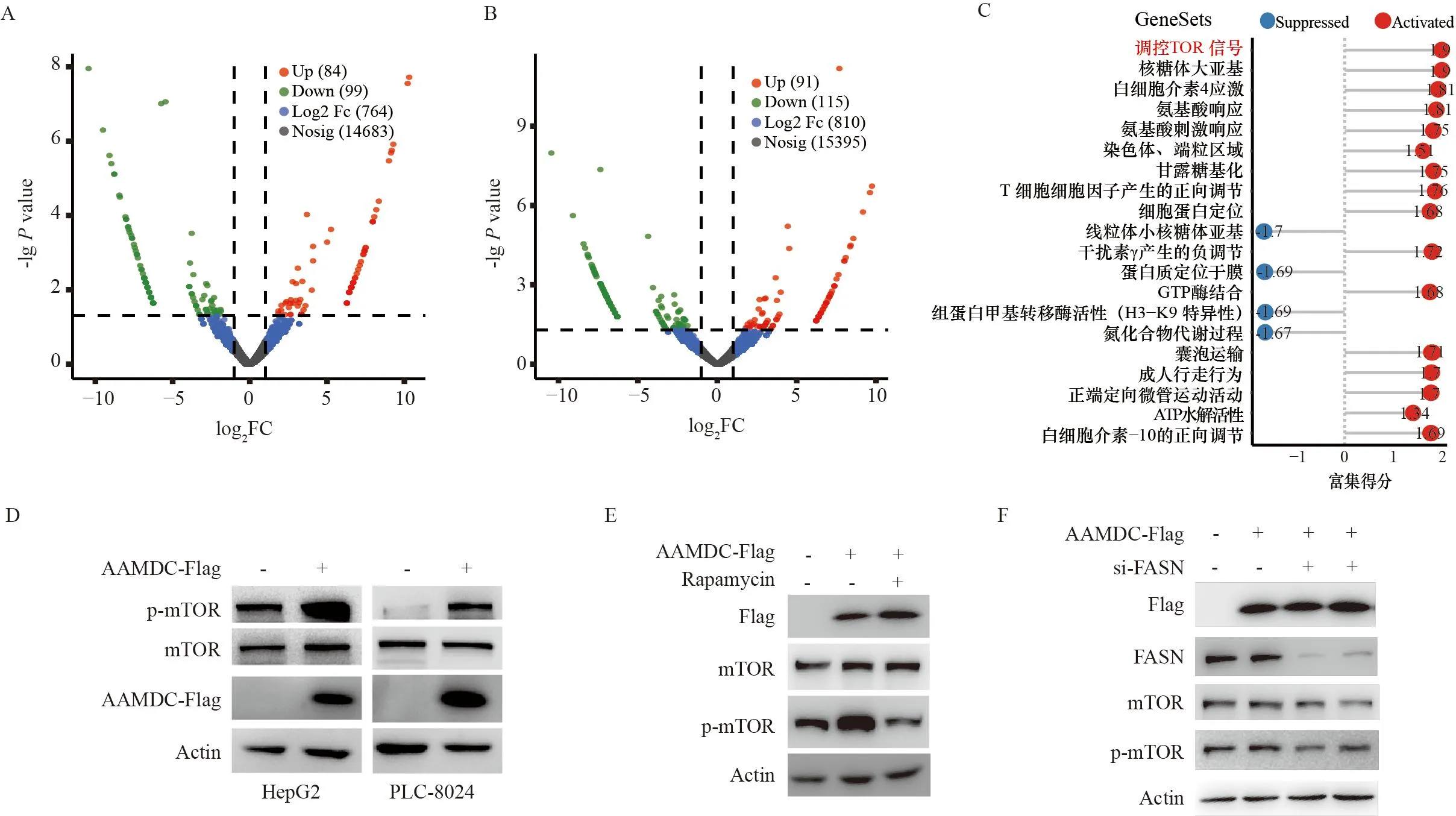
A-B:火山图显示在HepG2(A)和PLC8024(B)过表达AAMDC后差异表达的基因;C:点棒图显示mTOR通路在AAMDC过表达的HCC细胞中被显著激活;D:Western blot实验显示AAMDC过表达激活mTOR通路;E:过表达AAMDC后加入mTOR通路抑制剂,检测p-mTOR的变化;F:过表达AAMDC后沉默FASN表达,检测p-mTOR的变化。A-B: Volcano plots showed that differentially expressed genes after overexpression of AAMDC in HepG2(A) and PLC8024(B); C: The dot bar plot showed that the mTOR pathway was significantly activated in AAMDC overexpressed hepatocellular cells; D:Western blot experiments showed that AAMDC overexpression activated the mTOR pathway; E: AAMDC overexpression activated the p-mTOR was rescued by Rapamycin; F: AAMDC overexpression activated the p-mTOR was rescued by knockdown FASN.图5 AAMDC激活mTOR通路Figure 5 AAMDC activates the mTOR pathway
3 讨论
由于基因表达失调导致的肿瘤转移与HCC患者较差的预后密切相关。在本研究中,AAMDC在HCC组织中表达上调,通过激活mTOR通路促进HCC转移。在一项Genome-Wide Association Studies(GWAS)研究中,AAMDC被鉴定为HBV感染的易感因素[5],提示AAMDC可能与HBV相关HCC的发生发展相关。TCGA和临床队列的表达分析结果显示,与癌旁组织相比,AAMDC的 mRNA和蛋白表达水平均表现为癌组织高于癌旁组织,且AAMDC高表达的HCC患者肿瘤复发和迁移的时间较短,提示AAMDC与肿瘤转移相关。通过Transwell实验发现过表达AAMDC显著地促进HCC细胞的迁移和侵袭,这些数据均提示AAMDC在HCC进展中扮演着癌基因角色。
联合转录组测序及蛋白质互作网络分析发现AAMDC可能通过激活mTOR通路促进HCC转移,同时体外实验结果也表明在HCC细胞中过表达AAMDC可提高mTOR通路磷酸化水平。本研究结果和此前AAMDC促进三阴乳腺癌转移的研究结论一致[3]。多项研究数据表明AKT/mTOR通路可被circMDK/miR-346/ATG16L1[6]、ATF4/FUT1/EGFR[7]等信号轴激活,促进HCC的发生发展。药物fasting可通过抑制AKT/mTOR信号通路阻断Warburg效应,从而增强HCC细胞对sorafenib的药物敏感性而抑制肿瘤生长[8]。接受肝移植治疗的HCC患者中,使用mTOR抑制剂Rapamycin可显著延长患者总生存期和无疾病生存期[9]。本研究数据表明,AAMDC通过与脂肪酸合成酶FASN相互结合而促进mTOR通路激活。现有文献支持FASN在mTOR信号通路的调控中的作用。脂肪酸(FA)通常以甘油三酯(TG)形式存储,作为能量来源,脂肪酸也用于合成鞘脂和甘油磷脂,作为信号转导分子或生物膜构建组分[10-11]。多项研究表明,脂肪酸代谢异常与HCC相关表征具有较高的相关性,包括化疗敏感性、细胞增殖、血管生成和细胞侵袭[10-12]。此外,HCC的典型特征之一是脂肪酸合成相关基因的上调,研究显示FASN的高表达预示着HCC的不良预后[13]。敲除FASN显著抑制小鼠模型中由AKT活化驱动的HCC发生[14],另有研究显示FASN的缺失仅仅延迟了肿瘤的发生,表明其中还存在着支持HCC细胞增殖和存活的额外机制[15]。在FASN缺失的小鼠中,mTOR发生丙二酰化而失去了对p70S6K/4EBP1的磷酸化调控[16]。在DLBC中,FASN更是可直接调控4EBP1的蛋白表达而激活AKT/mTOR通路[17]。FASN在胃肠间质瘤中表达上调,通过调控C75而激活AKT/mTOR通路,促进肿瘤的发生发展[18]。在小鼠HCC模型中,FASN缺失或失活可显著地减少AKT/mTOR介导的肿瘤形成[19]。HCC细胞中,CD147激活的AKT/mTOR通路可反馈性促进FASN的转录而上调其表达[20]。研究结果发现AAMDC可与FASN相互结合进而激活AKT/mTOR通路,然而,AAMDC与FASN的结合如何调控mTOR通路的仍需要深入研究,例如,二者的相互作用场所,AAMDC是否可增强FASN的蛋白稳定性或者AAMDC是否可通过与FASN相互结合而参与脂质代谢等。
基于TCGA数据和临床样本检测数据,本研究发现AAMDC在HCC组织中表达显著上调,AAMDC的高表达水平导致HCC患者的高复发率和高转移率。基于高通量测序和蛋白质组学的生物信息学分析和体外实验结果显示AAMDC通过与FASN相互作用,激活AKT/mTOR通路,促进HCC细胞侵袭迁移。综上,本研究的数据支持AAMDC在HCC中发挥癌基因功能。
作者贡献声明
周宣辰:实施实验、整理数据、撰写及修改论文;胡丽玲:整理数据、修改论文;李钰莹、石富金、郑丹丹:整理数据;施心雨:修改论文;张志毅:提供指导意见;孟坤、田秋红:提出研究思路与框架、指导实验、汇总数据、修改论文。
利益冲突声明
本项目未受到企业、公司等第三方资助,不存在潜在利益冲突。

