霉变玉米作用下饲喂甘草与乳酸菌对肉鸡健康的影响
胡凇茗,麻俊渊,2,宋晓琛,武殿虎,向文迪,杨妍梅,扎西英派*
(1.西北民族大学 生命科学与工程学院,甘肃 兰州 730030;2.甘南州畜牧技术服务中心,甘肃 合作 747000)
近年来我国畜禽养殖业的结构由传统的散养模式为主逐渐向集约化、规模化、产业化养殖模式为主的方向改变,一定程度上提高了畜禽养殖综合效益,这离不开饲料的稳定供应。但受管理方式等因素的影响,饲料生产、加工、运输以及储存等环节均难以完全避免霉菌或霉菌毒素混入的情况,导致饲料或饲料原材料霉变,营养价值和适口性下降。目前,可产毒素的霉菌达300多种,其中有30多种产生的毒素可以在自然条件下对人或动物的健康造成影响[1-2]。据不完全统计,每个国家每年约有1/4的谷物受到霉菌污染[3]。因此,如何防止畜禽饲料和饲料原材料受到霉菌毒素的污染,成为当前畜牧行业亟待解决的难题。
在全面禁止使用抗生素作为饲料添加剂的时代背景下,如何在畜禽健康养殖环节合理利用中草药和益生菌等生物制剂受到了广泛关注。甘草(Glycyrrhiza uralensisFisch.)及其提取物均具有多种药理活性,如抗癌[4]、抑菌[5]、抗炎[6]、抗氧化[7]和免疫调节[8]等。乳酸菌(lactic acid bacteria,LAB)是最早被用作饲料发酵剂的一类益生菌,它将饲料中的大分子营养物质降解成利于畜禽消化吸收的小分子物质,可以大幅度提高饲料利用率[9]。同时,乳酸菌可通过产生乳酸抑制或杀灭肠道病原菌[10]。目前,对于甘草及乳酸菌联合应用于禽类生产的研究报道较少,李帅兵等[11]通过在肉鸡生长过程中添加甘草及乳酸菌,发现两者联合使用可显著提高肉鸡的生长性能、屠宰性能和表观消化率等,且联合作用效果明显优于单独作用效果。本试验以上述报道为参考,通过在霉变饲料中添加甘草与乳酸菌,探讨其对肉鸡健康的影响,以期为家禽养殖业中霉菌毒素的防控提供理论参考。
1 材料与方法
1.1 试验材料
甘草浸膏,由甘草根茎经水煮取上清、浓缩、干燥和研磨所得。乳酸菌,为成品嗜酸乳杆菌冻干粉,活菌数约3×1010cfu/kg。发霉玉米,自然霉变所得,通过高效液相色谱法检测出其中含有2种霉菌毒素,分别为玉米赤霉烯酮(ZEA)和呕吐毒素(DON),其中ZEA浓度为(2 090±52.25)μg/kg(国家限定值为≤500 μg/kg),DON浓度(1 331±33.28)μg/kg(国家限定值为≤5 mg/kg)。为防止玉米在试验期间继续霉变,将其置于干燥、通风、阴凉的环境下妥善储存。
1.2 试验主要仪器及试剂
1.2.1 主要仪器 全自动生物组织脱水机、生物组织包埋机、粘附载玻片、组织包埋盒、组织切片机、台式高速冷冻离心机、酶标检测仪、全自动生化分析仪。
1.2.2 主要试剂 总超氧化物歧化酶试剂盒、丙二醛测试盒、过氧化氢酶测试盒、鸡免疫球蛋白G(IgG)ELISA试剂盒、鸡免疫球蛋白A(IgA)ELISA试剂盒、丙氨酸氨基转移酶(ALT)测定试剂盒、天门冬氨酸氨基转移酶(AST)测定试剂盒、γ-谷氨酰基转移酶测定试剂盒、尿素氮测定试剂盒、肌酐测定试剂盒。
1.3 试验动物
试验期42 d,选取150只体重相近且健康状况一致的32日龄肉鸡(已接种疫苗),待其适应1周新环境后进入正试期。
1.4 试验设计
将150只肉鸡随机分成5个组,每个组设5个重复,每个重复6只鸡:对照组(Con组,30只)、低毒浓度组(Ⅰ组,30只)、中毒浓度组(Ⅱ组,30只)、高毒浓度组(Ⅲ组,30只)和中毒浓度+乳酸菌+甘草浸膏组(Ⅳ组,30只)。Con组:于40日龄开始饲喂基础玉米饲料;Ⅰ组:于40日龄开始饲喂基础玉米饲料+25%的霉变玉米;Ⅱ组:于40日龄开始饲喂基础玉米饲料+50%的霉变玉米;Ⅲ组:于40日龄开始饲喂100%的霉变玉米;Ⅳ组:于40日龄开始饲喂基础玉米饲料+50%的霉变玉米+0.3%甘草浸膏+3×109cfu/kg乳酸菌(前21 d在基础日粮中只添加50%的霉变玉米,后21 d在添加50%霉变玉米的基础上加入乳酸菌和甘草浸膏)。
1.5 试验方法
1.5.1 肉鸡腹泻率与腹泻指数测定 试验期间每天8∶00—9∶00、13∶00—14∶00和18∶00—19∶00详细观察与记录腹泻肉鸡只数,并对腹泻粪便进行评分,当粪便评分≥1分时,认定为发生腹泻。评分规则如表1所示。

表1 腹泻评分表[12]
1.5.2 血清生化指标测定 肉鸡饲养至第43天,于早晨在各试验组各重复中随机抽取5只肉鸡进行颈动脉放血处死,采集各组肉鸡的血液至抗凝管中,室温静置15 min后,置于离心机中3 000 r/min离心10 min,获得血清,-80 ℃下冷冻保存以备用。
严格按照相应试剂盒说明书测定肉鸡血清中的免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、γ-谷氨酰转移酶(γ-GT)、肌酐(CRE)和尿素氮(UN)含量。
1.5.3 免疫器官指数测定 于试验的第43天早晨,在5个试验组各重复中随机抽取5只肉鸡,提前对需要采样的肉鸡做好体重记录。在解剖过程中先用温水将肉鸡腹部的羽毛打湿,再迅速剖开腹腔分离出胸腺、肝脏、法氏囊和脾脏,分别使用吸水滤纸将取出的器官表面吸干并称重,记录其重量,最后计算免疫器官指数。
1.5.4 脏器组织病理学观察 取肉鸡的肝、肾、胸腺、法氏囊和脾脏等组织器官,用10%的中性福尔马林溶液进行固定,24 h后换液继续固定3周左右。取大小不超过1 cm3的组织块,经水洗、脱水、透明、浸蜡、包埋、切片(厚度5 μm)等处理后进行苏木精-伊红染色(HE)。
1.6 数据处理与分析
对以上所得所有数据均使用Excel 2019进行整理,之后再通过GraphPad Prism 8.0.2软件进行单因素方差分析(One-Way ANOVA),计算平均数±标准误(Mean±SD),当P<0.05时,表示差异显著。
2 试验结果
2.1 霉菌毒素作用下饲喂甘草与乳酸菌对肉鸡腹泻率与腹泻指数的影响
如图1A所示,在整个试验期内,各组鸡只均有腹泻发生。当对照组肉鸡发生腹泻时,粪便颜色正常,水分较低,并有白色尿酸盐混合在粪便中。而在其余各组肉鸡腹泻时,所排稀便呈棕褐色、红褐色或黑色,外观疑似血便,水分明显增多。Ⅳ组在未给食甘草与乳酸菌前,粪便外观与Ⅰ组、Ⅱ组和Ⅲ组相同,饲料中添加甘草与乳酸菌后,鸡只粪便逐渐趋于正常。
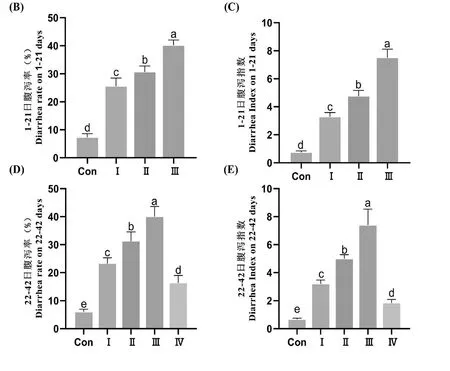
图1 试验期间肉鸡腹泻情况
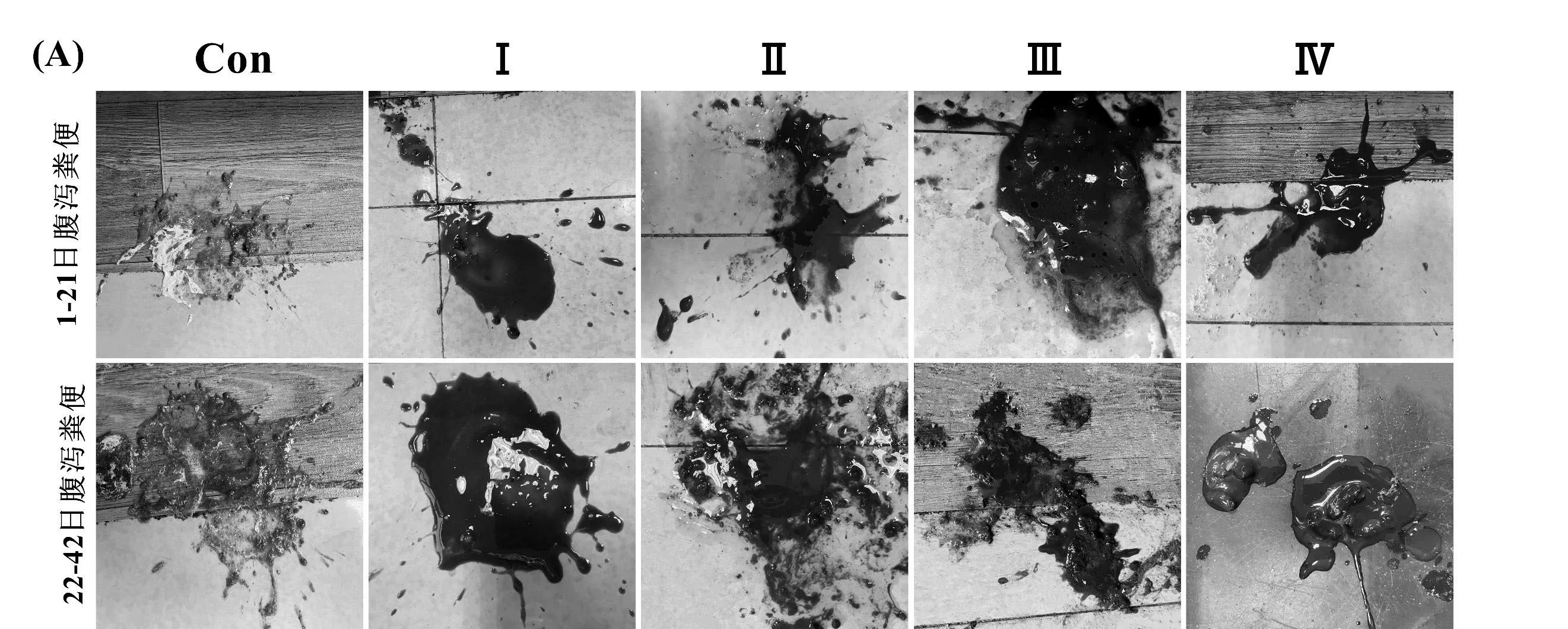
图1 试验期间肉鸡腹泻情况
试验期间肉鸡的腹泻率与腹泻指数见图1B—1E。在第1~21天,与对照组相比,Ⅰ组、Ⅱ组、Ⅲ组肉鸡的腹泻率与腹泻指数均显著升高(P<0.05),同时Ⅰ组、Ⅱ组和Ⅲ组互相之间也都具有显著性差异(P<0.05)。在第22~42天,当Ⅳ组饲料中加入甘草和乳酸菌后,与Ⅰ组、Ⅱ组和Ⅲ组相比,其腹泻率与腹泻指数显著降低(P<0.05)。
2.2 霉菌毒素作用下饲喂甘草与乳酸菌对肉鸡血清生化指标的影响
血清免疫指标检测结果(表2)显示,与Con组相比,Ⅱ组、Ⅲ组肉鸡血清中的IgA含量和IgY含量均显著降低(P<0.05),Ⅳ组无显著性变化(P>0.05)。与Ⅳ组相比,Ⅰ组肉鸡血清中的IgA含量和IgY含量没有发生显著性变化(P>0.05),而Ⅱ组和Ⅲ组则是显著降低(P<0.05)。
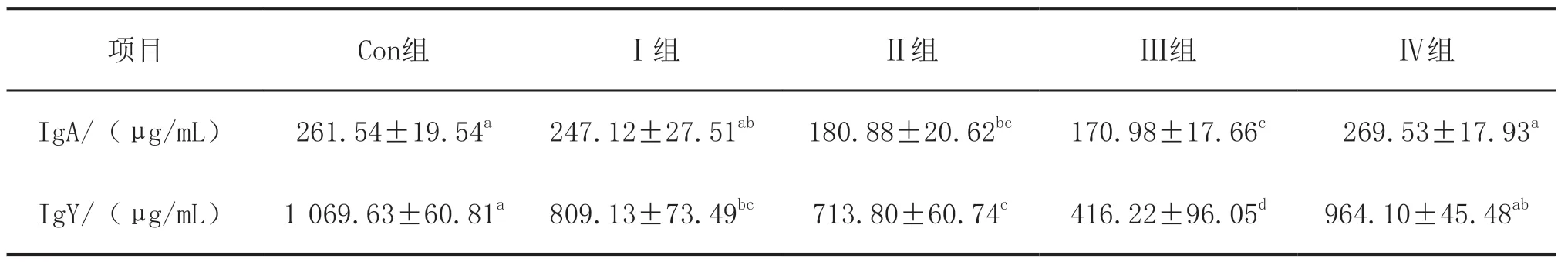
表2 霉菌毒素作用下饲喂甘草与乳酸菌对肉鸡血清免疫指标的影响
如表3所示,与Con组相比,Ⅰ组、Ⅱ组和Ⅲ组血清中的SOD活性显著降低(P<0.05),Ⅳ组显著上升(P<0.05)。与Ⅲ组相比,Con组、Ⅰ组、Ⅱ组和Ⅳ组血清中的MDA含量显著降低(P<0.05)。各组之间血清中的CAT含量无显著性变化(P>0.05)。
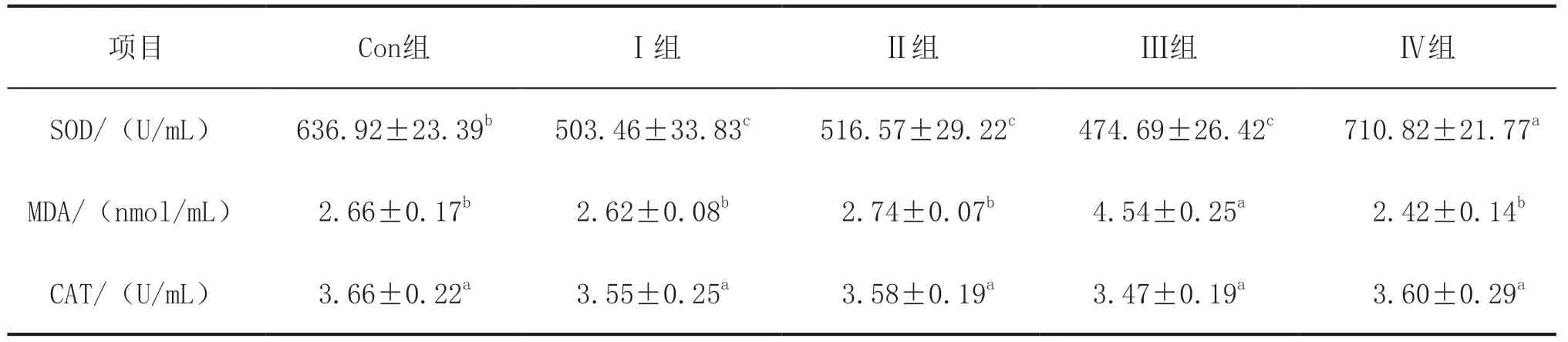
表3 霉菌毒素作用下饲喂甘草与乳酸菌对肉鸡血清抗氧化指标的影响
如表4所示,AST和ALT检测结果显示,Ⅰ组、Ⅱ组、Ⅲ组和Ⅳ组均显著高于Con组(P<0.05),但Ⅳ组显著低于Ⅰ组、Ⅱ组和Ⅲ组(P<0.05)。γ-GT检测结果显示,Ⅱ组、Ⅲ组显著高于Con组、Ⅰ组和Ⅳ组(P<0.05),Ⅰ组与Ⅳ组显著高于Con组(P<0.05),但Ⅰ组与Ⅳ组之间无显著性差异(P>0.05)。UN检测结果显示,Ⅰ组、Ⅱ组和Ⅲ组血清中的UN含量显著低于Con组和Ⅳ组(P<0.05),但这3组之间并无显著性差异(P>0.05),Ⅳ组与Con组相比,UN含量显著降低(P<0.05)。CRE检测结果显示,与Con组相比,其余各组均显著降低(P<0.05),但Ⅳ组显著高于Ⅰ组、Ⅱ组和Ⅲ组(P<0.05),Ⅱ组与Ⅰ组和Ⅲ组之间差异不显著,Ⅲ组与Ⅰ组相比显著降低(P<0.05)。
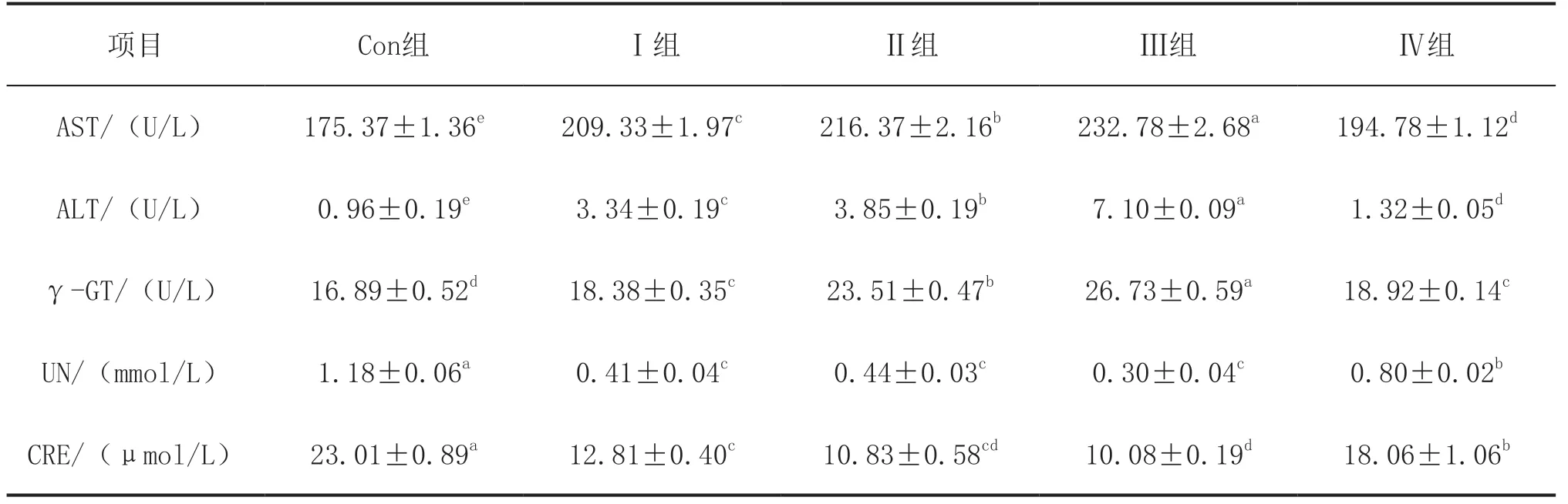
表4 霉菌毒素作用下饲喂甘草与乳酸菌对肉鸡血清中肝脏、肾脏生化指标的影响
2.3 霉菌毒素作用下饲喂甘草与乳酸菌对肉鸡组织器官指数的影响
如图2A所示,与Con组相比,Ⅰ组、Ⅱ组和Ⅲ组肉鸡的肝脏指数显著升高(P<0.05),Ⅳ组无显著性变化(P>0.05)。各组肉鸡的脾脏指数、胸腺指数和法氏囊指数(图2B—2D)均无显著性差异(P>0.05)。
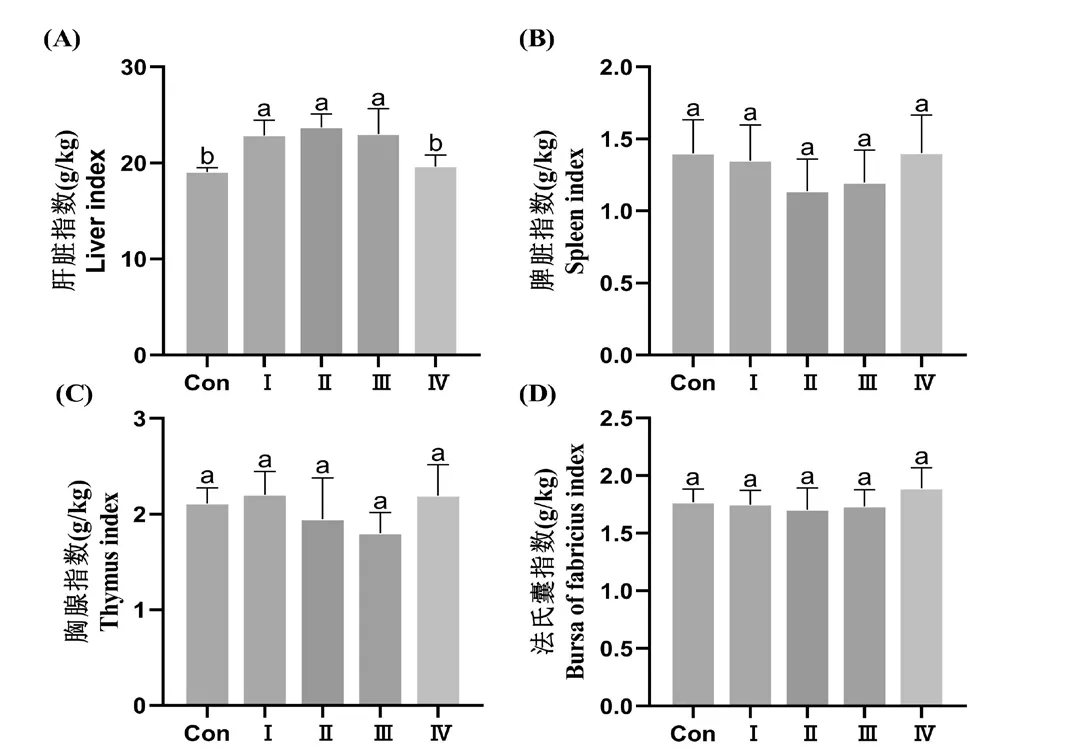
图2 霉菌毒素作用下饲喂甘草与乳酸菌对肉鸡组织器官指数的影响
2.4 霉菌毒素作用下饲喂甘草与乳酸菌对肉鸡脏器组织形态的影响
各处理组肉鸡肝脏病理损伤见图3,Con组肝脏细胞排列整齐,结构完整,未发生明显的病理学变化。相反,在Ⅰ组、Ⅱ组中,肝细胞出现大面积的水泡变性,同时,在肝细胞内和肝细胞间也有弥散的脂滴出现,由于肝细胞的肿胀、挤压,导致肝板之间的血窦结构消失,并伴有淤血出现。在Ⅲ组中,除了上述病变外,还出现了局部坏死灶,在坏死灶内,染色较浅,部分肝细胞核出现溶解、碎裂的情况。与3个毒素组相比,Ⅳ组肝脏内除了局部淤血外,并未出现其他明显的病变。
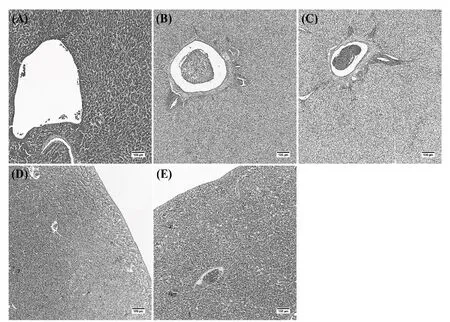
图3 肉鸡肝脏组织病理损伤观察(HE染色,100×)
各处理组肉鸡肾脏病理损伤见图4,Con组未观察到任何明显的病理学变化。与Con组相比,其余各组肾小管间质内均出现淤血、出血等现象,部分肾小管内皮细胞发生肿胀,其中Ⅰ组、Ⅳ组病变较轻,Ⅱ组、Ⅲ组病变较重。
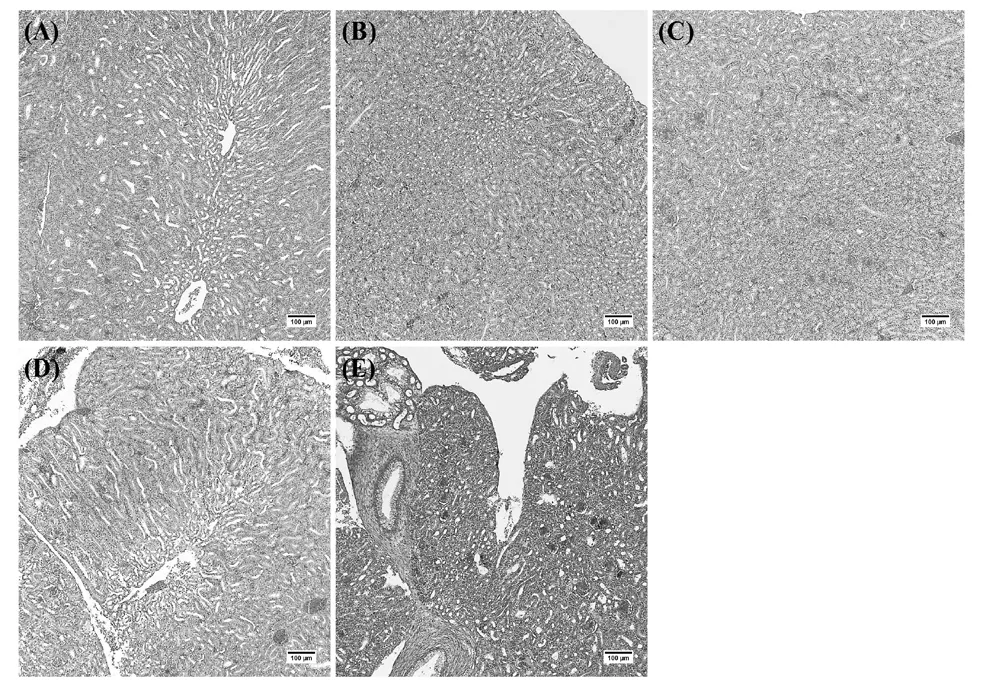
图4 肉鸡肾脏组织病理损伤观察(HE 染色,100×)
各处理组肉鸡法氏囊病理损伤见图5,在Con组和Ⅳ组中,法氏囊组织结构正常,并未出现异常现象,而在Ⅰ组、Ⅱ组和Ⅲ组中,法氏囊组织结构虽然未发生明显改变,但可以观察到部分囊小结中有轻微出血现象。
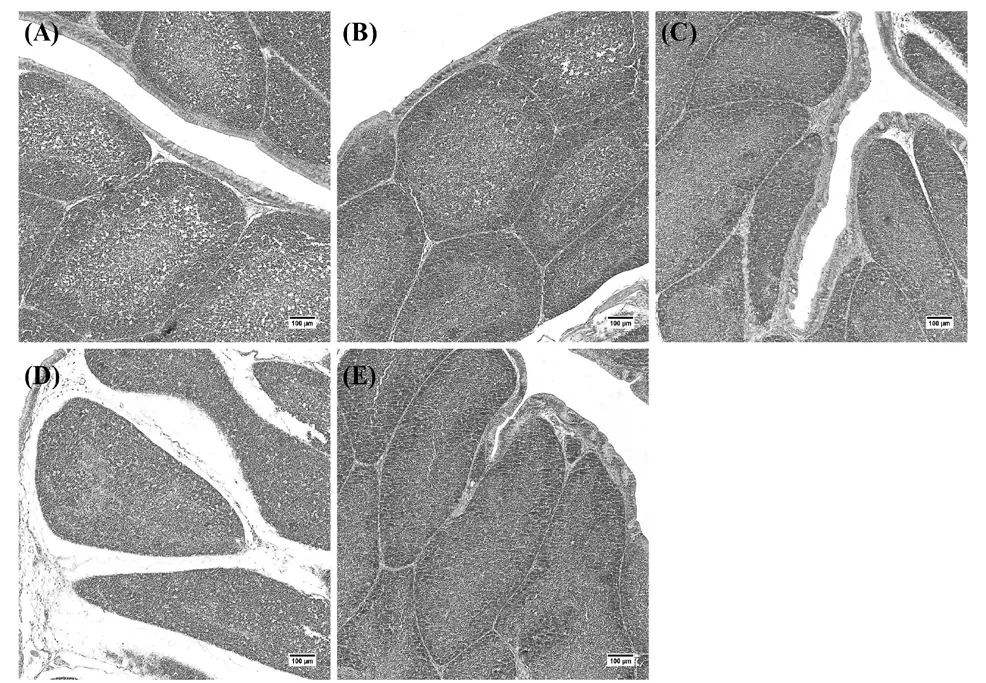
图5 肉鸡法氏囊组织病理损伤观察(HE染色,100×)
各处理组肉鸡脾脏病理损伤见图6,各组肉鸡脾脏组织结构完整,并未出现明显病变。

图6 肉鸡脾脏组织病理损伤观察(HE染色,100×)
各处理组肉鸡胸腺病理损伤见图7,与Con组相比,其余各组部分胸腺小叶内出现大量红细胞淤积在皮质与髓质之间,其中Ⅰ组、Ⅱ组和Ⅲ组病变较为严重,Ⅳ组最轻。
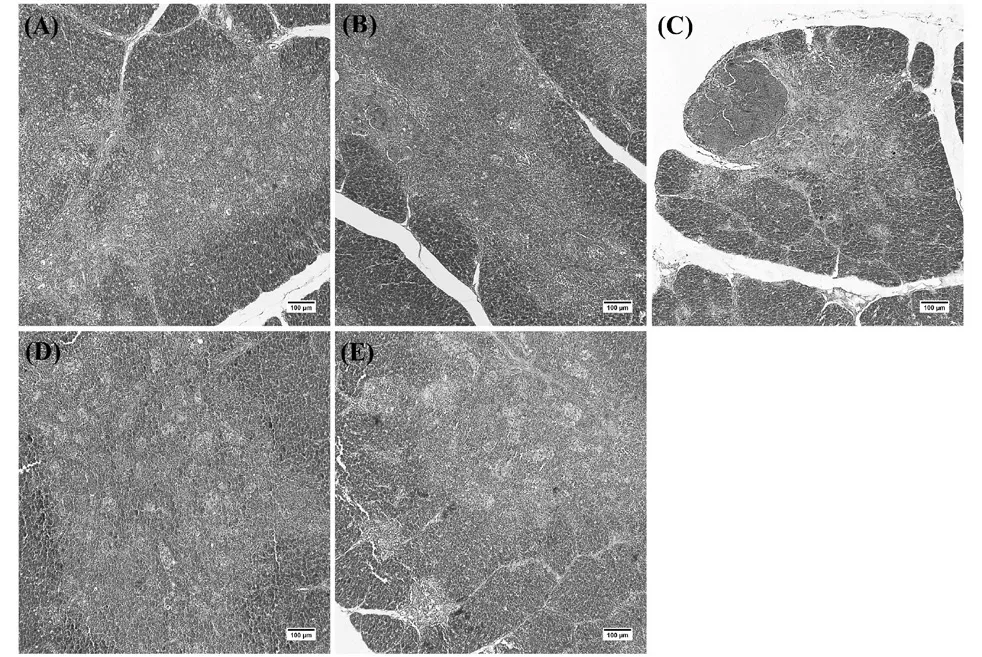
图7 肉鸡胸腺组织病理损伤观察(HE染色,100×)
3 讨论
3.1 霉菌毒素作用下饲喂甘草与乳酸菌对肉鸡腹泻的影响
肉鸡腹泻是一种以肉鸡排便频率增加和粪便中水分增多为特点的疾病。由于低龄肉鸡消化系统发育不完善和免疫能力较弱等原因,容易发生腹泻,轻则导致生长受阻和营养不良,重则导致脱水而亡。肉鸡摄入被霉菌毒素污染的饲料后,易发生腹泻。程志斌等[13]在饲料中混入750 μg/kg的ZEA饲喂仔猪21 d后,仔猪腹泻率大幅升高。有研究显示,甘草与乳酸菌可以促进肠道有益微生物增殖,抑制沙门氏菌等有害菌的生长,调节消化道pH值、酶活性和消化吸收功能,由此减少腹泻发生率[14-15]。本研究中,肉鸡的腹泻率与腹泻指数随着饲料中霉菌毒素含量的增加而明显上升,在加入甘草与乳酸菌后,肉鸡的腹泻率及腹泻指数显著降低,表明在霉变饲料中添加甘草与乳酸菌能够较好地改善霉菌毒素导致的肉鸡腹泻症状。
3.2 霉菌毒素作用下饲喂甘草与乳酸菌对肉鸡免疫能力及器官的影响
免疫器官作为免疫细胞分化、发育与成熟的部位,其指数的升高或降低能够在极大程度上反映动物体自身的免疫状况。霉菌毒素对禽类免疫器官的影响,集中体现在胸腺、法氏囊和脾脏等器官中[16]。耿芳芳等[17]研究发现,当雏鸡食入含有呕吐毒素(Deoxynivalenol,DON)与黄曲霉毒素B1(Aflatoxin 1,AFB1)的玉米后,其胸腺和法氏囊质量显著减轻。本研究中,3个毒素组肉鸡的脾脏、法氏囊和胸腺指数虽未发生显著性变化,但随着霉菌毒素浓度的上升,脾脏与胸腺指数出现了下降趋势。与此不同的是,宫佳杰[18]研究发现,270 μg/kg DON作用肉鸡36 d后,肉鸡脾脏、法氏囊指数显著升高,这与本文不同。DON既有免疫刺激作用,又有免疫抑制作用,由于试验时间较短及投喂方式不同等,最终导致肉鸡脾脏指数与法氏囊指数显著升高[19]。本研究中免疫器官指数差异虽未达到显著水平,但呈现降低趋势,可能是因为试验时间不够长。有研究表明,霉菌毒素对鸡器官指数的影响与时间长短相关,短时间接触霉菌毒素会导致鸡的免疫器官发生肿胀,指数有所升高,随着时间的延长,鸡的免疫器官逐渐萎缩,指数降低[20]。这提示本试验中霉菌毒素对肉鸡免疫器官的抑制正处于过渡阶段,随着霉菌毒素浓度的升高及试验时间的延长,最终会导致肉鸡免疫器官明显萎缩和指数显著降低。Chen等[21]与Samaha等[22]的研究表明,饲料中加入甘草与乳酸菌能够促进雏鸡免疫器官发育,显著提高鸡的免疫器官指数。相同的是,与中毒素组相比,其胸腺指数、法氏囊指数和脾脏指数均呈现上升趋势。
在禽类血清中,IgA与IgY是组成体液免疫的基础,同样也是衡量体液免疫的重要指标[23]。据报道,DON和ZEA均能抑制淋巴细胞对IgG、IgM和IgA的分泌能力,显著降低动物血清中的免疫球蛋白水平[24-25]。本试验中,随着霉菌毒素浓度的增加,中毒素组和高毒素组均显著降低了肉鸡血清中的IgA与IgY含量,这与前人的研究结果基本一致,表明霉菌毒素对肉鸡的体液免疫过程具有抑制作用,从而降低肉鸡机体免疫能力。有研究显示,在饲料中添加0.1%的甘草提取物可提升肉鸡机体内的抗体滴度,从而增强肉鸡体液免疫能力[26]。在有关植物乳杆菌的报道中,同样发现其对畜禽体液免疫能力有很好的提升效果[27]。一致的是,与中、高毒素组相比,甘草与乳酸菌组血清中的IgA和IgY含量均有显著提升,表明甘草与乳酸菌对霉菌毒素导致的肉鸡体液免疫抑制作用具有较好的缓解效果。
霉菌毒素能导致禽类免疫系统调节失衡,引发慢性损伤[28]。本试验通过组织切片观察发现,各毒素组肉鸡的胸腺均有不同程度的出血,与以往报道结果类似[19],表明饲喂霉变玉米会对家禽的免疫器官造成损伤,从而对免疫器官指数及功能造成影响。与3个毒素组相比,甘草与乳酸菌组皮质和髓质内出血较少,仅部分胸腺小叶中有零星红细胞散在分布。此结果说明,在霉变饲料中添加甘草与乳酸菌可以对霉菌毒素导致的肉鸡免疫器官损伤起到一定的保护。
3.3 霉菌毒素作用下饲喂甘草与乳酸菌对肉鸡肝脏、肾脏的影响
动物血清中,AST、ALT、γ-GT等含量的高低可以直接反映肝脏受损程度。研究发现,ZEA、DON等能够导致动物血清中AST和ALT的浓度显著升高[29]。本试验中,3个毒素组肉鸡血清中的AST、ALT和γ-GT浓度均显著升高,结合肝脏组织切片观察结果发现,低、中毒素组大片肝细胞发生肿胀、脂肪变性和淤血等病变,而高毒素组肝细胞除上述病变外,还有部分发生坏死。这与李樵锋等[30]的研究结果基本一致。当中毒素组加入甘草与乳酸菌后,肉鸡血清中的AST、ALT和γ-GT含量虽然显著高于对照组,但同样显著低于3个毒素组。从肝脏组织切片结果来看,肉鸡肝脏中除了局部淤血外,并未观察到其他明显病变。据报道,甘草对四氯化碳(CCl4)诱导的大鼠肝脏损伤具有很好的治疗效果,显著降低了大鼠血清中的AST和ALT含量[31]。这与本文结果类似,表明甘草与乳酸菌对霉菌毒素诱导的肝脏损伤能够起到一定的保护作用。
在临床上,尿素氮与肌酐是判断动物肾脏功能与损伤状况的主要指标,当肾脏受到损伤时,肌酐和尿素氮含量会有所升高。朱于斌等[32]研究发现,小鼠在DON与ZEA的共同作用下,肌酐与尿素氮含量显著升高。本试验中,各处理组肉鸡血清中的尿素氮与肌酐含量显著降低。结合肾脏组织切片结果来看,除对照组外,各组肾小管间质间均有淤血出现,部分肾小管内皮细胞肿胀,表明肾脏有所损伤,其中高毒素组和中毒素组较为严重,低毒素组和甘草与乳酸菌组症状较轻。查阅资料发现,在动物血清中,肌酐与尿素氮含量的升高或降低并不全由肾脏功能决定,如心功能不全、脱水和肌肉肥大等会导致肌酐含量上升,肌肉萎缩和营养不良等则会导致肌酐含量明显降低;脱水和尿路阻塞等会导致尿素氮含量升高,而肝功能不全和营养不良则会导致尿素氮含量明显降低。本试验中尿素氮和肌酐含量之所以显著降低,可能与霉菌毒素降低了饲料中的营养成分和肝脏受损等有关。王慧容[33]研究发现,霉菌毒素不仅使肉鸡体重下降,而且降低了肉鸡体内尿素氮的含量。据报道,甘草与乳酸菌可以提高肉鸡对饲料的营养吸收率[11]。当在中毒素组加入甘草与乳酸菌后,肉鸡体内肌酐含量与尿素氮含量虽然显著低于对照组,但却显著高于3个毒素组,此结果正好同本文中所猜测的尿素氮与肌酐含量降低的原因有所呼应,甘草与乳酸菌提高肉鸡的生长性能和缓解肝脏损伤后,肉鸡体内尿素氮与肌酐含量逐渐回归正常水平,但它们之间是否具有关联性还需进一步验证。

