双氢青蒿素对小鼠肺纤维化的影响及作用机制
白君, 陈珠妮, 叶景焕, 熊广, 李亚清, 谢纬
1.广州中医药大学第四临床医学院,广东深圳 518000;2.深圳市中医院,广东深圳 518000
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是局限于肺部的间质性肺炎的一种特殊类型,其组织病理学和胸部影像学表现为普通型间质性肺炎特征的慢性间质性肺疾病,具有慢性、进行性加重及纤维化的特点[1]。近年来青蒿素是中医药研究的热点课题,青蒿素类药物对自身免疫性疾病(抗炎)、感染性疾病(抗病毒、抗寄生虫、抗真菌等)、肿瘤及肺间质纤维化等方面均有一定疗效[2]。有研究发现,肺纤方能够减轻小鼠肺纤维化及肺泡炎症程度,抑制NIH3T3成纤维细胞增殖[3],本研究在此基础上探讨单药双氢青蒿素抗肺纤维化的作用及可能机制。
1 材料和方法
1.1 实验动物与细胞
35只SPF级雄性昆明小鼠购买于南方医科大学实验动物中心;NIH3T3成纤维细胞购自武汉普诺赛生命科技有限公司。
1.2 主要仪器与试剂
盐酸博莱霉素针剂(上海生工);复方双氢青蒿素片(重庆通和药业有限公司);甲泼尼龙(比利时辉瑞制造公司);水合氯醛、羟脯氨酸测定试剂盒和ELISA检测试剂盒(南京建成A030);MTS细胞增殖试剂盒(Promega公司);兔抗小鼠MMP-2(ab97779)、TIMP1(ab38978)、Cyclin D1(ab16663)多克隆抗体(Abcam公司)。
1.3 模型制作[4]及分组
将35只雄性昆明小鼠采用随机数字法分成空白对照组、模型组、甲泼尼龙组、双氢青蒿素低剂量组、双氢青蒿素高剂量组,每组各7只小鼠。将模型组、甲泼尼龙组、双氢青蒿素低剂量组、双氢青蒿素高剂量组小鼠用4%水合氯醛(0.01 mL/g)150 μL腹腔注射麻醉后,固定小鼠,沿着声门将雾化器(针头灌胃器)插入气管并喷入博来霉素溶液(8 mg/kg),随后将小鼠起立旋转3~5 min,尽量使喷入的博来霉素溶液在两肺内均匀分布,间隔10天后第2次给同等剂量博来霉素,第2次给药后14天完成模型构建[4]。空白对照组使用生理盐水,以上各组24天后成模。成模后第2天开始给药治疗,甲泼尼龙组、双氢青蒿素低剂量组、双氢青蒿素高剂量组,每日分别给与甲泼尼龙1 mg/kg,双氢青蒿素20、50 mg/kg灌胃,空白对照组、模型组则给与等量生理盐水;各组治疗14天后处死,留取肺脏标本进行相关指标检测。
1.4 小鼠肺组织病理学检查和肺泡炎症、肺纤维化评分
小鼠被处死后取左肺组织,固定后进行脱水,石蜡包埋和切片,HE染色及Masson染色,观察小鼠肺组织病理学情况,应尽量避开大气管和大血管进行拍照。根据肺泡炎症评价方法[5]分为0~3级,一级为轻度改变,病变范围占全肺比例<20%计1分;二级为中度改变,病变范围占全肺比例20%~50%计2分;三级为重度改变,病变范围占全肺比例50%计3分;0级是无明显病理改变,肺泡结构正常,计0分。将肺组织纤维化程度分为8级[6],一级计1分,可见局部轻纤维及肺泡轻微肿胀;二级计2分,可见明显纤维化出现;三级计3分,出现连续纤维区域;四级计4分,纤维面积≤10%;五级计5分,纤维面积占10%~50%;六级计6分,纤维面积>50%;七级计7分,可见肺泡腔充满纤维组织,肺大疱出现;八级计8分,整个区域出现纤维化病灶;正常肺组织为0级。随机选取每组所有小鼠各10个视野,将肺泡炎症评分和纤维化评分分值的均数作为该小鼠样本肺泡炎症、纤维化分级评分。采用盲评方法。
1.5 羟脯氨酸测定
取小鼠右肺组织,冲洗、滤纸吸湿后称取0.3 g肺组织,研磨后将其制成肺组织匀浆,离心后提取上清液,测定羟脯氨酸含量。羟脯氨酸含量测定的步骤按照ELISA试剂盒说明书规范操作。
1.6 小鼠NIH3T3成纤维细胞培养
培养NIH3T3成纤维细胞,待细胞长到90%汇合时胰酶消化,于6孔板中种植对数生长期的细胞,待细胞贴壁后行药物干预。共分6组,分别为对照组(Ctrl组)、双氢青蒿素低剂量组(LQ组)、双氢青蒿素中剂量组(MQ组)、双氢青蒿素高剂量组(HQ组)、甲泼尼龙低剂量组(LM组)、甲泼尼龙高剂量组(HM组);LQ、MQ、HQ组分别给与5、10、20 mg/L双氢青蒿素干预,LM、HM组分别给与10、20 mg/L甲泼尼龙干预;Ctrl组则给与等体积磷酸盐缓冲盐溶液。
1.7 MTS法检测细胞增殖
待细胞长到90%汇合时胰酶消化取对数生长期的细胞种于6孔板中,0.5×104个/孔。待细胞贴壁后,吸出部分等量培养基,分别换为含有等量各剂量的双氢青蒿素和甲泼尼龙。分别在0、4、24、48、72 h加入MTS检测溶液10 μL,37 ℃下孵育,最后于490 nm波长下,用酶标仪检测光密度值(optical density,OD)。细胞存活率(%)=(加药细胞OD/对照细胞OD)×100%。
1.8 Western blotting法测定成纤维细胞相关蛋白的表达
于6孔板中培养对数生长期的NIH3T3细胞系,经各剂量双氢青蒿素及甲泼尼龙干预24 h后,提取细胞总蛋白,完成电泳,滤膜、封闭后,加入CyclinD1、MMP-2、TIMP1抗体,孵育后加入相对应的HRP标记的二抗,化学发光底物显色后,使用Bio-Rad取像,最后蛋白条带光密度分析在Scion Image软件进行。
1.9 统计学方法
采用SPSS 25.0版统计软件,符合正态分布、方差齐性的计量资料采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 HE染色及肺泡炎症评分
HE染色结果显示,空白对照组肺组织结构清晰,肺泡无明显萎缩或扩张,肺泡壁无增厚,肺间质无炎症细胞浸润;模型组肺泡间隔被大量破坏,肺泡结构紊乱,实质区明显增多,有大量炎症细胞浸润;甲泼尼龙组、双氢青蒿素低剂量组、双氢青蒿素高剂量组肺泡结构基本完整,较少见肺泡塌陷或实变,相比模型组肺间隔仅轻度增宽,肺泡内炎症细胞浸润较少,肺泡破坏程度有所下降(图1)。
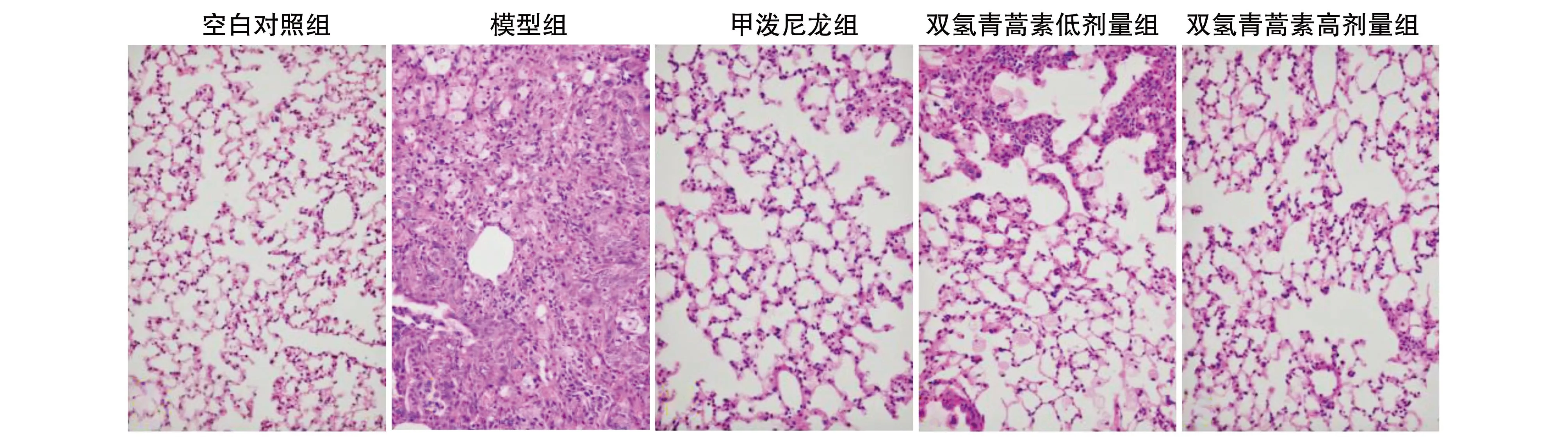
图1 各组小鼠肺组织HE染色结果(400×)
与空白对照组比较,模型组小鼠肺泡炎症评分升高(P<0.05);与模型组比较,甲泼尼龙组、双氢青蒿素低剂量组、双氢青蒿素高剂量组小鼠肺泡炎症评分降低(P<0.05);与甲泼尼龙组比较,双氢青蒿素低剂量组肺泡炎症评分升高(P<0.05);双氢青蒿素低剂量组较双氢青蒿素高剂量组升高(P<0.05;图1和表1)。

表1 各组小鼠肺组织肺泡炎症评分及肺纤维化评分比较(n=7) 分
2.2 Masson染色及肺纤维化评分
空白对照组肺组织肺泡结构整齐、规则,除支气管及血管壁有较少淡蓝色丝状纤维沉积,肺泡间隔无明显胶原纤维增生;模型组可见肺组织结构紊乱,肺泡间隔广泛增厚明显(间隔厚度≥3倍对照组),大量蓝色胶原沉积于肺泡间隔及肺间质;较模型组,甲泼尼龙组,双氢青蒿素低剂量组、双氢青蒿素高剂量组小鼠肺组织蓝色胶原沉积均明显减轻(图2)。与空白对照组比较,模型组肺纤维化评分升高(P<0.05);与模型组比较,甲泼尼龙组、双氢青蒿素低剂量组、双氢青蒿素高剂量组小鼠肺组织纤维化评分降低(P<0.05;表1)。

图2 各组小鼠肺组织形态masson染色结果(400×)
2.3 各组肺组织羟脯氨酸含量比较
与空白对照组比较,模型组羟脯氨酸含量升高(P<0.05);与模型组比较,甲泼尼龙组、双氢青蒿素低剂量组、双氢青蒿素高剂量组羟脯氨酸含量下降(P<0.05;表2)。

表2 各组小鼠肺组织羟脯氨酸含量比较 mg/g
2.4 各组细胞增殖的比较
药物干预4 h时,与Ctrl组相比,HM、LQ、MQ、HQ组细胞增殖率下降(P<0.05);干预24 h及以上,与Ctrl组相比,LM、HM、LQ、MQ、HQ组均能明显抑制细胞增殖,且随着时间延长,青蒿素各剂量组组间增殖率下降(P<0.05;表3)。

表3 MTS检测不同药物对小鼠成纤维细胞NIH3T3细胞增殖影响
2.5 成纤维细胞相关蛋白的表达水平
与Ctrl组相比,LQ、MQ、HQ、LM、HM组CyclinD1和MMP-2蛋白的表达均有下调,且随着双氢青蒿素剂量的增加,CyclinD1和MMP-2蛋白水平也下降;HM组与HQ组CyclinD1和MMP-2蛋白下降效果大致相当。与Ctrl组相比,LQ、MQ、HQ、LM、HM组对TIMP1蛋白的表达均有上调作用,以HQ、HM组上调最明显,两者上调作用大致相同(图3和表4)。
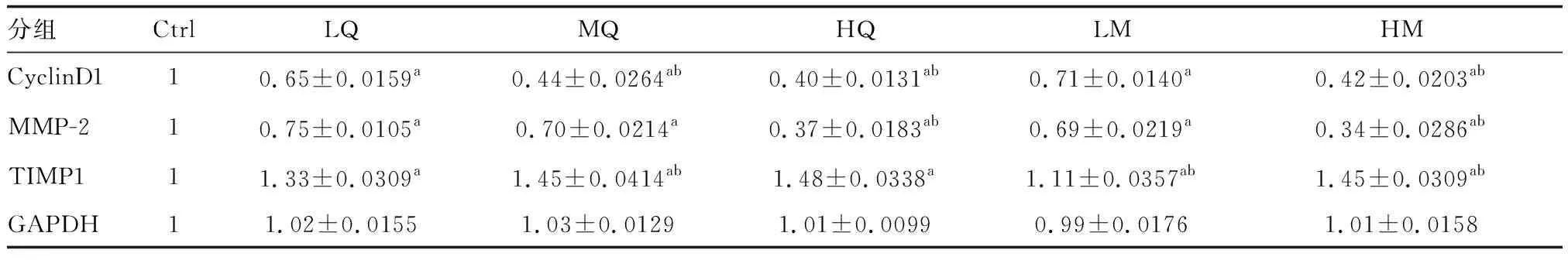
表4 蛋白质印迹法测定细胞MMP-2、TIMP1、Cyclin D1蛋白条带灰度值
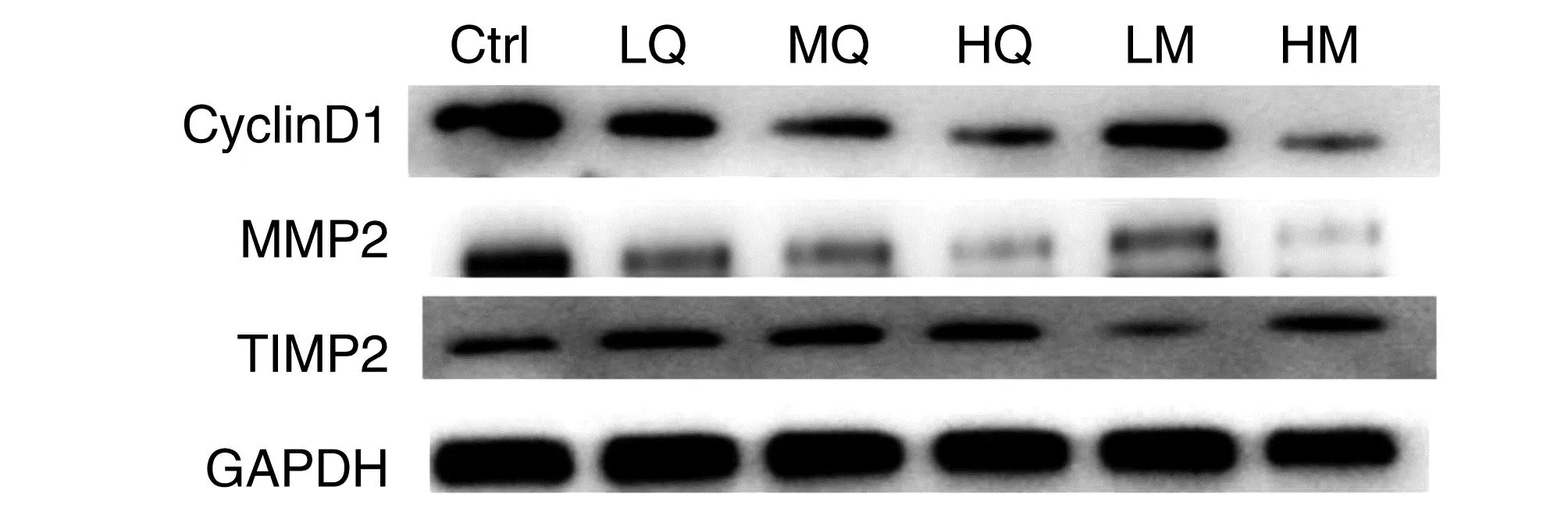
图3 Western blotting测定MMP-2、TIMP1、Cyclin D1蛋白表达
3 讨 论
青蒿是中药的一种,具有清虚热、凉血除蒸、解暑截疟的功效。青蒿素是从菊科植物黄花蒿(artemisia annua L)中提取的化合物,而双氢青蒿素(dihydroartemisinin,DHA)是体内青蒿素的活性代谢产物。双氢青蒿素可通过抑制氧化应激反应、降低细胞炎症因子表达等方式,减轻肺组织炎症、降低胶原合成水平、抑制血管内皮细胞分化、调节免疫状态等,并以此来抑制肺纤维化进程[7-8]。
本研究应用不同剂量的DHA、甲泼尼龙对体外培养的小鼠胚胎成纤维细胞(NIH3T3细胞)进行干预,MTS检测法提示DHA能抑制NIH3T3细胞的增殖能力,在一定范围内呈时间及剂量依赖。且小鼠胚胎成纤维细胞经DHA干扰后,炎症及肺纤维化评分、羟脯氨酸含量均下降,说明DHA能很好地减少肺损伤,抗炎、抑制成纤维细胞增殖,从而减轻肺纤维化程度。但目前肺纤维化的发病机制尚不明确,大部分学者认为IPF的发生[9]可能与肺泡上皮细胞受损、肌成纤维细胞异常增殖活化和细胞外基质过度积聚有关。研究指出,肺纤维化的形成过程与MMPs/TIMPs系统平衡和Rho/Rock信号通路参与调节成纤维细胞增殖有关[10-11]。如Rho激酶抑制剂法舒地尔[12]可逆转MMPs/TIMPs比值,且抑制成纤维细胞CyclinD1蛋白表达,进而抑制成纤维细胞增殖,而前期课题的中药复方肺纤方也具有同样的作用[3]。
基质金属蛋白酶组织抑制因子是其特异性的组织抑制因子,可以特异性抑制几乎所有基质金属蛋白酶,对维持ECM蛋白形成和平衡具有重要意义[13]。研究发现,MMP-2在IPF病人肺组织中广泛表达[14],MMP-2和MMP-9的过度表达被认为在基底膜破坏中起关键作用[15]。因为肺泡壁的结构完整性依赖于基底膜,因此上皮下基底膜的破坏可能是肺泡纤维化过程中的早期事件,这于IPF的发生来说至关重要。
研究发现,被激活的Rho/ROCK信号通路能影响细胞骨架重组调节,介导细胞迁移,参与肺、肝、肾脏等脏器的纤维化过程,还能介导炎症反应和氧化应激、促使成纤维细胞上皮-间质转化、分泌胶原蛋白等,参与肺纤维化的发生、发展[16-19]。G1/S期以及有丝分裂过程中ROCK被活化,抑制ROCK活力会促进G1期中心粒的异常分离[20]。在细胞增殖周期中,G1/S期和G2/M期是两个关键性限制点,G1期中两个关键调节蛋白分别是CyclinD1和CyclinE蛋白。CyclinD蛋白在细胞增殖中起正性调节作用,CyclniD1表达增加促使S期向G1期转换,推动细胞的有丝分裂。本实验发现DHA可以使CyclinD1蛋白表达下降,说明DHA可抑制成纤维细胞增殖。可见,DHA对于IPF中成纤维细胞病态增殖的治疗有一定价值。
综上,DHA对降低肺纤维化小鼠肺泡炎症、肺纤维化程度及羟肺氨酸水平的治疗有一定作用,表明双氢青蒿素可能是治疗肺纤维化的潜在良好候选药。
——青蒿素

