彩色多普勒超声Finkler评分系统联合血清肿瘤标志物在儿童卵巢肿瘤良恶性鉴别诊断中的价值
高文会,钱蔷英,孙颖华
复旦大学附属儿科医院超声科,上海 201102
儿童卵巢肿瘤是儿童肿瘤中常见的肿瘤之一,可分为良性及恶性肿瘤,良性肿瘤较常见,恶性则以儿童卵巢生殖细胞肿瘤居多[1]。卵巢肿瘤为内生性肿瘤,且卵巢位于盆腔深部,若无明显增大并压迫周围组织或器官,一般患儿及其家属不易发现,多因瘤体扭转导致的腹痛或在儿童生长发育评估中发现[2]。临床中,关于卵巢肿瘤的超声评分系统较多,常见的有Alaczar超声评分系统[3]及Finkler评分系统[4]等,已广泛用于成人卵巢肿瘤的超声评估中,由于成人与儿童的卵巢肿瘤疾病谱不同,目前尚无关于儿童卵巢肿瘤的超声评估系统。甲胎蛋白(alphafetoprotein,AFP)是检测卵巢肿瘤最常用的指标[5]。若卵巢肿瘤中含有较多的卵黄囊成分,血清AFP也会明显升高。神经元特异性烯醇化酶(neuron-specific enolase,NSE)是糖酵解途径中的关键酶,其特异性地存在于神经元和神经内分泌细胞[6],由于儿童卵巢肿瘤以生殖细胞肿瘤多见,在卵巢肿瘤患儿中,血清NSE的水平也有升高。为进一步提高鉴别儿童良恶性卵巢肿瘤的能力,本研究借鉴Finkler卵巢肿瘤超声评分系统并联合血清NSE及AFP水平测定的方式,对复旦大学附属儿科医院经病理学检查证实的卵巢肿瘤患儿的临床及相关的影像学资料进行回顾性分析。
1 资料和方法
1.1 临床资料
选取2017年1月1日—2020年12月31日于复旦大学附属儿科医院经术后病理学检查确诊的卵巢肿瘤患儿137例。其中良性卵巢肿瘤患儿105例(良性组),恶性肿瘤患儿32例(恶性组);左侧卵巢56例(40.9%),右侧卵巢75例(54.7%),双侧卵巢6例(4.4%)。肿瘤最大径11.9~500.0 mm,平均(76.55±64.72)mm。105例良性卵巢肿瘤患儿平均年龄(8.85±3.37)岁,直径(66.07±47.76)mm;32例恶性卵巢肿瘤患儿平均年龄(7.78±4.66)岁,直径(110.15±94.87)mm。纳入标准:① 术前完成腹部超声和血清AFP及NSE水平的检查;② 临床各项资料完整。排除标准:① 并发有其他恶性肿瘤的患儿;② 存在肾脏、心脏等其他重要器官功能障碍的患儿;③ 术前曾行其他手术或接受过放化疗。本研究经医院医学伦理委员会批准,患儿家属已知情同意。
1.2 仪器与方法
1.2.1 超声检查
采用荷兰Philips公司的iU 22、EPIQ 5彩色多普勒超声诊断仪,凸阵探头频率6 MHz,线阵探头频率7.5~10.0 MHz。患儿在安静状态下,取平卧位进行检查。较大患儿(>3岁),检查子宫卵巢盆腔时,需先行排空大便,并在膀胱充盈后检查;较小婴幼儿(<3岁),如若哭吵,可适当安抚,必要时可给予镇静药物辅助睡眠后检查。首先通过超声观察肿块大小、质地、形态、包膜、边界,以及与邻近器官或组织的关系;行彩色多普勒超声观察肿块内部血流以及周围器官或组织的血流情况,参照Kurjak等[7]建立评估附件区肿块的血流分级:0级,肿块内部及周边均无明显血流信号;Ⅰ级,实性部分可见点状、短线状血流信号或囊内分隔上、囊壁上可见血流信号;Ⅱ级,实性部分可见树枝状、网状血流信号,伴或不伴囊内分隔上、囊壁上可见血流信号。以上检查由2名中级及以上年资超声科医师完成并核对。
1.2.2 Finkler超声评分系统及诊断标准[4]
肿瘤边界清楚,无回声,纤维瘤或结节性囊肿,如输卵管积水等,评分为1分;肿瘤边界轻微不规则,无回声或低回声,肿瘤包膜,评分为2分;肿瘤边界轻微不规则,低回声,无结节(如内膜样瘤),绝经后的无回声囊肿,评分为3分;肿瘤为边界不规则的小囊肿伴内部回声反射(如血肿或卵巢良性肿瘤),等回声,实性卵巢增大,评分为4~6分;肿瘤为多分隔或不规则的囊性肿物,评分为7~9分,其中结节少评分为7分,结节多评分为8~9分;上述特征伴腹腔积液评分为10分。Finkler超声评分≥7分判断为恶性[8]。
1.2.3 血清NSE及AFP水平测定及诊断标准
患儿入院后于当天或第二天清晨(术前)收集患儿空腹静脉血,测定血清AFP及NSE水平,检测方法为酶联免疫吸附法。
1.3 统计学处理
2 结 果
2.1 两组一般资料比较
两组患儿在年龄、卵巢肿瘤最大径及肿瘤发病位置方面的差异均无统计学意义;术前血清标志物AFP及NSE比较差异均有统计学意义(P<0.05,表1)。

表1 一般资料比较
2.2 两组超声图像特征比较
两组在肿瘤的形态、边界、回声及肿瘤血供方面比较差异均有统计学意义(P<0.05),大小差异无统计学意义(表2,图1)。
图1 典型病例盆腔超声图像
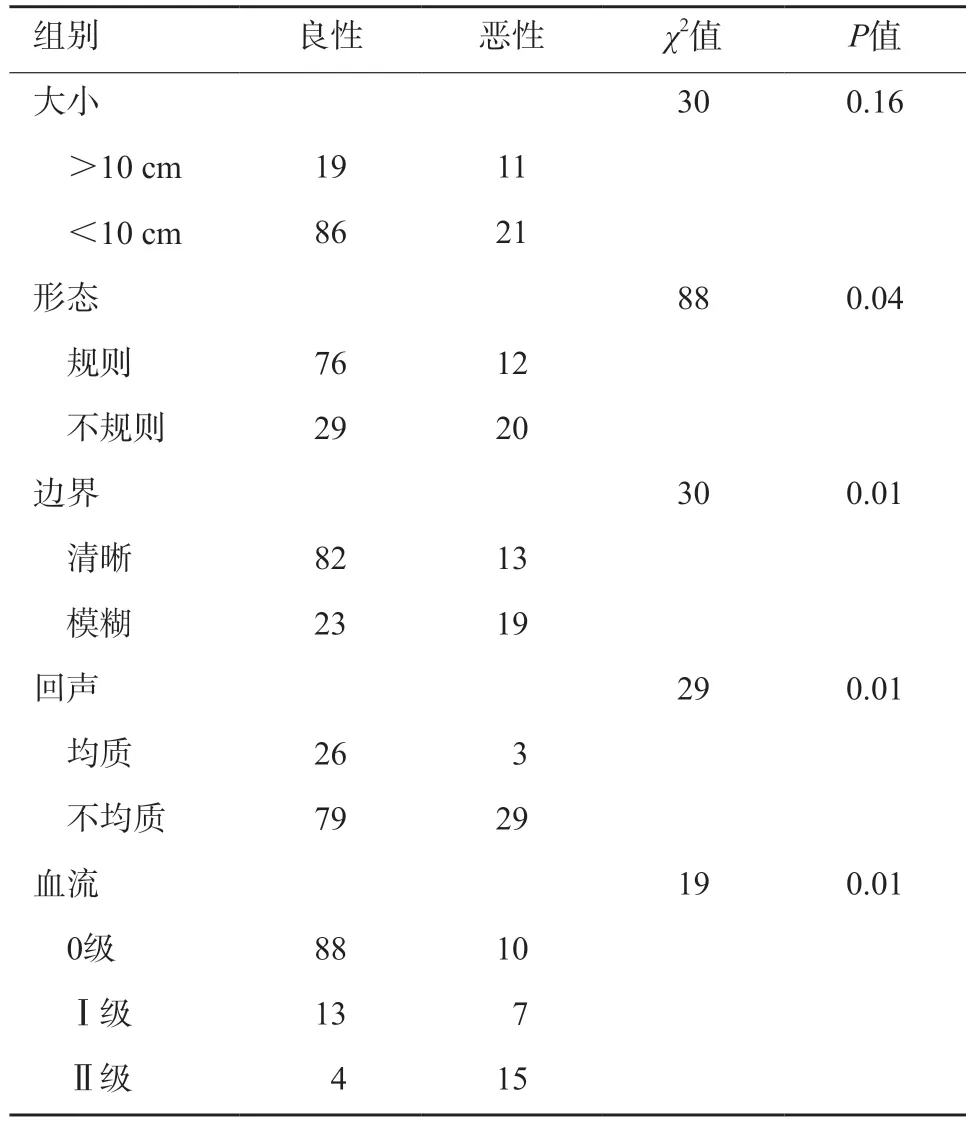
表2 超声特征比较
2.3 病理学检查结果
105例良性肿瘤中,良性畸胎瘤占比最多,88例良性畸胎瘤中以囊实性肿瘤为主,病理学切片显示肿瘤内部含有骨骼、毛发、脂肪,神经组织及成熟的脑组织等;其余为浆液性黏液瘤、黏液性囊腺瘤等。32例恶性卵巢肿瘤中,11例恶性畸胎瘤,其中2例分期为未成熟畸胎瘤Ⅱ~Ⅲ级,2例肿瘤中含有未成熟畸胎瘤成分和卵黄囊成分,余7例未成熟畸胎瘤的肿瘤分期为Ⅰ级;7例卵黄囊瘤,4例无性细胞瘤,2例幼年型颗粒细胞瘤,2例生殖细胞性索-间质肿瘤,1例B淋巴母细胞淋巴瘤,1例绒毛膜癌,1例成神经细胞瘤原发于右侧卵巢区,2例混合型生殖细胞肿瘤,其中均含有卵黄囊瘤成分;尚有1例卵巢交界性黏液性囊腺瘤。当肿瘤因体积过大,内部供血不足,良恶性肿瘤中均可见大片出血坏死。
2.4 Finkler评分、血清标志物AFP及NSE单独及联合诊断效能
Finkler超声评分、血清AFP及NSE单独诊断及三者联合对儿童卵巢肿瘤的诊断效能详见表3及图2。
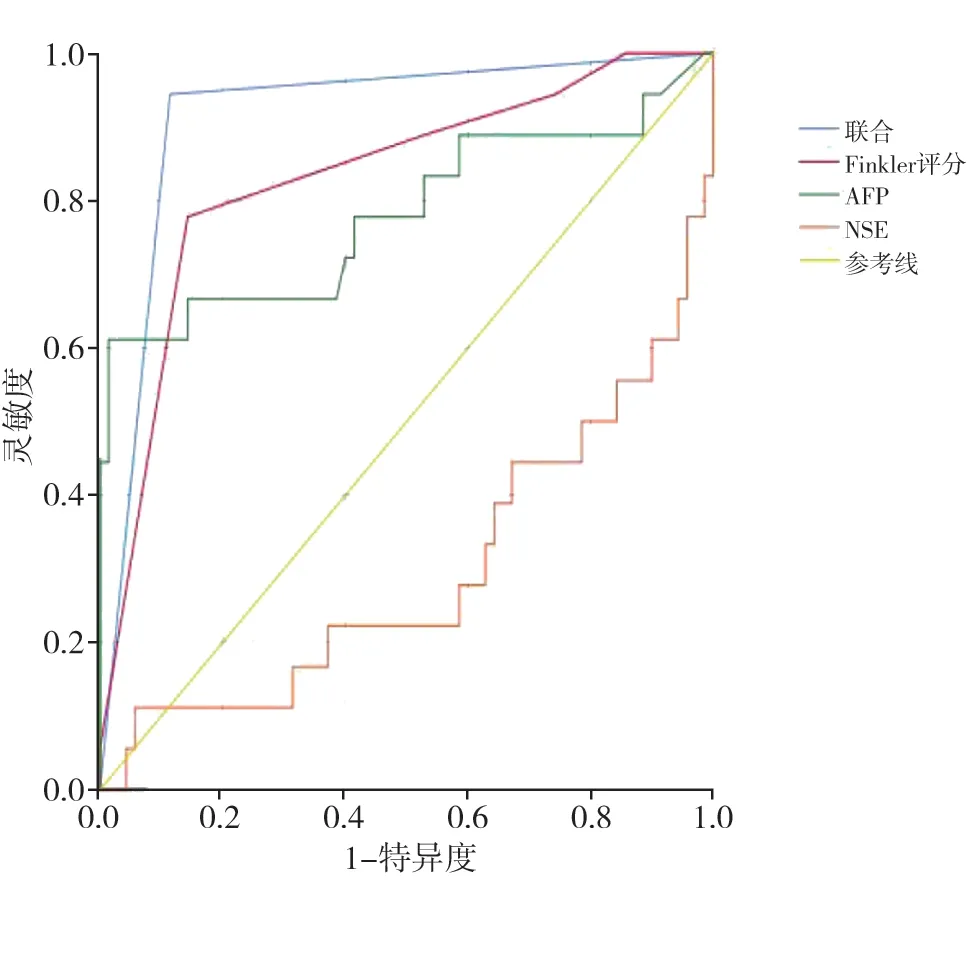
图2 AFP、NSE、超声Finkler评分单独及联合对儿童卵巢肿瘤诊断价值ROC曲线

表3 AFP、NSE、超声Finkler评分单独及三者联合对儿童卵巢肿瘤良恶性诊断价值
3 讨 论
目前,国际上关于卵巢肿瘤超声评分标准较多,Finkler超声评分是根据卵巢肿块的回声边界等超声特征制定的评分量表,且临床应用广泛。不同于成人,由于儿童疾病谱的特殊性,儿童卵巢恶性肿瘤以胚胎性肿瘤及未分化的肿瘤更为多见。因此关于儿童卵巢肿瘤的超声评估系统,目前国际上仍鲜有报道。本研究采用Finkler超声评分系统评估儿童卵巢肿瘤,以Finkler超声评分≥7分为恶性,灵敏度57.8%,特异度77.8%,准确度74.4%。陈鲜霞等[9]应用Finkler超声评分研究了100例卵巢肿瘤,卵巢恶性肿瘤诊断的灵敏度为90.90%,特异度为89.55%,准确度为90.00%,李洁等[10]采用Finkler超声评分研究了124例卵巢肿瘤,卵巢恶性肿瘤诊断的灵敏度为83.7%,特异度为69.3%,上述研究均与本研究的结果一致。由于Finkler评分是主要基于超声二维图像制定,对于卵巢肿瘤的血流情况无相应描述,国外有研究[11]表明,恶性肿瘤的新生血管较多,血流丰富。故本研究引用Kurjak等[7]建立的评估附件区肿块的血流分级方法,联合Finkler评分一同评估儿童卵巢肿瘤良恶性情况可帮助提高诊断的准确度。
AFP及NSE均为临床中较为常用的血清肿瘤标志物。AFP是瘤体内不成熟肝脏细胞以及胚胎卵黄囊中含有的一种特殊蛋白质[12-13],也可出现在未成熟畸胎瘤中,可高浓度局灶性聚集在腺上皮及神经节细胞中。本研究采用AFP及NSE水平评估儿童卵巢肿瘤的恶性程度,当以AFP>4.08 ng/mL作为截断值时,诊断的灵敏度77.8%,特异度84.0%,准确度83.2%,Youden指数最大值为0.72。NSE特异性地存在于神经及内分泌细胞中,临床中一般根据肿瘤中神经组织的分化程度对卵巢恶性进行分级。本研究以NSE<16.05 ng/mL作为截断值时,诊断的灵敏度66.7%,特异度78.7%,准确度76.6%,Youden指数最大值为 0.61。冯杰雄等[14]通过对14例畸胎瘤的儿童研究发现,NSE的阳性率分别为Ⅰ级100%,Ⅱ级75%,Ⅲ级25%,从而发现肿瘤分级越高,NSE表达越低,与本文结果一致。NSE主要在成熟畸胎瘤及分级较低的未成熟畸胎瘤中出现,而在未成熟畸胎瘤Ⅲ级及以上则呈现低表达,低于界值。将Finkler超声评分、血清AFP及NSE联合,相较于单独检查方法的评估,诊断灵敏度明显升高,达到81.2%,提高了儿童卵巢肿瘤的检出率。
超声Finkler评分+NSE+AFP联合检查可避免单一技术诊断的局限性和不足之处,还能显著提高早期鉴别儿童卵巢肿瘤的效能,降低误诊率。除此之外,本研究发现,单独使用Finkler评分评估儿童卵巢肿瘤,灵敏度不太高,可能是因为诊断医师水平层次不一,受主观因素影响大,且由于是腹部超声,容易受患儿腹腔内肠道气体及粪块回声等影响,给出的超声描述及诊断有所差异,从而影响Finkler评分的准确度。本研究为回顾性分析,结果具有一定的滞后性,且样本量较小,希望在后续的研究中可扩大研究样本量。
综上所述,彩色多普勒超声Finkler评分联合AFP及NSE可用于患儿良恶性卵巢畸胎瘤的鉴别,超声可作为首选的影像学检查方法。

