PEG浸种对黄芩种子萌发及生理特性的影响
陈秀灵, 赵春颖, 李季生, 李忠思, 赵红玲, 李 娜
(1.承德医学院蚕业研究所,河北省高校特色蚕桑应用技术研发中心, 河北 承德 067000;2.承德医学院中药研究所-河北省中药研究与开发重点实验室, 河北 承德 067000)
黄芩(ScutellariabaicalensisGeorigi)属于唇形科黄芩属多年生草本植物,根呈圆锥状,茎丛生,分枝多而细,叶片披针形,为总状无限花序,种子梯次成熟,成熟期长,具有耐旱、耐寒、不耐涝的生物学特性[1-2]。作为历史悠久的中国秦岭五大商药之一,黄芩为常用大宗中药材,始载于《神农本草经》,主要以根入药,主要分布于我国内蒙古、河北、山西、山东、黑龙江及辽宁等省,河北承德为道地产区,俗称“热河黄芩”[3-4]。黄芩的主要药用成分为黄芩苷、汉黄芩苷、黄芩素等成分,在抗菌、消炎、抗肿瘤、抗氧化、止血安胎、泻火解毒等方面具有重要功效[5-6]。黄芩已被广泛应用于临床疾病的治疗,约70%的清热解毒中成药及配方均含黄芩[6]。近年来,野生黄芩资源因过度采挖日趋减少,逐渐被人工引种栽培代替,但黄芩种子质量良莠不齐,很难满足规模化生产[3,7]。而且,黄芩为短寿命种子,种子活力易丧失,导致种子萌发受阻、田间出苗率低及长势弱等,不利于黄芩产业发展[8]。因此,研究如何提高黄芩种子萌发能力,对种苗培育以及陈种子的再利用具有重要的现实意义。
种子萌发是植物生命周期中的起始阶段,萌发与植物的形态建成和成株状态密切相关[9]。种子引发是在特定的条件下使其产生“引发记忆”的播前处理技术,能够改善种子的萌发潜力,提高种子发芽速度、出苗整齐度、幼苗健壮度以及植株抗逆性[10]。聚乙二醇(PEG)不仅可以作为评价种子抗旱能力的重要标志,也是较为理想的种子引发剂,通过渗透调节作用来延长种子吸水时间,以降低电导率和营养物质渗漏,使细胞的修复能力增强,但本身不会渗入活细胞,对种子无毒害作用,从而提高种子活力和萌发能力[11-13]。研究表明,适宜的PEG浓度和分子量引发对茄子、大麦、高羊茅、甜菜、远志、苜蓿等种子的发芽指标具有明显的促进作用[13-18]。早期研究表明,PEG引发可能抑制商洛黄芩种子萌发[11],但适宜的黄芩种子PEG引发条件仍需要深入探讨。本研究采用正交试验设计,研究活力水平、PEG分子量、PEG浸种浓度和浸种时间对黄芩种子萌发的影响,为以PEG作为引发剂促进黄芩种子萌发提供科学依据和技术指导。
1 材料与方法
1.1 试验材料
黄芩种子为2021年10月采集于承德医学院中药材种植实验基地,收获种子含水量为6.34%,种子初始发芽率水平为60.48%。PEG试剂购自于北京索莱宝科技有限公司,分析纯试剂AR级。分别用蒸馏水配制3种分子量(600,2 000和6 000)的不同浓度(5%,10%,20%;质量/体积分数)PEG浸种液,备用。
1.2 试验方法
1.2.1种子老化
种子置于人工加速老化箱,采用高温(40 ℃)、高湿(相对湿度80%)处理获得在活力水平上具有差异的种子。老化1 d和2 d后,分别取出测定,种子发芽率为41.93%和37.49%。
1.2.2种子引发
采用L9(34)正交实验优化种子引发处理方案,试验因素与水平见表1。
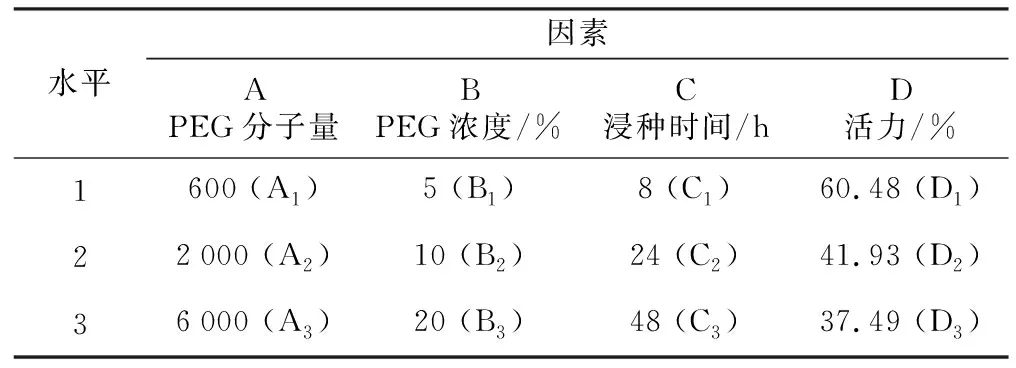
表1 PEG处理黄芩种子实验因素与水平
称取约0.5 g黄芩种子,装入对应编号的尼龙网袋,将网袋放入种子发芽盒中,用移液器分别量取80 mL不同浓度的PEG浸种液加入到发芽盒中,以三种活力水平的未浸种处理的种子作为对照,分别记为ck1、ck2、ck3。将密封的发芽盒置于室温(25 ℃)黑暗条件下进行浸种,浸种结束后用蒸馏水冲洗网袋3次,吸水纸吸干表面水分,将种子置于25 ℃、80%相对湿度条件下平衡约5 h。
1.3 指标测定
1.3.1发芽指标
将处理后的种子放入铺有2层滤纸且对应编号的发芽盒中,加入12 mL蒸馏水,每盒50粒黄芩种子,置于人工气候箱中培养,培养温度设为25 ℃(昼/夜),相对湿度为80%,光照12 h/d,光照强度为2 000 lx。 每个处理4个重复,每天记录种子发芽数,培养至第7天结束。发芽标准按照国际种子协会(ISTA)规定,有明显的胚根“露白”且胚根长度为种子的1/2认定为发芽[19]。以发芽率、发芽势、发芽指数和活力指数作为萌发测试分析指标[13,19-20]。
发芽率/%=(发芽终期全部正常发芽种子总数/供试种子总数)×100%,以第7天种子发芽数计算;
发芽势/%=(规定时期内正常发芽种子总数/供试种子总数)×100%,以第4天种子发芽数计算;
发芽指数(GI)=∑(每日种子发芽数/相应种子发芽天数);
活力指数=发芽指数×平均根苗干重,干重为将7 d后幼苗放入70 ℃恒温箱烘干48 h后称重。
1.3.2生理指标
选择每个活力水平上种子引发处理效果相对较好的组合以及相应的未引发种子,吸干引发种子表面水分,液氮速冻,置于-80 ℃的冰箱保存,用于测定生理指标。可溶性糖含量采用蒽酮比色法测定,丙二醛含量采用硫代巴比妥酸法测定,总淀粉酶活力采用3,5-二硝基水杨酸显色试剂盒测定,活性氧含量采用荧光探针检测试剂盒(Reactive Oxygen Species Assay Kit)测定,总抗氧化能力采用亚铁还原微板法试剂盒测定。活性氧检测试剂盒购自上海酶科生物科技有限公司,其余试剂盒均购自北京索莱宝科技有限公司。
1.4 数据分析
对4个测试指标进行极差分析、方差分析和多重比较。处理间平均数差异显著性比较采用Duncan’s新复极差法,所有数据采用SPSS22.0软件进行。
2 结果与分析
2.1 PEG引发对人工老化黄芩种子发芽率的影响
4因素的极差大小顺序为RC>RB>RA>RD,表明其对发芽率影响作用为浸种时间>浸种浓度>PEG分子量>种子活力(表2)。根据4因素均值最优组合为A1B2C1D1,即PEG分子量为600,浸种浓度为10%,浸种时间为8 h,种子活力为60.48%(表2)。方差分析结果表明, PEG分子量、浸种浓度和种子活力均对发芽率的影响差异达到显著水平(p<0.05),浸种时间对发芽率的影响差异达到极显著水平(p<0.01)(表4)。进一步的多重比较显示,PEG分子量(A)的高低顺序为A1>A2>A3,A1显著高于A3,即在PEG分子量为600时,发芽率最高,其次为2000;浸种浓度(B)的高低顺序为B2>B3>B1,B2和B3显著高于B1,即在PEG浸种浓度为10%时,发芽率最高,其次为20%;浸种时间(C)的高低顺序为C1>C2>C3,三水平间存在显著差异,即浸种时间为8 h时,发芽率最高;种子活力(D)的高低顺序为D1>D3>D2,D1显著高于D2和D3,即当种子处于60.48%的活力水平时,发芽率最高(表4)。与对照相比,当种子活力为D1水平时,仅A1B1C1D1组合对发芽率具有显著的促进作用,促进程度为15.86%;当种子活力为D2水平时, A1B2C2D2和A2B3C1D2组合对发芽率具有促进作用,促进程度分别为55.28%和62.03%;当种子活力为D3水平时,三种组合均对发芽率具有促进作用,促进程度为34.92%~69.49%,A3B2C1D3组合的促进程度最高(表3)。

表2 PEG处理下三因子的黄芩种子极差分析结果
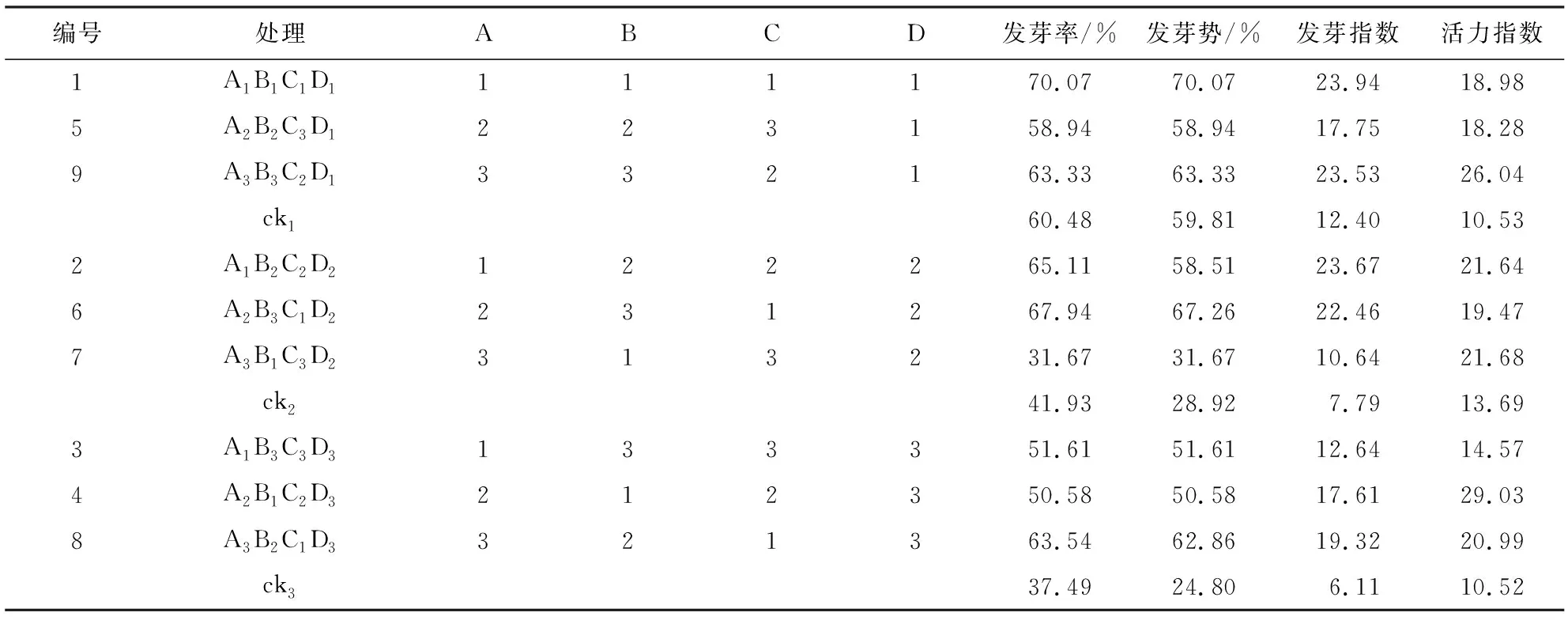
表3 PEG处理对黄芩种子萌发状况的影响

表4 黄芩种子萌发方差分析及多重比较
2.2 PEG引发对人工老化黄芩种子发芽势的影响
4因素对发芽势的极差顺序为RA>RC>RD>RB,表明其对发芽率影响作用为PEG分子量>浸种时间>种子活力>浸种浓度(表2)。根据4因素均值最优组合为A1B3C1D1,即PEG分子量为600,浸种浓度为20%,浸种时间为8 h,种子活力为60.48%(表2)。方差分析结果表明:PEG浸种浓度和种子活力水平对发芽势的影响差异达到显著性水平(p<0.05),浸种时间对发芽势的影响差异达到极显著水平(p<0.01)(表4)。进一步的多重比较结果显示,B2和B3显著高于B1,即在浸种浓度为20%和10%时,发芽势最高;浸种时间因素的三水平间存在显著差异,且C1水平最高,即在浸种时间为8 h时,发芽势较高;种子活力水平为D1时,发芽势最高,显著高于D2和D3(表4)。与对照相比,当种子活力为D1水平时,仅A1B1C1D1组合对发芽势具有显著的促进作用,促进程度为17.15%;当种子活力为D2水平时,A1B2C2D2和A2B3C1D2组合对发芽势具有促进作用,促进程度分别为102.32%和132.57%;当种子活力为D3水平时,三种组合均对发芽势具有促进作用,促进程度为103.95%~153.47%,A3B2C1D3组合的促进程度最高(表3)。
2.3 PEG引发对人工老化黄芩种子发芽指数的影响
4因素对发芽指数的极差顺序为RC>RD>RB>RA,表明其对发芽指数影响作用为浸种时间>种子活力>浸种浓度>PEG分子量(表2)。根据4因素均值最优组合为A1B2C1D1,即PEG分子量为600,浸种浓度为10%,浸种时间为8 h,种子活力为60.48%(表2)。方差分析结果表明:浸种浓度对发芽指数的影响差异达显著水平(p<0.05),浸种时间和种子活力水平对发芽指数的影响差异达极显著水平(p<0.01)(表4)。进一步的多重比较结果显示:浸种浓度(B)中B2显著高于B1,而B3与B2和B1间无显著差异,即浸种浓度为10%的发芽指数最高;浸种时间(C)中C1和C2显著高于C3,C1和C2之间无显著差异,即浸种时间为8 h的发芽指数最高,浸种24 h次之;种子活力(D)中D1显著高于D2和D3,而D2和D3之间无显著差异,即种子活力水平为60.48%时,发芽指数最高(表4)。与对照相比,当种子活力为D1水平时,三种组合对发芽指数的促进程度为41.12%~88.24%,A1B1C1D1和A3B3C2D1组合的促进程度相对较高;当种子活力为D2水平时,三种组合对发芽指数的促进程度为99.53%~342.84%;A1B2C2D2和A2B3C1D2组合对发芽指数促进程度较高;当种子活力为D3水平时,三种组合对发芽指数的促进程度为177.04%~332.45%,A3B2C1D3组合的促进程度最高(表3)。
2.4 PEG引发对人工老化黄芩种子活力指数的影响
4因素对活力指数的极差顺序为RC>RA>RB>RD,表明其对发芽指数影响作用为浸种时间>PEG分子量>浸种浓度>种子活力(表2)。根据4因素均值最优组合为A3B1C2D3,即PEG分子量为6000,浸种浓度为5%,浸种时间为24 h,种子活力为37.49%(表1)。方差分析结果表明,浸种时间对活力指数的影响差异达显著水平(p<0.05),而PEG分子量、浸种浓度和种子活力水平对活力指数的影响差异均未达显著水平(表4)。进一步的多重比较结果显示:浸种时间(C)中C2显著高于C1和C3,而C1和C3之间无显著差异,即浸种时间为24 h的活力指数最高(表4)。与对照相比,当种子活力为D1水平时,三种组合对活力指数的促进程度为71.78%~145.78%,A3B3C2D1组合的促进程度相对较高;当种子活力为D2水平时,三种组合对活力指数的促进程度为108.36%~132.40%,A3B1C3D2和A1B2C2D2组合对发芽指数促进程度较高;当种子活力为D3水平时,三种组合对活力指数的促进程度为86.01%~270.09%,A2B1C2D3组合的促进程度最高(表3)。
2.5 PEG引发对黄芩种子活性氧积累的影响
为进一步探究PEG引发处理对黄芩种子生理的影响,选择了6个引发效果相对较好的处理组合进行比较分析。活性氧积累在引发处理组间差异达显著水平,当种子生活力水平为D1时,A1B1C1D1、A1B1C2D1分别较对照降低了20.30%和5.02%,但A1B2C1D1、A1B2C2D1分别较对照增加了7.91%和17.26%,且A1B1C1D1活性氧含量最低;生活力为D2和D3的黄芩种子引发处理(A1B2C2D2和A1B2C2D3)后,活性氧仍处于非常高的水平,且无显著差异(图1A)。相对于未引发处理,PEG引发处理能够降低丙二醛含量,当种子生活力为D1水平时,A1B1C1D1、A1B1C2D1和A1B2C2D1分别较对照降低了16.32%,5.79%和24.83%,A1B2C1D1较对照增加了3.80%;人工老化导致D2和D3生活力水平的黄芩种子丙二醛含量急剧升高,A1B2C2D2和A1B2C2D3引发处理后,丙二醛含量分别降低了54.43%和41.82%(图1B)。总抗氧化能力在不同生活力水平间的PEG引发结果变化不一致,当种子生活力水平为D1时,总抗氧化能力呈增加和不变的趋势,A1B1C1D1、A1B2C2D1、A1B1C2D1和A1B2C2D1分别较对照增加了6.77%,26.56%,11.45%和0.80%;当种子生活力下降至D2和D3时,总抗氧化能力被提高,但A1B2C2D2和A1B2C2D3引发处理后,相对于未引发处理,其值出现轻微下降(图1C)。
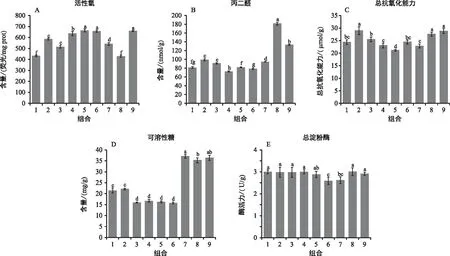
注:1~6分别表示黄芩种子引发处理为A1B1C1D1、A1B2C1D1、A1B1C2D1、A1B2C2D1、A1B2C2D2和A1B2C2D3,7~9分别表示未引发生活力水平为D1、D2和D3的对照种子。图1 PEG引发适宜处理对黄芩种子活性氧、丙二醛、总抗氧化能力、可溶性糖和总淀粉酶的影响
2.6 PEG引发对黄芩种子可溶性糖和淀粉酶活力的影响
相对于未引发处理,PEG引发处理显著地降低了可溶性糖含量,在种子生活力水平为D1时,A1B1C1D1、A1B2C2D1、A1B1C2D1和A1B2C2D1分别较对照降低了42.19%,40.17%,56.89%和54.80%;在黄芩种子生活力下降至D2和D3水平时,可溶性糖含量出现轻微下降,A1B2C2D2和A1B2C2D3引发后,可溶性糖含量进一步下降,下降幅度分别达53.78%和56.49%(图1D)。可溶性糖含量的下降,可能是因为PEG引发处理促进了糖代谢。在生活力水平为D1时,相对于未引发处理,PEG引发处理导致总淀粉酶活力显著增加,A1B1C1D1、A1B2C2D1、A1B1C2D1和A1B2C2D1分别较对照增加了14.39%,13.85%,13.59%和14.55%;人工老化使D2和D3水平种子的总淀粉酶活力增加,但A1B2C2D2和A1B2C2D3引发后造成了总淀粉酶活力不同程度的下降,下降幅度分别为3.97%和11.26%(图1E)。
3 讨论与结论
种子萌发期属于植物生长史的关键阶段,极易受外界环境条件影响,属于比较敏感的时期,决定了田间出苗率高低与整齐度[21]。种子类型、贮藏条件等因素影响了种子老化速率,导致种子活力水平出现了不同程度的下降,诱发DNA损伤、氧化胁迫及活性氧积累等一系列生理变化,直接影响了种子萌发状况[22]。适宜的引发剂能够改善种子活力,促进种子萌发[23]。种子的发芽率、发芽势、发芽指数、活力指数是衡量种子质量的重要指标,能够有效地反映种子的萌发能力。
PEG引发通过调节溶液水势,影响种子的吸水速率,使种子萌发所需物质和能量提前启动,降低了吸胀伤害事件的发生,促进种子萌发[23-25]。PEG处理对种子萌发的影响与种子类型、种子活力、PEG分子量、浸种浓度、浸种时间等多种因素有关[13,16,18,26]。种子引发的PEG分子量主要为6000和8000,如李卫芬等[12]利用PEG-6000引发陈年野菜种子,表明浓度为15%~30%的PEG处理能显著提高藿香、罗勒、板蓝根等的发芽率、发芽势、发芽指数等;辛秋宇等[27]研究发现,浓度为15%的PEG-8000浸种显著提高了谷子种子的活力水平。适宜的PEG浓度因种子老化程度存在差异,安衍茹等[16]研究表明,20%的PEG-6000溶液引发能促进人工加速老化36 h(种子活力:24.44%)远志幼苗株高、根长、地上部分生物量和地下部分生物量的增加,而人工老化48 h的种子引发效果减弱;类似的研究结果也在甜菜中被报道[28]。在本研究中,相对于未经人工老化的黄芩种子,老化24 h和48 h黄芩种子的引发效果明显减弱。适宜的引发时间因PEG浓度高低也存在差异,如在甜菜的研究中,60%的PEG-6000浸种24 h、40%PEG-6000浸种72 h对种子萌发的促进作用最大[17];在紫花苜蓿中,10%的PEG-6000溶液引发24 h能够显著提高种子发芽速度[18];PEG浓度为13.33%,引发时间为24.57 h时,玉米种子的萌发效果最好[29]。
为了全面评价PEG引发对黄芩种子萌发的影响,本试验研究了不同PEG分子量、浸种浓度、浸种时间以及种子生活力对黄芩种子引发的影响。结果表明,PEG浸种时间对种子萌发影响更大,其次为种子生活力和浸种浓度,PEG分子量影响程度最小。PEG浸种时间为8 h的发芽率、发芽势、发芽指数获得了最大程度的提高,但活力指数却在浸种24 h获得了最大值,推测适宜的浸种时间可能在8~24 h之间;浸种浓度和种子生活力均对引发处理发芽率、发芽势和发芽指数的影响差异达到显著水平,且分别在浸种浓度为10%和种子生活力为60.48%时获得最强的引发促进作用;PEG分子量仅对发芽率的影响差异达到显著水平,且低分子量(600)和中分子量(2000)PEG对发芽率的促进作用最大。这与李小玲等[10]、华智锐和李小玲[11]得出PEG抑制黄芩种子萌发的结果相反,这可能是因为黄芩种质不同所致。PEG引发处理后,对膜系统损伤具有一定的修复作用,可以改善种子生活力,但随着种子老化程度的加深,生物体的修复作用被削弱。从四种发芽指标促进程度来看,D1(60.48%)生活力水平下的黄芩种子,组合A1B1C1的引发效果相对更好。根据活性氧积累、丙二醛含量、总抗氧化能力、可溶性糖含量以及总淀粉酶活力等生理指标的变化,组合A1B1C1D1相对更能有效地避免ROS过量积累,防止细胞膜发生脂质过氧化,抑制MDA的产生,维持相对较高的总抗氧化能力水平,促进糖代谢和淀粉水解,从而为种子萌发提供能量[30-31]。
综合上述结果,可将PEG引发处理技术应用于黄芩种子,对提高种子萌发能力、增强抗逆性能等方面具有重要的应用价值。

